Получение крайне малых и однородных по размеру парамагнитных или псевдопарамагнитных наночастиц на основе оксида железа и, с их использованием, контрастных веществ для т1-режима мрт
Иллюстрации
Показать всеИзобретение относится к способу получения парамагнитных наночастиц оксида железа. Заявленный способ включает взаимодействие комплекса железа, содержащего железо в качестве центрального атома и карбоксилатную группу, имеющую от 10 до 22 атомов углерода, связанную с центральным атомом в форме лиганда; С10-С22-жирной кислоты и С10-С22-алифатического спирта или С10-С22-алифатического амина с получением наночастиц оксида железа. Получение наночастиц оксида железа выполняется путем повышения температуры от комнатной температуры до температуры от 200 до 250°C со скоростью повышения температуры 5°C/мин или более и проведением реакции при температуре от 200 до 250°C в течение периода времени от 5 до 60 минут. Изобретение обеспечивает получение наночастиц оксида железа с размерами 4 нм и менее, которые применимы в качестве контрастного вещества для Т1-режима МРТ. 6 з.п. ф-лы, 1 табл., 25 ил., 31 пр.
Реферат
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к способу получения одноразмерных парамагнитных или псевдопарамагнитных наночастиц на основе оксида железа, наночастицам на основе оксида железа, получаемым этим способом, и включающему их контрастному веществу для T1-режима МРТ. Более конкретно, настоящее изобретение относится к способу получения наночастиц оксида железа, крайне малых и имеющих одинаковый (однородный) размер 4 нм или менее, на основе термического разложения комплекса олеата железа, наночастицам оксида железа, получаемым этим способом, и контрастному веществу для T1-режима, включающему парамагнитные или псевдопарамагнитные наночастицы.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
В последнее время в медицине и биологии активно проводят множество исследований, касающихся различных типов наночастиц, например окрашивание клеток, разделение клеток, доставка лекарственных средств in vivo, доставка генов, диагностика и лечение заболевания или нарушения, молекулярная диагностика или т.п.
Для определения существенного значения медицинского применения таких наночастиц необходимо получать удовлетворительные результаты как in vitro, так и in vivo.
Другими словами, оказывающие положительное воздействие наночастицы, сначала прошедшие эксперименты на клетках, затем подвергают дополнительным тестам на животных для подтверждения того, что тестируемые наночастицы можно применять в медицине.
Магнитно-резонансная томография (МРТ) является хорошо известным способом получения анатомической, физиологической и/или биохимической информации об организме человека с помощью изображений релаксации спинов атомов водорода в магнитном поле и в настоящее время представляет собой превосходный инструмент для визуальной диагностики, позволяющий визуализировать органы животного или человека в реальном времени неинвазивным способом.
Для лучшего и разнообразного использования МРТ в биологии или медицине используют способ инъецирования постороннего вещества в организм для повышения контрастности МРТ-изображений. В связи с этим постороннее вещество часто обозначают как контрастное вещество. Такое контрастное вещество может являться веществом, в котором используют суперпарамагнитный или парамагнитный материал, вызывающий контрастность сигналов в участке, исследуемом с помощью МРТ, таким образом, позволяя четко определять участок.
На МРТ-изображениях контраст между тканями представляет собой явление, возникающее в результате различия релаксации между тканями, где релаксация относится к восстановлению ядерного спина молекул воды в тканях до равновесного состояния. Контрастное вещество влияет на такую релаксацию и, таким образом, может повышать различие в релаксации между тканями и вызывать различие в МРТ-сигналах, таким образом, позволяя четко определять контраст между тканями. Однако контрастное вещество может вызывать различия в применимости и точности в зависимости от характеристик и функций контрастного вещества, индивидуумов, которым инъецируют контрастное вещество или т.п.
Кроме того, когда контраст улучшают с использованием контрастного вещества, помогающего регулировать сигналы изображения конкретных органов и/или тканей так, чтобы они были более высокими или низкими, чем сигналы соседних органов и/или тканей, получают более выразительное (четкое) изображение. Контрастное вещество, повышающее уровень сигналов изображения на желаемом участке организма, МРТ-изображения которого получают, относительно другого участка (соседнего для желаемого участка), можно обозначать как "положительное" контрастное вещество ("контрастное вещество дл T1-режима"). С другой стороны, контрастное вещество, снижающее уровень сигналов изображения на желаемом участке относительно другого участка, можно обозначать как "отрицательное" контрастное вещество ("контрастное вещество для T2-режима"). Более конкретно, контрастное вещество для МРТ можно классифицировать на контрастное вещество для T1-режима, в котором используют высокий спин парамагнитного материала, и контрастное вещество дл T2-режима, в котором используют магнитную неоднородность вокруг парамагнитного или суперпарамагнитного материала. "Положительное" контрастное вещество относится к T1-релаксации, т.е. продольной релаксации. Такая продольная релаксация означает, что после того, как намагниченный компонент "Mz" по оси Z направления спина поглощает энергию импульса RF, прикладываемую со стороны оси X, намагниченный компонент располагается вдоль оси Y на плоскости XY и испускает энергию вовне, в свою очередь, возвращаясь к исходному значению (или состоянию) Mz. Описываемое выше действие обозначают как "T1-релаксация". Время, затраченное для возвращения Mz к 63% исходного значения, обозначают как "время релаксации T1", и по мере снижения времени релаксации T1 сигналы МРТ повышаются, что, в свою очередь, снижает время получения изображения.
Аналогично, "отрицательное" контрастное вещество относится к T2-релаксации, т.е. поперечной релаксации. Как описано выше, после того как намагниченный компонент "Mz" в направлении оси Z спина поглощает энергию импульса RF, прикладываемую со стороны оси X, намагниченный компонент располагается вдоль оси Y на плоскости XY и спонтанно затухает и/или испускает энергию в сторону соседних спинов, в свою очередь, возвращаясь к исходному значению Mz. В связи с этим другой спиновый компонент "My", в равной степени распределенный на плоскости XY, снижается по экспоненте, и это обозначают как "T2-релаксацию". Время, затраченное на снижение My до 37% исходного значения, обозначают как "время релаксации T2", и значение My, измеряемое посредством измерительной рамки, установленной на оси Y, как функция времени, где значение My снижается с течением времени, обозначают как спад свободной индукции (FID). Ткани с коротким временем релаксации T2 при МРТ представлены как темные области.
В коммерчески доступных контрастных веществах для МРТ парамагнитные соединения используют в качестве "положительных" контрастных веществ, в то время как суперпарамагнитные наночастицы используют в качестве "отрицательных" контрастных веществ.
В настоящее время контрастное вещество для T2-режима включает наночастицы оксида железа, такого как SPIO (суперпарамагнитный оксид железа). В этом случае T2-контраст является отрицательным контрастом, т.е. используют способ с отрицательным контрастом, где желаемые участки являются более темными, чем окружающие. Таким образом, этот способ не оказывает выраженные эффекты контраста и обладает тем недостатком, что вызывает эффект расплывания, контрастируя область, большую, чем фактическая.
С другой стороны, контрастное вещество для T1-режима обладает преимуществом, обеспечивая положительный контраст для яркого отображения желаемого участка, и содержит материал с высоким спином. Поэтому обычно используют комплекс гадолиния с 7 электронами с параллельными спинами на 4f-орбиталях. Однако комплекс гадолиния имеет очень короткое время удержания in vivo и/или в сосудах по причине относительно небольшой молекулярной массы, вызывая затруднения в точной диагностике. Кроме того, указанное выше контрастное вещество для T1-режима нельзя использовать для индивидуумов с нарушениями почек из-за опасности развития нефрогенного системного фиброза, и недавно было получено предупреждение от Управления по контролю качества пищевых продуктов и лекарственных средств США. Таким образом, существует острая потребность в разработке улучшенного контрастного вещества для T1-режима, с помощью которого можно преодолевать недостатки комплекса гадолиния, включая, например, короткое время удержания, высокую токсичность для пациентов с заболеваниями почек или т.п.
Среди новых тенденций в разработке контрастных веществ для T1-режима описывают статью, относящуюся к использованию наночастиц оксида марганца с 5 электронами с параллельными спинами на 3d-орбиталях (H.B. Na et al., Angew. Chem. Int. Ed. 2007, 46, 5397).
Наночастицы оксида марганца обладают преимуществами, такими как высокий эффект T1-релаксации, характерный для ионов марганца, и легкое связывание с молекулами-мишенями и легкое внутриклеточное инъецирование, характерное для наночастиц. Однако в случае когда наночастицы оксида марганца встраивают в эндосому, ионы марганца выходят из наночастицы по причине кислого внутреннего окружения. Таким образом, если такие ионы марганца остаются в организме, они могут вызывать нарушения работы кальциевых каналов (L.K. Limbach, et al., Environ. Sci. Technol. 2007, 41, 4158).
Для преодоления указанных выше недостатков можно предложить использование оксида железа в качестве контрастного вещества для T1-режима, где оксид железа имеет пять электронов с параллельными спинами, а также большую биосовместимость, чем марганец.
Типичные наночастицы оксида железа (в особенности, магнетит или маггемит) являются суперпарамагнитными при температуре, близкой к комнатной. В результате таких суперпарамагнитных свойств, т.е. высокой намагниченности, уровень T2 повышается, и могут возникать свойства магнитной восприимчивости, таким образом, вызывая проблемы, такие как искажение сигнала. Таким образом, сообщают, что магнетит не подходит для использования в качестве контрастного вещества для T1-режима (Y.-W. Jun, et al. J. Am. Chem. Soc. 2005, 127, 5732).
Однако указанные выше проблемы можно решать, контролируя размер наночастиц оксида железа. Более конкретно, со снижением размера частиц оксида железа, можно снижать их магнитные свойства, что, в свою очередь, снижает их магнитную неоднородность. Таким образом, можно прогнозировать использование наночастиц оксида железа в качестве контрастного вещества для T1-режима. Например, в патенте США № 6638494 (заявитель: Herbert Pilgrim) описывают повышение T1-релаксивности (r1) посредством снижения размера частиц суперпарамагнитного оксида железа. Согласно патенту наночастицы оксида железа, синтезированные совместным осаждением, имеющие размер частиц от 1 до 10 нм, и средний размер (d50: срединный) от 2 до 4 нм, и гидрофильную поверхность, демонстрировали T1-релаксивность в диапазоне от 2 до 50 л/ммоль·с, и r2/r1 составляет 5 или менее. Однако хотя средний размер (срединный) частиц невелик, диапазон размера частиц достаточно широк, например от 1 до 10 нм, таким образом, вызывая неравномерность размера частиц. Если размер частицы оксида железа составляет 4 нм или более, T2-эффекты могут быстро повышаться с размером частиц. Таким образом, хотя средний размер невелик, улучшение T1-релаксивности не столь высоко, если частицы имеют неодинаковый размер. Таким образом, эти наночастицы также не подходят для использования в качестве контрастного вещества для T1-режима.
Среди недавних исследований сообщали об использовании наночастиц оксида железа с размером от 4 до 6 нм в качестве контрастного вещества для T1-режима (E. Taboada et al., Langmuir, 2007, 23, 4583; U.I. Tromsdorf et al., Nano Lett. 2009, 9, 4434). Однако из-за относительно большого размера частиц, T2-эффекты все еще являются значительными, таким образом, наночастицы вызывают ограничения их использования в качестве контрастного вещества для T1-режима.
Combidex® (AMAG Co.), в настоящее время находящийся на клинических испытаниях на предмет его использования в качестве контрастного вещества для режима T2 для лимфоузлов, также исследовали в отношении его T1-контрастирующих свойств. Однако, т.к. средний размер наночастиц оксида железа являлся относительно большим в диапазоне от 4 до 6 нм и размер структурных частицы неодинаков, известно, что его T2-эффект преобладает над T1-эффектом (Claire Corot et al., Advanced Drug Delivery Reviews 58 (2006) 1471).
Кроме того, существует способ получения имеющих одинаковый размер частиц оксида железа посредством термического разложения. Однако необходимы строгие требования к получению наночастиц оксида железа, имеющих размер 4 нм или менее, что, в свою очередь, нежелательно при коммерческом применении (Jongnam Park, et al., Nature Mate., 3(2004), 891).
Кроме того, даже если можно получать наночастицы, имеющие размер 4 нм или менее, сырье является дорогим и/или обладает сильными токсическими свойствами, таким образом не имея большого значения в отношении коммерческого применения (Xiaowei Teng, J. Mater. Chem., 14 (2004), 774).
Таким образом, еще не сообщали о синтезе и поточном производстве наночастиц оксида железа, имеющих крайне малый и одинаковый размер 4 нм или менее, высоко производительным способом при низких затратах, а также исследовании контрастного вещества для T1-режима и его использовании, в чем все еще существует потребность.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
ТЕХНИЧЕСКАЯ ЗАДАЧА
Т.к. существующее контрастное вещество для T1-режима магнитно-резонансной томографии, а именно комплекс гадолиния, имеет достаточно небольшую молекулярную массу, то, таким образом, он демонстрирует слишком короткое время удержания in vivo и в сосудах. Кроме того, комплекс может вызывать проблемы у пациентов с заболеваниями почек, связанные с высокой токсичностью. Т.к. наночастицы оксида железа являются кристаллом, они обладают относительно размером частиц, что, таким образом, приводит к повышению времени удержания in vivo и в сосудах, и они обладают минимальной токсичностью. С учетом таких преимуществ планируют разработку нового контрастного вещества для T1-режима с использованием наночастиц оксида железа. Однако наночастицы оксида железа, получаемые общепринятыми способами, являются такими большими, что все еще вызывают проблему сильного преобладания T2-эффекта над T1-эффектом, и, таким образом, они не подходят для использования в качестве контрастного вещества для T1-режима.
Таким образом, цель настоящего изобретения относится к способу получения наночастиц оксида железа, где наночастицы можно использовать в качестве контрастного вещества для T1-режима, имеют крайне малый и одинаковый размер частиц, и их легко получать и осуществлять их поточное производство.
Более конкретно, указанная выше цель относится к способу получения наночастиц оксида железа, где наночастицы имеют парамагнитные или псевдопарамагнитные (далее в настоящем описании обозначаемые как "(псевдо) парамагнитные") свойства, одинаковый размер (средний размер ±1 нм) и небольшой средний размер 4 нм или менее по сравнению с общепринятыми наночастицами оксида железа с суперпарамагнитными свойствами.
Другая цель настоящего изобретения относится к наночастицам оксида железа, обладающим (псевдо) парамагнитными свойствами, одинаковым размером (средний размер ±1 нм) и крайне малым средним размером 4 нм или менее и не описанным в предшествующем уровне техники.
Другая цель настоящего изобретения относится к контрастному веществу для T1-режима МРТ, включающему описываемые выше (псевдо) парамагнитные наночастицы оксида железа, и, более конкретно, контрастному веществу для T1-режима МРТ, включающему наночастицы оксида железа с различными преимуществами, где: контрастное вещество обладает улучшенным T1-контрастным эффектом без искажения изображения, но с получением ярких изображений; находится в форме наночастицы с целью повышения скорости внутриклеточного проникновения и внутриклеточной поглощающей способности; вызывает мишенеспецифичный контрастный эффект; его легко доставлять к мишени, и оно безопасно выводится из организма; минимизирует побочные эффекты или т.п. Кроме того, настоящее изобретение относится к контрастному веществу для T1-режима, обладающему желаемым временем удержания in vivo и в сосудах, являющимся не слишком коротким (т.е. относительно продолжительным) по сравнению с общепринятыми контрастными веществами для T1-режима на основе Gd.
РЕШЕНИЕ ТЕХНИЧЕСКОЙ ЗАДАЧИ
Для преодоления указанных выше проблем в предшествующем уровне техники авторы настоящего изобретения проводили интенсивные и обширные исследования и осуществляли синтез наночастиц оксида железа, имеющих крайне малый и одинаковый размер 4 нм или менее, на основе термического разложения комплекса олеата железа с помощью простого способа. Настоящее изобретение осуществляли с использованием синтезированных наночастиц оксида железа в качестве контрастного вещества для T1-режима.
Таким образом, настоящее изобретение относится к способу получения наночастиц оксида железа, включающему (a) проведение реакции: комплекса железа, содержащего железо в качестве центрального атома и карбоксилатную группу с 4-25 атомами углерода ("C4-C25-карбоксилатную группу"), связанную с центральным атомом в форме лиганда; C4-C25-жирной кислотой и C4-C25-алифатическим спиртом или C4-C25-алифатическим амином при температуре от 150 до 350°C для получения наночастиц оксида железа, и дополнительно включающему, после операции (a), (b) диспергирование преципитата в органическом растворителе, где преципитат получают охлаждением и промыванием описываемых выше наночастиц.
Получаемые описываемым выше способом наночастицы оксида железа могут иметь размер 4 нм или менее и (псевдо) парамагнитные свойства, таким образом, являясь применимыми в качестве контрастного вещества для T1-режима МРТ.
Предшественник железа, используемый в получении наночастиц оксида железа, может содержать атом железа и группу C10-C22-жирной кислоты в форме лиганда, связанного с атомом железа, и, более предпочтительно, является комплексом олеата железа (далее в настоящем описании обозначаемым как "олеат железа").
Кроме того, жирная кислота и/или алифатический спирт (или алифатический амин), используемые в получении наночастиц оксида железа, могут включать C10-C22-жирные кислоты и/или алифатические спирты (или алифатические амины). Более предпочтительно, жирная кислота и алифатический спирт являются олеиновой кислотой и олеиловым спиртом, в то время как алифатический амин является олеиламином.
В то же время, с учетом практических условий обработки описываемое выше получение наночастиц оксида железа можно осуществлять реакцией нагревания материалов, т.е. комплекса железа, жирной кислоты и алифатического спирта (или алифатического амина), в смешанном состоянии от комнатной температуры до 200-310°C при скорости повышения температуры 5°C/мин или более, и позволяя реакции протекать при температуре от 200 до 310°C в течение периода времени от 5 до 60 минут.
В соответствии с другой целью настоящее изобретение также относится к крайне малым и одноразмерным наночастицам оксида железа, получаемым описываемым выше способом получения. В связи с этим каждая из наночастиц оксида железа может иметь размер 4 нм или менее и проявлять (псевдо) парамагнитные свойства. Размер получаемой по настоящему изобретению наночастицы оксида железа можно контролировать, регулируя молярные отношения реагирующих материалов, таких как C4-C25-жирная кислота, C4-C25-алифатический спирт (или алифатический амин), вводимых при получении.
Т.к. поверхность наночастиц оксида железа покрыта органическими материалами, являющимися производными реакционных материалов, они являются гидрофобными и хорошо диспергируемыми в неполярных органических растворителях, таких как гексан, толуол и т.п.
Кроме того, настоящее изобретение относится к гидрофильным наночастицам оксида железа, полученным модификацией поверхности гидрофобных наночастиц гидрофильными материалами с использованием способов лигандного обмена или инкапсуляции.
Гидрофильные наночастицы оксида железа по настоящему изобретению можно получать модификацией поверхности оксида железа полиэтиленгликолем ("PEG"), фосфолипид-PEG, PEG-фосфатом, моносахарид-фосфатом, производными моносахарид-фосфатов, бетаинами или лимонной кислотой. Более предпочтительно, поверхность оксида железа можно модифицировать молекулой PEG-фосфата (PO-PEG), содержащей PEG, связанный с фосфатной группой или фосфиноксидной группой, глюкозо-6-фосфатом, глюкозо-6-фосфат-этаноламином, глюкозо-6-фосфат-PEG, бетаином или лимонной кислотой.
Кроме того, настоящее изобретение относится к коллоидному раствору, включающему гидрофильные наночастицы оксида железа, в котором наночастицы диспергированы в воде.
Кроме того, настоящее изобретение относится к контрастному веществу для T1-режима магнитно-резонансной томографии, включающему коллоидный раствор гидрофильных наночастиц оксида железа.
По настоящему изобретению, даже когда наночастица оксида железа является наночастицей, синтезированной любым известным способом, наночастица может являться (псевдо) парамагнитной, если она имеет размер 4 нм или менее, и, таким образом, наночастицы могут проявлять улучшенный T1-контрастный эффект.
Альтернативный способ получения наночастиц оксида железа по настоящему изобретению может включать проведение реакции: комплекса железа, содержащего железо в качестве центрального атома и C4-C25-карбоксилатную группу, связанную с центральным атомом в форме лиганда; и C4-C25-жирной кислоты при температуре от 290 до 310°C со скоростью повышения температуры от 3 до 3,5°C/мин для получения наночастиц оксида железа. Другой альтернативный способ получения наночастиц оксида железа по настоящему изобретению может включать сначала проведение реакции: комплекса железа, содержащего железо в качестве центрального атома и C4-C25-карбоксилатную группу, связанную с центральным атомом в форме лиганда; и C4-C25-жирной кислоты при температуре от 265 до 275°C, с последующим проведением их повторной реакции при температуре от 315 до 325°C для получения наночастиц оксида железа.
Настоящее изобретение не ограничено указанными выше целями, и, наоборот, другие цели и преимущества настоящего изобретения будут очевидны из следующего подробного описания и четко понятны благодаря предпочтительным вариантам осуществления настоящего изобретения.
Кроме того, следует понимать, что другие цели, свойства и аспекты настоящего изобретения можно осуществлять средствами и/или способами и их сочетаниями, описываемыми в заявленной формуле изобретения.
БЛАГОПРИЯТНЫЕ ЭФФЕКТЫ
По настоящему изобретению (псевдо) парамагнитные наночастицы оксида железа, имеющие крайне малый и одинаковый размер 4 нм или менее, можно воспроизводимо и массово производить с использованием сырья при низких затратах с помощью более легкого способа получения по сравнению с существующими способами предшествующего уровня техники. Кроме того, размер наночастиц можно легко контролировать.
Кроме того, наночастицы оксида железа, производимые указанным выше способом, имеют одинаковое распределение по размеру, по сравнению с существующими способами предшествующего уровня техники, таким образом, обеспечивая постоянные T1-контрастные эффекты.
Кроме того, настоящее изобретение относится к контрастному веществу для T1-режима, включающему (псевдо) парамагнитные наночастицы оксида железа, таким образом, делающему возможным высокое качество T1-контраста, которое нельзя получать существующими способами предшествующего уровня техники.
ОПИСАНИЕ ЧЕРТЕЖЕЙ
Указанные выше и другие цели, свойства и преимущества настоящего изобретения станут очевидными из следующего описания предпочтительных вариантов осуществления, приведенных в сочетании с сопутствующими чертежами, в которых:
на фиг.1 представлены изображения наночастиц оксида железа размером 3 нм, синтезированных описываемым в примере 1 способом, полученные с помощью трансмиссионной электронной микроскопии (TEM), более конкретно: (a) полученное с помощью TEM изображение; (b) полученное с помощью TEM изображение в широком диапазоне; (c) полученное с помощью трансмиссионной электронной микроскопии изображение высокого разрешения (HR-TEM) и (d) микродифракционная электронограмма (SAED);
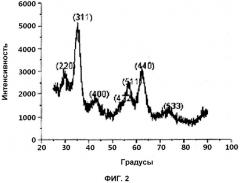
на фиг.2 представлен спектр дифракции рентгеновских лучей (XRD) наночастиц размером 3 нм, синтезированных описываемым в примере 1 способом;
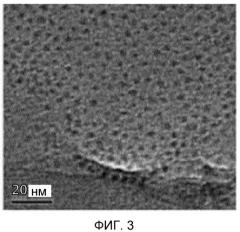
на фиг.3 представлено полученное с помощью TEM изображение наночастиц оксида железа размером 2,3 нм, синтезированных описываемым в примере 2 способом;
на фиг.4 представлено полученное с помощью TEM изображение наночастиц оксида железа размером 1,8 нм, синтезированных описываемым в примере 3 способом;
на фиг.5 представлено полученное с помощью TEM изображение наночастиц оксида железа размером 3,3 нм, синтезированных описываемым в примере 4 способом;
на фиг.6 представлено полученное с помощью TEM изображение наночастиц оксида железа размером 3,5 нм, синтезированных описываемым в примере 5 способом;
на фиг.7 представлено полученное с помощью TEM изображение наночастиц оксида железа размером 1,6 нм, синтезированных описываемым в примере 6 способом;
на фиг.8 представлено полученное с помощью TEM изображение наночастиц оксида железа размером 2,4 нм, синтезированных описываемым в примере 7 способом;
на фиг.9 представлено полученное с помощью TEM изображение наночастиц оксида железа размером 3,5 нм, синтезированных описываемым в примере 8 способом;
на фиг.10 представлено полученное с помощью TEM изображение наночастиц оксида железа размером 2,3 нм, синтезированных описываемым в примере 9 способом;
на фиг.11 (a) представлено полученное с помощью TEM изображение наночастиц оксида железа размером 2,7 нм, синтезированных описываемым в примере 10 способом; (b) представлено полученное с помощью TEM изображение наночастиц оксида железа, синтезированных описываемым в сравнительном примере 1 способом; и (c) представлено полученное с помощью TEM изображение наночастиц оксида железа, синтезированных описываемым в сравнительном примере 2 способом;
на фиг.12 (a) представлены M-H-графики при 5 K и 300 K соответственно, для наночастиц размером 3 нм, синтезированных описываемым в примере 1 способом; (b) представлены изменения M-H-графика при 300 K для наночастиц с изменением размера частиц; (c) представлены M-T-графики при охлаждении в нулевом магнитном поле и охлаждении в магнитном поле для наночастиц размером 2,3 нм, синтезированных описываемым в примере 2 способом, соответственно; (d) представлен M-T-график для наночастиц размером 3 нм, синтезированных описываемым в примере 1 способом; (e) представлен M-T-график для наночастиц размером 12 нм, синтезированных описываемым в сравнительном примере 3 способом; (f) представлены M-H-графики при 5 K и 300 K соответственно, для наночастиц размером 1,6 нм, синтезированных описываемым в примере 6 способом; (g) представлен M-T-график для наночастиц из примера 6; и (h) представлены M-H-графики при 5 K и 300 K соответственно, для наночастиц размером 2,3 нм, синтезированных описываемым в примере 9 способом;
на фиг.13 показано распределение среднечисловых гидродинамических размеров (среднее число 11,8 нм) наночастиц размером 3 нм, диспергированных в воде с использованием PEG-фосфата (PO-PEG) описываемым в примере 13 способом;
на фиг.14 представлены мнимые изображения при T1-режиме МРТ дисперсий, полученных сначала модификацией поверхности наночастиц оксида железа PEG-фосфатом (PO-PEG) и фосфолипид-PEG соответственно, с размером частиц, и затем вторичным диспергированием наночастиц с модифицированной поверхностью в воде; в частности, в случае, когда PO-PEG используют для обработки наночастиц размером 2,3 нм, 3 нм, 4 нм и 7 нм, каждый из них обозначают как 2,3P, 3P и 4P соответственно; аналогично, в случае когда фосфолипид-PEG используют для обработки указанных выше наночастиц, каждую из них обозначают как 2,3L, 3L, 4L и 7L;
на фиг.15 представлены результаты мнимых МРТ-изображений клеток для наночастиц размером 3 нм и наночастиц размером 12 нм соответственно; в частности на (a) представлено мнимое МРТ-изображение клеток для наночастиц размером 3 нм; и на (b) представлено ложное МРТ-изображение клеток для наночастиц размером 12 нм;
на фиг.16 представлены четкие контрастные изображения яремных вен, сонных артерий и дуги аорты, полученные с использованием наночастицы по настоящему изобретению, по сравнению с комплексом гадолиния Gadovist® (Bayer Schering Co.). На (a) представлено контрастное МРТ-изображение сосудов in vivo, полученное с использованием наночастиц размером 3 нм; и на (b) представлено контрастное МРТ-изображение сосудов in vivo, полученное с использованием Gadovist®;
на фиг.17 представлено полученное с помощью TEM изображение наночастиц оксида железа размером 4 нм, синтезированных описываемым в примере 20 способом;
на фиг.18 представлены результаты анализа MTT для MCF-7 клеток с использованием гидрофильно-модифицированных наночастиц оксида железа по примеру 21;
на фиг.19 представлены результаты анализа молекулярной массы наночастиц оксида железа посредством MALDI-TOF в примере 22;
на фиг.20 представлено полученное с помощью TEM изображение наночастиц оксида железа размером 12 нм, синтезированных описываемым в сравнительном примере 3 способом;
на фиг.21 представлено полученное с помощью TEM изображение наночастиц оксида железа размером 12 нм, синтезированных описываемым в сравнительном примере 4 способом;
на фиг.22 представлено полученное с помощью TEM изображение наночастиц оксида железа размером 7 нм, синтезированных описываемым в сравнительном примере 5 способом;
на фиг.23 представлено полученное с помощью TEM изображение наночастиц оксида железа размером 4 нм, инкапсулированных в форме агрегата с последующим негативным окрашиванием, описываемым в сравнительном примере 6 способом; и
на фиг.24 представлено полученное с помощью TEM изображение наночастиц оксида железа размером 6 нм, синтезированных по сравнительному примеру 7,
на фиг.25 представлены усиленные контрастные МРТ-изображения сосудов, полученные с использованием наночастиц размером 3 нм, покрытых глюкозо-6-фосфатом, описываемых в примере 17.
ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
Указанные выше цели, свойства и преимущества станут более очевидными из следующего описания предпочтительных вариантов осуществления настоящего изобретения со ссылкой на сопутствующие чертежи, приведенные далее в настоящей заявке. Таким образом, специалист в области, к которой относится настоящее изобретение, легко осуществит технические идеи или сущность настоящего изобретения. Кроме того, терминология, используемая в настоящем описании, включает значения, общепринятые специалистами в этой области, если не указано иначе. Когда технические конфигурации, известные в предшествующем уровне техники, как считают, делают содержание настоящего изобретения неясным, их подробное описание опускают.
Далее в настоящем описании предпочтительные варианты осуществления настоящего изобретения будут подробно описываться со ссылкой на сопутствующие чертежи.
Способ получения наночастиц оксида железа по настоящему изобретению включает (a) проведение реакции: комплекса железа, содержащего железо в качестве центрального атома и карбоксилатную группу с 4-25 атомами углерода ("C4-C25-карбоксилатную группу", далее в настоящем описании обозначаемую, как указано выше), связанную с центральным атомом в форме лиганда; C4-C25-жирной кислотой; и C4-C25-алифатическим спиртом или C4-C25-алифатическим амином при температуре от 150 до 350°C для получения наночастиц оксида железа и дополнительно включает после получения (a) (b) диспергирование преципитата в органическом растворителе, где преципитат получают охлаждением и промыванием описываемых выше наночастиц.
Предшественник железа, используемый в получении (a) наночастиц оксида железа, может иметь атом железа и связанную с ним группу C10-C22-жирной кислоты в форме лиганда, и примеры таких лигандов могут включать: стеариновую кислоту; олеиновую кислоту; линолевую кислоту; пальмитиновую кислоту; пальмитолеиновую кислоту; миристиновую кислоту; лауриновую кислоту; арахидоновую кислоту; бегеновую кислоту или т.п. Более предпочтительно, предшественник железа, используемый в настоящем описании, является олеатом железа.
Жирная кислота и алифатический спирт, используемые в получении (a) наночастиц оксида железа, могут включать C10-C22-жирную кислоту, C10-C22-алифатический спирт и/или C10-C22-алифатический амин. Примеры жирной кислоты могут включать: стеариновую кислоту; олеиновую кислоту; линолевую кислоту; пальмитиновую кислоту; пальмитолеиновую кислоту; миристиновую кислоту; лауриновую кислоту; арахидоновую кислоту; рицинолеиновую кислоту; бегеновую кислоту или т.п. Примеры алифатического спирта могут включать: стеариловый спирт (октадеканол); олеиловый спирт; линолеиловый спирт; гескадеканол; пальмитолеиловый спирт; тетрадеканол; додеканол; арахидиловый спирт; эйкозанол; докозанол; гексадекандиол или т.п. Кроме того, примеры алифатического амина могут включать: стеариламин (октадециламин); олеиламин; гексадециламин; пальмитиламин; тетрадециламин; додециламин; арахидиламин или т.п.
Более предпочтительно, жирная кислота и алифатический спирт, используемые в настоящем описании, являются олеиновой кислотой и олеиловым спиртом соответственно. Аналогично, алифатический амин, используемый в настоящем описании, является олеиламином.
Что касается практических условий обработки, получение наночастиц оксида железа можно осуществлять нагреванием реакционных материалов, т.е. комплекса железа, жирной кислоты и алифатического спирта (или алифатического амина), в смешанном состоянии от комнатной температуры до 200-310°C со скоростью повышения температуры 5°C/мин или более, позволяя реакции протекать при температуре от 200 до 310°C в течение периода от 5 до 60 минут.
Наночастицы оксида железа, получаемые в настоящем изобретении, могут иметь размер 4 нм или менее. Характеристики наночастиц оксида железа, получаемых способом получения по настоящему изобретению, описаны ниже.
На фиг.1 (a) и (b) представлены полученные с помощью TEM изображения наночастиц оксида железа размером 3 нм. На фигурах можно видеть, что наночастицы крайне малы и одинаковы. На фиг.1 (b) представлена обширная область изображения для демонстрации того, что небольшие частицы не агрегируют, а однородно распределяются на всем протяжении обширной области без примеси больших частиц. По сравнению с наночастицами металлов, оксид с низкой электронной плотностью и, таким образом, крайне малые частицы оксида не наблюдают при TEM четко. Таким образом, как показано на фиг.1 (c), структуру решетки нечетко определяют при HR-TEM из-за энергии электронного пучка при TEM. Но на фиг.1 (d) показаны пики (311, 400) типичной структуры магнетита или маггемита на электронограмме (ED).
Фиг.2 представляет собой спектр XRD наночастиц размером 3 нм. На фигуре можно видеть, что наночастицы размером 3 нм имеют структуру магнетита или маггемита, хотя они демонстрируют относительно широкие пики (311, 400, 440) благодаря своему малому размеру. Четко различать магнетит и маггемит очень трудно, т.к. дифракционные рентгенограммы этих двух структур очень схожи. Согласно вычислению по уравнению Дебая-Шеррера наночастицы имеют размер 3 нм, являющийся тем же размером, что и на полученных с помощью TEM изображениях (фиг.1), таким образом, демонстрируя превосходную кристалличность.
Размер наночастиц оксида железа, получаемых по настоящему изобретению, можно контролировать, регулируя молярное отношение реагирующих материалов, таких как C4-C25-жирная кислота или C4-C25-алифатический спирт (или алифатический амин), вводимых при получении.
По настоящему изобретению размер наночастиц оксида железа можно снижать, снижая концентрацию предшественника железа, таким образом, контролируя размер наночастиц оксида железа.
Когда повышают количество алифатического спирта (или алифатического амина), как одного из реакционных материалов, можно синтезировать наночастицы со сниженным размером. Однако контроль размера может зависеть от типов реакционных материалов и/или условий реакции.
Например, в случае когда в качестве предшественника железа используют олеат железа, можно получать наночастицы с меньшим размером, снижая концентрацию реакционного материала, т.е. олеата железа. Т.е. наночастицы размером 3 нм, синтезированные с исходной концентрацией предшественника 0,2M; и наночастицы размером 2,3 нм, синтезированные с исходной концентрацией предшественника 0,1M. В результате, следует понимать, что размер наночастиц оксида железа можно контролировать через количество предшественника железа.
Что касается контроля размера на основе отношения между алифатическим спиртом (или алифатическим амином) и жирной кислотой, указанное выше отношение не рассматривают как существенно влияющее на размер наночастиц. Однако размер наночастиц снижают, повышая количество алифатического спирта, такого