Производные бис-бензимидазола в качестве ингибиторов вируса гепатита с
Иллюстрации
Показать всеИзобретение относится к области органической химии, а именно к производным бис-бензимидазола формулы I и к его возможным стереоизомерам, фармацевтически приемлемым солям и сольватам, где R и R' независимо выбраны из -CR1R2R3, фенила, замещенного 1 заместителем, выбранным из галогена; и тетрагидрофуранила, где R1 выбран из С1-4алкила, необязательно замещенного метокси, гидроксилом или диметиламино; С3-6циклоалкила; фенила, необязательно замещенного 1, 2 или 3 заместителями, независимо выбранными из галогена, С1-4алкокси, трифторметокси, или 2 заместителя на соседних атомах кольца образуют 1,3-диоксолановую группу; бензила, замещенного галогеном или метокси; пиридинила; индолила; пиридинилметила и индолилметила; R2 выбран из водорода, гидроксила, ди-С1-4алкиламино, (С3-6циклоалкил) (С1-4алкил)амино, С1-4алкилкарбониламино, фениламино, С1-4алкилоксикарбониламино, (С1-4алкилоксикарбонил)(С1-4алкил)амино, С1-4алкиламинокарбониламино, тетрагидро-2-оксо-1(2Н)-пиримидинила, пирролидин-1-ила, пиперидин-1-ила, 3,3-дифторпиперидин-1-ила, морфолин-1-ила, 7-азабицикло[2.2.1]гепт-7-ила и имидазол-1-ила; и R3 представляет собой водород или С1-4алкил или CR2R3 вместе образуют карбонил; или CR1R3 образует циклопропильную группу. Также изобретение относится к фармацевтической композиции на основе соединения формулы I. Технический результат: получены производные бис-бензимидазола, обладающие ингибирующей активностью в отношении вируса гепатита С. 2 н. и 7 з.п. ф-лы, 4 табл., 3 пр.
Реферат
Область техники, к которой относится изобретение
Это изобретение относится к производным бис-безимидазола, которые являются ингибиторами вируса гепатита C (HCV), их синтезу и их применению, отдельно или в сочетании с другими ингибиторами HCV, для лечения или профилактики HCV.
Предшествующий уровень техники
HCV представляет собой одноцепочечный положительный РНК-вирус, относящийся к семейству вирусов Flaviviridae рода hepacivirus. Геном вируса транслируется в единую открытую рамку считывания, которая кодирует множество структурных и неструктурных белков.
После первоначальной острой инфекции у большинства инфицированных индивидов развивается хронический гепатит, поскольку HCV реплицируется предпочтительно в гепатоцитах, но не является непосредственно цитопатическим. В частности, отсутствие интенсивного T-лимфоцитарного ответа и высокая способность вируса к мутациям, по-видимому, обеспечивают высокий уровень хронической инфекции. Хронический гепатит может прогрессировать в печеночный фиброз, приводящий к циррозу, заболеванию печени конечной стадии, и в HCC (печеночно-клеточную карциному), что делает его основной причиной трансплантаций печени.
Существуют 6 основных генотипов HCV и более 50 подтипов, которые географически распределены по-разному. HCV 1 типа представляет собой преобладающий генотип в Европе и США. Выраженная генетическая гетерогенность HCV имеет высокое диагностическое и клиническое значение, являясь возможным объяснением трудностей в разработке вакцины и отсутствия ответа на лечение.
HCV может передаваться через контакт с зараженной кровью или продуктами крови, например, после переливания крови или внутривенного введения лекарственного средства. Внедрение диагностических тестов, используемых для скрининга крови, вызвало тенденцию к понижению встречаемости посттрансфузионного заражения HCV. Однако учитывая медленное прогрессирование в заболевание печени конечной стадии существующие инфекции будут оставаться серьезной медицинской и экономической проблемой в течение десятилетий.
Современные способы лечения HCV основаны на (пегилированном) интерфероне-альфа (IFN-α) в сочетании с рибавирином. Эта комбинированная терапия приводит к замедленному вирусологическому ответу более чем у 40% пациентов, инфицированных вирусами 1 генотипа и приблизительно у 80% пациентов, инфицированных 2 и 3 генотипами. Помимо ограниченной эффективности в отношении HCV 1 генотипа, эта комбинированная терапия обладает значительными побочными эффектами, включая гриппоподобные симптомы, гематологические нарушения и нейропсихиатрические симптомы. Таким образом, существует необходимость в более эффективных, более удобных и лучше переносимых способах лечения.
Опыт, связанный с лекарственными средствами против ВИЧ, и, в частности, с ингибиторами протеазы ВИЧ, показал, что субоптимальная фармакокинетика и комплексные схемы дозирования быстро приводят к непредусмотренным проблемам, связанным с режимом лечения. Это, в свою очередь, означает, что 24-часовая минимальная концентрация (минимальная концентрация в плазме) соответствующих лекарственных средств в схеме лечения ВИЧ часто снижается ниже порога IC90 или ED90 на большую часть дня. Полагают, что 24-часовой минимальный уровень по меньшей мере IC50 и, более реалистично, IC90 или ED90 является необходимым для замедления возникновения устойчивых к лекарственному средству мутантных форм. Достижение необходимой фармакокинетики и метаболизма лекарственного средства для обеспечения таких минимальных уровней представляет собой важную задачу при разработке лекарственного средства.
Белок NS5A HCV расположен ниже белка NS4B и выше белка NS5B. После посттрансляционного расщепления вирусной сериновой протеазой NS3/4A, NS5A созревает в цинксодержащий фосфопротеин из трех доменов, который существует либо в виде гипофосфорилированной (56-кДа, p56), либо гиперфосфорилированной формах (58-кДа, p58). NS5A HCV вовлечен во множество аспектов жизненного цикла вируса, включая репликацию вируса и сборку инфекционных частиц, а также модулирование окружающей среды его клетки-хозяина. Хотя этому белку не приписывается ферментативная функция, описано, что он взаимодействует с многочисленными вирусными и клеточными факторами.
В ряде патентов и патентных заявок описаны соединения с ингибирующей активностью в отношении HCV, в частности нацеленные на NS5A. В WO2006/133326 описаны производные стилбена, а в WO2008/021927 и WO2008/021928 описаны бифенильные производные, обладающие активностью ингибирования NS5A HCV. В WO2008/048589 описаны производные 4-(фенилэтинил)-1H-пиразола и их противовирусное применение. В WO2008/070447 описан широкий диапазон ингибирующих HCV-соединений, включая бензимидазольную часть. Как в WO2010/017401, так и в WO2010/065681 описаны бис-имидазольные ингибиторы NS5A HCV.
Существует потребность в ингибиторах HCV, которые могут преодолеть недостатки современной терапии HCV, такие как побочные эффекты, ограниченная эффективность, возникновение устойчивости и несоблюдение пациентом режима лечения, а также улучшить ответ в виде постоянной вирусной нагрузки.
Настоящее изобретение относится к группе ингибирующих HCV бис-бензимидазольных производных с пригодными свойствами в отношении одного или нескольких из следующих параметров: противовирусная эффективность, благоприятный профиль развития устойчивости, снижение или отсутствие токсичности или генотоксичности, благоприятная фармакокинетика и фармакодинамика, простота изготовлении и введения и ограниченное взаимодействие лекарственное средство - лекарственное средство с другими лекарственными веществами, в частности с другими средствами против HCV, или его отсутствие.
Соединения по изобретению также могут быть привлекательными вследствие того факта, что они лишены активности против других вирусов, в частности против ВИЧ. ВИЧ-инфицированные пациенты часто страдают от коинфекций, таких как HCV. Лечение таких пациентов ингибитором HCV, который также ингибирует ВИЧ, может привести к появлению устойчивых к ВИЧ штаммов.
Описание изобретения
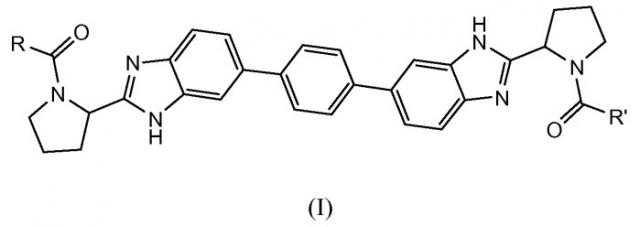
В одном аспекте настоящее изобретение относится к соединениям, которые могут быть представлены формулой I:
включая любые их возможные стереоизомеры, где
R и R' независимо выбраны из -CR1R2R3, арила, необязательно замещенного 1 или 2 заместителями, выбранными из галогена и метила, и гетероС4-7циклоалкила, где R1 выбран из C1-4алкила, необязательно замещенного метокси, гидроксилом или диметиламино; C3-6циклоалкила; тетрагидропиранила; фенила, необязательно замещенного 1, 2 или 3 заместителями, независимо выбранными из галогена, C1-4алкокси, трифторметокси, или 2 заместителя на соседних атомах кольца образуют 1,3-диоксолановую группу; бензила, необязательно замещенного галогеном или метокси; гетероарила и гетероарилметила;
R2 выбран из водорода, гидроксила, амино, моно- и ди-C1-4алкиламино, (C3-6циклоалкил)(C1-4алкил)амино, C1-4алкилкарбониламино, фениламино, C1-4алкилоксикарбониламино, (C1-4алкилоксикарбонил)(C1-4алкил)амино, C1-4алкиламинокарбониламино, тетрагидро-2-оксо-1(2H)-пиримидинила, пирролидин-1-ила, пиперидин-1-ила, 3,3-дифторпиперидин-1-ила, морфолин-1-ила, 7-азабицикло[2.2.1]гепт-7-ила и имидазол-1-ила; и
R3 представляет собой водород или C1-4алкил, или
CR2R3 вместе образуют карбонил; или
CR1R3 образует циклопропильную группу;
и их фармацевтически приемлемым солям и сольватам.
В следующем аспекте изобретение относится к применению соединений формулы I или их подгрупп, как описано в настоящем документе, для ингибирования HCV. Альтернативно предусмотрено применение указанных соединений для изготовления лекарственного средства для ингибирования HCV.
Варианты осуществления настоящего изобретения относятся к соединениям формулы (I) или любой их подгруппе, как описано в настоящем документе, где применимо одно или несколько определений для R, R', R1, R2 и R3, как указано в настоящем документе.
Подгруппы соединений формулы I представляют собой соединения формулы I или подгруппы соединений формулы I, как определено в настоящем документе, где R и R' независимо представляют собой -CR1R2R3 или арил, где арил представляет собой 5-членный гетероарил; в частности, где R и R' независимо представляют собой -CR1R2R3; более конкретно, где R и R' представляют собой -CR1R2R3 и являются одинаковыми.
Подгруппы соединений формулы I представляют собой соединения формулы I или подгруппы соединений формулы I, как определено в настоящем документе, где R2 представляет собой гидроксил, амино, моно- или ди-C1-4алкиламино, C1-4алкилкарбониламино, C1-4алкилоксикарбониламино; в частности, R2 представляет собой C1-4алкилкарбониламино или C1-4алкилоксикарбониламино.
Подгруппы соединений формулы I представляют собой соединения формулы I или подгруппы соединений формулы I, как определено в настоящем документе, где R1 выбран из C1-4алкила; фенила, необязательно замещенного 1 или 2 заместителями, независимо выбранными из галогена, метила, метокси, или 2 заместителя на соседних атомах кольцах образуют 1,3-диоксолановую группу; и гетероарила. В частности, R1 выбран из разветвленного C3-4алкила; фенила, необязательно замещенного 1 заместителем, выбранным из галогена и метила; и гетероарила. Более конкретно, R1 выбран из разветвленного C3-4алкила; фенила, необязательно замещенного 1 заместителем, выбранным из галогена.
В первом варианте осуществления R и R' независимо выбраны из -CR1R2R3, арила, необязательно замещенного 1 или 2 заместителями, выбранными из галогена и метила, и гетероС4-7циклоалкила, где
R1 выбран из C1-4алкила, необязательно замещенного метокси или диметиламино; фенила, необязательно замещенного 1, 2 или 3 заместителями, независимо выбранными из галогена, C1-4алкокси, трифторметокси, или 2 заместителя на соседних атомах кольцах образуют 1,3-диоксолановую группу; бензила, необязательно замещенного галогеном или метокси; гетероарила и гетероарилметила;
R2 выбран из водорода, гидроксила, амино, моно- и ди-C1-4алкиламино, C1-4алкилкарбониламино, C1-4алкилоксикарбониламино, C1-4алкиламинокарбониламино, пиперидин-1-ила и имидазол-1-ила; и
R3 представляет собой водород, или R1 и R3 вместе образуют оксо или циклопропильную группу; или их фармацевтически приемлемая соль и/или сольват.
Во втором варианте осуществления R и R' независимо выбраны из -CR1R2R3, арила, необязательно замещенного 1 или 2 заместителями, выбранными из галогена и метила, и гетероС4-7циклоалкила, где
R1 выбран из C1-4алкила, необязательно замещенного метокси, гидроксилом или диметиламино; C3-6циклоалкила; фенила, необязательно замещенного 1, 2 или 3 заместителями, независимо выбранными из галогена, C1-4алкокси, трифторметокси, или 2 заместителя на соседних атомах кольцах образуют 1,3-диоксолановую группу; бензила, необязательно замещенного галогеном или метокси; гетероарила и гетероарилметила;
R2 выбран из водорода, гидроксила, амино, моно- и ди-C1-4алкиламино, (C3-6циклоалкил)(C1-4алкил)амино, C1-4алкилкарбониламино, фениламино, C1-4алкилоксикарбониламино, (C1-4алкилоксикарбонил)(C1-4алкид)амино, C1-4алкиламинокарбониламино, тетрагидро-2-оксо-1(2H)-пиримидинила, пирролидин-1-ила, пиперидин-1-ила, 3,3-дифторпиперидин-1-ила, морфолин-1-ила, 7-азабицикло[2.2.1]гепт-7-ила и имидазол-1-ила; и
R3 представляет собой водород или C1-4алкил, или
CR2R3 вместе образуют карбонил; или
CR1R3 образует циклопропильную группу;
и их фармацевтически приемлемые соли и сольваты;
при условии, что (a) когда R и R' являются идентичными и представляют собой -CR1R2R3, где (a-1) R2 представляет собой C1-4алкилоксикарбониламино и R3 представляет собой водород, тогда R1 отличен от незамещенного C1-4алкила, или этила, замещенного гидроксилом или метокси; или где (a-2) R2 представляет собой метилоксикарбониламино и R3 представляет собой водород, тогда R1 отличен от незамещенного фенила; и
(b) когда R и R' отличаются и каждый из них независимо представляет собой -CR1R2R3, где R1 представляет собой фенил или 2-пропил, R2 представляет собой диметиламин и R3 представляет собой водород в одной группе -CR1R2R3, тогда в другой группе -CR1R2R3 R1 не может принимать значение 2-пропила и R2 не может принимать значение метилоксикарбониламино и R3 не может принимать значение водорода.
В третьем варианте осуществления R и R' независимо выбраны из -CR1R2R3, где R1 выбран из фенила, необязательно замещенного 1, 2 или 3 заместителями, независимо выбранным из галогена, C1-4алкокси, трифторметокси, или 2 заместителя на соседних атомах кольцах образуют 1,3-диоксолановую группу;
R2 выбран из гидроксила, моно- или ди-C2-4алкиламино, (C3-6циклоалкил)(C1-4алкил)амино, C1-4алкилкарбониламино, (C1-4алкилоксикарбонил)(C1-4алкил)амино, C1-4алкиламинокарбониламино, тетрагидро-2-оксо-1(2H)-пиримидинила, пирролидин-1-ила, пиперидин-1-ила, 3,3-дифторпиперидин-1-ила, морфолин-1-ила, 7-азабицикло[2.2.1]гепт-7-ила и имидазол-1-ила; и
R3 представляет собой водород или C1-4алкил, или
CR2R3 вместе образуют карбонил; или
CR1R3 образует циклопропильную группу;
и их фармацевтически приемлемые соли и сольваты;
В четвертом варианте осуществления R1 выбран из гетероарила и гетероарилметила;
R2 выбран из водорода, моно- или ди-C1-4алкиламино, (C3-6циклоалкил)(C1-4алкил)амино, C1-4алкилкарбониламино, C1-4алкилоксикарбониламино, (C1-4алкилоксикарбонил)(C1-4алкил)амино, C1-4алкиламинокарбониламино, тетрагидро-2-оксо-1(2H)-пиримидинила, пирролидин-1-ила, пиперидин-1-ила, 3,3-дифторпиперидин-1-ила, морфолин-1-ила, 7-азабицикло[2.2.1]гепт-7-ила и имидазол-1-ила; и
R3 представляет собой водород;
и их фармацевтически приемлемые соли и сольваты.
В пятом варианте осуществления
R1 представляет собой C1-4алкил;
R2 выбран из C1-4алкиламинокарбониламино или тетрагидро-2-оксо-1(2H)-пиримидинила; и
R3 представляет собой водород или C1-4алкил;
и их фармацевтически приемлемые соли и сольваты.
В шестом варианте осуществления
R1 представляет собой C3-6циклоалкил;
R2 представляет собой водород
и R3 представляет собой водород;
и их фармацевтически приемлемые соли и сольваты.
В следующем аспекте изобретение относится к соединению формулы I или его фармацевтически приемлемой соли, гидрату или сольвату для применения для лечения или профилактики (или для изготовления лекарственного средства для лечения или профилактики) инфекции HCV. Типичные генотипы HCV в контексте лечения или профилактики согласно изобретению включают, но не ограничиваются ими, генотип 1b (преобладающий в Европе) и 1a (преобладающий в Северной Америке). Также изобретение относится к способу лечения или профилактики инфекции HCV, в частности генотипа 1a или 1b, включающему введение индивидууму, нуждающемуся в этом, терапевтически эффективного количества соединения, как определено в настоящем документе выше.
Чистые стереоизомерные формы соединений и промежуточных соединений, упоминаемых в настоящем документе, определяют как изомеры, по существу не содержащие других энантиомерных или диастереомерных форм той же основной молекулярной структуры указных соединений или промежуточных соединений. В частности, термин "стереоизомерно чистый" относится к соединениям или промежуточным соединениям, имеющим стереоизомерный избыток по меньшей мере 80% (т.е. минимум 90% одного изомера и максимум 10% других возможных изомеров) вплоть до стереоизомерного избытка 100% (т.е. 100% одного изомера и отсутствие другого изомера), более конкретно, соединения или промежуточные соединения, имеющие стереоизомерный избыток от 90% вплоть до 100%, еще более конкретно имеющие стереоизомерный избыток от 94% вплоть до 100% и наиболее конкретно имеющие стереоизомерный избыток от 97% вплоть до 100%. Термины "энантиомерно чистый" и "диастереомерно чистый" следует понимать аналогично, но рассматривая энантиомерный избыток и диастереомерный избыток, соответственно, данной смеси.
Чистые стереоизомерные формы или стереоизомеры соединений и промежуточных соединений по настоящему изобретению можно получать с использованием известных в данной области способов. Например, энантиомеры можно отделять друг от друга селективной кристаллизацией их диастереомерных солей с оптически активными кислотами или основаниями. Их примерами являются винная кислота, дибензоилвинная кислота, дитолуолвинная кислота и камфорсульфоновая кислота. Альтернативно энантиомеры можно разделять хроматографическими способами с использованием хиральных стационарных фаз. Указанные чистые стереохимически изомерные формы также можно получать из соответствующих чистых стереоизомерных форм соответствующих исходных материалов при условии, что реакция протекает стереоспецифично. Предпочтительно, если является желательным конкретный стереоизомер, указанное соединение синтезируют стереоспецифическими способами получения. В этих способах преимущественно используются энантиомерно чистые исходные материалы.
Диастереомерные рацематы соединений формулы I можно получать по отдельности общепринятыми способами. Соответствующими способами физического разделения, которые можно преимущественно использовать, являются, например, селективная кристаллизация и хроматография, например колоночная хроматография или сверхкритическая жидкостная хроматография.
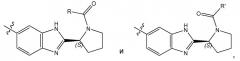
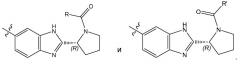
Соединения формулы имеют несколько центров хиральности. Интерес представляют стереогенные центры кольца пирролидина на 2 атоме углерода. Конфигурация в этом положении может соответствовать L-пролину, т.е.
или соответствовать D-пролину, т.е.
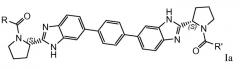
Особый интерес представляют соединения формулы I или их подгруппы, как определено в настоящем документе, которые соответствуют формуле Ia.
Также интерес представляет конфигурация группы -CR4R2R3: когда R1 выбран из C1-4алкила, необязательно замещенного метокси, гидроксилом или диметиламино; C3-6циклоалкила и тетрагидропиранила, тогда предпочтительной является S-конфигурация; когда R1 выбран из фенила, необязательно замещенного 1, 2 или 3 заместителями, независимо выбранными из галогена, C1-4алкокси, трифторметокси, или 2 заместителя на соседних атомах кольцах образуют 1,3-диоксолановую группу; и гетероарила; тогда предпочтительной является R-конфигурация.
Фармацевтически приемлемые аддитивные соли включают терапевтически активные нетоксичные кислотные и основно-аддитивные солевые формы соединений формулы (I) или их подгрупп. Интерес представляют свободные, т.е. несолевые формы соединений формулы I, или любой подгруппы соединений формулы I, указанных в настоящем документе.
Фармацевтически приемлемые кислотно-аддитивные соли можно удобным образом получать путем обработки основной формы такой подходящей кислотой. Подходящие кислоты включают, например, неорганические кислоты, такие как галогенводородные кислоты, например, хлористоводородная или бромистоводородная кислота, серная, азотная, фосфорная кислоты и т.п.; или органические кислоты, например, такие как уксусная, пропионовая, гидроксиуксусная, молочная, пировиноградная, щавелевая (т.е. этандиовая), малоновая, янтарная (т.е. бутандиовая кислота), малеиновая, фумаровая, яблочная (т.е. гидроксибутандиовая кислота), винная, лимонная, метансульфоновая, этансульфоновая, бензолсульфоновая, п-толуолсульфоновая, цикламовая, салициловая, п-аминосалициловая, памовая кислоты и т.п. Наоборот, указанные солевые формы можно превращать обработкой соответствующим основанием в форму свободного основания.
Соединения формулы (I), содержащие кислотный протон, также можно превращать в их основно-аддитивные соли, в частности аддитивные солевые формы металлов или аминов, путем обработки подходящими органическими и неорганическими основаниями. Подходящие солевые формы включают, например, соли аммония, соли щелочных и щелочноземельных металлов, например соли лития, натрия, калия, магния, кальция и т.п., соли с органическими основаниями, например, бензатином, N-метил-D-глюкамином, соли гидрабамина и соли с аминокислотами, например, такими как аргинин, лизин и т.п.
Термин "сольваты" охватывает любые фармацевтически приемлемые сольваты, которые соединения формулы I, а также их соли способны образовывать. Такие сольваты представляют собой, например, гидраты, алкоголяты, например, этаноляты, пропаноляты и т.п.
Некоторые из соединений формулы I также могут существовать в таутомерных формах. Например, таутомерными формами амидных (-C(=O)-NH-) групп являются иминоспирты (-C(OH)=N-). Подразумевается, что таутомерные формы, хотя и не указаны явно в структурных формулах, представленных в настоящем документе, включены в объем настоящего изобретения.
Как используют в настоящем документе, "C1-4алкил" в качестве группы или части группы определяет насыщенные прямые или разветвленные углеводородные группы, имеющие от 1 до 4 атомов углерода, например, такие как метил, этил, 1-пропил, 2-пропил, 1-бутил, 2-бутил, 2-метил-1-пропил, 2-метил-2-пропил. Для целей настоящего изобретения среди C1-4алкилов интерес представляют C3-4алкилы, т.е. прямые или разветвленные углеводородные группы, имеющие 3 или 4 атома углерода, такие как 1-пропил, 2-пропил, 1-бутил, 2-бутил, 2-метил-1-пропил, 2-метил-2-пропил. Особый интерес может представлять разветвленный C3-4алкил, такой как 2-пропил, 2-бутил, 2-метил-1-пропил, 2-метил-2-пропил.
Термин "C3-6циклоалкил" в качестве группы или ее части определяет насыщенные циклические углеводородные группы, имеющие от 3 до 6 атомов углерода, которые вместе образуют циклическую структуру. Примеры C3-6циклоалкила включают циклопропил, циклобутил, циклопентил и циклогексил.
"C1-4алкокси" в качестве группы или части группы означает группу формулы -O-C1-4алкил, где C1-4алкил является таким, как определено выше. Примерами C1-4алкокси являются метокси, этокси, н-пропокси, изопропокси.
Термин "галоген" является общим для фтора, хлора, брома и йода.
Как используют в настоящем документе, термин "(=O)" или "оксо" образует карбонильную группу, когда она присоединена к атому углерода. Следует отметить, что атом может быть замещен только оксогруппой, когда валентность этого атома допускает это.
Как используют в настоящем документе "арил" для цели определения в качестве группы или ее части означает ароматическую кольцевую структуру, необязательно содержащую один или два гетероатома, выбранных из N, O и S, в частности из N и O. Указанная ароматическая кольцевая структура может иметь 5 или 6 атомов в кольце.
Как используют в настоящем документе, приставка "гетеро-" в определении группы означает, что группа содержит по меньшей мере 1 гетероатом, выбранный из N, O и S, в частности N и O. Например, термин "гетероарил" означает ароматическую кольцевую структуру, как определено для термина "арил", содержащую по меньшей мере 1 гетероатом, выбранный из N, O и S, в частности из N и O, например, фуранил, оксазолил, пиридинил. Альтернативно термин "гетероС4-7циклоалкил" означает насыщенные углеводородные группы, содержащие по меньшей мере 1 гетероатом, выбранный из N, O и S, в частности из N и O, например, тетрагидрофуранил, тетрагидропиранил, пиперидинил.
Когда положение группы на молекулярной части не указано (например, заместитель на фениле) или представлено нефиксированной связью, такая группа может быть расположена на любом атоме такой части при условии, что полученная структура является химически стабильной. Когда какая-либо переменная присутствует в молекуле более одного раза, каждое определение является независимым.
Когда термин "соединения формулы I", или "настоящие соединения" или сходные термины используют в настоящем документе, он включает соединения формулы I, включающие возможные его стереоизомерные формы и фармацевтически приемлемые соли и сольваты.
Общие способы синтеза
Схема 1
Соединения формулы I, где R и R' являются одинаковыми, можно получать с использованием синтетических реакций, проиллюстрированных на схеме 1 выше. Окислительная циклизация N-(трет-бутоксикарбонил)-L-пролиналя с 4-бромбензол-1,2-диамином приводит к производному бензимидазола II, которое превращается в бороновый сложный эфир III в катализируемых Pd условиях в присутствии бис(пинаколято)дибора. Затем бороновый сложный эфир III превращают в соединение IV путем связывания с 1,4-дийодбензолом с использованием условий Сузуки-Майяра. Альтернативно вместо 1,4-дийодбензола можно использовать 1,4-дибромбензол. Пригодным Pd-катализатором является дихлор-((бис-дифенилфосфино)ферроценил)палладий(II) (Pd(dppf)Cl2). Соединение V получают после удаления трет-бутоксикарбонильной (Boc) защитной группы азота пирролидина в кислотных условиях, например, с использованием HCl в изопропаноле. Затем полученное соединение V можно превращать в соединение формулы I ацилированием соответствующей кислотой формулы R-C(=O)-OH, где R имеет значения R и R', как определено для соединений формулы I или любой их подгруппы.
Указанное ацилирование можно проводить путем реакции исходных материалов в присутствии агента реакции сочетания или путем превращения карбоксильной функциональной группы в активную форму, такую как активный сложный эфир, смешанный ангидрид или хлорид, или бромид карбоновой кислоты. Общие описания таких реакций сочетания и реагентов, используемых в них, могут быть найдены в общих справочниках по химии пептидов, например, M. Bodanszky, "Peptide Chemistry", 2nd rev. ed., Springer-Verlag, Berlin, Germany, (1993).
Примеры реакций сочетания для ацилирования по аминогруппе или образования амидной связи включают азидный способ, способ смешанного ангидрида угольной-карбоновой кислоты (изобутилхлорформиат), карбодиимидный способ (дициклогексилкарбодиимид, диизопропилкарбодиимид или растворимый в воде карбодиимид, такой как N-этил-N'-[3-(диметиламино)пропил]карбодиимид), способ активного сложного эфира (например, п-нитрофенилового, п-хлорфенилового, трихлорфенилового, пентахлорфенилового, пентафторфенилового, N-гидроксиянтарного имидо- сложных эфиров и т.п.), способ с реагентом K Вудводрда, способ 1,1-карбонилдиимидазола (CDI или N,N'-карбонилдиимидазол), способы фосфорных реагентов или окислительно-восстановительные способы. Некоторые из этих способов можно усиливать добавлением пригодных катализаторов, например в способе карбодиимида - добавлением 1-гидроксибензотриазола или 4-DMAP. Следующими агентами реакции сочетания являются гексафторфосфат (бензотриазол-1-илокси)-трис-(диметиламино)фосфония либо самостоятельно, либо в присутствии 1-гидроксибензотриазола или 4-DMAP; или тетрафторборат 2-(1H-бензотриазол-1-ил)-N,N,N',N'-тетраметилурония (TBTU), или гексафторфосфат O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония (HATU). Эти реакции сочетания можно проводить либо в фазе раствора (жидкая фаза), либо в твердой фазе. Для целей настоящего изобретения предпочтительный способ ацилирования проводят с использованием HATU.
Реакции сочетания предпочтительно проводят в инертных растворителях, таких как галогенированные углеводороды, например, дихлорметан, хлороформ, диполярные апротонные растворители, такие как ацетонитрил, диметилформамид, диметилацетамид, DMSO, HMPT или простые эфиры, такие как тетрагидрофуран (THF).
Во многих случаях реакции сочетания проводят в присутствии пригодного основания, такого как третичный амин, например, триэтиламин, диизопропилэтиламин (DIPEA), N-метилморфолин, N-метилпирролидин, 4-DMAP или 1,8-диазабицикло[5.4.0]ундец-7-ен (DBU). Температура реакции может находиться в диапазоне от 0°С до 50°С и время реакции может находиться диапазоне от 15 мин до 24 ч.
Схема 2
Альтернативно соединения формулы I, где R и R' не являются одинаковыми, т.е. соединения формулы XIII, можно получать с использованием синтетического пути, проиллюстрированного на схеме 2. С использованием стандартных условий Сузуки-Майяра, можно проводить реакцию сочетания боронового сложного эфира III и 1,4-дийодбензола в условиях, сравнимых с условиями, используемыми для превращения III в IV (схема 1), за исключением того, что соотношение 1,4-дийодбензола и боронового сложного эфира III составляет приблизительно 1 к 1, возможно выше, для получения монойодида VII. Альтернативно вместо 1,4-дийодбензола можно использовать 1,4-дибромбензол. Затем VII можно подвергать реакции сочетания с бороновым сложным эфиром VIII. Следует понимать, что аминозащитную группу PG на азоте пирролидина в бороновом сложном эфире VIII следует выбирать так, чтобы ее можно было удалить в условиях, которые не влияют на Boc-группу или R-C(=O)-группу на другом азоте в молекуле. Также следует понимать, что PG также может представлять собой R'-C(=O)-группу конечного синтезируемого соединения формулы I. Реакцию сочетания VII и VIII можно вновь проводить с использованием стандартных условий Сузуки-Майяра, и получать соединение IX. Затем из соединения IX можно селективно удалять защитную группу с получением соединения X с использованием условий, подходящих для удаления Boc-защитной группы. Например, в случае, когда PG представляет собой бензилоксикарбонил или бензил, Boc-защитную группу можно селективно удалять в стандартных условиях удаления защитной группы Boc, т.е. путем обработки кислотой.
Более того, в случае, когда PG представляет собой бензилоксикарбонил или бензил, PG можно селективно удалять восстановительной обработкой, оставляющей R-C(=O)-группу в соединении XI незатронутой. Другие пригодные защитные группы PG и соответствующие условия селективного удаления защитных групп могут быть найдены в Greene, "Protective groups in organic synthesis", Peter G. M. Wuts, Fourth Edition, Chapter 7: "Protection for the Amino group". Затем соединение X можно ацилировать соответствующей кислотой формулы R-C(=O)-OH, где R имеет значения R, как определено для соединений формулы I или любой их подгруппы. Получают соединение XI.
Для соединения XI, в случае, когда PG представляет собой -(C=O)-R', соединение XI совпадает с соединением XIII. В случае, когда PG представляет собой аминозащитную группу, PG можно удалять в условиях, совместимых с -(C=O)-R, например путем гидрогенизации, когда PG представляет собой бензил или бензилоксикарбонил, или в основных условиях, таких как диэтиламин, в случае, когда PG представляет собой флуоренилметилоксикарбонил, с получением соединения XII. Другие способы селективного удаления защитных групп могут быть найдены в справочнике Greene.
В случае, когда -(C=O)-R несовместим с условиями удаления защитной группы PG, можно использовать путь, представленный на схеме 5, где защитная группа PG выбрана так, чтобы она была совместима с группой Boc.
Соединения XII можно превращать в соединение XIII ацилированием, сходным с превращением XIV в XV, V в I и X в XI, и как подробно описано для превращения V в I согласно схеме 1.
Схема 3
Схема 4
Бороновый сложный эфир VIII можно получать по меньшей мере двумя различными путями, как проиллюстрировано на схемах 3 и 4. В случае, когда PG представляет собой защитную группу, например, такую как бензилоксикарбонил, флуоренилметилоксикарбонил, бензил или другую пригодную защитную группу PG, как описано в справочнике Greene, соединение можно синтезировать способами, используемыми для синтеза промежуточных соединений II и IIa (см. пример 2), и боронового сложного эфира III, начиная с соответствующим образом защищенного производного пирролидина. В случае, когда PG представляет собой -(C=O)-R', соединение можно получать из промежуточного соединения II, как представлено на схеме 4, путем удаления защитной группы азота пролина в кислых условиях, таких как обработка HCl, например, в iPrOH, или трифторуксусной кислотой с получением соединения XIV, с последующей реакцией конденсации в стандартных условиях ацилирования, таких как применение HATU в присутствии основания, такого как DIPEA. Далее полученный бромид XV можно превращать в бороновую кислоту VIII (где PG представляет собой -(C=O)-R'), как например, как превращение II в III.
Схема 5
Альтернативно, как показано на схеме 5, защитную группу соединения IX можно удалять в условиях, совместимых с защитной группой Boc, например, путем гидрогенизации, когда PG представляет собой бензил или бензилоксикарбонил, или в основных условиях, таких как диэтиламин, в случае, когда PG представляет собой флуоренилметилоксикарбонил, с получением соединения XVI. Другие способы селективного удаления защитных групп могут быть найдены в справочнике Greene. В этом случае соединение XVI совпадает с соединением X, причем PG представляет собой Boc. В этом случае удаление защитной группы из XI-XII можно проводить в условиях, сходных с превращением II в XIV и IV в V.
Способы синтеза, представленные выше на схемах 1-5, также можно проводить с использованием рацемических производных пролина или производных D-пролина вместо L-пролина. Таким образом, можно получать соединения формулы I с альтернативной стереохимией.
В следующем аспекте настоящее изобретение относится к фармацевтической композиции, содержащей терапевтически эффективное количество соединения формулы I, как описано в настоящем описании, и фармацевтически приемлемый носитель. Терапевтически эффективное количество в данном случае представляет собой количество, достаточное для стабилизации или снижения инфекции HCV у инфицированных индивидуумов, или количество, достаточное для предупреждения инфекции HCV у индивидуумов, обладающих риском инфицирования. В следующем аспекте это изобретение относится к способу получения фармацевтической композиции, как описано в настоящем описании, который включает смешение в однородную смесь фармацевтически приемлемого носителя с терапевтически эффективным количеством соединения формулы I, как описано в настоящем описании.
Таким образом, для целей введения соединения по настоящему изобретению или любую их подгруппу можно изготавливать в виде различных фармацевтических форм. В качестве пригодных композиций можно назвать все композиции, обычно используемые для системного введения лекарственных средств. Для получения фармацевтических композиций по настоящему изобретению, эффективное количество конкретного соединения необязательно в форме аддитивной соли или комплекса с металлом в качестве активного ингредиента смешивают в однородную смесь с фармацевтически приемлемым носителем, который может находиться в различных в формах в зависимости от желательной формы препарата для введения. Желательно, чтобы эти фармацевтические композиции были представлены в единичной дозированной форме, в частности для перорального, ректального, подкожного введения или для парентеральной инъекции. Например, для получения композиций в пероральной дозированной форме можно использовать любую обычную фармацевтическую среду, например такую как вода, гликоли, масла, спирты и т.п. в случае пероральных жидких препаратов, таких как суспензии, сиропы, эликсиры, эмульсии и растворы; или твердые носители, такие как крахмалы, сахара, каолин, лубриканты, связующие вещества, дезинтегрирующие вещества и т.п. в случае порошков, пилюль, капсул и таблеток. Вследствие простоты введения таблетки и капсулы представляют собой наиболее пр