Элюирующий стент с емкостями
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к разработке расширяемых медицинских устройств, в частности стентов, и может быть использовано для лечения рестеноза в просвете сосуда. Предложенное имплантируемое медицинское устройство включает интралюминальный каркас (ИК), содержащий множество выполненных в нём отверстий. При этом ИК имеет трубчатую конфигурацию и включает множество цилиндрических секций, соединенных между собой множеством соединительных элементов. Каждая из цилиндрических секций ИК сформирована из сетки удлиненных распорок, которые соединены между собой пластическими шарнирами и окружными распорками. При этом в разные отверстия ИК заложены по меньшей мере два разных лечебных средства. По меньшей мере одно лечебное средство, заложенное по меньшей мере в одно из множества отверстий, инкорпорировано в матрицу сополимера молочной и гликолевой кислот (PLGA) для управления скоростью высвобождения и кумулятивной высвобожденной дозой лечебного средства в окружающую ткань. Изобретение обеспечивает эффективную комбинированную лекарственную терапию за счёт использования двух и более лекарств и/или активных веществ, закладываемых в разные отверстия устройств без увеличения толщины его стенки и без ограничения его подвижности, а также за счёт возможности доставки лекарственных средств с разными кинетиками высвобождения и/или периодами выведения. 5 з.п. ф-лы, 2 табл., 3 пр.
Реферат
УРОВЕНЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
1. Область техники, к которой относится изобретение
Для настоящей заявки испрашивается приоритет в соответствии с предварительной заявкой США № 61/148,610, поданной 30 января 2009 г.
Настоящее изобретение относится к поддерживающим ткани медицинским устройствам и, в частности, к расширяющимся (расширяемым) несъемным устройствам, которые имплантируют в просвет тела живого животного или человека для поддержки органа и сохранения раскрытого состояния и которые содержат отверстия для доставки множества лечебных средств к месту вмешательства, а также поверхностное покрытие из антитромботического средства.
2. Обзор состояния техники
Раньше уже разрабатывали постоянные или биоразлагаемые устройства для имплантации в проход в теле, чтобы поддерживать раскрытое состояние прохода. Данные устройства обычно вводили чрескожно и проводили транслюминально до установки в требуемое место. Затем данные устройства либо расширяют механически, например расширением оправки или баллона, расположенного внутри устройства, либо расширяются самостоятельно путем высвобождения накопленной энергии после активизации внутри тела. После расширения внутри просвета данные устройства, называемые стентами, инкапсулируются внутри ткани тела и становятся постоянным имплантатом.
Известные конструкции стентов содержат спиральные стенты из одножильной проволоки (патент США № 4969458); сварные металлические каркасы (патенты США №№ 4733665 и 4776337); и, в основном, тонкостенные металлические цилиндры с осевыми прорезями, сформированными по окружности (патенты США №№ 4733665; 4739762; и 4776337). Известные конструкционные материалы для применения в стентах содержат полимеры, органические тканые материалы и биосовместимые металлы, например нержавеющую сталь, золото, серебро, тантал, титан и сплавы с памятью формы, например никель-титановый сплав.
В патенте США № 6241762, который в полном объеме включен в настоящую заявку путем отсылки, предлагается непризматическая конструкция стента, которая устраняет некоторые недостатки функциональных характеристик предшествующих стентов. Кроме того, предпочтительные варианты осуществления, описанные в данном патенте, обеспечивают стент с крупными недеформирующимися распорными и соединительными элементами, которые могут содержать лунки, не снижающие механических свойств распорных и соединительных элементов или устройства в целом. Кроме того, данные лунки могут служить как крупные защищенные емкости для доставки различных лечебных средств в место имплантации устройства, без обязательного поверхностного покрытия на стенте.
Среди многих проблем, которые можно решить посредством локальной доставки лечебных средств из стента, одной из наиболее важных является рестеноз. Рестеноз является основным осложнением, которое может возникать после таких сосудистых вмешательств, как ангиопластика и имплантация стентов. Согласно простому определению, рестеноз является ранозаживляющим процессом, который уменьшает диаметр просвета сосуда в результате отложения внеклеточного матрикса и пролиферации сосудистых гладкомышечных клеток, и который может, в конечном счете, иметь следствием повторное сужение или даже повторную закупорку просвета. Несмотря на внедрение усовершенствованных хирургических методов, устройств и фармакологических средств, общая скорость рестеноза для обнаженных металлических стентов, согласно сообщениям, остается в диапазоне от приблизительно двадцати пяти процентов до приблизительно пятидесяти процентов в течение от шести до двенадцати месяцев после операции ангиопластики. Для лечения данного состояния часто требуются дополнительные процедуры реваскуляризации, что усиливает травмы и повышает риск для пациента.
Обычные стенты с поверхностными покрытиями из различных лечебных средств показали перспективные результаты по ослаблению рестеноза. В патенте США № 5716981, например, предложен стент, который снабжен поверхностным покрытием из композиции, содержащей полимер-носитель и паклитаксел. В патенте подробно описаны способы нанесения покрытий на поверхности стентов, например распыление и окунание, а также требуемый характер самого покрытия, а именно: покрытие должно «покрывать стент гладко и ровно» и «обеспечивать равномерное, предсказуемое, продолжительное высвобождение антиангиогенного фактора». Однако поверхностные покрытия, могут обеспечивать лишь малозначительное фактическое регулирование кинетики высвобождения лечебных средств. Данные покрытия неизбежно являются очень тонкими, обычно, глубиной от пяти до восьми микрометров. Площадь поверхности стента является сравнительно очень большой, и поэтому весь объем лечебного средства характеризуется очень коротким путем диффузии до выделения в окружающую ткань. Получаемый профиль кумулятивного высвобождения лекарства характеризуется значительным начальным резким подъемом, завершаемым быстрым достижением асимптоты, вместо требуемого «равномерного продолжительного высвобождения» или линейного высвобождения.
Увеличение толщины поверхностного покрытия оказывает положительное влияние в отношении улучшения кинетики высвобождения лекарства, в том числе, дает возможность лучше регулировать высвобождение лекарства и увеличивать лекарственную закладку. Однако увеличение толщины покрытия приводит к увеличению общей толщины стенки стента. Это нежелательно по ряду причин, включая возможность усиления травм просвета сосуда во время имплантации, уменьшение доступного кровотоку поперечного сечения просвета после имплантации и повышенную уязвимость покрытия для механического повреждения или повреждения во время расширения и имплантации. Толщина покрытия является одним из нескольких факторов, которые влияют на кинетику высвобождения лечебного средства, и, следовательно, ограничения толщины ограничивают диапазон скоростей, сроков и подобных характеристик высвобождения, которые можно обеспечивать.
Поверхностные покрытия могут также ограничивать доставку нескольких лекарств из стента. Например, если из поверхностного покрытия требовалось доставлять несколько лекарств, то скорости высвобождения, периоды доставки и другие характеристики высвобождения невозможно было легко регулировать взаимно независимым способом. Однако рестеноз вовлекает несколько биологических процессов и наиболее эффективно может лечиться комбинацией лекарств, выбранных для воздействия на данные разные биологические процессы.
В статье «Physiological Transport Forces Govern Drug Distribution for Stent-Based Delivery», авторов Chao-Wei Hwang et al., показана важная взаимосвязь между характеристиками пространственно-временного распределения лекарств элюирующими лекарства стентами и механизмами клеточного транспорта лекарств. В попытках добиться повышенных механических рабочих характеристик и структурных свойств, конструкциям стентов стали придавать более сложные геометрические формы со специфической неоднородностью окружного и продольного распределения распорок стентов. Примерами данной тенденции являются типичные коммерчески доступные стенты, которые расширяются до приближенно ромбовидной или многогранной формы, при развертывании в просвете тела. Стенты обеих форм применялись для доставки лечебного средства в форме поверхностного покрытия. Исследования показали, что участки тканей просвета, непосредственно прилегающие к распоркам, получают более высокие концентрации лекарства, чем более удаленные участки тканей, например участки, расположенные в середине «ромбовидных» распорных ячеек. Характерно, что данный градиент концентраций лекарства внутри стенки просвета остается со временем выше для гидрофобных лечебных средств, например паклитаксела или рапамицина, которые оказались наиболее эффективными антирестенотическими препаратами на настоящее время. Поскольку локальные концентрации лекарств и их градиенты сложным образом связаны с биологическими действиями, то начальное пространственное распределение источников лечебного средства (распорок стента) является решающим фактором эффективности.
Помимо субоптимального пространственного распределения лечебных средств, существуют другие потенциальные недостатки стентов с поверхностным покрытием. Некоторые полимерные носители с химически связанной матрицей, применяемые в покрытиях устройства, обычно неопределенно долго удерживают значительный процент лечебного средства в покрытии. Поскольку данные лечебные средства, например паклитаксел, могут быть цитотоксичными, то могут возникать подострые и хронические проблемы, например хроническое воспаление, поздний тромбоз и позднее или неполное заживление стенки сосуда. Кроме того, сами полимеры-носители часто вызывают воспаление ткани стенки сосуда. С другой стороны, применение биологически рассасывающихся полимерных носителей на поверхностях стента может приводить к «плохому контакту» или пустым пространствам между стентом и тканью стенки сосуда после рассасывания полимерного носителя. Пустые пространства допускают относительное движение между стентом и прилегающей тканью. Возникающие, в результате, проблемы включают в себя микроистирание и воспаление, медленное перемещение стента и невозможность осуществления реэндотелизации стенки сосуда.
Начальные клинические испытания на людях предполагают возможность некоторых недостатков, связанных с доставляющими лекарства устройствами первого поколения. Последующее исследование пациентов, участвовавших в клинических испытаниях, через шесть - восемнадцать месяцев после имплантации стента с лекарственным покрытием показывает, что плохой контакт распорок стента с артериальными стенками и краевой рестеноз могут иметь место для большого числа пациентов. Краевой рестеноз появляется непосредственно за проксимальным и дистальным краями стента и развивается вблизи краев стента и во внутреннее (просветное) пространство, что часто требует повторной реваскуляризации пациента.
Другой потенциальный недостаток состоит в том, что расширение стента может создать напряжение в нанесенном на него полимерном покрытии, в результате чего покрытие отслаивается, растрескивается или рвется, что может влиять на кинетику высвобождения лекарства или вызывать другие неблагоприятные эффекты. Данные эффекты наблюдались в стентах первого поколения с лекарственными покрытиями, когда данные стенты расширялись до больших диаметров, что препятствовало до сих пор применению упомянутых стентов в артериях большего диаметра. Кроме того, расширение упомянутых стентов с покрытиями в атеросклеротическом кровеносном сосуде будет приводить к воздействию окружных усилий сдвига на полимерное покрытие, что могло привести к отделению покрытия от нижележащей поверхности стента. Такое отделение может снова вызывать неблагоприятные эффекты, включая эмболизацию фрагментов покрытия, вызывающую закупорку сосудов.
Другая проблема, которую можно решить посредством локальной доставки лечебных средств из стента, состоит в тромбозе. Стент можно покрыть антитромботическим средством в дополнение к, по меньшей мере, одному терапевтическому средству для терапии рестеноза.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
С учетом недостатков известного уровня техники, целесообразно создание стента, способного доставлять относительно большой объем лекарственного средства в травмированное место в просвете сосуда, с исключением, при этом, многочисленных потенциальных проблем, связанных с поверхностными покрытиями, содержащими лекарственные средства, но без увеличения эффективной толщины стенки стента и без неблагоприятного воздействия на механические свойства расширения стента.
Кроме того, целесообразно создание поддерживающего ткани устройства с разными лечебными средствами, находящимися в разных лунках, чтобы получать требуемое пространственное распределение, по меньшей мере, двух лечебных средств.
Кроме того, целесообразно создание поддерживающего ткань устройства с разными лечебными средствами, находящимися в разных лунках, чтобы получать требуемую разную кинетику высвобождения для, по меньшей мере, двух разных лечебных средств из одного и того же устройства.
Кроме того, целесообразно создание поддерживающего ткань устройства со всеми поверхностями, покрытыми антитромботическим средством, и затем применение грунтовки в лунках или отверстиях в упомянутом устройстве, чтобы усилить адгезию, по меньшей мере, одного лечебного средства, которое заполняет лунки.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Вышеописанные и другие признаки и преимущества изобретения очевидны из нижеприведенного подробного описания предпочтительных вариантов осуществления изобретения, представленных на прилагаемых чертежах.
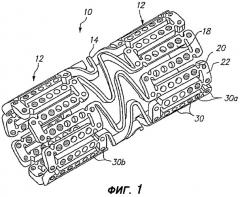
Фигура 1 - изометрическое изображение расширяемого медицинского устройства с лечебным средством на концах в соответствии с настоящим изобретением.
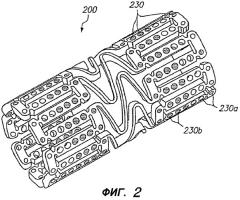
Фигура 2 - изометрическое изображение расширяемого медицинского устройства с лечебным средством на центральном участке и без лечебного средства на концах в соответствии с настоящим изобретением.
Фигура 3 - изометрическое изображение расширяемого медицинского устройства с разными лечебными средствами в разных отверстиях в соответствии с настоящим изобретением.
Фигура 4 - изометрическое изображение расширяемого медицинского устройства с разными лечебными средствами в чередующихся отверстиях в соответствии с настоящим изобретением.
Фигура 5 - увеличенный вид сбоку участка расширяемого медицинского устройства с отверстиями под лечебные средства в соединительных элементах в соответствии с настоящим изобретением.
Фигура 6 - увеличенный вид сбоку участка расширяемого медицинского устройства с бифуркационным отверстием в соответствии с настоящим изобретением.
Фигура 7 - сечение расширяемого медицинского устройства, содержащего комбинацию из первого активного вещества, например противовоспалительного средства, в первом множестве отверстий, и второго активного вещества, например антипролиферативного средства, во втором множестве отверстий, в соответствии с настоящим изобретением.
Фигура 8 - график скоростей высвобождения одного примера противовоспалительного средства и антипролиферативного средства, доставляемых расширяемым медицинским устройством, показанным на фигуре 7, в соответствии с настоящим изобретением.
Фигуры 9A-9С - местные схематические изображения альтернативного примерного варианта осуществления расширяемого медицинского устройства в соответствии с настоящим изобретением.
Фигура 10 - схема реакции конъюгации между PLGA (сополимером молочной и гликолевой кислот) с карбоксильной концевой группой и низкомолекулярным PEI (полиэтиленимином) в соответствии с настоящим изобретением.
Фигура 11 - схема реакции конъюгации между PLGA с карбоксильной концевой группой и высокомолекулярным или разветвленным PEI в соответствии с настоящим изобретением.
Фигура 12 - кинетика высвобождения из емкости в зависимости от поверхностного покрытия в соответствии с настоящим изобретением.
ПОДРОБНОЕ ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
На фигуре 1 изображено расширяемое медицинское устройство, содержащее множество отверстий, содержащих лечебное средство для доставки в ткань расширяемым медицинским устройством. Расширяемое медицинское устройство 10, изображенное на фигуре 1, вырезано из трубчатого материала для формирования цилиндрического расширяемого устройства. Расширяемое медицинское устройство 10 содержит множество цилиндрических секций 12, соединенных между собой множеством соединительных элементов 14. Соединительные элементы 14 позволяют поддерживающему ткани устройству аксиально изгибаться при прохождении по извилистому пути в сосудистой сети к месту развертывания и позволяют устройству аксиально изгибаться, при необходимости, соответственно кривизне просвета, который следует поддерживать. Каждая из цилиндрических трубок 12 сформирована сеткой удлиненных распорок 18, которые соединены между собой пластическими шарнирами 20 и окружными распорками 22. Во время расширения медицинского устройства 10, пластические шарниры 20 деформируются, а распорки 18 не деформируются. Дополнительные сведения об одном примере расширяемого медицинского устройства приведены в патенте США № 6241762, который целиком включен в настоящее описание путем отсылки.
Как показано на фигуре 1, удлиненные распорки 18 и окружные распорки 22 содержат отверстия 30, некоторые из которых содержат лечебное средство для доставки в просвет, в который имплантировано расширяемое медицинское устройство. Кроме того, другие участки устройства 10, например соединительные элементы 14, могут содержать отверстия, как описано ниже со ссылкой на фигуру 5. В предпочтительном варианте отверстия 30 находятся в недеформирующихся участках устройства 10, например распорках 18, чтобы отверстия были недеформирующимися, и лечебное средство доставлялось без риска разрушения, вытеснения или иного повреждения во время расширения устройства. Дополнительное описание одного примера способа, каким лечебное средство может быть заложено в отверстия 30, приведено в заявке на патент США № 09/948,987, поданной 7 сентября 2001 г., которая целиком включена в настоящую заявку путем отсылки.
Примерные варианты осуществления настоящего изобретения можно дополнительно оптимизировать с использованием анализа методом конечных элементов и другими методами, чтобы оптимизировать размещение лечебных средств в отверстиях 30. По существу, форму и местоположение отверстий 30 можно модифицировать, чтобы максимально увеличить объем пустот, при одновременном сохранении относительно высокой прочности и жесткости распорок по отношению к пластическим шарнирам 20. В соответствии с одним предпочтительным вариантом осуществления настоящего изобретения, отверстия имеют площадь, по меньшей мере, 5×10-6 квадратных дюймов и, предпочтительно, по меньшей мере, 7×10-6 квадратных дюймов. Обычно, отверстия заполняют лечебным средством на от приблизительно пятидесяти процентов до приблизительно девяносто пяти процентов.
Определения
Термины «активное вещество», «терапевтическое средство» или «лечебное средство», как предполагается в контексте настоящей заявки, имеют максимально широкое возможное толкование и применяются так, чтобы включать в себя любое терапевтическое средство или лекарство, а также инертные вещества, например барьерные слои, слои-носители, терапевтические слои или защитные слои.
Термины «лекарство» или «терапевтическое средство» применяются равнозначно для обозначения любого терапевтически активного вещества, которое доставляется в просвет тела живого существа для создания требуемого, обычно полезного, эффекта. Лечебные средства могут содержать, по меньшей мере, одно лекарство или терапевтическое средство.
Настоящее изобретение особенно хорошо подходит, в частности, для доставки противоопухолевых средств, антиангиогенных средств, ангиогенных факторов, противовоспалительных средств, иммунодепрессантов, например рапамицина, антирестенотических средств, антитромбоцитарных средств, сосудорасширяющих средств, антитромботических средств, антипролиферативных средств, например паклитаксела, и антиромбиновых средств, например гепарина.
Термин «размытие» означает процесс, в ходе которого компоненты среды или матрицы биологически рассасываются и/или разлагаются, и/или разрушаются химическими или физическими, или ферментативными процессами. Например, что касается биоразлагаемых полимерных матриц, размытие может происходить посредством разрыва или гидролиза полимерных цепей, с повышением, тем самым, растворимости матрицы и удерживаемых в виде взвеси лечебных средств.
Термин «скорость размытия» является мерой количества времени, которое занимает процесс размытия, и измеряется обычно в единицах площади на единицу времени.
Термины «матрица» или «биологически рассасывающаяся матрица» применяются равнозначно для обозначения среды или материала, который, после имплантации в человека, не вызывает вредной ответной реакции, достаточной, в результате, для отторжения матрицы. Сама по себе, матрица обычно не обеспечивает никаких терапевтических ответных реакций, хотя, матрица может содержать или окружать лечебное средство, которому дано определение в настоящей заявке. Матрица является также средой, которая может просто обеспечивать опору, конструктивную целостность или конструктивные барьеры. Матрица может быть полимерной, неполимерной, гидрофобной, гидрофильной, липофильной, амфифильной и т.п. Кроме того, следует понимать, что термин «биологически рассасывающаяся матрица» подразумевает полное рассасывание матрицы организмом со временем.
Термин «отверстия» включает в себя как сквозные отверстия, так и углубления.
Термин «фармакологически приемлемый» относится к особенности отсутствия токсичности в отношении реципиента или пациента и пригодности для поддержки стабильности лечебного средства и обеспечения доставки лечебного средства к клеткам-мишеням или намеченной ткани.
Термин «полимер» относится к молекулам, сформированным в виде химического соединения, по меньшей мере, двух повторяющихся элементарных звеньев, называемых мономерами. Соответственно, термин «полимер» может охватывать, например, димеры, триммеры и олигомеры. Полимер может быть синтетическим, натуральным или полусинтетическим. В предпочтительной форме, термин «полимер» относится к молекулам, которые обычно имеют молекулярную массу (Mw) больше чем приблизительно 3000 и, предпочтительно, больше чем приблизительно 10,000, и Mw, которая меньше чем приблизительно 10 миллионов, но, предпочтительно, меньше чем приблизительно один миллион и, еще более предпочтительно, меньше чем приблизительно 200,000. Примеры полимеров включают в себя, но без ограничения, сложные полиэфиры альфа-оксикислот, например полимолочную кислоту (PLLA или DLPLA (D,L-полимолочная кислота)), полигликолевую кислоту, сополимер полимолочной кислоты и гликолевой кислоты (PLGA), сополимер полимолочной кислоты и капролактона; полимеры типа (блок-этиленоксид-блок-сополимер лактида и гликолида), (PEO (полиэтиленоксид)-блок-PLGA и PEO-блок-PLGA-блок-PEO); полиэтиленгликоль и полиэтиленоксид, полимер типа (блок-этиленоксид-блок-пропиленоксид-блок-этиленоксид); поливинилпирролидон; сложные полиортоэфиры; полисахариды и производные полисахаридов, например полигиалуроновую кислоту, поли(глюкозу), полиальгиновую кислоту, хитин, хитозан, производные хитозана, целлюлозу, метилцеллюлозу, гидроксиэтилцеллюлозу, гидроксипропилцеллюлозу, карбоксиметилцеллюлозу, циклодекстрины и замещенные циклодекстрины, например сульфобутиловые эфиры бета-циклодекстрина; полипептиды и белки, например полилизин, полиглютаминовую кислоту, альбумин; полиангидриды; полиоксиальконоаты, например полиоксивалерат, полиоксибутират и т.п.
Термин «в основном», применительно к направленной доставке, означает, что в основном направлении доставляется количество, большее, чем приблизительно пятьдесят процентов от общего количества терапевтического средства, доставляемого в кровеносный сосуд.
Различные примерные варианты осуществления настоящего изобретения, описанные в настоящей заявке, предусматривают закладку разных лечебных средств в разных отверстиях в расширяемом устройстве или лечебного средства в некоторых отверстиях, а не в других. Конкретное строение расширяемого медицинского устройства можно изменять без выхода за пределы существа изобретения. Поскольку каждое отверстие заполняют по отдельности, лечебному средству в каждом отверстии можно придавать особые химические композиции и фармакокинетические свойства.
Один пример применения разных лечебных средств в разных отверстиях в расширяемом медицинском устройстве или лечебных средств в некоторых отверстиях, а не в других, относится к устранению краевого рестеноза. Как изложено выше, нынешнее поколение стентов с покрытиями может сталкиваться со сложной проблемой краевого рестеноза или рестеноза, возникающего непосредственно за краями стента и развивающегося вокруг стента и во внутреннее просветное пространство.
Причины краевого рестеноза при использовании доставляющих лекарства стентов первого поколения не вполне понятны в настоящее время. Возможно, что область повреждения тканей вследствие ангиопластики и/или имплантации стента продолжается за пределы области диффузии лечебных средств современного поколения, например паклитаксела, которые, обычно, интенсивно распадаются в ткани. Аналогичное явление наблюдалось при лучевой терапии, в ходе которой небольшие дозы излучения на краях стента оказывались стимулирующими в присутствии повреждения. В данном случае, облучение на длине, увеличенной настолько, чтобы облучать неповрежденную ткань, решало проблему. В случае доставляющих лекарства стентов, размещение более крупных доз или более высоких концентраций лечебных средств по краям стентов, размещение на краях стентов отличающихся активных средств, которые быстрее диффундируют сквозь ткань, или размещение отличающихся лечебных средств или комбинаций лечебных средств на краях устройства может способствовать устранению проблемы краевого рестеноза.
На фигуре 1 изображено расширяемое медицинское устройство 10 с, так называемыми, «активными концами» или с лечебным средством, обеспеченным в отверстиях 30a на концах устройства, чтобы лечить и ослаблять краевой рестеноз. Остальные отверстия 30b на центральном участке устройства могут быть пустыми (как показано) или могут содержать меньшую концентрацию лечебного средства.
Другие механизмы краевого рестеноза могут затрагивать цитотоксичность специфических лекарств или комбинаций лекарств. Данные механизмы могут содержать физическое или механическое сокращение ткани, аналогичное сокращению, наблюдаемому при образовании эпидермальной рубцовой ткани, и стент может предотвращать ответную реакцию сокращения в пределах его собственных границ, но не за его краями. Кроме того, механизм данной последней формы рестеноза может быть связан с последствиями длительной или локальной доставки лекарства в артериальную стенку, которые проявляются даже после того, как само лекарство больше не присутствует в стенке. То есть рестеноз может быть ответной реакцией на вид токсического поражения, связанного с лекарством и/или носителем лекарства. В данной ситуации, возможно, было бы полезно исключить некоторые активные средства из применения на краях устройства.
На фигуре 2 изображен альтернативный примерный вариант осуществления расширяемого медицинского устройства 200, содержащего множество отверстий 230, из которых отверстия 230b в центральной части устройства заполнены лечебным средством, и отверстия 230a на краях устройства остаются пустыми. Устройство, показанное на фигуре 2, называется устройством с «инертными концами».
В дополнение к использованию для ослабления краевого рестеноза, расширяемое медицинское устройство 200, показанное на фигуре 2, можно применять в сочетании с расширяемым медицинским устройством 10, показанным на фигуре 1, или другим доставляющим лекарство стентом, когда исходную процедуру стентирования следует дополнить дополнительным стентом. Например, в некоторых случаях устройство 10, показанное на фигуре 1, с «активными концами» или устройство с равномерным распределением лекарства может быть имплантировано ненадлежащим образом. Если врач определяет, что устройство не перекрывает достаточный участок просвета, то на одном конце существующего устройства можно добавить дополнительное устройство, немного перекрывающее существующее устройство. Когда имплантируют дополнительное устройство, то устройство 200, показанное на фигуре 2, применяют так, чтобы «инертные концы» медицинского устройства 200 предотвращали удвоение дозы лечебного средства на участках перекрытия устройств 10, 200.
На фигуре 3 изображен дополнительный альтернативный примерный вариант осуществления изобретения, в котором в разных отверстиях расширяемого медицинского устройства 300 находятся разные лечебные средства. Первое лечебное средство обеспечено в отверстиях 330a на концах устройства, и второе лечебное средство обеспечено в отверстиях 330b на центральном участке устройства. Лечебное средство может содержать разные лекарства, одинаковые лекарства в разных концентрациях или разные варианты одного и того же лекарства. Примерный вариант осуществления, показанный на фигуре 3, можно применять для обеспечения расширяемого медицинского устройства 300 либо с «активными концами», либо с «инертными концами».
В предпочтительном варианте, каждый концевой участок устройства 300, который содержит отверстия 330a, содержащие первое лечебное средство, продолжается в длину на от, по меньшей мере, одного отверстия до приблизительно пятнадцати отверстий от края. Данное расстояние соответствует участку от приблизительно 0,005 до приблизительно 0,1 дюймов от края нерасширенного устройства. Расстояние от края устройства 300, которое содержит первое лечебное средство, предпочтительно, приблизительно равно одной секции, где секция ограничена между соединительными элементами.
Разные лечебные средства, содержащие разные лекарства, могут находиться в разных отверстиях в стенте. Это допускает доставку, по меньшей мере, двух лечебных средств из одного стента по любой требуемой схеме доставки. В альтернативном варианте, разные лечебные средства, содержащие одно и то же лекарство в разных концентрациях, могут находиться в разных отверстиях. Это дает возможность лекарству равномерно распределяться в ткань, при неоднородной конструкции устройства.
По меньшей мере, два разных лечебных средства, обеспеченных в устройствах, описанных в настоящей заявке, могут содержать (1) разные лекарства; (2) одно и то же лекарство в разных концентрациях; (3) одно и то же лекарство с разными кинетиками высвобождения, т.е. разными скоростями размытия матрицы; или (4) разные формы одного и того же лекарства. Примеры разных лечебных средств, содержащих одно и то же лекарства с разными кинетиками высвобождения могут использовать разные носители для получения профилей элюирования с разными формами. Некоторые примеры разных форм одного и того же лекарства содержат формы лекарства, обладающие изменяющимися гидрофильностью или липофильностью.
В одном примере устройства 300, показанного на фигуре 3, отверстия 330a на концах устройства заправлены первым лечебным средством, содержащим лекарство с высокой липофильностью, тогда как отверстия 330b на центральном участке устройства заправлены вторым лечебным средством со сниженной липофильностью. Первое высоколипофильное лекарственное средство на «активных концах» будет диффундировать в окружающую ткань быстрее и, тем самым, ослаблять краевой рестеноз.
Устройство 300 может содержать резкую линию перехода, на которой лекарственное средство сменяется с первого средства на второе средство. Например, все отверстия в пределах 0,05 дюймов от края устройства могут содержать первое средство, тогда как остальные отверстия содержат второе средство. В альтернативном варианте, устройство может содержать постепенный переход между первым средством и вторым средством. Например, концентрация лекарства в отверстиях может последовательно повышаться (или снижаться) к концам устройства. В другом примере количество первого лекарства в отверстиях увеличивается, тогда как количество второго лекарства в отверстиях уменьшается с перемещением к концам устройства.
На фигуре 4 изображен дополнительный альтернативный примерный вариант осуществления расширяемого медицинского устройства 400, в котором разные лечебные средства находятся в разных отверстиях 430a, 430b в устройстве, с чередованием или вразброс. Таким образом, несколько лечебных средств можно доставлять в ткань по всей зоне или участку зоны поддержки устройством. Данный примерный вариант осуществления будет полезен для доставки нескольких лечебных средств, когда объединение нескольких средств в одной композиции для заправки в устройство невозможно из-за проблем с взаимодействием между лечебными средствами или с их стабильностью.
В дополнение к применению разных лечебных средств в разных отверстиях для получения разных концентраций лекарств в разных заданных зонах ткани, заправку разных лечебных средств в разные отверстия можно применять для обеспечения более равномерного пространственного распределения лечебного средства, доставляемого в случаях, когда расширяемое медицинское устройство имеет неравномерное распределение отверстий в расширенной конфигурации.
Применение разных лекарств в разных отверстиях вразброс или с чередованием допускает доставку двух разных лекарств, которые нельзя было бы доставить при их объединении внутри одной и той же композиции матрицы полимера/лекарства. Например, сами лекарства могут взаимодействовать нежелательным образом. В альтернативном варианте, два лекарства могут быть несовместимы с одинаковыми полимерами для формирования матрицы или с одинаковыми растворителями для доставки матрицы полимера/лекарства в отверстия.
Кроме того, примерный вариант осуществления, показанный на фигуре 4, содержащий разные лекарства в разных отверстиях по схеме вразброс, обеспечивает возможность доставлять разные лекарства с очень разными требуемыми кинетиками высвобождения из одного и того же медицинского устройства или стента и оптимизировать кинетику высвобождения, в зависимости от механизма действия и свойств отдельных активных средств. Например, водорастворимость активного средства сильно влияет на высвобождение активного средства из полимерной или другой матрицы. Соединение с высокой водорастворимостью обычно будет очень быстро доставляться из полимерной матрицы, тогда как липофильное средство будет доставляться из той же самой матрицы в течение более продолжительного времени. Следовательно, если гидрофильное средство и липофильное средство требуется доставлять в виде комбинации двух лекарств из медицинского устройства, то, для двух данных активных средств, доставляемых из одной и той же полимерной матрицы, трудно получить требуемый профиль высвобождения.
Система, показанная на фигуре 4, допускает удобную доставку гидрофильного и липофильного лекарства из одного и того же стента. Кроме того, система, показанная на фигуре 4, позволяет доставлять два активных средства с двумя разными кинетиками высвобождения и/или периодами введения. Каждую характеристику из начального высвобождения за первые двадцать четыре часа, скорости высвобождения после первых двадцати четырех часов, суммарного периода введения и любых других характеристик высвобождения двух лекарств можно контролировать независимо. Например, скорости высвобождения первого лечебного средства можно отрегулировать так, чтобы доставлять, по меньшей мере, сорок процентов (предпочтительно, по меньшей мере, пятьдесят процентов) доставляемого лекарства за первые двадцать четыре часа, и второго лекарственного средства можно отрегулировать так, чтобы доставлять менее, чем двадцать процентов (предпочтительно, менее, чем десять процентов) доставляемого лекарства за первые двадцать четыре часа. Период введения первого лекарственного средства может составлять около трех недель или менее (предпочтительно, двух недель или менее), и период введения второго лекарственного средства может составлять около четырех недель или более.
Рестеноз или рецидив окклюзии после вмешательства включает в себя комбинацию или последовательность биологических процессов. Данные процессы содержат активацию тромбоцитов или макрофагов. Цитокины и факторы роста вносят вклад в пролиферацию гладкомышечных клеток, и повышающая регуляция генов и металлопротеиназ приводят к росту клеток, перестройке внеклеточного матрикса и миграции гладкомышечных клеток. Лекарственная т