Способ получения функционального белкового продукта для больных гистидинемией
Иллюстрации
Показать всеИзобретение относится к пищевой промышленности. Подготавливают белоксодержащую биологическую систему. Осуществляют гидролиз, глубина расщепления белков при определенных условиях должна быть не менее 85-98%. Обрабатывают специфическим ферментом L-гистидин-аммоний-лиазой в количестве 0,000016-0,8% от массы белка. Проводят инактивацию фермента методом кратковременного нагревания до 85°С в течение 10-15 с. Осуществляют адсорбцию, сгущение до содержания сухих веществ 40-45% и сушку при 165°С до содержания влаги 14%. Изобретение обеспечивает создание эффективной диетотерапии за счет снижения содержания гистидина в белковом продукте до 0. 4 табл., 2 пр.
Реферат
Изобретение относится к пищевой промышленности, а именно к производству специализированных продуктов, предназначенных для детей и взрослых, больных гистидинемией, с низким содержанием гистидина.
Наиболее близким аналогом является способ получения функционального белкового продукта для больных гистидинемией, включающий подготовку белоксодержащей биологической системы (казеин), проведение гидролиза, обработку гидролизата ферментом L-гистидин-аммоний-лиазой, инактивацию фермента нагреванием (см. Борисова Г.В., Бессонова О.В., Крупин А.В., «Разработка технологии удаления продуктов биотрансформации гистидина из гидролизатов казеина», Техника и технология пищевых производств, №4, 2011 г., КемТИПП, с. 23-27).
Заявленное изобретение отличается от аналога тем, что способ включает подготовку белоксодержащей смеси (концентрат сывороточных белков), ферментативный или кислотный гидролиз, обработку полученного гидролизата ферментом L-гистидин-аммоний-лиазой (количество вносимого фермента составляет 0,000016-0,8% от массы белка) с целью биотрансформации гистидина до аммиака и транс-уроканиновой кислоты, удаление побочных продуктов и инактивацию фермента путем кратковременного нагрева до 85°C в течение 10-15 с, сгущения белоксодержащей системы до содержания сухих веществ 40-45%, сушки при 165°C до содержания влаги 14%. Удаление из полученных гидролизатов сывороточных белков побочных продуктов биотрансфорации гистидина (аммиака и транс-уроканиновой кислоты) позволили привести разработанную технологию в соответствие с требованиями, предъявляемыми к продуктам без гистидина или с низким его содержанием. Также основным отличием является использование концентрата сывороточных белков (альбуминов и глобулинов) в качестве биологической системы (субстрата) вместо казеина, которые имеют более высокую биологическую ценность по аминокислотному составу по сравнению с казеином.
Данное техническое решение является наиболее близким к заявляемому по совокупности существенных признаков, т.к. предполагается получение готового промежуточного продукта с заданным аминокислотным составом (прототип).
Другим аналогом является способ получения белкового продукта для детей, больных фенилкетонурией (см. Просеков А.Ю., Бабич О.О., Остроумов Л.A. RU 2376893 С1 от 27.12.2009 г. - реферат), где основным отличием является использование в качестве биологической системы концентрата сывороточных белков вместо казеина, как биологически полноценного источника молочного белка, а также ферментных препаратов, применяемых для ферментативного гидролиза белка. В заявленном изобретении применяется ферментативный гидролиз, как наиболее рациональный способ извлечения аминокислоты гистидин из полипептидной цепи белковой молекулы, эндопепти-дазами (термолизин) и экзопептидазами (карбоксипептидаза А и лейцинами-нопептидаза) в равных соотношенях. Термолизин катализирует гидролиз пептидных связей, образованных аминокислотными остатками гистидина, карбоксипептидаза А расщепляет С-концевые связи, а лейцинаминопептидаза расщепляет аминные связи в полипептидной цепи. Процесс ферментативного гидролиза проводят при подобранных параметрах в рабочих диапазонах данных ферментных препаратов: при температуре 50±1°C, активной кислотности 7,6±0,01 при фермент-субстратном соотношении 1:50, продолжительностью 8±0,05 ч. Полученный гидролизат подвергали дополнительному ферментативному гидролизу специфическим ферментом по отношению к гистидину, L-гистидин-аммоний-лиазой, в количестве, подобранным опытным путем, 0,000016-0,8% от массы белка, с целью максимального удаления гистидина из полипептидной цепи.
Наиболее близким аналогом является способ получения функционального белкового продукта для больных гистидинемией, включающий подготовку белоксодержащей биологической системы (казеин), проведение гидролиза, обработку гидролизата ферментом L-гистидин-аммоний-лиазой, инактивацию фермента нагреванием (см. Борисова Г.В., Бессонова О.В., Крупин А.В., «Разработка технологии удаления продуктов биотрансформации гистидина из гидролизатов казеина», Техника и технология пищевых производств, №4, 2011 г., КемТИПП, с.23-27).
Заявленное изобретение отличается от аналога тем, что способ получения белкового продукта для больных гистидинемией включает стадии адсорбции, сгущения смеси до содержания сухих веществ 40-45%, сушки при 165°C до содержания влаги 14%), количество вносимого фермента составляет 0,000016-0,8%) от массы белка, инактивацию фермента проводят путем кратковременного нагрева до 85°C в течение 10-15 с. Также основным отличием является использование концентрата сывороточных белков (альбуминов и глобулинов) в качестве биологической системы, которые имеют более высокую биологическую ценность по аминокислотному составу.
В заявленном изобретении применяется ферментативный гидролиз, термолизином (эндопептидазой) и карбоксипептидазой А и лейцинаминопептидазой (экзопептидазами) в равных соотношениях. Термолизин используется для разрыва полипептидных связей, образованных аминокислотными остатками гистидина, карбоксипептидаза А расщепляет С-концевые связи, а лейцинаминопептидаза расщепляет N-концевые связи в полипептидной цепи. Процесс ферментативного гидролиза проводят при температуре 50±1°C, активной кислотности 7,6±0,01 при фермент-субстратном соотношении 1:50, продолжительностью 8±0,05 ч, что позволяет расщепить белок до 98%. Далее гидролизат подвергают дополнительному ферментативному гидролизу для расщепления гистидина до уроканиновой кислоты и аммиака ферментом L-гистидин-аммоний-лиазой. Температура сушки (165°C) подобрана технологическим методом проб с учетом максимального сохранения при нагревании всех незаменимых и заменимых аминокислот в белковых гидролизатах с целью получения полноценного продукта для специализированных продуктов питания, предназначенных для больных гистидинемией.
Задачей технического решения является способ получения функционального белкового продукта с низким содержанием гистидина массовой долей до 0 мг, предназначенный для специализированных продуктов питания с целью создания эффективной диетотерапии для больных гистидинемией детей и взрослых.
Технический результат достигается за счет использования в качестве белоксодержащей биологической системы концентрата сывороточных белков, подвергаемого ферментативному или кислотному гидролизу, обеспечивающему полное расщепление полипептидной цепи белковой молекулы на свободные аминокислоты. В процессе гидролиза глубина расщепления белков при определенных условиях должна быть не менее 85-98%. Полученный гид-ролизат, практически представленный смесью аминокислот, обрабатывают ферментом, осуществляющим превращение гистидина в уроканиновую кислоту и аммиак, затем проводят инактивацию фермента методом кратковременного нагревания до 85°C в течение 10-15 с. В результате дальнейшей обработки гидролизаты белка полностью свободны от гистидина.
Способ получения функционального белкового продукта для больных гистидинемией реализуют следующим образом:
1) биологическую систему (в качестве белоксодержащей биологической системы используют КБС) подвергают ферментативному или кислотному гидролизу, с целью расщепления полипептидной цепи белковой молекулы на свободные аминокислоты;
2) полученный гидролизат обрабатывают ферментом, осуществляющим превращение гистидина в уроканиновую кислоту, в количестве 0,000016-0,8% от массы белка, затем проводят инактивацию фермента методом кратковременного нагревания до 85°C в течение 10-15 с;
3) гидролизат белка, полностью свободный от гистидина, сгущают до содержания сухих веществ 40-45% и сушат при 165°C до содержания влаги 14%.
Температура сушки (165°C) подобрана технологическим методом проб с учетом максимального сохранения при нагревании всех незаменимых и заменимых аминокислот в белковых гидролизатах с целью получения полноценного продукта для специализированных продуктов питания, предназначенных для больных гистидинемией.
Пример 1
Подготавливают белоксодержащую биологическую систему, в качестве которой используют концентрат сывороточных белков (массовая доля белка 95,0%). Для этого сухой концентрат сывороточных белков в количестве 15 кг на 100 л растворяют в 45-65 л воды температурой 35-40°C в течение 30 мин, фильтруют, доводят водой до заданного объема. Далее полученную смесь пастеризуют при 74±2°C и охлаждают до температуры 37±1°C. Затем проводят ферментативный гидролиз. Для этого подготавливают ферментативную систему, состоящую из эндопептидаз (термолизин) и экзопептидаз (карбоксипептидаза А и лейцинаминопептидаза) в равных соотношениях в количестве 0,075 кг, что соответствует 0,5% от массы белка. После подготовки обеих систем приступают к проведению ферментативного гидролиза. Для этого в подготовленную белоксодержащую биологическую систему вносят ферментативную систему при температуре 50±1°C, выдерживают 8±0,05 при фермент-субстратном соотношении 1:50, затем проводят инактивацию ферментов методом кратковременного нагревания до 85°C в течение 10-15 с.
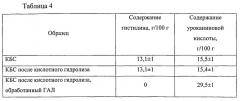
Ферментативный гидролиз белков, при данных условиях, обеспечивает достаточно полное (96,8%) расщепление полипептидной цепи белковой молекулы в биологической системе на свободные аминокислоты. Полученные данные приведены в таблице 1.
Полученный гидролизат обрабатывают ферментом, осуществляющим превращение гистидина в уроканиновую кислоту, а именно L-гистидин-аммоний-лиазой (ГАЛ) в количестве 0,000016 кг, что соответствует 0,00016% от массы белка (табл. 2), затем проводят инактивацию фермента методом кратковременного нагревания до 85°C в течение 10-15 с.
После окончания гидролиза полученный гидролизат, освобожденный от гистидина в количестве 70±0,2 кг, подвергают сгущению до содержания сухих веществ 40-45% и сушке при 165°C до содержания влаги 14%. После проведения технологического процесса получают 7,0±0,1 кг порошка с влажностью 14%.
Пример 2
Подготавливают белоксодержащую биологическую систему, в качестве которой используют сухой концентрат сывороточных белков в количестве 15 кг на 100 л растворяют в 45-65 л воды температурой 35-40°C в течение 30 мин, фильтруют, добавляют воды до необходимого объема. После чего полученную смесь пастеризуют и охлаждают до температуры 37±1°C. В качестве гидролиза используют солянокислый способ. Для этого подготавливают соляную кислоту путем трехкратной перегонки до получения 5,7 н. раствора. После подготовки обеих систем приступают к проведению кислотного гидролиза. Для этого в подготовленную биологическую систему вносят 18,7 л 5,7 н. раствор соляной кислоты. Гидролиз ведут при температуре 120°C, продолжительности 5 часов, давлении 1,3 атм.
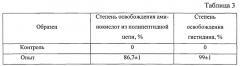
Проведение кислотного гидролиза белков при данных условиях обеспечивает достаточно полное (86,7%) расщепление полипептидной цепи молекулы белка в белоксодержащей биологической системе на свободные аминокислоты. Данные опыта представлены в таблице 3.
Далее прогидролизованную смесь направляют на деминерализацию, с целью освобождения от соляной кислоты. Колонку загружают ионообменной смолой - анионитом марки АВ-17-8, при этом высота слоя загрузки фильтра - 0,4 м, диаметр фильтра - 0,2 м, скорость фильтрации - 5-8 м/ч. Деминерализацию проводят при рН 7±0,5, продолжительность процесса 120±5 мин при нормальном атмосферном давлении.
Полученный гидролизат обрабатывают ферментом, осуществляющим превращение гистидина в уроканиновую кислоту, а именно L-гистидин-аммоний-лиазой в количестве 0,8 кг, что соответствует 5% от массы белка (табл. 4), затем проводят инактивацию фермента методом кратковременного нагревания до 85°C в течение 10-15 с.
После этого гидролизат, освобожденный от гистидина в количестве 70±0,2 кг, подвергают сгущению до содержания сухих веществ 40-45% и сушке при 165°C до содержания влаги 14%. После проведения технологического процесса получают 7,0±0,1 кг порошка с влажностью 14%.
Таким образом, в процессе ферментативного или кислотного гидролиза обеспечивается достаточно полное расщепление полипептидной цепи белковой молекулы в биологической системе на свободные аминокислоты, а за счет специфического фермента - L-гистидин-аммоний-лиазы, осуществляется превращение гистидина в уроканиновую кислоту, в результате чего достигается полное удаление гистидина из биологической системы, улучшение эффективности диетотерапии за счет снижения содержания гистидина в функциональном белковом продукте.
Способ получения функционального белкового продукта для больных гистидинемией, включающий подготовку белоксодержащей биологической системы, проведение гидролиза, адсорбцию, сгущение, сушку, отличающийся тем, что после гидролиза белоксодержащую биологическую систему обрабатывают специфическим ферментом, L-гистидин-аммоний-лиазой, в количестве 0,000016-0,8% от массы белка, затем проводят инактивацию фермента методом кратковременного нагревания до 85°C в течение 10-15 с, полученную смесь сгущают до содержания сухих веществ 40-45% и сушат при 165°C до содержания влаги 14%.