Фармацевтические композиции, содержащие глюкагон-подобный пептид 1 (glp-1)
Иллюстрации
Показать всеГруппа изобретений относится к области медицины и касается сухой порошкообразной композиции для легочного введения, содержащей микрочастицы, включающие глюкагон-подобный пептид (GLP-1) и фармацевтически приемлемую соль дикетопиперазина (DKP). Указанная композиция может быть использована в качестве фармацевтического препарата для лечения заболеваний или состояний, таких как, но не ограничивающихся ими, диабет, рак и ожирение. Раскрыт также способ получения композиции и способ введения. Группа изобретений обеспечивает стабильность, длительную эффективность и оптимальную абсорбцию при введении в организм. 4 н. и 15 з.п. ф-лы, 20 пр., 7 табл., 31 ил.
Реферат
Перекрестная ссылка на родственные заявки
Настоящая заявка является частичным продолжением заявки на патент США № 10/632878, поданной 22 июля 2003; и в настоящей заявке, согласно статье 35, § 119 (е) Кодекса законов США, испрашивается преимущество предварительной заявки на патент США №. 60/744882, поданной 14 апреля 2006. Каждая из вышеупомянутых приоритетных заявок во всей своей полноте вводится в настоящее описание посредством ссылки.
Область, к которой относится изобретение
Настоящее изобретение относится к области разработки фармацевтических композиций. В настоящем изобретении описаны сухие порошкообразные препараты, содержащие частицы дикетопиперазина (DKP) в комбинации с глюкагон-подобным пептидом 1 (GLP-1). Настоящее изобретение относится к применению фармацевтического препарата для лечения заболеваний, таких как, но не ограничивающихся ими, диабет, рак и ожирение. Более конкретно, настоящее изобретение относится к применению фармацевтического препарата для внутрилегочной доставки.
Предшествующий уровень техники
Глюкагон-подобный пептид 1 (GLP-1), описанный в литературе, представляет собой инкретин длиной в 30 или 31 аминокислоту, высвобождаемый эндокринными L-клетками тонкого кишечника в ответ на поступление жира, углеводов и белка с пищей. Было обнаружено, что уровень секреции такого пептидного гормона снижается у индивидуума с сахарным диабетом типа 2, а поэтому указанный гормон является потенциальным кандидатом на средство для лечения этих и других родственных заболеваний.
В нормальном состоянии GLP-1 секретируется L-клетками тонкого кишечника в ответ на поступающие с пищей питательные вещества (в частности, сахар), которые стимулируют индуцируемое пищей высвобождение инсулина из поджелудочной железы, ингибируют высвобождения глюкагона из печени, а также оказывают другое воздействие на желудочно-кишечный тракт и головной мозг. Действие GLP-1 в поджелудочной железе зависит от глюкозы и минимизирует риск развития гипогликемии во время экзогенного введения пептида. GLP-1 также стимулирует все стадии биосинтеза инсулина и непосредственно стимулирует рост и выживаемость β-клеток, а также дифференцировку β-клеток. Комбинация этих эффектов приводит к увеличению массы β-клеток. Кроме того, рецептор GLP-1 передает сигнал, приводящий к снижению апоптоза β-клеток, что способствует увеличению массы β-клеток.
В желудочно-кишечном тракте GLP-1 ингибирует перистальтику желудочно-кишечного тракта, повышает секрецию инсулина в ответ на действие глюкозы и снижает секрецию глюкагона, что способствует замедлению метаболизма глюкозы. Было показано, что введение GLP-1 в центральную нервную систему подавляет потребление пищи грызунами, что позволяет предположить, что периферическое высвобождение GLP-1 может непосредственно влиять на функцию головного мозга. Это предположение является вполне обоснованным, так как было показано, что циркулирующий GLP-1 может быть доступным для GLP-1-рецепторов в некоторых областях головного мозга, а именно в субфорникальном органе и в области самого заднего поля (posttrema). Известно, что эти области головного мозга участвуют в регуляции аппетита и энергетического гомеостаза. Интересно отметить, что растяжение желудка активирует GLP-1-содержащие нейроны в хвостатом ядре одиночного пути и, вероятно, играют определенную роль в экспрессии GLP-1 в центральной нервной системе как вещества, подавляющего аппетит. Эти гипотезы были подтверждены исследованиями, проводимыми с использованием антагониста рецептора GLP-1, экзендина (9-39), где наблюдался противоположеный эффект. У человека введение GLP-1 приводило к эффекту насыщения (Verdich et al., 2001), а при непрерывном подкожном вливании в течение 6 недель у пациентов с диабетом наблюдалось снижение аппетита, что приводило к значительному снижению массы тела (Zander et al., 2002).
Было также показано, что GLP-1 является эффективным у пациентов с диабетом типа 2, а именно, при непрерывном внутривенном вливании он вызывает увеличение секреции инсулина и нормализует уровни глюкозы в крови натощак и после приема пищи (Nauck et al., 1993). Кроме того, было показано, что вливание GLP-1 приводит к снижению уровней глюкозы у пациентов, которые ранее подвергались лечению не-инсулиновыми пероральными лекарственными средствами, и у пациентов, которым требовалось лечение инсулином после неудачной терапии с использованием сульфонилмочевины (Nauck et al, 1993). Однако, как было описано в литературе и как обсуждается ниже, действие одной подкожной инъекции GLP-1 дало разочаровывающие результаты. Хотя были достигнуты высокие уровни иммунореактивного GLP-1 в плазме, однако секреция инсулина быстро возвращалась на уровни, наблюдаемые до проведения лечения, а концентрации глюкозы в крови не нормализовались (Nauck et al., 1996). Только после повторного подкожного введения влияние на уровни глюкозы в крови натощак было сравнимо с эффектом, наблюдаемым при внутривенном введении (Nauck et al., 1996). Было показано, что непрерывное подкожное введение в течение 6 недель приводило к снижению концентраций глюкозы в крови натощак и после приема пищи, и к снижению уровней HbA1c (Zander et al., 2002). Кратковременная эффективность одноразовых подкожных инъекций GLP-1 была ассоциирована с его нестабильностью в кровотоке. Было показано, что GLP-1 подвергается метаболизму в плазме in vitro, и что за такое разложение ответственен фермент дипептидил-петидаза-IV (DPP-IV (Mentlein et al., 1993).
Поскольку было продемонстрировано, что GLP-1 играет важную физиологическую роль при диабете, и что экзогенный GLP-1 быстро разлагается по амино-концу у здоровых индивидуумов и у индивидуумов с диабетом типа 2, то многие исследования были посвящены возможности повышения in vivo стабильности GLP-1, что можно рассматривать как новый подход к разработке противодиабетического средства для лечения диабета (Deacon et al., 2004). Было предложено два отдельных подхода: 1) получение аналогов, которые являются нечувствительными к ферментативному расщеплению и 2) применение селективных ингибиторов ферментов для предотвращения деградации GLP-1 in vivo и увеличение уровней интактных биологически активных пептидов. Были проведены клинические испытания аналогов GLP-1 длительного действия (например, лираглутида (Novo Nordisk, Copenhagen, Denmark)); экзенатида (экзендина-4; Byetta®) (Amylin Inc., San Diego, CA) и экзенатида-LAR (Eli Lilly, Indianapolis, IN)), которые являются резистентными к расщеплению и получили название «миметики инкретина». Ингибиторы дипептидил-пептидазы IV (например, вилдаглиптин (Galvus), разработанный Novartis, Basel, Switzerland), и ситаглиптин (Januvia), разработанный Merck, Whitehouse Station, New Jersey)), которые ингибируют фермент, ответственный за разложение инсулина, также находятся на стадии исследований (Deacon et al., 2004). Так, например, очевидно, что широкий спектр действия GLP-1 (например, повышение уровня высвобождения инсулина, замедление скорости опустошения желудка и повышение насыщаемости), наряду с его низкой предрасположенностью к развитию гипогликемии, делает этот препарат более предпочтительным для применения по сравнению с имеющимися в настоящее время терапевтическими средствами.
Однако, несмотря на имеющиеся в настоящее время методы/преимущества GLP-1-терапии, ни одно из лекарственных средств, применяемых в настоящее время для лечения диабета, не дают нужного терапевтического эффекта (снижения уровней HbA1c, снижения уровней глюкозы в крови натощак и улучшения метаболизма глюкозы), и у всех пациентов наблюдаются побочные эффекты, такие как токсикоз, гипогликемия, увеличение массы, тошнота и стресс от рвоты. Следовательно, необходимость в разработке стабильных препаратов GLP-1, обладающих длительной эффективностью и оптимальной абсорбцией при их введении в качестве фармацевтических препаратов, остается актуальной.
Описание сущности изобретения
В настоящее время не существует каких-либо стабильных и вводимых путем ингаляции препаратов, содержащих глюкагон-подобный пептид 1 (GLP-1) и применяемых в качестве фармацевтических средств. Для решения этой проблемы было разработано настоящее изобретение, которое относится к препаратам, содержащим GLP-1 в комбинации с частицами дикетопиперазина (DKP) и используемым в качестве фармацевтического средства.
Поэтому в своих конкретных вариантах изобретения настоящее изобретение относится к сухой порошкообразной композиции, содержащей молекулу GLP-1 и дикетопиперазин или их фармацевтически приемлемую соль. В других вариантах изобретения сухая порошкообразная композиция согласно изобретению содержит молекулу GLP-1, выбранную из группы, состоящей из нативного GLP-1, метаболита GLP-1, аналога GLP-1, производного GLP-1, GLP-1, защищенного от действия дипептидил-пептидазы IV (DPP-IV), GLP-1-миметика, экзендина, аналога пептида GLP-1 или биосинтетического аналога GLP-1. В еще одном варианте настоящего изобретения сухая порошкообразная композиция содержит дикетопиперазин, имеющий формулу 2,5-дикето-3,6-ди(4-X-аминобутил)пиперазин, где X выбран из группы, состоящей из сукцинила, глутарила, малеила и фумарила. В другом варианте изобретения сухая порошкообразная композиция содержит соль дикетопиперазина. В еще одном своем варианте настоящее изобретение относится к сухой порошкообразной композиции, где указанным дикетопиперазином является 2,5-дикето-3,6-ди(4-фумарил-аминобутил)пиперазин.
Кроме того, в настоящем изобретении рассматривается сухая порошкообразная композиция, где указанной молекулой GLP-1 является нативная или амидированная молекула GLP-1, где указанной амидированной молекулой GLP-1 является амид GLP-1 (7-36).
В еще одном своем конкретном варианте настоящее изобретение относится к способу получения частиц, содержащих молекулу GLP-1 и дикетопиперазин, где указанный способ включает стадии получения раствора GLP-1, содержащего молекулу GLP-1; получения раствора дикетопиперазина, образующего частицы, или суспензии частиц дикетопиперазина; и объединения раствора GLP-1 с раствором или суспензией дикетопиперазина. В других конкретных вариантах изобретения способ получения частиц, содержащих молекулу GLP-1 и дикетопиперазин, также включает удаление растворителя из раствора или суспензии путем лиофилизации, фильтрации или сушки распылением. В еще одном варианте изобретения частицы согласно изобретению образуются при удалении растворителя или перед удалением растворителя.
В одном из своих вариантов настоящее изобретение относится к способу получения частиц, содержащих молекулу GLP-1 и дикетопиперазин, где указанная молекула GLP-1 выбрана из группы, состоящей из нативного GLP-1, аналога GLP-1, производного GLP-1, GLP-1, защищенного от действия дипептидил-пептидазы IV (DPP-IV), GLP-1-миметика, экзендина, аналога пептида GLP-1 или биосинтетического аналога GLP-1. В другом варианте изобретения способ получения частиц, содержащих молекулу GLP-1 и дикетопиперазин, включает получение дикетопиперазина в виде суспензии частиц. В другом варианте изобретения дикетопиперазин получают в растворе, и такой способ включает коррекцию pH раствора для осаждения дикетопиперазина и образования частиц.
В других конкретных вариантах изобретения раствор GLP-1 имеет концентрацию, составляющую примерно 1 мкг/мл - 50 мг/мл, более предпочтительно, примерно 0,1 мг/мл - 10 мг/мл. В еще одном конкретном варианте изобретения раствор GLP-1 имеет концентрацию примерно 0,25 мг/мл.
Другой способ получения частиц, содержащих молекулу GLP-1 и дикетопиперазин, также включает добавление агента в раствор, где указанный агент выбран из солей, поверхностно-активных веществ, ионов, осмолитов, хаотропов и лиотропов, кислоты, основания и органических растворителей. Такой агент стимулирует ассоциацию частиц GLP-1 и дикетопиперазина, а также повышает стабильность и/или улучшает фармакодинамику молекулы GLP-1. В некоторых вариантах изобретения указанным агентом является соль, такая как, но не ограничивающаяся ею, хлорид натрия. Также рассматривается, что указанным агентом может быть поверхностно-активное вещество, такое как, но не ограничивающееся ими, твин, тритон, плюроновая кислота, CHAPS, цетримид и Brij, H(CH2)7SO4Na. Таким агентом может быть ион, например, катион или анион. Указанным агентом может быть осмолит (стабилизатор), такой как, но не ограничивающийся ими, гексилен-гликоль (Hex-Gly), трегалоза, глицин, полиэтиленгликоль (ПЭГ), N-оксид триметиламина (TMAO), маннит и пролин. Указанным агентом может быть хаотроп или лиотроп, такой как, но не ограничивающийся ими, хлорид цезия, цитрат натрия и сульфат натрия. Указанным агентом может быть органический растворитель, например, спирт, выбранный из метанола (MeOH), этанола (EtOH), трифторэтанола (TFE) и гексафторизопропанола (HFIP).
В другом своем конкретном варианте настоящее изобретение относится к способу получения частиц, содержащих молекулу GLP-1 и дикетопиперазин, где указанный способ включает доведение pH суспензии частиц до значения, составляющего примерно 4 или более. В других своих вариантах настоящее изобретение относится к способу получения частиц, содержащих молекулу GLP-1 и дикетопиперазин, где указанная молекула GLP-1 в данных частицах имеет более высокую стабильность.
В настоящем изобретении также рассматривается способ введения эффективного количества молекулы GLP-1 индивидууму, нуждающемуся в этом, где указанный способ включает введение индивидууму частиц GLP-1/дикетопиперазина. Такими способами введения могут быть, но не ограничиваются ими, внутривенное, подкожное, пероральное, интраназальное, трансбуккальное, ректальное или внутрилегочное введение. В одном из вариантов изобретения указанным способом введения является внутрилегочное введение. В другом варианте изобретения указанный способ введения осуществляют для лечения состояния или заболевания, выбранного из группы, состоящей из диабета, ишемии, реперфузионного поражения ткани, дислипидемии, диабетической кардиомиопатии, инфаркта миокарда, острого коронарного синдрома, ожирения, катаболических изменений после хирургического вмешательства, гипергликемии, синдрома раздраженного кишечника, инсульта, нейродегенеративных расстройств, расстройства памяти и нарушения познавательных способностей и состояний, связанных с имплантацией островковых клеток и регенеративной терапией.
В другом варианте изобретения способ введения композиции частиц GLP-1/дикетопиперазина позволяет улучшить фармакокинетику, увеличить время полужизни и улучшить биологическую доступность GLP-1.
В еще одном своем конкретном варианте настоящее изобретение относится к способу получения сухой порошкообразной композиции с улучшенным фармакокинетическим профилем, где указанный способ включает стадии: получения раствора молекулы GLP-1; получения дикетопиперазина, образующего частицы; образования частиц; и объединения GLP-1 и дикетопиперазина; а затем удаления растворителя методом сушки с получением сухого порошка, где указанный сухой порошок имеет улучшенный фармакокинетический профиль. Термин «улучшенный фармакокинетический профиль» означает более длительное время полужизни GLP-1 и/или улучшенную биологическую доступность GLP-1. Такое более длительное время полужизни GLP-1 составляет 7,5 минут или более.
В одном из своих вариантов настоящее изобретение относится к получению сухой порошкообразной композиции, содержащей молекулу GLP-1 и дикетопиперазин или их фармацевтически приемлемую соль. В другом варианте изобретения молекула GLP-1 выбрана из группы, состоящей из нативных GLP-1; метаболитов GLP-1; аналогов GLP-1; производных GLP-1; GLP-1, защищенных от действия дипептидил-пептидазы IV (DPP-IV); GLP-1-миметиков; аналогов пептида GLP-1 или биосинтетических аналогов GLP-1.
В другом варианте изобретения указанный дикетопиперазин представляет собой дикетопиперазин, имеющий формулу 2,5-дикето-3,6-ди(4-X-аминобутил)пиперазин, где X выбран из группы, состоящей из сукцинила, глутарила, малеила и фумарила. В другом варианте изобретения указанным дикетопиперазином является соль дикетопиперазина. В другом варианте изобретения указанным дикетопиперазином является 2,5-дикето-3,6-ди-(4-фумарил-аминобутил)пиперазин.
В одном из вариантов изобретения молекула GLP-1 представляет собой нативный GLP-1. В другом варианте изобретения молекула GLP-1 представляет собой амидированную молекулу GLP-1. В другом варианте изобретения указанной амидированной молекулой GLP-1 является амид GLP-1 (7-36).
В одном из своих вариантов настоящее изобретение относится к способу получения частиц, содержащих молекулу GLP-1 и дикетопиперазин, где указанный способ включает стадии: получения молекулы GLP-1; получения дикетопиперазина в форме, выбранной из дикетопиперазина, образующего частицы, дикетопиперазиновых частиц и их комбинаций; и объединения молекулы GLP-1 и дикетопиперазина в форме сораствора, где образуются частицы, содержащие молекулу GLP-1 и дикетопиперазин.
В одном из вариантов изобретения указанный способ также включает удаление растворителя из указанного сораствора путем лиофилизации, фильтрации или сушки распылением. В другом варианте изобретения частицы, содержащие указанную молекулу GLP-1 и дикетопиперазин, образуются при удалении растворителя. В другом варианте изобретения частицы, содержащие указанную молекулу GLP-1 и дикетопиперазин, образуются перед удалением растворителя.
В другом варианте изобретения молекула GLP-1 выбрана из группы, состоящей из нативного GLP-1, аналога GLP-1, производного GLP-1, GLP-1, защищенного от действия дипептидил-пептидазы IV (DPP-IV), GLP-1-миметика, аналога пептида GLP-1 или биосинтетического аналога GLP-1. В другом варианте изобретения молекулу GLP-1 получают в виде раствора, содержащего GLP-1 в концентрации примерно 1 мкг/мл - 50 мг/мл. В другом варианте изобретения молекулу GLP-1 получают в виде раствора, содержащего GLP-1 в концентрации примерно 0,1 мг/мл - 10 мг/мл. В другом варианте изобретения молекулу GLP-1 получают в виде раствора, содержащего GLP-1 в концентрации примерно 0,25 мг/мл.
В другом варианте изобретения дикетопиперазин получают в форме суспензии дикетопиперазиновых частиц. В другом варианте изобретения дикетопиперазин получают в форме раствора, содержащего образующий частицы дикетопиперазин, где указанный способ также включает доведение рН раствора до значения, благоприятствующего образованию дикетопиперазиновых частиц. В другом варианте изобретения указанный способ также включает добавление агента в указанный раствор или суспензию, где указанный агент выбран из группы, состоящей из солей, поверхностно-активных веществ, ионов, осмолитов, хаотропов и лиотропов, кислот, оснований и органических растворителей. В другом варианте изобретения указанный агент стимулирует ассоциацию молекулы GLP-1 и дикетопиперазиновых частиц или дикетопиперазина, образующего частицы. В другом варианте изобретения указанный агент повышает стабильность или улучшает фармакодинамику молекулы GLP-1. В другом варианте изобретения указанным агентом является хлорид натрия.
В другом варианте изобретения указанный способ также включает коррекцию рН суспензии или раствора. В другом варианте изобретения указанный способ также включает доведение рН примерно до 4,0 или более. В еще одном варианте изобретения молекула GLP-1, присутствующая в частице, является более стабильной, чем нативный GLP-1.
В другом варианте изобретения указанный сораствор содержит GLP-1 в концентрации примерно 1 мкг/мл-50 мг/мл. В другом варианте изобретения указанный сораствор содержит GLP-1 в концентрации примерно 0,1 мг/мл - 10 мг/мл. В другом варианте изобретения указанный сораствор содержит молекулу GLP-1 в концентрации примерно 0,25 мг/мл.
В другом варианте изобретения указанный способ также включает добавление агента в сораствор, где указанный агент выбран из группы, состоящей из солей, поверхностно-активных веществ, ионов, осмолитов, хаотропов и лиотропов, кислот, оснований и органических растворителей. В другом варианте изобретения указанный агент стимулирует ассоциацию молекулы GLP-1 и дикетопиперазиновых частиц или дикетопиперазина, образующего частицы. В другом варианте изобретения указанный агент повышает стабильность или улучшает фармакодинамику молекулы GLP-1. В другом варианте изобретения указанным агентом является хлорид натрия.
В другом варианте изобретения указанный способ также включает коррекцию рН сораствора. В другом варианте изобретения указанный способ также включает доведение рН примерно до 4,0 или более.
В одном из своих вариантов настоящее изобретение относится к способу введения эффективного количества молекулы GLP-1 индивидууму, нуждающемуся в этом, где указанный способ включает введение указанному индивидууму частиц, содержащих GLP-1 и дикетопиперазин. В другом варианте изобретения указанный способ осуществляют путем внутривенного, подкожного, перорального, интраназального, трансбуккального, ректального или внутрилегочного введения. В другом варианте изобретения указанный способ осуществляют путем внутрилегочного введения.
В другом варианте изобретения указанный способ осуществляют для лечения состояния или заболевания, выбранного из группы, состоящей из диабета, ишемии, реперфузионного поражения ткани, дислипидемии, диабетической кардиомиопатии, инфаркта миокарда, острого коронарного синдрома, ожирения, катаболических изменений после хирургического вмешательства, гипергликемии, синдрома раздраженного кишечника, инсульта, нейродегенеративных расстройств, расстройства памяти и нарушения познавательных способностей и состояний, связанных с имплантацией островковых клеток и регенеративной терапией.
В другом варианте изобретения введение указанных частиц, по сравнению с введением нативного GLP-1, приводит к улучшению фармакокинетики, увеличению времени полужизни и улучшению биологической доступности GLP-1.
В одном из своих вариантов настоящее изобретение относится к способу получения порошкообразной композиции с улучшенным фармакокинетическим профилем GLP-1, где указанный способ включает стадии: получения молекулы GLP-1; получения дикетопиперазина, образующего частицы в растворе; образования частиц дикетопиперазина; объединения молекулы GLP-1 и раствора с образованием сораствора; и удаления растворителя из сораствора путем сушки распылением с получением порошка, имеющего улучшенный фармакокинетический профиль GLP-1.
В другом варианте изобретения указанный улучшенный фармакокинетический профиль GLP-1 включает более длительное время полужизни GLP-1. В другом варианте изобретения более длительное время полужизни GLP-1 составляет 7,5 минут или более. В другом варианте изобретения указанный улучшенный фармакокинетический профиль GLP-1 включает улучшенную биологическую доступность GLP-1 по сравнению с нативным GLP-1.
Краткое описание графического материала
Нижеследующий графический материал составляет часть описания настоящей заявки и включает некоторые другие аспекты настоящего изобретения. Настоящее изобретение будет более понятным из нижеследующего описания со ссылками на одну или несколько иллюстраций в сочетании с подробным описанием представленных здесь конкретных вариантов осуществления изобретения.
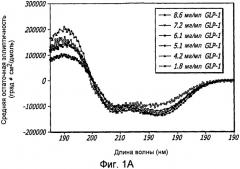
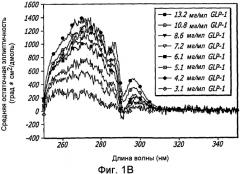
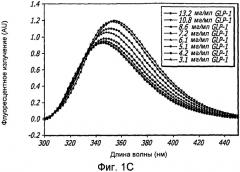
Фиг. 1A-1D. Структурный анализ GLP-1 при различных концентрациях (pH 4, 20°С). Фиг. 1A - Круговой дихроизм (КД) в далекой области УФ-излучения GLP-1 показал, что по мере увеличения концентрации вторичная структура пептида трансформируется, в основном, из неструктурированной конформации в спиральную конформацию. Фиг. 1B - КД в ближнем УФ показал, что степень третичной структуры увеличивается с увеличением концентрации пептида, что позволяет предположить, что GLP-1 подвергается самосборке. Фиг. 1С - Флуоресцентное излучение GLP-1 при различных концентрациях (pH 4, 20°С), возникающее в результате возбуждения триптофана на 280 нм. Фиг. 1D - Просвечивающая инфракрасная Фурье-спектроскопия (FTIR) GLP-1 при различных концентрациях (pH 4, 20°С). Полоса амида I при 1656 см-1 указывает на то, что GLP-1 имеет α-спиральную структуру при концентрациях ≥ 2 мг/мл.
Фиг. 2A-2D. Структурный анализ GLP-1 при низких концентрациях и при варьирующейся ионной силе (pH 4, 20°С). Фиг. 2A - КД в далекой области УФ-излучения GLP-1 при 1,0 мг/мл показал, что при возрастании концентрации соли, неупорядоченная структура GLP-1 превращается в более упорядоченные α-спиральные структуры. Фиг. 2B - КД в ближней области УФ-излучения пептида при 1,0 мг/мл показал, что при возрастании концентрации NaCl также наблюдалась тенденция к увеличению степени третичной структуры GLP-1. Фиг. 2C - Собственное флуоресцентное излучение GLP-1 в концентрации 1,0 мг/мл при варьирующихся концентрациях NaCl (pH 4, 20°С) после возбуждения триптофана на 280 нм. При высоких концентрациях пептида максимальное значение интенсивности снижается и сдвигается в сторону более низкой длины волны, что указывает на присутствие хорошо определенной третичной структуры. Фиг. 2D - Анализ третичной структуры GLP-1 в концентрации 10 мг/мл при варьирующейся ионной силе (pH 4, 20°С). КД в ближней области спектра УФ-излучения показал, что с увеличением ионной силы увеличивается степень третичной структуры GLP-1, подвергаемого самосборке.
Фиг. 3A-3B. Структурный анализ 10 мг/мл GLP-1 при различных температурах (pH 4). Фиг. 3A - КД в ближнем УФ показал, что олигомеры GLP-1 диссоциируются с увеличением температуры. Фиг. 3B - Структурный анализ 10 мг/мл GLP-1 при различных температурах (pH 4). Фиг. 3C - Структурный анализ 0,05 мг/мл GLP-1 при различных температурах (pH 4). КД в далеком УФ показал, что данный пептид не чувствителен к изменению температуры.
Фиг. 4A-4B. Структурный анализ GLP-1 при варьирующихся pH (20°С). Фиг. 4A - КД в далеком УФ GLP-1 в концентрации 10 мг/мл при варьирующихся pH (20°С). По мере увеличения pH GLP-1, подвергнутый самосборке, осаждается при pH 6,3-7,6, но сохраняет спиральную структуру при 1,5 и 11,7. Фиг. 4B - Уширение спектра при pH 7,6 показало, что при снижении концентрации вторичная структура GLP-1 становится неупорядоченной.
Фиг. 5. Резистентность GLP-1 в концентрации 1 мг/мл к дезамидированию и окислению была продемонстрирована с помощью ЖХВД. Условия дезамидирования были достигнуты путем инкубирования GLP-1 при pH 10,5 в течение 5 дней при 40°С. Окислительные условия были достигнуты путем инкубирования GLP-1 в 0,1 % H2O2 в течение 2 часов при комнатной температуре.
Фиг. 6A-6B. Влияние перемешивания на третичную структуру GLP-1 при концентрациях 1,5 и 9,4 мг/мл (pH 4). КД в ближнем УФ (Фиг. 6A) и флуоресцентное излучение GLP-1 (Фиг. 6B) показали, что третичная структура пептида GLP-1 не подвергается каким-либо значительным изменениям при перемешивании. Образцы перемешивали в течение 30 и 90 минут при комнатной температуре, и после возбуждения триптофана на 280 нм получали спектры флуоресцентного излучения.
Фиг. 7A-7C. Влияние 10 циклов «замораживания - оттаивания» на третичную структуру GLP-1 при концентрациях 1,6, 5,1 и 8,4 мг/мл (pH 4). КД в ближнем УФ (Фиг. 7A) и флуоресцентное излучение GLP-1 (Фиг. 7B) показали, что третичная структура данного пептида не подвергается каким-либо значительным изменениям при проведении множества циклов «замораживания - оттаивания». Образцы замораживали при -20°С и размораживали при комнатной температуре. После возбуждения триптофана на 280 нм получали спектры флуоресцентного излучения. Аналогичные эксперименты по влиянию 11 циклов «замораживания - оттаивания» на вторичную структуру GLP-1 (рН4) при концентрации 10 мг/мл были проведены методом КД в далеком УФ (Фиг. 7C).
Фиг. 8A-8B. Исследование солей. Кривые загрузки GLP-1/FDKP в зависимости от pH и концентрации NaCl (Фиг. 8A). Загрузку осуществляли при 5 мг/мл FDKP и 0,25 мг/мл GLP-1. Концентрации NaCl выражали в мМ. Фиг. 8B - Указано количество GLP-1, обнаруженное в разведенных контрольных образцах, не содержащих FDKP, в зависимости от pH и концентрации NaCl.
Фиг. 9A-9B. Исследование поверхностно-активных веществ. Кривые загрузки GLP-1/FDKP в зависимости от pH и поверхностно-активного вещества (Фиг. 9A). Загрузку осуществляли при 5 мг/мл FDKP и 0,25 мг/мл GLP-1. Фиг. 9B - Указано количество GLP-1, обнаруженное в разведенных контрольных образцах, не содержащих FDKP, в зависимости от pH и добавленного поверхностно-активного вещества.
Фиг. 10A-10D. Исследование ионов. Кривые загрузки GLP-1/FDKP в зависимости от pH и ионов. Загрузку осуществляли при 5 мг/мл FDKP и 0,25 мг/мл GLP-1 (фиг.10А и 11С). Концентрации ионов указаны в надписях к графическому материалу (мМ). На кривых, расположенных справа, представлены результаты для 1М NaCl. Фиг. 10В и 10D - Указано количество GLP-1, обнаруженное в разведенных контрольных образцах, не содержащих FDKP, в зависимости от pH, ионов и 1М NaCl.
Фиг. 11-11В. Исследование осмолитов. Кривые загрузки GLP-1/FDKP в зависимости от pH и от присутствия общих стабилизаторов (осмолитов; фиг.11А). Загрузку осуществляли при 5 мг/мл FDKP и 0,25 мг/мл GLP-1. Фиг. 11В. - Указано количество GLP-1, обнаруженное в разведенных контрольных образцах, не содержащих FDKP, в зависимости от pH и осмолитов. «N/A» означает отсутствие осмолитов в образце.
Фиг. 12A-12B. Исследование хаотропов/лиотропов. Кривые загрузки GLP-1/FDKP в зависимости от концентрации хаотропов или лиотропов при рН 3,0 (фиг.12А) и рН 4,0 (Фиг. 12C). Загрузку осуществляли при 5 мг/мл FDKP и 0,25 мг/мл GLP-1. Фиг. 12В и 12D. - Указано количество GLP-1, обнаруженное в разведенных контрольных образцах, не содержащих FDKP, в зависимости от pH в присутствии различных хаотропов или лиотропов. «N/A» означает отсутствие хаотропов или лиотропов в образце.
Фиг. 13A-13B. Исследование спиртов. Кривые загрузки GLP-1/FDKP в зависимости от pH и от спиртов. Загрузку осуществляли при 5 мг/мл FDKP и 0,25 мг/мл GLP-1. Были оценены четыре концентрации для каждого спирта, 5%, 10%, 15% и 20% об/об. (Фиг. 13A). TFE=трифторэтанол; HFIP=гексафторизопропанол. Фиг. 13B - Указано количество GLP-1, обнаруженное в разведенных контрольных образцах, не содержащих FDKP, в зависимости от pH и спирта (20%).
Фиг. 14A-14B. Исследование загрузки концентраций GLP-1/FDKP (Фиг. 14A). Загрузку осуществляли при 5 мг/мл FDKP, и анализируемую концентрацию GLP-1 откладывали по оси Х. Фиг. 14B - Изображения множества прапаратов GLP-1/FDKP, полученные с помощью сканирующей электронной микроскопии (СЭМ) (при увеличении 10000x), указывают на образование скоплений сферических и палочко-подобных GLP-1/FDKP-частиц, используемых в качестве препаратов. (Панель A) - 0,5 мг/мл GLP-1 и 2,5 мг/мл FDKP; (панель B) 0,5 мг/мл GLP-1 и 10 мг/мл FDKP; (панель C) 0,5 мг/мл GLP-1 и 10 мг/мл FDKP в 20 мМ хлорида натрия, 20 мМ ацетата калия и 20 мМ фосфата калия, pH 4,0; и (панель D) 10 мг/мл GLP-1 и 50 мг/мл FDKP в 20 мМ хлорида натрия, 20 мМ ацетата калия и 20 мМ фосфата калия, pH 4,0.
Фиг. 15. Показано влияние стресса на множество препаратов GLP-1/FDKP. Указано процентное содержание (по массе) GLP-1 по отношению к частицам FDKP и к другим компонентам, которые присутствовали в растворе до лиофилизации. Образцы инкубировали в течение 10 дней при 40°С.
Фиг. 16A-16C. Структура GLP-1. Фиг. 16A - Показана удлиненная за счет глицина форма GLP-1 (SEQ ID NO.1) и амидированная форма (SEQ ID NO. 2). Фиг. 16B - Ингибирование DPP-IV-активности апротинином. Фиг. 16C - Ингибирование DPP-IV-активности ингибитором DPPIV.
Фиг. 17. Обнаружение GLP-1 после инкубирования в легочном лаваже.
Фиг. 18A-18B. Проиллюстрирована количественная оценка GLP-1 в плазме. На фиг. 18A проиллюстрирована количественная оценка при разведении 1:2 в плазме. На фиг. 18B проиллюстрирована количественная оценка при разведении 1:10 в плазме.
Фиг. 19A-19B. Влияние GLP-1 и аналогов GLP-1 на выживание клеток. Влияние GLP-1 на гибель эпителиальных клеток поджелудочной железы крыс (ARIP) (Фиг. 19A). Окрашивание аннексином V указывало на ингибирование апоптоза в присутствии GLP-1 и стауроспорина (Stau), используемых в качестве отдельных средств и в комбинации (Фиг. 19B). Концентрация GLP-1 составлет 15 нМ, а концентрация стауроспорина составляет 1 мкМ.
Фиг. 20. Влияние аналога GLP-1, экзендина-4, на жизнеспособность клеток. Клетки ARIP обрабатывали 0, 10, 20 и 40 нМ экзендина 4 в течение 16, 24 и 48 часов.
Фиг. 21. Влияние множества препаратов GLP-1/FDKP на индуцированную стауроспорином гибель клеток. Клетки ARIP, предварительно обработанные образцами GLP-1, подвергали воздействию 5 мкМ стауроспорина в течение 4 часов и анализировали с использованием реагента Cell Titer-GloTM на жизнеспособность клеток. Образцы помещали на 4 недели в условия стресса при 4°С и 40°С. Контрольные образцы, показанные справа (среда, GLP-1, STAU, GLP+STAU), иллюстрируют жизнеспособность клеток в среде (без GLP-1 или стауроспорина), в среде с GLP-1, в среде со стауроспорином и в среде с GLP-1 и стауроспорином (примечание: надписи на графике не относятся к контрольным образцам). Все результаты представлены как средние величины для трех экспериментов.
Фиг. 22A-22B. Фармакокинетические исследования, иллюстрирующие одну внутривенную инъекцию (i.v., фиг. 22A) и внутрилегочную инсуффляцию (i.s.; фиг. 22B) крысам с использованием различных концентраций препаратов GLP-1/FDKP. Указаны процентное содержание (по массе) GLP-1 по отношению к частицам FDKP для анализируемых препаратов.
Фиг. 23A-23B. Снижение общего потребления пищи у крыс через 2 часа (фиг. 23A) и 6 часов (фиг. 23B) после введения им дозы препаратов GLP-1/FDKP.
Фиг. 24. Фармакодинамические исследования GLP-1/FDKP, вводимого путем внутрилегочной инсуффляции самцам крыс, у которых было индуцировано ожирение в результате кормления их сахаром. Представлены данные измерения уровня глюкозы через 0, 15, 30, 45, 60 и 90 минут для контроля (воздух; группа 1) и для GLP-1/FDKP-обработанных животных (группа 2).
Фиг. 25. Фармакодинамические исследования GLP-1/FDKP, вводимого путем внутрилегочной инсуффляции самцам крыс, у которых было индуцировано ожирение в результате кормления их сахаром. Представлены данные измерения уровня GLP-1 через 0, 15, 30, 45, 60 и 90 минут для контроля (воздух; группа 1) и для GLP-1/FDKP-обработанных животных (группа 2).
Фиг. 26. Фармакодинамические исследования GLP-1/FDKP, вводимого путем внутрилегочной инсуффляции самцам крыс, у которых было индуцировано ожирение в результате кормления их сахаром. Представлены данные измерения уровня инсулина через 0, 15, 30, 45, 60 и 90 минут для контроля (воздух; группа 1) и для GLP-1/FDKP-обработанных животных (группа 2).
Фиг. 27. Фармакокинетические исследования GLP-1/FDKP различными концентрациями GLP-1, вводимыми самкам крыс путем внутрилегочной инсуффляции. Представлены данные измерения уровня GLP-1 через 0, 2, 5, 10, 20, 30, 40 и 60 минут для контроля (воздух; группа 1) и для GLP-1/FDKP-обработанных групп 2, 3 и 4, которым вводили 5%, 10% и 15% GLP-1, соответственно.
Фиг. 28. Фармакокинетические исследования GLP-1/FDKP с различными концентрациями GLP-1, вводимыми самкам крыс путем внутрилегочной инсуффляции. Данные измерения уровня FDKP через 0, 2, 5, 10, 20, 30, 40 и 60 минут для контроля (воздух; группа 1) и для GLP-1/FDKP-обработанных групп 2, 3 и 4, которым вводили 5%, 10% и 15% GLP-1, соответственно.
Фиг. 29. Фармакодинамические исследования GLP-1/FDKP у самок крыс, которым вводили GLP-1/FDKP, содержащий 15% GLP-1 (0,3 мг GLP-1), посредством внутрилегочной инсуффляции, проводимой один раз в день (n=10) 4 дня подряд. Полученные данные указывают на среднее потребление пищи, измеряемое перед введением дозы, и через 1, 2, 4 и 6 часов после введения дозы 4 дня подряд.
Фиг. 30. Фармакодинамические исследования GLP-1/FDKP у самок крыс, которым вводили GLP-1/FDKP, содержащий 15% GLP-1 (0,3 мг GLP-1), посредством внутрилегочной инсуффляции, проводимой один раз в день (n=10) 4 дня подряд. Полученные данные указывают на среднюю массу тела, измеряемую перед введением дозы, и через 1, 2, 4 и 6 часов после введения дозы 4 дня подряд.
Фиг. 31. Токсикокинетические исследования GLP-1/FDKP у обезьян, которым ороназально вводили GLP-1/FDKP один раз в день (в течение 30 минут) 5 дней подряд. Полученные данные указывают на максимальные концентрации (Cmax) GLP-1 в плазме самцов и самок. Животным контрольной группы вводили воздух (группа 1), животным группы 2 вводили 2 мг/кг FDKP, а животным групп 3, 4 и 5 вводили 0,3, 1,0 или 2,0 мг/кг GLP-1/FDKP, соответственно.
Подробное описание предпочтительного варианта изобретения
В настоящее время не существует каких-либо стабильных и вводимых путем ингаляции препаратов, содержащих глюкагон-подобный пептид 1 (GLP-1) и применяемых в качестве фармацевтических средств. Это обусловлено нестабильностью пептида GLP-1 in vivo. Соединения GLP-1 могут сохраняться в растворе в различных условиях, но они имеют относительно непродолжительное время полужизни in vivo при их введении в виде раствора. Кроме того, было обнаружено, что в различных биологических жидкостях, таких как легочная жидкость и кровь, присутствует дипептидил-пептидаза IV (DPP-IV), которая значительно снижает биологическое время полужизни молекул GLP-1. Так, например, было показано, что биологическое время полужизни GLP-l(7-37) составляет 3-5 минут, см., патент США No. 5118666. Было так