Соединения плазмалогенов, содержащие их фармацевтические композиции и способы лечения возрастных заболеваний
Иллюстрации
Показать всеИзобретение относится к новым соединениям формулы I, в которой R1 и R2 являются одинаковыми или разными и выбраны из алкильной или алкенильной углеводородной цепи, значения группы R3, которая отщепляется липазой, определены в формуле изобретения. R4 и R5 являются независимо водородом или С1-С7алкилом; R6 представляет собой водород или С1-С7алкил; и R7 и R8 независимо являются водородом или С1-С7алкилом. Изобретение также относится к применению соединений формулы I, которые при введении в биологическую систему млекопитающего приводят к повышению клеточных концентраций специфических sn-2 замещенных этаноламин-плазмалогенов. Данные соединения могут применяться для лечения или предупреждения возрастных заболеваний, ассоциированных с повышенным уровнем холестерина в мембране, повышенным уровнем амилоида и пониженными уровнями плазмалогенов, таких как нейродегенерация, когнитивное нарушение, деменции, рак, остеопороз, биполярное нарушение и сосудистые заболевания.
5 н. и 6 з.п. ф-лы, 18 ил., 7 пр.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к синтезу и применению новых химических соединений, обладающих полезными биохимическими, физиохимическими и клиническими свойствами. В частности, обеспечены серии производных 1-алкил, 2-ацилглицерина, которые могут применяться для лечения или предупреждения заболевания. Изобретение также относится к фармацевтическим композициям и наборам, содержащим такие соединения.
Уровень техники
Известно, что вероятность возникновения многих различных заболеваний человека, таких как рак, деменция или пониженное когнитивное функционирование увеличивается с возрастом. С эпидемиологической и статистической точки зрения данные заболевания часто выглядят очень похожими. Однако с клинической точки зрения каждое из раковых заболеваний, деменций и уменьшенного когнитивного функционирования сильно отличаются. В настоящее время большим фактором риска для этих заболеваний является возраст субъекта. Более того, установлено, что большинство раковых заболеваний, деменций и уменьшенное когнитивное функционирование имеют продолжительную продромальную фазу (5-15 лет), во время которой заболевание присутствует, но протекает субклинически. Сообщалось о возрастном повышении уровня холестерина в мембранах1-3 и повышенном содержании холестерина в мембранах митохондрий4-6. Данные повышения уровня холестерина в мембране приводят к понижению текучести мембран2, понижению функции ионных каналов6-8, понижению активностям некоторых мембраносвязанных ферментов, таких как 5'-нуклеотидаза9 и α-секретаза10, и изменению диффузионных свойств сигнальных молекул, таких как оксид азота11.
Субъекты, страдающие от повышенного уровня холестерина в мембране, демонстрируют увеличенную распространенность нейродегенеративных заболеваний (например, Альцгеймера, Паркинсона, рассеянного склероза и возрастной макулярной дегенерации), когнитивных нарушений, деменций, рака (например, предстательной железы, легких, молочной железы, яичников и почек), остеопороза, биполярного расстройства и сосудистых заболеваний (атеросклероза, гиперхолестеринемии).
В отношении специфических заболеваний, холестерин накапливается в мембранных структурах головного мозга пациентов с болезнью Альцгеймера в зависимости от тяжести заболевания12-14. При этом было показано, что понижение уровня холестерина в мембранах уменьшает активности бета- и гамма-секретаз, блокируя патологический процессинг бета-амилоида15-16. На молекулярном уровне холестерин связывается с трансмембранным доменом белка-предшественника бета-амилоида (АРР), активируя миграцию АРР в богатые холестерином домены мембраны с высоким содержанием бета- и гамма-секретаз, что приводит к продукции бета-амилоида17. Изменения синаптических мембран, происходящие в результате повышенного уровня холестерина, также могут быть важным фактором в использовании фосфолипидов мембран для поддержки холинергической нейротрансмиссии (концепция аутоканнибализма)18. Было предложено раннее назначение статинов для снижения заболеваемости или задержки начала болезни Альцгеймера и Паркинсона19. Накопление холестерина также наблюдается в друзах, ассоциированных с возрастной макулярной дегенерацией20. Уровень холестерина в мембране также является повышенным при раке21 и была выдвинута гипотеза о том, что повышение уровня холестерина в мембранах митохондрий является дефектом, приводящим к эффекту Варбурга, который ассоциирован с большинством раковых клеток22. Эффект Варбурга является определяющим признаком раковых клеток, поскольку, в отличие от нормальных клеток, которые практически полностью зависят от дыхания для энергии, раковые клетки для энергии могут использовать как дыхание, так и гликолиз.
Дополнительно к сложным негативным эффектам накопления холестерина на мембраны, существует также повышенное образование оксистерола23. Данные оксистеролы являются цитотоксическими (апоптоз и некроз), провоспалительными, истощают глутатион GSH и индуцируют фосфолипидоз23-26. Заболевания, в которые могут быть вовлечены данные токсические оксистеролы, включают нейродегенерацию (нейрональную и демиелинизирующую), остеопороз, возрастную макулярную дегенерацию и сердечно-сосудистые заболевания, в частности атеросклероз23.
Современные клинические терапии для снижения уровня холестерина в основном заключаются в ингибировании синтеза холестерина статинами или блокировании абсорбции холестерина из желудочно-кишечного тракта эзетимибом. По мнению авторов изобретения, в настоящее время не существует лекарственных средств, предназначенных для мобилизации миграции холестерина из мембран.
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к соединениям и способам лечения возрастных заболеваний, ассоциированных с патологическими уровнями холестерина в мембране. Описанные соединения включают новые предшественники плазмалогенов, которые уменьшают уровни свободного холестерина в мембране и усиливают этерификацию холестерина для транспорта из клеточных мембран. Данные соединения, следовательно, являются полезными для снижения уровней холестерина в мембране у субъектов, страдающих от повышенных уровней холестерина в мембране. Соединения могут также применяться для лечения или предупреждения заболеваний, ассоциированных с повышенным содержанием холестерина в мембране, таких как нейродегенеративные заболевания (включающие, но без ограничения, болезнь Альцгеймера, болезнь Паркинсона, рассеянный склероз и возрастную макулярную дегенерацию), когнитивные нарушения, деменцию, рак (включающий, но без ограничения, рак предстательной железы, легких, молочной железы, яичника и почки), остеопороз, биполярное нарушения и сосудистые заболевания (включающие, но без ограничения, атеросклероз и гиперхолестеролемию). Кроме того, данные соединения являются эффективными для лечения нарушений, возникающих в результате аномальной экспрессии генов транспортных белков холестерина, таких как аполипопротеин Е.
Данные предшественники плазмалогенов содержат глицериновый остов с алкильным или алкенильным липидным замещением в sn-1-положении или ацильным липидным замещением в sn-2-положении. Полярный заместитель обеспечен в sn-3-положении для улучшения фармацевтических свойств (например, для улучшения стабильности и/или биодоступности, или для составления в виде соли).
Без привязки к теории, полагают, что в определенных вариантах заместитель в sn-3-положении расщепляется липазами, и полученные 1-алкил, 2-ацил глицерин или 1-алкенил, 2-ацил глицерин затем превращаются в плазмалогены в эндоплазматическом ретикулуме, тем самым обходя пероксисомальный компартмент, который может демонстрировать пониженную функцию при старении.
Соответственно, в отношении композиции обеспечены соединения формулы I:
в которой:
R1 и R2 могут быть одинаковыми или разными; и представляют собой алкильную или алкенильную углеводородную цепь, выбранную из Таблицы 1 или 2;
| Таблица 1 | ||
| Алкильные или алкенильные углеводородные группы | ||
| № | Химическая структура | Сокращение |
| 1 | СН3(СН2)3- | С4:0 |
| 2 | СН3(СН2)5- | С6:0 |
| 3 | СН3(СН2)7- | С8:0 |
| 4 | СН3(СН2)9- | С10:0 |
| 5 | СН3(СН2)11- | С12:0 |
| 6 | СН3(СН2)13- | С14:0 |
| 7 | СН3(СН2)15- | С16:0 |
| 8 | СН3(СН2)17- | С18:0 |
| 9 | СН3(СН2)19- | С20:0 |
| 10 | СН3(СН2)21- | С22:0 |
| 11 | СН3(СН2)23- | С24:0 |
| 12 | СН3(СН2)3СН=СН(СН2)7- | С14:1 |
| 13 | СН3(СН2)5СН-СН(СН2)7- | С16:1 |
| 14 | CH3(CH2)7CH=CH(CH2)7- | С18:1 |
| 15 | СН3(СН2)4СН=СНСН2СН=СН(СН2)7- | С18:2 |
| 16 | CH3CH2CH=CHCH2CH=CH(CH2)7- | С18:3 |
| 17 | СН3СН2(СН=СН)- | С4:1 |
| 18 | СН3(СН2)3(СН-СН)- | С6:1 |
| 19 | СН3(СН2)5(СН=СН)- | С8:1 |
| 20 | CH3(CH2)7(CH=CH)- | С10:1 |
| 21 | CH3(CH2)9(CH=CH)- | С12:1 |
| 22 | СН3(СН2)11(СН=СН)- | С14:1 |
| 23 | СН3(СН2)13(СН-СН)- | С16:1 |
| 24 | СН3(СН2)15(СН=СН)- | С18:1 |
| 25 | СН3(CH2)17(CH=СН)- | С20:1 |
| 26 | СН3(СН2)19(СН=СН)- | С22:1 |
| 27 | СН3(СН2)21(СН-СН)- | С24:1 |
| 28 | CH3(CH2)3CH=CH(CH2)5(CH=CH)- | С14:2 |
| 29 | СН3(СН2)5СН=СН(СН2)5(СН=СН)- | С16:2 |
| 30 | СН3(СН2)7СН=СН(СН2)5(СН=СН)- | С18:2 |
| 31 | CH3(CH2)4CH=CHCH2CH=CH(CH2)5(CH=CH)- | С18:3 |
| 32 | CH3CH2CH=CHCH2CH=CHCH2CH=CH(CH2)5(CH=CH)- | С18:4 |
| Таблица 2 | ||
| Боковые цепи цис-ненасыщенных жирных кислот | ||
| № | Название кислоты | Химическая стркутура |
| 1 | Миристолеиновая (14:1) | СН3(СН2)3СН=СН(СН2)7- |
| 2 | Пальмитолеиновая (16:1) | СН3(СН2)5СН=СН(СН2)7- |
| 3 | Олеиновая (18:1) | СН3(СН2)7СН=СН(СН2)7- |
| 4 | Линолевая(18:2) | CH3(CH2)4(CH=CHCH2)2(CH2)6- |
| 5 | Линоленовая (18:3) | СН3СН2(СН=СНСН2)3(СН2)6- |
| 6 | Арахидоновая (20:4) | СН3(СН2)4(СН=СНСН2)4(СН2)2- |
| 7 | Эйкозапентаеновая (20:5) | СН3СН2(СН=СНСН2)5(СН2)2- |
| 8 | Эруковая(22:1) | CH3(CH2)7CH=CH(CH2)11- |
| 9 | Докозагексаеновая (22:6) | СН3СН2(СН=СНСН2)6СН2- |
R3 представляет собой группу, выбранную из жирных кислот, карнитина, ацетил-D/L-карнитина, тиокарнитина, ацетил-D/L-тиокарнитина, креатина, норкарнитина, фосфохолина, липоевой кислоты, дигидролипоевой кислоты, фосфоэтаноламина, фосфосерина, N-ацетилцистеина, замещенных или незамещенных аминокислот и групп, имеющих структуры, показанные ниже в Таблице 3.
| Таблица 3 | |
R4 и R5 являются одинаковыми или разными, и могут представлять собой водород или низший алкил, например, метил или этил;
R6 представляет собой водород или низший алкил, например, метил или этил; и
R7 и R8 являются одинаковыми или разными, и могут представлять собой водород или низший алкил, например, метил или этил,
и также включая рацематы или изолированные стереоизомеры и их фармацевтически приемлемые соли или сложные эфиры.
Другой аспект данного изобретения направлен на фармацевтические композиции, включающие фармацевтически приемлемый носитель и соединение, как описано выше.
В одном варианте настоящего изобретения R2 может представлять собой боковую цепь докозагексаеноевой кислоты (DHA) или СН3СН2(СН=СНСН2)6СН2-.
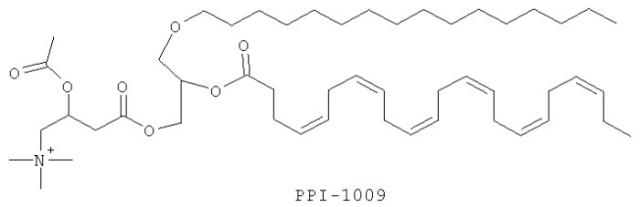
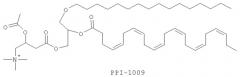
В другом варианте соединение может представлять собой 2-ацетокси-4-(2-((4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19-гексаеноилокси)-3-(гексадецилокси)пропокси)-N,N,N-триметил-4-оксобутан-1-аминий.
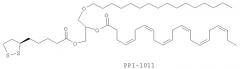
В других вариантах соединение может представлять собой (4Z,7Z,10Z,13Z,16Z,19Z)-1-(5-((R)-1,2-дитиолан-3-ил)пентаноилокси)-3-(гексадецилокси)пропан-2-ил докоза-4,7,10,13,16,19-гексаеноат:
или (4Z,7Z,10Z,13Z,16Z,19Z)-1-(2-ацетамидо-3-меркаптопропаноилокси)-3-(гексадецилокси)пропан-2-ил докоза-4,7,10,13,16,19-гексаеноат:
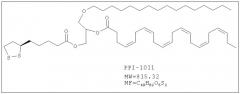
Изобретение также включает фармацевтические композиции, содержащие PPI-1009, PPI-1011, PPI-1014 или их комбинации.
Без привязки к теории, полагают, что определенные варианты соединений, описанных здесь, повышают уровни плазмалогенов, гидролиз ацетил-L-карнитин в sn-3-положении, и могут участвовать в возможных молекулярных механизмах, которые включают: (1) ацетилирование функциональных -NH2 и -ОН-групп в аминокислотах и N-концевых аминокислотах в пептидах и белках, что приводит к изменению их структуры, динамики, функции и обмена; и/или (ii) функционирование в качестве молекулярного шаперона для более крупных молекул, что приводит к изменению в структуре, молекулярной динамике и функции более крупных молекул.
Карнитин является важным в бета-окислении жирных кислот, и ацетильная группа может использоваться для поддержания уровней ацетил-СоА. Действия ацетил-L-карнитина (ALCAR) включают модуляцию: (i) мозговой энергии и метаболизма фосфолипидов; (ii) клеточных макромолекул, включающих нейротрофический фактор и гормоны; (iii) морфологии синапсов; и (iv) синаптической трансмиссии множественных нейротрансмиттеров.
Согласно еще одному аспекту настоящего изобретения, обеспечен способ лечения или предупреждения возрастных заболеваний, опосредованных дефицитом плазмалогенов, включающий введение пациенту, нуждающемуся в этом, эффективного количества соединения или композиции, как описано выше.
В еще другом аспекте настоящего изобретения обеспечен способ лечения возрастных заболеваний, ассоциированных с повышенным уровнем холестерина в мембране, повышенным уровнем амилоида и пониженными уровнями плазмалогенов, включающий введение пациенту, нуждающемуся в этом, эффективного количества соединения или композиции, как описано выше.
Изобретение также относится к способу приготовления соединения согласно структуре формулы II:
где R1 и от R4 до R8 являются такими, как описано выше, и R9 является блокирующей группой, и включает рацематы или изолированные стереоизомеры, и фармацевтически приемлемые соли или их эфиры.
Способ включает взаимодействие соединения формулы III:
в пригодном растворителе с нуклеофильным катализатором, основанием и блокирующим агентом в условиях, пригодных для образования указанного соединения формулы II и факультативной очистки полученного соединения.
В определенных неограничивающих вариантах в качестве блокирующего агента может быть использован силан, например, трет-бутилдиметилсилил галогенид, который затем вызывает образование R9, являющийся трет-бутилдиметилсилильной группой.
В других неограничивающих вариантах нуклеофильным катализатором может являться DMAP, основанием может являться триэтиламин и растворитель может содержать диметилфармамид (DMF) и CH2Cl2.
Без желания быть ограниченными, в определенных вариантах предпочтительно готовить раствор, включающий соединение формулы III, нуклеофильный катализатор и основание в соответствующем растворителе при температуре от 0°С до 5°С перед добавлением блокирующего агента, с последующим добавлением блокирующего агента и дальнейшим проведением реакции при температуре примерно от 15 до 25°С, например, при 20°С. Предпочтительно, чтобы реакция проходила до полного завершения в течение вплоть до 20 часов.
Также обеспечено промежуточное соединение согласно структуре формулы II:
где R1 и от R4 до R9 являются такими, как описано выше, включая рацематы или изолированные стереоизомеры, и фармацевтически приемлемые соли или их эфиры.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Данные и другие признаки изобретения станут более очевидными из следующего описания, в котором сделано обращение на прилагающиеся чертежи, в которых:
ФИГУРА 1 показывает общую экспериментальную методику приготовления PPI-1009: 2-ацетокси-4-(2-((4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19-гексаеноилокси)-3-(гексадецилокси)пропокси)-N,N,N-триметил-4-оксобутан-1-аминия согласно варианту настоящего изобретения.
ФИГУРА 2 показывает, что пониженные уровни общих DHA плазмалогенов в N-Rel клетках относительно контрольных клеток СНО являются восстановленными зависимым от концентрации образом с помощью PPI-1005 (R1=16:0; R2=DHA; R3=ОН), 72 ч инкубирования, *р<0/05 в зависимости от носителя (нос).
ФИГУРА 3 показывает (А) период внедрения PPI-1009 (10 мкМ) в плазмалогены и отсутствие эффекта на клеточных уровнях химилового спирта или связанного алкенил-ацил-глицерина (В) N-Rel клеток (0, 6, 12, 24, 48 и 72 ч). Содержание в клетках плазмалогенов и докозагексаеновой кислоты (DHA) подсчитывали методом ЖХ-МС/МС, тогда как химиловый спирт подсчитывали методом GC-MS.
ФИГУРА 4 показывает (А) зависимое от концентрации увеличение (72 ч) DHA плазмалогенов в клетках СНО с помощью PPI-1005 и PPI-1009. Несмотря на то что химиловый спирт повышал DHA-плазмалогены в клетках N-Rel, эффекта в СНО клетках не было (В). Содержание плазмалогенов в клетках подсчитывали методом ЖХ-МС и выражали относительно контролей СНО или контролей N-Rel.
ФИГУРА 5 показывает отклик концентрации на уменьшение холестерина в мембранах в клетках N-Rel через 48 часов инкубации с 16:0 (sn-1 алкил/DHA(sn-2 ацил) глицерином (PLM-05). Следует учесть, что уровни холестерина являются значительно повышенными (р<0.05) в клетках NRel относительно клеток СНО, и при 20 мкМ (PLM-05) уровни свободного холестерина в мембране понижаются и уровни эфиров холестерина в мембране повышаются (р<0.05).
ФИГУРА 6 показывает структурно-специфическое и зависимое от концентрации внедрение (72 ч) в связанный плазмалоген (R1=16:0, R2=22:6, R3 = фосфоэтаноламин) N-Rel клеток с помощью PPI-1005 (А; 1 или 5 мкМ) и PPI-1009 (В; 0.5, 1, 2, 3&10 мкМ). Заместители жирной кислоты в sn-2-положении также подвергали деацилированию и реацилированию для формирования связанных плазмалогенов с 20:4, 18:3, 18:2 и 18:1 в sn-2-положении. Содержание плазмалогенов в клетках подсчитывали методом ЖХ-МС/МС и нормализовали относительно клеток N-Rel, обработанных носителем.
ФИГУРА 7 показывает, что уровень холестерина в мембране повышается в мутантных клетках N-Rel относительно контрольных клеток СНО. Уровень холестерина в мембране в клетках N-Rel является пониженным (р<0.05) через 48 ч инкубации (20 мкМ) с предшественниками плазмалогенов, содержащими пальмитиновую (16:0) или стеариновую (18:0) кислоту в sn-1-положении в комбинации с ненасыщенными жирными кислотами, в частности DHA, в sn-2-положении. При 20 мкМ свободная DHA была неэффективной для изменения уровней холестерина в мембране. В противоположность активности аналогов с алкильной связью в sn-1-положении, диацильный аналог (16:0*:DHA глицерин) был неактивным. PPI-1009 (16:0/DHA/ALCAR) вызвал самое сильное уменьшение свободного холестерина и наращивание этерифицированного холестерина. V, носитель.
ФИГУРА 8 показывает уменьшение (р<0.04) холестерина в мембране в клетках НЕК293 через 48 ч инкубации с 20 мкМ 16:0 (sn-1 алкил)/ВНА(sn-2 ацил) глицерином, 18:0/DHA глицерином или 16:0/18:3 глицерином. При 20 мкМ 16:0/18:1 глицерин, 16:0/18:2 глицерин, 16:0/20:4 глицерин и свободная DHA были неэффективными для изменения уровней свободного холестерина в мембране. В отличие от активности аналогов с алкильной связью в sn-1-положении, диацильный аналог (16:0*:DHA глицерин) был неактивным.
ФИГУРА 9 показывает отклик концентрации на уменьшение холестерина в мембране в НЕК293 клетках через 48 ч инкубации с 16:0(sn-l алкил)/DHA (sn-2 ацил)/ацетил-L-картинин (sn-3 ацил)глицерином (PPI-1009).
ФИГУРА 10 показывает, что PPI-1005 (5а, 20 мкМ) уменьшает базальную и стимулированную холестерином (25.8 мкМ) секрецию Aβ42 клетками НЕК293, (А). PPI-1009 (PLM09, 10 мкМ) действовал аналогично (В).
ФИГУРА 11 иллюстрирует эффект PPI-1011 на плазмалогены в плазме кроликов. PPI-1011 был внедрен в этаноламин-плазмалогены (PlsEtn) и фосфатидилэтаноламины (PtdEtn) плазмы через 1, 3, 6 и 12 часов после орального введения дозы 200 мг/кг в желатиновой капсуле. Также наблюдали высвобождение DHA (свободной 22:6) из sn-2 посредством деацилаз. Группы включали от 3 до 5 кроликов.
ФИГУРА 12 показывает график включения предшественника плазмалогенов PPI-1011 в циркулирующие Pls 16:0/22:6, DHA, Pls 18:0/22:6 и Ptd 16:0/22:6 во времени. Включение PPI-1011 в этаноламин-плазмалогены (Pls) и фосфатидилэтаноламины (Ptd) плазмы измеряли через 1, 3, 6, 12, 18, 24 и 48 часов после орального введения дозы 200 мг/кг в желатиновой капсуле. Также наблюдали высвобождение DHA из sn-2 посредством деацилаз. Группы включали от 3 до 5 кроликов, за исключением 12 часовой отметки, которая включала 7 кроликов из 2 отдельных экспериментов.
ФИГУРА 13 иллюстрирует дозо-зависимое включение PPI-1011 в плазмалогены и фосфатидилэтаноламины плазмы. Включение PPI-1011 в этаноламин-плазмалогены (Pls) и фосфатидилэтаноламины (Ptd) плазмы измеряли через 6 часов после орального введения доз в 10, 75, 200, 500 и 1000 мг/кг в желатиновой капсуле. Также наблюдали высвобождение DHA из sn-2 посредством деацилаз. Группы включали от 3 до 5 кроликов.
ФИГУРА 14 показывает увеличение плазмалогенов и DHA в тканях под действием PPI-1011 в почке кроликов. Включение PPI-1011 в этаноламин-плазмалогены (PlsEtn) и фосфатидилэтаноламины (PtdEtn) почки измеряли через 1, 3, 6 и 12 часов после орального введения дозы в 200 мг/кг в желатиновой капсуле. Также наблюдали высвобождение DHA (свободной 22:6) из sn-2 посредством деацилаз. Группы включали от 3 до 5 кроликов.
ФИГУРА 15 показывает время увеличение плазмалогенов и DHA в ткани во времени под действием PPI-1011 в почках кроликов. Включение PPI-1011 в этаноламин-плазмалогены (16:0/22:6) почки измеряли через 1, 3, 6, 12, 18, 24 и 48 часов после орального введения дозы в 200 мг/кг в желатиновой капсуле. Группы включали от 3 до 5 кроликов.
ФИГУРА 16 показывает время увеличение плазмалогенов и DHA в ткани во времени под действием PPI-1011 в печени кроликов. Включение PPI-1011 в этаноламин-плазмалогены (16:0/22:6) печени измеряли через 12, 18, 24 и 48 часов после орального введения дозы в 200 мг/кг в желатиновой капсуле. Группы включали от 3 до 5 кроликов.
ФИГУРА 17 показывает структурно-специфическое и зависимое от концентрации включение PPI-1014 в этаноламин-плазмалогены (PlsEtn) и фосфатидилэтаноламины (PtdEtn) N-Rel клеток через 72 часа (5, 10 и 20 мкМ). Содержание плазмалогенов в клетках подсчитывали методом ЖХ-МС/МС и нормализовали относительно клеток N-Rel, обработанных носителем. Группы состояли из трех 10 см планшетов.
ФИГУРА 18 показывает (А) эффекты повышения концентрации PPI-1005 на мембранные резидентные белки в нагруженных холестерином клетках НЕК293, (В) эффекты PPI-1005 на мембранные резидентные белки в клетках НЕК293 дикого типа, и (С) эффекты правастатина на мембранные резидентные белки ADAM10 и SOAT1. β-актин использовали в качестве контроля нагрузки.
ОСУЩЕСТВЛЕНИЕ ИЗОБРЕТЕНИЯ
Описаны соединения согласно структуре формулы I:
где:
R1 и R2 являются одинаковыми или разными, и выбраны из алкильной или алкенильной углеводородной цепи, выбранной из группы, состоящей из: СН3(СН2)3-, СН3(СН2)5-, СН3(СН2)7-, СН3(СН2)9-, СН3(СН2)11-, СН3(СН2)13-, СН3(СН2)15-, СН3(СН2)17-, СН3(СН2)19-, СН3(СН2)21-, СН3(СН2)23-, СН3(СН2)3СН=СН(СН2)7-, СН3(СН2)5СН=СН(СН2)7-, СН3(СН2)7СН=СН(СН2)7-, СН3(CH2)4CH-CHCH2CH=CH(CH2)7-, СН3СН2СН-СНСН2СН=СНСН2СН-СН(СН2)7-, СН3СН2(СН=СН)-, СН3(СН2)3(СН=СН)-, СН3(СН2)5(СН=СН)-, СН3(СН2)7(СН=СН)-, СН3(СН2)9(СН=СН)-, СН3(СН2)11(СН=СН)-, СН3(СН2)13(СН=СН)-, СН3(СН2)15(СН=СН)-, СН3(СН2)17(СН=СН)-, СН3(СН2)19(СН=СН)-, СН3(СН2)21(СН-СН)-, СН3(СН2)3СН=СН(СН2)5(СН-СН)-, СН3(СН2)5СН=СН(СН2)5(СН-СН)-, CH3(CH2)7CH=CH(CH2)5(CH=CH)-, СН3(СН2)4СН=СНСН2СН=СН(СН2)5(СН=СН), CH3CH2CH=CHCH2CH=CHCH2CH=CH(CH2)5(CH-CH)-, CH3(CH2)3CH=CH(CH2)7-, CH3(CH2)5CH=CH(CH2)7-, СН3(СН2)7СН=СН(СН2)7-, CH3(CH2)4(CH=CHCH2)2(CH2)6-, СН3СН2(СН=СНСН2)3(СН2)6-, СН3(СН2)4(СН=СНСН2)4(СН2)2-, СН3СН2(СН=СНСН2)5(СН2)2-, СН3(СН2)7СН-СН(СН2)11 и СН3СН2(СН=СНСН2)6СН2-:
R3 представляет собой группу, выбранную из жирных кислот, карнитина, ацетил-D/L-карнитина, тиокарнитина, ацетил-D/L-тиокарнитина, креатина, норкарнитина, фосфохолина, липоевой кислоты, дигидролипоевой кислоты, фосфоэтаноламина, фосфосерина, N-ацетилцистеина, замещенных или незамещенных аминокислот и групп, имеющих структуры, показанные ниже:
R4 и R5 являются независимо водородом или низшим алкилом;
R6 представляет собой водород или низший алкил; и
R7 и R8 независимо являются водородом или низшим алкилом, и включают рацематы или изолированные стереоизомеры и фармацевтически приемлемые соли или их эфиры.
Такие соединения являются эффективными для лечения или предупреждения возрастных заболеваний, ассоциированных с повышенным уровнем холестерина в мембране, повышенным уровнем амилоида или пониженными уровнями плазмалогена.
Такие соединения также являются эффективными для лечения или предупреждения возрастных заболеваний, опосредованных дефицитом плазмалогенов.
Такие соединения могут также применяться для лечения нейродегенеративных заболеваний (включающих, но без ограничения, болезнь Альцгеймера, болезнь Паркинсона и возрастную макулярную дегенерацию), когнитивного нарушения, деменции, рака (включающего, но без ограничения, рак предстательной железы, легких, молочной железы, яичников и почек), остеопороза, биполярного нарушения и сосудистых заболеваний (включающих, но без ограничения, атеросклероз и гиперхолестеролемию).
В целях настоящего изобретения, гидрокси-группы в положениях sn-1, sn-2 и sn-3 глицеринового остова соединений формулы I названы с использованием общепризнанной номенклатуры плазмалогенов, т.е. атом кислорода глицерина, присоединенный к карбонильной группе -С=O(ацетил), -С (образует эфирную связь) и -Р (фосфорил) обозначен в формуле I.
В определенных неограничивающих вариантах, соединения, как описано здесь, могут содержать один или более хиральных центров. Обычно, такие соединения могут быть приготовлены в виде рацемической смеси. При желании, однако, такие соединения могут быть приготовлены или изолированы в виде чистых стереоизомеров, т.е. в виде индивидуальных энантиомеров или диастереомеров, или в качестве обогащенных стереоизомерами смесей. Все такие стереоизомеры (и обогащенные смеси) соединений формулы I включены в объем данного изобретения. Чистые стереоизомеры (или обогащенные смеси) могут быть приготовлены с использованием, например, оптически активных исходных материалов или стереоселективных реагентов, хорошо известных в данной области. Или же, рацемические смеси таких соединений могут быть разделены с использованием, например, хиральной колоночной хроматографии, хиральных оптически расщепляющих агентов и подобных.
Определения:
При описании алкил/ацил жирных кислот (Таблица 1, Таблица 2) и биологически активных соединений (Таблица 3), фармацевтических композиций и способов данного изобретения, следующие термины имеют следующие значения, если не указано иное.
«Жирные кислоты» представляют собой алифатические монокарбоновые кислоты, извлеченные или содержащиеся в этерифицированной форме в животных или растительных жирах, маслах или воске. Натуральные жирные кислоты обычно имеют цепь, состоящую из 4-28 атомов углерода (обычно неразветвленную и даже пронумерованную), которая может быть насыщенной или ненасыщенной. Такие кислоты известны как ациклические алифатические карбоновые кислоты.
В рамках значения насыщенных жирных кислот, термин «насыщенный» относится к атомам углерода (за исключением исходной карбоксильной [-СООН] группы), содержащим столько атомов водорода, насколько это возможно. Другими словами, конечный омега (ω) содержит 3 атома водорода (СН3-) и атом углерода в цепи содержит 2 атома водорода.
Ненасыщенные жирные кислоты (включающие, но не ограничивающиеся примерами, описанными в Таблице 2) имеют форму, аналогичную насыщенным жирным кислотам, за исключением того, что одна или более алкенильных функциональных групп присутствует вдоль цепи, причем каждый алкен имеет замещение простой связи -СН2-СН2- в цепи на двойную связь -СН=СН- (т.е. атом углерода соединен двойной связью с другим атомом углерода). Такие кислоты называются как CIS/TRANS и C:D, где С обозначает число атомов углерода, и D обозначает двойную связь.
«Незамещенные и замещенные аминокислоты» относятся к факультативно замещенному фрагменту аминокислоты, содержащему аминогруппу, группу карбоновой кислоты и вариабельную боковую цепь, при этом боковая цепь может включать общие боковые цепи аминокислоты, т.е. такие, которые используются при формировании белков или др., хорошо известных в данной области. Формирующие белки аминокислотные остатки являются особенно предпочтительными и включают аланин, аргинин, аспарагин, аспарагиновую кислоту, цистеин, глутамин, глутаминовую кислоту, глицин, гистидин, изолейцин, лейцин, лизин, метионин, фенилаланин, пролин, серии, треонин, триптофан, тирозин и валин. Также возможны заместители аминокислотных остатков, включающие заместители с функциональными группами, включающими, но без ограничения, низшие алкилы, ацетат, фосфат, липиды и карбогидраты.
Термин «низший алкил» относится к циклическому моновалентному алкильному радикалу с разветвленной или прямой цепью, содержащему от одного до семи атомов углерода (C1-C7) и в определенных неограничивающих вариантах от одного до четырех атомов углерода (C1-C4). Данный термин, кроме того, представлен такими радикалами, как метил, этил, н-пропил, изо-пропил, н-бутил, трет-бутил, изо-бутил (или 2-метилпропил), циклопропилметил, изо -амил, н-амил, гексил и гептил. Низшие алкильные группы также могут быть незамещенными или замещенными, при этом конкретным примером замещенного алкила является 1,1-диметилгептил.
«Гидроксил» относится к -ОН.
«Фармацевтически приемлемая соль» относится к любой соли соединения данного изобретения, которая сохраняет свои биологические свойства и которая не является биологически или иначе нежелательной. Такие соли могут быть получены из разных органических и неорганических противоионов, хорошо известных в данной области, и включают, например, натрий, калий, кальций, магний, аммоний, тетраалкиламмоний и подобные; и когда молекула содержит щелочные функциональные группы, соли органических или неорганических кислот, такие как гидрохлорид, гидробромид, тартрат, мезилат, ацетат, малеат, оксалат и подобные. Термин «фармацевтически приемлемый катион» относится к фармацевтически приемлемому катионному противоиону кислой функциональной группы. Примерами таких катионов являются катионы натрия, калия, кальция, магния, аммония, тетраалкиламмония и подобные.
«Фармацевтически приемлемый эфир» относится к обычно используемому этерифицированному соединению Формулы I, содержащему карбоксильную группу, при этом эфир сохраняет биологическую эффективность и свойства соединений Формулы I, и расщепляется in vivo (в организме) на соответствующую активную карбоновую кислоту. Информация, касающаяся эфиров и использования эфиров для доставки фармацевтических соединений, имеется в Design of Products. Bundgaard H ed. (Elsevier 1985). Также смотри H.Ansel et al., Pharmaceutical Dosage Forms and Drug Delivery Systems (6th Ed. 1995) на стр.108-109; Krogsgaard-Larsen, et al. Textbook of Drug Design and Development (2d Ed. 1996) на стр.152-191.
«Фармацевтический агент» или «препарат» относится к химическому соединению или композиции, способной вызывать требуемый терапевтический или профилактический эффект при соответствующем введении субъекту.
Термин «эффективное количество» означает такое количество препарата или фармацевтического агента, которое будет вызывать биологический или медицинский отклик тканей, системы, животного или человека, которое определяется, например, исследователем или клиницистом. Более того, термин «терапевтически эффективное количество» означает любое количество, которое, по сравнению с соответствующим субъектом, который не получал такого количества, приводит к улучшению лечения, облегчению, предупреждению или ослаблению заболевания, нарушения или побочного действия, или уменьшению скорости развития заболевания или нарушения. Термин также включает, в пределах его объема, количества, эффективные для усиления нормальной физиологической функции.
Все химические соединения включают оба (+) и (-) стереоизомера, а также один из (+) или (-) стереоизомеров.
Другие указанные здесь химические термины используются в соответствии с традиционным использованием в данной области, как показано в The McGraw-Hill Dictionary of Chemical Terms (1985) и The Condensed Chemical Dictionary (1981).
Соединения, описанные здесь, которые включают предшественников плазмалогенов, извлеченных из глицеринового остова с замещением в sn-1 и sn-2-положении жирными кислотами, и в sn-3-положении жирными кислотами или эндогенными метаболическими промежуточными соединениями, могут быть приготовлены из легкодоступных исходных материалов с использованием следующих общих способов и методик, показанных на Фигуре 1. Предпочтительно, чтобы при заданных типичных или предпочтительных условиях процесса (т.е. температура реакции, время, молярные соотношения реагентов, растворители, давление и т.д.), также можно было использовать другие условия, если не указано иное. Оптимальные условия реакции могут различаться в зависимости от конкретных используемых реагентов или растворителя, но такие условия могут быть определены опытным в данной области специалистом с помощью обычных методов оптимизации.
К тому же, опытным в данной области специалистам будет очевидно, что обычно используемые защитные группы могут потребоваться для защиты определенных функциональных групп от нежелательных реакций. Выбор пригодных защитных групп для конкретных функциональных групп, а также приемлемых условий для защиты и снятия защиты хорошо известны в данной области. Например, многочисленные защитные группы, а также их введение и удаление описаны в T.W.Greene and G.M.Wuts, Protecting Groups in Organic Synthesis, Second Edition, Wiley, New York, 1991 и в указанных здесь ссылках.
В предпочтительном способе синтеза, описанные здесь соединения, содержащие замещения глицерина в sn-1 и sn-2-положениях жирными кислотами, и в sn-3-положении жирными кислотами или эндогенными метаболическими промежуточными соединениями, как описано здесь, приготовлены с помощью протекции/депротекции гидроксильных групп глицеринового остова пригодными защитными группами с последующим O-алкилированием и O-ацилированием соединения; например PPI-1009, PPI-1011 и PPI-1014.
При использовании в качестве фармацевтических препаратов, соединения, как описано здесь, обычно вводятся в форме фармацевтической композиции. Такие композиции могут быть приготовлены с использованием методик, хорошо известных в фармацевтической области, и включают, по меньшей мере, одно активное соединение.
В целом, соединения данного изобретения вводятся в фармацевтически эффективном количестве. Количество фактически вводимого соединения обычно определяется терапевтом с учетом соответствующих обстоятельств, включающих состояние, подлежащее лечению, выбранный режим введения, конкретное вводимое соединение, возраст, вес, индивидуальные особенности пациента, тяжесть симптомов и подобные.
Соединения и композиции, описанные здесь, могут вводиться субъекту, предпочтительно млекопитающему, более предпочтительно человеку, для лечения и/или предупреждения заболевания любым приемлемым способом, включающим, например, оральный, местный, ректальный, трансдермальный, подкожный, внутривенный, внутримышечный, интраназальный, и подобные. В зависимости от предполагаемого способа доставки, соединения данного изобретения предпочтительно составлены для оральных, местных или инъецируемых композиций.
Фармацевтические композиции для орального введения могут быть в виде жидких растворов, суспензий или порошков. В целом, однако, такие композиции представлены в виде однократной лекарственной