Противоопухолевое лекарственное средство пролонгированного действия на основе противоопухолевого препарата, ингибитора синтеза эстрогенов - анастрозола
Иллюстрации
Показать всеИзобретение относится к противоопухолевому лекарственному средству пролонгированного действия на основе ингибитора синтеза эстрогенов - анастрозола. Лекарственное средство содержит анастрозол, сополимер молочной и гликолевой, поливиниловый спирт и D-маннитол. Лекарственное средство представляет собой частицы субмикронного размера и может быть выполнено в виде капсул, гранул, порошка, а также суспензии для инъекций. Применение разработанного лекарственного средства позволит достигнуть лечебного эффекта меньшими терапевтическими дозами и сделать более удобной для пациента противоопухолевую терапию. 1 з.п. ф-лы, 1 табл., 2 ил., 3 пр.
Реферат
Изобретение относится к области фармакологии и медицины, конкретно к новому поколению противоопухолевых препаратов пролонгированного действия на основе ингибитора синтеза эстрогенов - анастрозола.
Проблема снижения смертности населения - одна из актуальных проблем современной России. Первоочередной задачей этого направления является снижение смертности от так называемых устранимых причин смерти, среди которых важное место занимает снижение смертности от рака. Всего в России число состоящих в онкологических учреждениях на 2010 год составляет около 2.7 млн. человек [1]. Распространенность злокачественных новообразований составляет 1969 на 100000 населения, за 2010 г. Структура смертности женщин представлена следующей локализацией новообразований [1]: молочная железа - 17.2%; желудок - 11%; ободочная кишка - 9.4%; трахея, бронхи, легкое - 6.5%. Из приведенных данных видно, что в структуре онкологических заболеваний женщин рак молочной железы занимает первое место. Снижение смертности от рака молочной железы - один из резервов и одна из возможных решаемых задач по снижению смертности от злокачественных новообразований в целом.
Одним из современных препаратов, применяемых при лечении рака молочной железы, является анастрозол [2]. Анастрозол представляет собой α,α,α′,α′-тетраметил-5-(1H-1,2,4-триазол-1-ил-метил)-м-бензолдиацетонитрил и выпускается под торговым названием Аримидекс. Анастрозол является высокоселективным нестероидным ингибитором ароматазы - фермента, с помощью которого у женщин в постменопаузе андростендион в периферических тканях превращается в эстрон и далее в эстрадиол. Снижение концентрации циркулирующего эстрадиола у больных раком молочной железы оказывает терапевтический эффект. У женщин в постменопаузе анастрозол в суточной дозе 1 мг вызывает снижение концентрации эстрадиола на 80%. Метаболизм анастозола проходит в процессе N-дезалкилирования, гидроксилирования и конъюгации с глюкуроновой кислотой. Основным метаболитом является триазол, определяемый в плазме и моче. Метаболиты выводятся в основном почками в течение 72 часов, причем 10% в неизменном виде. Препарат принимают ежедневно в течение 5 лет в виде таблеток по 1 мг 1 раз в сутки. Длительное применение препарата приводит к нарушению функции печени и почек, а также: со стороны костно-мышечной системы, со стороны репродуктивной системы, со стороны кожи и кожных придатков, со стороны пищеварительной системы, со стороны гепатобилиарной системы, со стороны нервной системы, со стороны метаболизма. Прием препарата может вызывать снижение минеральной плотности костной ткани в связи со снижением концентрации циркулирующего эстрадиола, тем самым повышая риск возникновения остеопороза и переломов костей. Серьезная проблема при применении анастрозола заключается в длительном и регулярном его приеме, что часто сопровождается сбоями в графике лечебного процесса и приводит к нежелательным осложнениям. Решением данной проблемы является создание новой лекарственной формы анастрозола, обеспечивающей длительность (пролонгированность) его действия. Это позволяет также снизить дозу препарата и создать более комфортные условия для пациентов, вынужденных регулярно и длительно применять лекарство.
Технический результат может быть достигнут путем включения в новое лекарственное средство, на основе анастрозола, коммерчески доступных биосовместимых, биодеградируемых полимеров, разрешенных к медицинскому применению, таких как сополимер молочной и гликолевой кислот (PLGA), и получения полимерных частиц субмикронного размера. Согласно общепринятой терминологии к частицам субмикронного размера относятся частицы, имеющие средний диаметр в диапазоне от 100 до 1000 нм [3, 4]. Использование полимерных частиц субмикронного размера оптимизирует фармакокинетические и фармакодинамические характеристики лекарственного средства. Большим преимуществом этих полимеров является способность защищать длительное время активные вещества, находящиеся внутри полимерных частиц, от воздействия различных факторов в организме человека, в том числе и многих ферментов. В результате этого во многих случаях значительно повышается эффективность действия лекарств.
Известна работа A.S. Zidan и соавт. [5]. В работе осуществлено получение композиции («formulation») для доставки анастрозола, включающее также биодеградируемый полимер - сополимер молочной и гликолевой кислот PLGA 50:50 с молекулярной массой 70000÷100000 дальтон, поверхностно-активное вещество -поливиниловый спирт (PVA). Композиция представляет собой полимерные микрочастицы с размером частиц 75-420 мкм, в связи с чем существенно отличается от патентуемого лекарственного средства, представляющего собой частицы субмикронного размера. Для получения полимерных микрочастиц применяли метод однократного эмульгирования (вода/масло) с последующим удалением органического растворителя из полученной эмульсии вода/масло. Было изучено высвобождение анастрозола из полимерных частиц в модельных экспериментах in vitro. Было показано, что в течение недели высвобождалось из полимерной матрицы не более 40% анастрозола, а в последующие дни (до 40 дня наблюдения) происходит высвобождение до уровня 45-70% (в зависимости от размера частиц). Эксперименты на животных in vivo не проводились, поэтому трудно судить о перспективности использования данного препарата.
Отдаленные аналоги предлагаемого лекарственного средства представлены в патентах: авторов P.R. Gellert, В.S. Matharu «Prolonged release formulations comprising anastrozole» (WO 2007026145 Al, дата публикации - 08. 03.2007) и авторов B.S. Masa Lu, P.R. Gellert ((Prolonged release formulations comprising anastrozole» (CN 101252909 А, дата публикации - 27. 08. 2008). В этих патентах приводятся данные по получению композиции («formulation») пролонгированного действия в виде геля на основе полимерной матрицы с включением анастрозола, а также данные о противоопухолевой активности полученных композиций. Согласно приведенным патентам полимерный гель состоит из анастрозола и биодеградируемого полимера - полимера молочной кислоты (полилактида) или сополимера молочной и гликолевой кислот PLGA 50:50 с молекулярной массой 10000÷50000 дальтон с молярным соотношением остатков молочной и гликолевой кислот от 100:0 до 50:50%. Однако данная композиция существенно отличается от патентуемого лекарственного средства как по консистенции (гель вместо субмикронных частиц), так и способу возможного применения (импланты вместо орального или инъекционного введения). Существенно отличается и методика получения композиции в данных патентах, основанная на формировании полимерного геля in situ («in situ gelling formulation»).
Патентов-прототипов выполненной нами работы не выявлено.
Техническим результатом изобретения является положительное фармакодинамическое действие противоопухолевого лекарственного средства при меньших дозах, с одновременным достижением эффекта пролонгации действия.
Технический результат достигается по совокупности всех существующих признаков созданного лекарственного средства на основе противоопухолевого препарата, ингибитора синтеза эстрогенов - анастрозола, обладающего противоопухолевой активностью и пролонгированным действием.
Для достижения указанного результата предложено противоопухолевое лекарственное средство пролонгированного действия на основе противоопухолевого препарата, ингибитора синтеза эстрогенов - анастрозола, содержащее сополимер молочной и гликолевой кислот, поливиниловый спирт, D-маннитол и представляющее собой частицы субмикронного размера, при следующем соотношении компонентов в лекарственном средстве, % мас:
| анастрозол | 8,4-8,5 |
| сополимер молочной и гликолевой кислот | 59,0-59,7 |
| поливиниловый спирт | 15,2-15,4 |
| D-маннитол | 16,6-17,0 |
Лекарственное средство может быть выполнено в виде капсулы или гранулы, или порошка, а также суспензии для инъекций.
Достижение технического результата осуществляется путем разработки и терапевтического применения противоопухолевого лекарственного средства пролонгированного действия на основе противоопухолевого препарата, ингибитора синтеза эстрогенов - анастрозола, включающего также биодеградируемый полимер, в виде сополимера молочной и гликолевой кислот с молекулярной массой от 40000 до 75000 дальтон, молярным соотношением мономерных звеньев 50 на 50% и концевой карбоксильной группой (PLGA-COOH 50/50), поверхностно-активное вещество - поливиниловый спирт и криопротектор D-маннитол.
Лекарственное средство на основе анастрозола получали известным методом простого (однократного) эмульгирования (вода/масло).
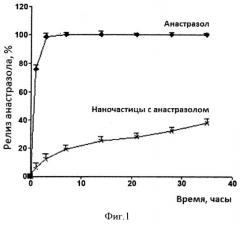
Было также изучено высвобождение анастрозола из полимерных частиц (релиз) в модельных экспериментах in vitro. Эксперимент проводили в фосфатно-солевом буферном растворе при pH 7,6 и 36°C. В течение 40 часов высвобождалось из полимерных частиц не более 40% анастрозола (фиг. 1). Кривая релиза не имеет выраженного начального выброса вещества, что указывает на локализацию анастрозола в объеме частицы. На этом рисунке приведена также кривая релиза анастрозола в той же концентрации, взятого в виде лекарственной формы «Анастрозол-Тева» (измельченной перед опытом). Сравнение кривых релиза свидетельствует о том, что более медленное высвобождение вещества из полимерных частиц не связано с насыщением раствора и растворимостью анастрозола в воде.
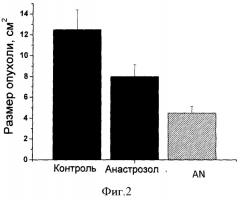
Изучение противоопухолевой активности лекарственного средства на основе ингибитора синтеза эстрогенов - анастрозола проводили с использованием овариоэктамизованных мышей линии C57 B1/6j с привитой опухолью аденокарциномы молочной железы линии Ca755. Опухоль Ca755 инокулировалась подкожно, в подлопаточную область, в дозе 106 опухолевых клеток. Лечение начинали через 48 часов после инокуляции опухолевых клеток. В ходе эксперимента проводили измерения увеличения размера опухоли и фиксировали продолжительность жизни мышей. Было установлено, что лекарственное средство пролонгированного действия на основе анастрозола, как и субстанция анастрозола, оказывают ингибирующее воздействие на рост опухоли после их введения лабораторным животным с привитой аденокарциномой молочной железы. На фигуре 2 представлена диаграмма, отражающая размеры опухоли в зависимости от применяемого лекарственного средства - анастрозола, включенного в состав полимерных частиц, в дозе 0.02 мг/кг (по анастрозолу) или свободной субстанции анастрозола в эквивалентной дозе, на модели аденокарциномы молочной железы линии Ca755 на 13 день после начала лечения.
Показано, что в/б введение лекарственного средства пролонгированного действия на основе анастрозола более эффективно ингибировало рост опухоли (примерно в 2 раза) и увеличивало продолжительность жизни животных на 20%, по сравнению с субстанцией анастрозола, что свидетельствует о более высокой эффективности созданного препарата.
Изучение продолжительности действия лекарственного средства пролонгированного действия на основе анастрозола проводили также на овариоэктамизованных мышах линии C57 Bl/6j, которым в течение 3 дней в/б вводили препарат в дозе 0.02 мг/кг (по анастрозолу). В качестве сравнения использовали субстанцию анастрозола. Содержание анастрозола в крови экспериментальных животных определяли методом ВЭЖХ. При использовании субстанции анастрозола препарат не обнаруживался в крови уже по истечении 48 ч после его последнего введения животным, в то время как после введения лекарственного средства пролонгированного действия анастрозол обнаруживался даже через 7 дней. Эти результаты свидетельствуют о пролонгированном действии созданного препарата и возможности снижения частоты его приема больными.
Полученное лекарственного средства пролонгированного действия на основе анастрозола может быть выполнено в виде капсулы, или гранулы, или порошка, или другой пероральной формы, а также суспензии для инъекций.
Предлагаемое изобретение иллюстрируется нижеследующими примерами.
Пример 1. Получение полимерных частиц с включенным в них анастрозолом методом простых эмульсий.
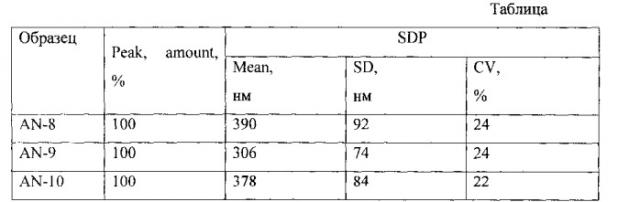
В 10 мл хлороформа растворяли при перемешивании на магнитной мешалке 700.0±4.1 мг (59÷59.7%, мас. от загруженных сухих веществ) полилактидгликолида (PLGA- COOH 50/50) и 100.0±0.6 мг (8.4÷8.5%, мас.) анастрозола. Раствор перемешивали 15 мин, после чего его добавляли в течение 15 мин при интенсивном перемешивании в 0.5% в раствор поливинилового спирта (PVA) в воде 36.5 мл, ~182±0.8 мг (15.2÷15.4%, мас.). Полученную смесь интенсивно перемешивали еще 30 мин. После этого подвергали гомогенизации при 24 тыс.об/мин погружным диспергатором (гомогенизатором) Ultra-Turrax® T-25 (IKA®, ФРГ) с помощью диспергирующего элемента (S25N-S25F) 3 раза по 1 мин с перерывами по 1 мин. Из полученной эмульсии отгоняли хлороформ на роторном испарителе. Полученную суспензию фильтровали через стеклянный фильтр (пор. 40÷110 мкм). Фильтрат дополнительно вакуумировали с помощью водоструйного насоса для удаления остатков хлороформа. В полученном коллоидном растворе растворяли 201.6±2.4 мг (16.6÷17.0%, мас.) D-маннитола и замораживали его в бане с жидким азотом. Затем сушили на лиофильной сушке при 0.3÷1.5 мБар в течение 20 ч. Выход готового продукта составил 100% (от общей массы взятых ингредиентов). Средний размер частиц определяли методом автокорреляционной спектроскопии на субмикронном лазерном спектрометре Coulter N4MD (USA). Полученные частицы имели субмикронные размеры (размер из диапазона от 100 до 1000 нм). Распределение частиц по размерам было унимодальным во всех образцах (см. табл.).
Примечания. SDF (size distributional particles) - распределение частиц по размерам; Peak, amount - количество частиц (%), образующих основной пик; Mean - средний диаметр; SD (standard deviation) - стандартное отклонение; CV (coefficient of variation) - коэффициент вариации.
Аналогичные опыты были проведены с использованием сополимеров молочной и гликолевой кислот PLGA 50:50, PLGA 75:25 и полилактидом - PLA.
Полученное лекарственное средство может быть выполнено в виде капсулы, порошка или другой пероральной формы на основе известных технологий, а также в виде суспензии для инъекций.
Пример 2. Сравнительная фармакологическая эффективность лекарственного средства пролонгированного действия на основе анастрозола.
В эксперименте использовались овариоэктамизованные мыши линии С57 Bl/6j, всем группам ежедневно вводился гормон метандростенолон в дозировке 100 мкг с момента инокуляции опухоли. Для исследования противоопухолевой активности лекарственного средства пролонгированного действия на основе анастрозола была выбрана аденокарцинома молочной железы мышей линии Ca755. Опухолевые клетки инокулировались подкожно, в подлопаточную область, в дозе 106 опухолевых клеток. Лечение начато через 48 часов после инокуляции опухолевых клеток.
Ход операции. 1 - Подготовка операционного поля. 2 - Кожный разрез. 3 - Тупое проникновение в брюшную полость. 4 - Выведение яичника в рану. 5 - Наложение лигатуры. 6 - Эктомия яичника. 7 - Наложение кожных швов.
Схема лечения. Группа №1 - Вводился физраствор по 0,1 мл ежедневно, в/б, до момента гибели. Группа №2 - Вводился анастрозол (раствор) ежедневно, в/б, 0.02 мг/кг (по анастрозолу) до момента гибели. Группа №3 - Вводился препарат AN (лекарственное средство пролонгированного действия на основе анастрозола в виде полимерных частиц) в дозе 0.02 мг/кг (по анастрозолу) ежедневно, в/б, до момента гибели. Группа №4 - Вводился препарат AN (лекарственное средство пролонгированного действия на основе анастрозола в виде полимерных частиц) в дозе 0.02 мг/кг (по анастрозолу) через день, в/б, до момента гибели.
Пример 3. Количественное определение анастрозола в плазме крови мышей методом ВЭЖХ после введения лекарственного средства пролонгированного действия на основе анастрозола.
Изучение фармакокинетики лекарственного средства пролонгированного действия на основе анастрозола проводили на овариоэктамизованных мышах линии C57 Bl/6j, которым в течение 3 дней в/б вводили лекарственное средство в дозе 0.02 мг/кг (по анастрозолу) (группа 1). В качестве сравнения использовали субстанцию анастрозола (группа 2). Мышей забивали с интервалом 12 ч по 5 из каждой группы и забирали кровь, из которой получали сыворотку стандартным методом. Определение содержания анастрозола проводили согласно методике [6]. К 0.5 мл плазмы добавляли 2.5 мл дихлорметана, пробы помещали на горизонтальный шейкер и интенсивно встряхивали в течение 15 мин. Пробы центрифугировали при 4500 об/мин, органический слой отбирали и упаривали досуха при 37 °C. Сухой остаток растворяли в 10 мл подвижной фазы и аликвоту объемом 100 мкл инжектировали в хроматограф.
Хроматографию проводили на высокоэффективном жидкостном хроматографе LC-20 Prominence (Shimadzu, Япония) с УФ детектором на колонке LC-18-OB, 150×4.5 мм. В качестве подвижной фазы использовали смесь ацетонитрила и 0.01 Μ раствор KH2PO4 (30% и 70% по объему) с добавлением о-фосфорной кислоты до pH=3.6. Скорость элюирования составляла 1 мл/мин. Детектирование осуществляли при 215 нм. Концентрацию анастрозола определяли методом абсолютной калибровки. Предел обнаружения составлял 5 нг/мл.
Таким образом, по совокупности всех полученных результатов испытаний лекарственного средства пролонгированного действия на основе анастрозола с использованием биодеградируемого полимера PLGA-COOH (50/50) в виде частиц субмикронного размера можно с уверенностью заключить, что полученное лекарственное средство пролонгированного действия на основе анастрозола обладает более высокой специфической активностью и выраженным пролонгирующим действием. Эти результаты позволяют сделать заключения о росте терапевтической широты и увеличении терапевтического индекса при сокращении кратности приема нового препарата, что позволит создать более комфортные условия для пациентов, вынужденных регулярно и длительно применять лекарство.
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ
1. ДЕМОСКОП Weekly Электронная версия бюллетеня «Население и общество» Издание института демографии Государственного университета - Высшая школа экономики №311-312.
2. Кваша Е.А., Харькова Т.Л. Статистико-демографический анализ смертности от рака молочной железы в России // Вопросы статистики, 2006, №8, стр. 25-33.
3. Biomaterials Science: An Introduction to Materials in Medicine / Ed. B.D. Ratner, A.S. Hoffman, F.J. Schoen, J.E. Lemons. - 2012. Academic Press, 1576 p.
4. Cellular Response to Biomaterials / L. Di Silvio. - 2008. Woodhead Publishing, 648 p.
5. A.S. Zidan, O.A. Sammour, M.A. Hammad, N.A. Megrab, M.D. Hussain, M.A. Khan, M.J. Habib. Formulation of Anastrozole Microparticles as Biodegradable Anticancer Drug Carriers // AAPS Pharm. Sci. Tech 2006; V. 7 (3) Article 61.
6. Клиническая фармакокинетика: теоретические, прикладные и аналитические аспекты: руководство / Под ред. В.Г. Кукеса. - 2009. 432 стр.
1. Противоопухолевое лекарственное средство пролонгированного действия на основе противоопухолевого препарата, ингибитора синтеза эстрогенов - анастрозола, содержащее сополимер молочной и гликолевой кислот, поливиниловый спирт, D-маннитол и представляющее собой частицы субмикронного размера, при следующем соотношении компонентов в лекарственном средстве, % мас.:
| анастрозол | 8,4÷8,5 |
| сополимер молочной и гликолевой кислот | 59,0÷59,7 |
| поливиниловый спирт | 15,2÷15,4 |
| D-маннитол | 16,6÷17,0 |
2. Лекарственное средство по п. 1, отличающееся тем, что оно выполнено в виде капсулы или гранулы, или порошка, а также суспензии для инъекций.