Связывающие протеины, специфичные по отношению к инсулин-подобным факторам роста, и их использование
Иллюстрации
Показать всеНастоящее изобретение относится к области иммунологии. Предложено полностью человеческое моноклональное антитело, которое связывает инсулиноподобный фактор роста-II (IGF-II) и имеет перекрестную реактивность к IGF-I, а также его антигенсвязывающий фрагмент. Рассмотрены молекула нуклеиновой кислоты, кодирующая антитело по изобретению, вектор и клетка-хозяин для экспрессии антитела по изобретению. Описана фармацевтическая композиция, а также конъюгаты для лечения и диагностики злокачественной опухоли, применение антитела по изобретению в получении лекарственного средства и способ определения уровня IGF-II и IGF-I в пробе пациента. Настоящее изобретение может найти дальнейшее применение в терапии рака. 8 н. и 8 з.п. ф-лы, 27 пр., 18 табл.
Реферат
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
В данной заявке заявляется приоритет, согласно 35 U.S.С. §119, предварительной заявки США, серийный номер U60/750,085, поданной 13 декабря, 2005 г.; предварительной заявки США, серийный номер 60/750,772, поданной 14 декабря 2005 г.; предварительной заявки США, серийный номер 60/774,747, поданной 17 февраля 2005 г.; и предварительной заявки США, серийный номер 60/808,183, поданной 24 мая 2006 г., каждая из которых полностью включена в данную заявку путем ссылок.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Область изобретения Изобретение относится к связывающим протеинам, которые связывают инсулиноподобный фактор роста - 2 (IGF-II) имеющим перекрестную реактивность к инсулиноподобному фактору роста - 1 (IGF-I) и к использованию таких связывающих протеинов. Более конкретно, изобретение относится к моноклональным антителам, направленным на IGF-II имеющим перекрестную реактивность к IGF-I и к использованию таких антител. Аспекты данного изобретения также относятся к гибридомам или другим линиям, которые экспрессируют такие антитела.
Описание уровня техники
Инсулиноподобные факторы роста IGF-I и IGF-II представляют собой небольшие полипептиды, которые задействованы в регулировании клеточной пролиферации, выживании, дифференциации и трансформации. IGFs различными способами влияют, путем, в основном, взаимодействия со специфическим рецептором клеточной поверхности, рецептором IGF-I (IGF-IR) и активирования различных межклеточных сигнальных каскадов. IGFs циркулирует в сыворотке, в основном связывая IGF-связывающие протеины (IGFBP-1-6). Взаимодействие IGFs с IGF-IR регулируется IGFBPs, a IGFs может связывать только IGF-IR после освобождения из IGFBPs (главным образом, путем протеолиза IGFBPs). IGF-I может также связывать гибридный рецептор, состоящий из IGF-IR и инсулинового рецептора (IR). Было показано, что IGF-II связывает "А" изоформу рецептора инсулина.
Злокачественные преобразования включают в себя дисбаланс различных процессов, таких как рост клеток, дифференциация, апоптоз и преобразование. IGF-I и IGF-II были задействованы в патофизиологии широкого диапазона условий, и считается, что они принимают участие в мутагенезе, что вызвано их митогенными и антиапоптозными свойствами, опосредованными рецептором IGF-IR. LeRoith and Roberts, Cancer Lett. 195: 127-137 (2003).
IGF-I был открыт как фактор роста, который вырабатывается печенью под регулированием гормона роста слизистой, и изначально получил название соматомедин - С.Salmon et al., J. Lab. Clin. Med. 49: 825-826 (1957). Как IGF-I, так и IGF-II экспедируются повсеместно и действуют в качестве эндокринных, паракринных и аутокринных факторов роста, посредством их взаимодействия с IGF-IR, транс-мембранной тирозин-киназой, которая структурно и функционально относится к рецепторам инсулина (IR). IGF-I функционирует, в основном, путем активации IGF-IR, где IGF-II может действовать через IGF-IR или через изоформу IR-A. LeRoith and Roberts, Cancer Lett. 195: 127-137 (2003). Дополнительно, взаимодействие как IGF-I, так и IGF-II с IGF-связывающими протеинами может оказывать влияние на полупериод жизни и бионакопление IGFs, также как и их непосредственное взаимодействие с рецепторами в аналогичных случаях. Rajaram et al., Endocr. Rev. 18: 801-831 (1997).
IGF-I оказывает продолжительное влияние на клеточную пролиферацию, дифференциацию, и апоптоз. Эксперименты с культивированной остеосаркомой и раком молочной железы предположили, что IGF-I является протеиновым митогеном и проявляет свое митогенное действие путем возрастания синтеза DNA и путем стимулирования экспрессии циклинового D1, ускоряющего прогрессию клеточного цикла от G1 до S фазы. Furlanetto et al., Mol. Endocrinol. 8: 510-517 (1994); Dufourny et al., J. Biol. Chem. 272: 311663-31171 (1997). Подавление экспрессии D1 в раковых клетках поджелудочной железы упраздняет митогенное влияние IGF-I. Kornmann et al., J. Clin. Invest. 101: 344-352 (1998). Кроме стимулирования прогрессии клеточного цикла, IGF-I также ингибирует апоптоз. Было показано, что IGF-I стимулирует экспрессию Bсl протеинов и подавляет экспрессию Вах, что приводит к возрастанию относительного количества гетеродимера Bcl/Bax, блокируя, таким образом, путь апопотоза. Minshall et al., J. Immunol. 159: 1225-1232 (1997); Parrizas etal, Endocrinology 138: 1355-1358 (1997); Wang et al., Endocrinology 139: 1354-1360 (1998).
Аналогично IGF-I, IGF-II также имеет мутагенное и антиапоптическое действие и регулирует клеточную пролиферацию и дифференциацию. По сравнению с IGF-I, в сыворотке циркулируют высокие концентрации IGF-II. Высокое содержание IGF-II в сыворотке было найдено у пациентов, имеющих рак кишечника, с тенденцией к увеличению концентрации при развитии болезни. Renehan et al., Br. J. Cancer 83:1344-1350. Кроме того, большинство первичных опухолей и перерожденных клеточных линий избыточно экспрессируют IGF-II и РНК и протеин. Werner and LeRoith Adv. Cancer Res. 68:183-223 (1996). Избыточная экспрессия IGF-II рака толстой кишки связана с агрессивным фенотипом, потеря отпечатков (потерей аллель-специфичной экспрессии) IGF-II гена может быть важна в карциногенезе толстой кишки. Michell et al., Br. J. Cancer 76:60-66 (1997); Takano et al., Oncology 59: 210-216 (2000). Раковые клетки, которые имеют сильную тенденцию к образованию метастаз, имеют уровни экспрессии IGF-, в четыре раза превышающие экспрессию в тех клетках, которые имеют слабую тенденцию к образованию метастаз Guerra et al., Int. J. Cancer 65: 812-820 (1996).
Научные и клинические исследования высветили роль членов семейства IGF в развитии, сохранении и прогрессировании рака. Было показано, что многие раковые клетки имеют избыточную экспрессию h IGF-IR и/или IGF лигандов. Например, IGF-I и IGF-II являются сильными митогенами широкого диапазона раковых клеточных линий, включая саркому, лейкемию, и рак простаты, молочной железы, легких, толстой кишки, желудка, пищевода, печени, поджелудочной железы, почек, щитовидной железы, мозга, яичников, и матки. Macaulay et al., Br. J. Cancer 65: 311-320 (1992); Oku et al., Антиcacancer Res. 11: 1591-1595 (1991); LeRoith et al., Ann. Intern. Med. 122:54-59 (1995); Yaginuma et al., Oncology 54: 502-507 (1997); Singh et al., Endocrinology 137: 1764-1774 (1996); Frostad et al., Eur. J. Haematol 62: 191-198 (1999). Когда IGF-I вводили в злокачественные раковые клетки пищевода, они становились резистентными к апоптозу, вызываемому цитокинами. Remacle-Bonnet et al., Cancer Res. 60: 2007-2017 (2000).
Роль IGFs в развитии рака также подтверждена эпидемиологическими исследованиями, в которых было показано, что высокие уровни циркуляции IGF-I и низкие уровни IGFBP-3 связаны с повышенным риском развития нескольких видов обычного рака (простаты, молочной железы, толстой кишки и легких). Mantzoros et al., Br. J. Cancer 76: 1115-1118 (1997); Hankinson et al., Lancet 351: 1393-1396 (1998); Ma et al., J. Natl. Cancer Inst. 91: 620-625 (1999); Karasik et al., J. Clin. Endocrinol Metab. 78: 271-276 (1994). Эти результаты предполагают, что IGF-I и IGF-II действуют как мощные митогенные и анти-апоптозные сигналы, и их избыточная экспрессия коррелирует с неблагоприятными прогнозами для пациентов с несколькими видами рака.
Используя модели нокаутированных мышей, в нескольких исследованиях была дополнительно установлена роль IGFs при росте опухолей. С развитием технологии тканеспецифической, условной генной делеции, была разработана мышиная модель печеночной IGF-I недостаточности (LID). Печеночно-специфическая делеция гена igfl упраздняла экспрессию IGF-I иРНК и вызывала сильное уменьшение уровней циркуляции IGF-I. Yakar et al., Proc. Natl. Acad. Sci. USA 96: 7324-7329 (1999). Когда опухоли млекопитающих индуцировали у мышей LID, уменьшение уровней циркуляции IGF-1 приводило к значительному уменьшению развития рака, роста и образования метастаз, в то время как увеличение уровней циркуляции IGF-1 было связано с усилением роста опухолей. Wu et al., Cancer Res. 63: 4384-4388 (2003).
В нескольких статьях сообщалось о том, что ингибирование IGF-IR экспрессии и/или сигналов приводит к ингибированию роста опухолей, как in vitro, так и in vivo. Было также показано, что ингибирование передачи сигналов IGF увеличивает чувствительность опухолевых клеток к химиотерапевтическим агентам. Было разработано множество стратегий (антисмысловые олигонуклеотиды, растворимый рецептор, пептидные ингибиторы, доминантные негативные рецепторы-мутанты, малые молекулы - ингибиторы киназной активности и анти-hIGF-IR антитела) для ингибирования IGF-IR путей передачи сигнала в опухолевых клетках. Один из подходов состоял в поражении киназной активности IGF-IR небольшими молекулами-ингибиторами. Недавно были идентифицированы два соединения в качестве небольших молекул - ингибиторов киназы, способных селективно ингибировать IGF-IR. Garcia-Echeverria et al., Cancer Cell 5: 231-239 (2004); Mitsiades et al., Cancer Cell 5: 221-230 (2004). Ингибирование киназной активности IGF-IR не разрешало IGF-I-опосредованное выживание и образование колоний в мягком агаре раковых клеток MCF-7 человеческой молочной железы. Garcia-Echeverria et al., Cancer Cell 5: 231-239 (2004). При введении киназного ингибитора IGF-IR мышам с опухолевыми ксенотрансплантатами, передача сигналов IGF-IR в опухолевых ксенотрансплантантах ингибировалось, а рост вызываемых IGF-IR фибросарком значительно уменьшился. Garcia-Echeverria et al., Cancer Cell 5: 231-239 (2004). Аналогичный эффект наблюдался при гематологических злокачественных опухолях, особенно множественной миеломы. В клетках множественной миеломы (болезнь Рустицкого-Калера), небольшая молекула IGF-IR, ингибитор киназы, проявляла в >16-большую мощность по отношению к IGF-IR, по сравнению с рецептором инсулина, и проявляла аналогичную эффективность при ингибировании роста и выживания клеток. Mitsiades et al., Cancer Cell 5: 221-230 (2004). Аналогичные соединения вводили мышам интраперитонеально и ингибировали рост клеток множественной миеломы и усиливали выживаемость мышей Mitsiades et al., Cancer Cell 5: 221-230 (2004). В сочетании с другими химиотерапевтическими агентами в субтерапевтических дозах, ингибирование киназной активности IGF-IR синергетически уменьшало массу опухолей Mitsiades et al., Cancer Cell 5: 221-230 (2004).
Другой подход в ингибировании передачи сигналов IGF состоял в разработке эффективных нейтрализующих антител, направленных против рецептора IGF-IR. Различными группами были разработаны антитела к IGF-IR для ингибирования стимулированного рецепторами IGF-I аутофосфорилирования, индуцирования рецепторной интернализации и деградации и уменьшения пролиферации и выживаемости различных человеческих раковых клеточных линий. Hailey et al., Mol Cancer Ther. 1: 1349-1353 (2002); Maloney et al., Cancer Res. 63: 5073-5083 (2003); Benini et al., Clin. Cancer Res. 7: 1790-1797 (2001); Burtrum et al., Cancer Res. 63: 8912-8921 (2003). Кроме того, в ксенотрансплантатных опухолевых моделях, блокада IGF-IR приводила к значительному ингибированию роста опухолей молочной железы, почек и поджелудочной железы in vivo. Burtrum et al., Cancer Res. 63: 8912-8921 (2003); Maloney et al., Cancer Res. 63: 5073-5083 (2003). Эксперименты, в которых использовали химерные гуманизированные антитела IGF-IR привели к аналогичным результатам, ингибируя рост раковых клеток молочной железы in vitro и в опухолевых ксенотрансплантатах. Sachdev et al., Cancer Res. 63: 627-635 (2003). Другие гуманизированные IGF-IR антитела блокировали вызванное IGF-I фосфорилирование щитовидной железы и ингибирование роста опухолей в молочной железе и не мелких клетках легких, так же как и in vivo. Cohen et al., Clin. Cancer Res. 11: 2063-2073 (2005); Goetsch et al., Int. J. Cancer 113: 316-328 (2005).
Увеличенные уровни IGF-I также были связаны с несколькими не-раковыми патологическими состояниями, включая акромегалию и гигантизм (Barkan, Cleveland Clin. J. Med. 65: 343, 347-349, 1998), в то время как ненормальное функционирование рецептора IGF-I/IGF-II было задействовано в псориазе (Wraight et al., Nat. Biotech. 18: 521-526, 2000), атеросклерозе и рестенозе гладкой мускулатуры кровяных сосудов после ангиопластики (Bayes-Genis et al., Circ. Res. 86: 125-130, 2000). Увеличенные уровни IGF-I были задействованы в диабете или осложнениях, связанных с диабетом, таких как микрососудистая пролиферация (Smith et al., Nat. Med. 5: 1390-1395, 1999).
Антитела к IGF-I и IGF-II описаны в уровне техники. См., например, Goya et al., Cancer Res. 64: 6252-6258 (2004); Miyamoto et al., Clin. Cancer Res. 11: 3494-3502 (2005). Дополнительно, см. WO 05/18671, WO 05/28515 и WO 03/93317.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Воплощения данного изобретения относятся к связывающим протеинам, которые специфично связывают инсулиноподобные факторы роста и уменьшают рост опухолей. В одном воплощении, связывающие протеины являются полностью человеческими моноклональными антителами, или их связывающими фрагментами, которые специфично связывают инсулиноподобные факторы роста и уменьшают рост опухолей. Механизмы достижения этого могут включать и не ограничиваются либо ингибированием связывания IGF-I/II и его рецептора IGF-IR, ингибированием вызванной IGF-I/II передачи сигналов IGF-IR, либо увеличением клиренса IGF-I/II, таким образом, уменьшая эффективную концентрацию IGF-I/II.
Таким образом, некоторые воплощения обеспечивают полностью человеческий выделенный специфичный связывающие протеин, который, предпочтительно связывает инсулиноподобный фактор роста-II (IGF-II) и имеет перекрестную реактивность к инсулиноподобному фактору роста I (IGF-I), нейтрализует активность IGF-I и IGF-II. В некоторых аспектах, связывающий протеин связывает IGF-II с афинностью, которая, как минимум, в 2,5 раза превышает его афинность к IGF-I. В других аспектах, связывающий протеин, связывающий IGF-II с афинностью, которая, как минимум, в 3, как минимум, в 4, как минимум, в 5, как минимум, в 7, как минимум, в 10, как минимум, в 50, как минимум, в 60, как минимум, в 100 или, как минимум, в 150 раз превышает его афинность к IGF-I.
В некоторых воплощениях, специфический связывающий протеин имеет ЕС50 не более 15 нМ для ингибирования IGF-I-зависимого фосфорилирования IGF-I рецептора в NIH3T3 клетках, которые эктопически экспрессируют IGF-1R. В некоторых аспектах, специфический связывающий протеин имеет ЕС50 не более 15 нМ, не более 10 нМ, или не более 8 нМ для ингибирования IGF-I-зависимого фосфорилирования IGF-I рецептора в NIH3T3 клетках, которые эктопически, экспрессируют IGF-1R.
В некоторых воплощениях, специфический связывающий протеин имеет ЕС50 не более 5 нМ, не более 4 нМ, или не более 3 нМ для ингибирования IGF-I-зависимого фосфорилирования IGF-I рецептора в NIH3T3 клетках, которые эктопически экспрессируют IGF-1R.
В других воплощениях, специфический связывающий протеин ингибирует более чем 70% IGF-II зависимой пролиферации клеток NIH3T3, которые экспрессируют рекомбинантные hIGF-IR при значениях ЕС50, не превышающих 25 нМ, не превышающих 20 нМ, не превышающих 15 нМ, или не превышающих 10 нМ.
В других воплощениях, специфический связывающий протеин ингибирует более 70% IGF-I зависимой пролиферации клеток NIH3T3, которые экспрессируют рекомбинантные hIGF-IR при значениях ЕС50, не превышающих 40 нМ, не превышающих 30 нМ, не превышающих 25 нМ.
В некоторых воплощениях, специфический связывающий протеин конкурирует за связывание с моноклональным антителом, которое содержит последовательность вариабельной тяжелой цепи, которую выбирают из группы, состоящей из SEQ ID №: 2, SEQ ID №: 6, SEQ ID №: 10, SEQ ID №: 14 и SEQ ID №: 18, последовательность вариабельной легкой цепи, которую выбирают из группы, состоящей из SEQ ID №: 4, SEQ ID №; 8, SEQ ID №: 12 и SEQ ID №: 16.
Одним из воплощений данного изобретения является полностью человеческое антитело, которое связывает IGF-I при Kd, которое имеет значение менее чем 500 пикомолей (пМ). Более предпочтительно, антитело связывается при Kd, которое имеет значение менее чем 450 пикомолей (пМ). Более предпочтительно, антитело связывается при Kd, которое имеет значение менее чем 410 пикомолей (пМ). Более предпочтительно, антитело связывается при Kd, которое имеет значение менее чем 350 пМ. Даже более предпочтительно, антитело связывается при Kd, которое имеет значение менее чем 300 пМ. Измерения афинности и/или авидности могут быть проведены при помощи BIACORE®, как описано в данной заявке.
Еще одно воплощение данного изобретения представляет собой полностью человеческое антитело, которое связывает IGF-II при Kd, которое имеет значение менее чем 175 пикомолей (пМ). Более предпочтительно, антитело связывается при Kd, которое имеет значение менее чем 100 пикомолей (пМ). Более предпочтительно, антитело связывается при Kd, которое имеет значение менее чем 50 пикомолей (пМ). Более предпочтительно, антитело связывается при Kd, которое имеет значение менее чем 5 пикомолей (пМ). Даже более предпочтительно, антитело связывается при Kd, которое имеет значение менее чем 2 пМ.
В некоторых воплощениях, специфический связывающий протеин представляет собой полностью человеческое моноклональное антитело или связывающий фрагмент представляет собой полностью человеческого моноклонального антитела. Связывающие фрагменты могут включать Fab, Fab(или F(ab′)2 и Fv.
Одно из воплощений данного изобретения включает полностью человеческие моноклональные антитела 7.251.3 (номер доступа АТСС РТА-7422), 7.34.1 (номер доступа АТСС РТА-7423) и 7.159.2 (номер доступа АТСС РТА-7424) которые специфически связывают IGF-I/II, как более подробно обсуждается ниже.
В некоторых воплощениях специфический связывающий протеин, который связывает инсулиноподобный фактор роста-II (IGF-II) и имеет перекрестную реактивность к инсулиноподобному фактору роста-I (IGF-I), или его связывающий фрагмент может включать полипептид тяжелой цепи, имеющий последовательность SEQ ID №: 6, и полипептид легкой цепи, имеющий последовательность SEQ ID №: 8.
Специфический связывающий протеин может включать полипептид тяжелой цепи, имеющий последовательность SEQ ID №: 10, и полипептид легкой цепи, имеющий последовательность SEQ ID №: 12.
Специфический связывающий протеин в соответствии с данным изобретением может включать полипептид тяжелой цепи, имеющий последовательность SEQ ID №: 14 и полипептид легкой цепи, имеющий последовательность SEQ ID №: 16.
В некоторых воплощениях, специфический связывающий протеин может представлять собой смесь с фармацевтически приемлемым носителем.
Другое воплощение включает выделенные молекулы нуклеиновой кислоты, кодирующие любые специфические связывающие протеины, описанные в данной заявке, вектора, имеющие выделенные молекулы нуклеиновой кислоты, кодирующие специфические связывающие протеины, или клетки-хозяева, трансформированные с любыми такими молекулами нуклеиновой кислоты и векторами.
В некоторых воплощениях специфический связывающий протеин, который связывает инсулиноподобный фактор роста-II (IGF-II) и имеющий перекрестную реактивность к инсулиноподобному фактору роста-I (IGF-I), или его связывающий фрагмент не связывает специфически IGF-II или IGF-I протеины, если указанные протеины связаны со связывающими протеинами инсулинового фактора роста.
Дополнительные воплощения включают способы определения уровней инсулиноподобного фактора роста-II (IGF-II) и инсулиноподобного фактора роста I (IGF-I) в пробе пациента. Эти способы могут включать обеспечение пробы пациента; контактирование пробы со специфическим связывающим протеином, который связывает инсулиноподобный фактор роста-II (IGF-II) и имеющий перекрестную реактивность к инсулиноподобному фактору роста-I (IGF-I), или его связывающий фрагмент; и определение уровня IGF-I и IGF-II в указанной пробе. В некоторых аспектах, пробой пациента была кровь.
Дополнительные воплощения включают способы лечения злокачественных опухолей у млекопитающих. Эти способы могут включать отбор млекопитающего, который нуждается в лечении злокачественной опухоли; и введение млекопитающему терапевтически эффективной дозы специфически связывающего протеина, который связывает инсулиноподобный фактор роста-II (IGF-II) и имеет перекрестную реактивность к инсулиноподобному фактору роста-I (IGF-I), или их связывающего фрагмента. В некоторых аспектах животным является человек. В некоторых аспектах, связывающий протеин представляет собой полностью человеческое моноклональное антитело, и его выбирают из группы, состоящей из mAb 7.251.3 (номер доступа АТСС РТА-7422), mAb 7.34.1 (номер доступа АТСС РТА-7423) и mAb 7.159.2 (номер доступа АТСС РТА-7424).
Заболевания, поддающиеся лечению, могут включать меланому, немелкоклеточный рак легких, глиому, печеночно-клеточный рак, опухоль щитовидной железы, рак желудка, рак простаты, рак молочной железы, рак яичников, рак мочевого пузыря, рак легких, глиобластому, рак эндометрия, рак почек, рак толстой кишки, рак поджелудочной железы и плоскоклеточный рак.
Дополнительные воплощения включают способы лечения заболевания, зависящие от фактора роста у млекопитающих. Эти способы включают отбор млекопитающего, который нуждается в лечении заболевания; и введение указанному млекопитающему терапевтически эффективной дозы специфически связывающего протеина, который связывает инсулиноподобный фактор роста-II (IGF-II) и имеет перекрестную реактивность к инсулиноподобному фактору роста-I (IGF-I), или их связывающего фрагмента. В некоторых аспектах, млекопитающим может быть человек. В некоторых аспектах, связывающий протеин представляет собой полностью человеческое моноклональное антитело, и его выбирают из группы, состоящей из mAb 7.251.3 (номер доступа АТСС РТА-7422), mAb 7.34.1 (номер доступа АТСС РТА-7423) и mAb 7.159.2 (номер доступа АТСС РТА-7424).
Поддающиеся лечению заболевания, зависимые от фактора роста, могут включать остеопороз, диабет и сердечно-сосудистые заболевания. Другие поддающиеся лечению болезненные состояния включают акромегалию и гигантизм, псориаз, атеросклероз и рестеноз гладкой мускулатуры кровяных сосудов, а также диабет.
Дополнительные воплощения включают конъюгат, состоящий из полностью человеческого моноклонального антитела, которое связывает инсулиноподобный фактор роста-II (IGF-II) и имеет перекрестную реактивность к инсулиноподобному фактору роста-I (IGF-I), или его связывающего фрагмента, и терапевтическое средство. В некоторых аспектах, терапевтическим средством может быт токсин, радиоактивный изотоп, или фармацевтическая композиция.
В других воплощениях, изобретение обеспечивает полностью человеческие моноклональные антитела, или их связывающий фрагмент, которые связывают инсулиноподобный фактор роста-II (IGF-II) и имеют перекрестную реактивность к инсулиноподобному фактору роста-I (IGF-I), и содержат гипервариабельный участок 1 (CDR1) тяжелой цепи, имеющий аминокислотную последовательность "Ser Tyr Tyr Trp Ser" (SEQ ID №: 21); гипервариабельный участок 2 (CDR2) тяжелой цепи, имеющий аминокислотную последовательность "Туr Phe Phe Tyr Ser Gly Tyr Thr Asn Tyr Asn Pro Ser Leu Lys Ser" (SEQ ID №: 22); и гипервариабельный участок 3 (CDR3) тяжелой цепи, имеющий аминокислотную последовательность "Ile Thr Gly Thr Thr Lys Gly Gly Met Asp Val" (SEQ ID №: 23).
Дополнительные воплощения включают полностью человеческие моноклональные антитела, или их связывающий фрагмент, содержащие гипервариабельный участок 1 (CDR1) легкой цепи, имеющий аминокислотную последовательность "Thr Gly Ser Ser Ser Asn Ile Gly Ala Gly Tyr Asp Val His" (SEQ ID №: 24). Антитела в данной заявке могут также включать гипервариабельный участок 2 (CDR2) легкой цепи, имеющий аминокислотную последовательность "Gly Asn Asn Asn Arg Pro Ser" (SEQ ID №: 25); и гипервариабельный участок 3 (CDR3) легкой цепи, имеющий аминокислотную последовательность "Gin Ser Phe Asp Ser Ser Leu Ser Gly Ser Val" (SEQ ID№: 26).
В других воплощениях, изобретение обеспечивает полностью человеческие моноклональные антитела, или их связывающий фрагмент, которые связывают инсулиноподобный фактор роста-II (IGF-II) и имеют перекрестную реактивность к инсулиноподобному фактору роста-I (IGF-I), и содержат гипервариабельный участок 1 (CDR1) тяжелой цепи, имеющий аминокислотную последовательность "Ser Tyr Tyr Trp Ser" (SEQ ID №: 27); гипервариабельный участок 2 (CDR2) тяжелой цепи, имеющий аминокислотную последовательность "Tyr Phe Phe Tyr Ser Gly Tyr Thr Asn Tyr Asn Pro Ser Leu Lys Ser" (SEQ ID №: 28); и гипервариабельный участок 3 (CDR3) тяжелой цепи, имеющий аминокислотную последовательность "Ile Thr Gly Thr Thr Lys Gly Gly Met Asp Val" (SEQ ID №: 29).
Дополнительные воплощения включают полностью человеческие моноклональные антитела, или их связывающий фрагмент, содержащий гипервариабельный участок 1 (CDR1) легкой цепи, имеющий аминокислотную последовательность "Thr Gly Arg Ser Ser Asn Ile Gly Ala Gly Tyr Asp Val His" (SEQ ID №: 30); гипервариабельный участок 2 (CDR2) легкой цепи, имеющий аминокислотную последовательность "Gly Asn Ser Asn Arg Pro Ser" (SEQ ID №: 31); и гипервариабельный участок 3 (CDR3) легкой цепи, имеющий аминокислотную последовательность "Gln Ser Tyr Asp Ser Ser Leu Ser Gly Ser Val" (SEQ ID №: 32).
В других воплощениях, изобретение обеспечивает полностью человеческие моноклональные антитела, или их связывающий фрагмент, которые связывают инсулиноподобный фактор роста-II (IGF-II) и имеют перекрестную реактивность к инсулиноподобному фактору роста-I (IGF-I), и содержат гипервариабельный участок 1 (CDR1) тяжелой цепи, имеющий аминокислотную последовательность "Ser Tyr Asp Ile Asn" (SEQ ID №: 33); гипервариабельный участок 2 (CDR2) тяжелой цепи, имеющий аминокислотную последовательность "Trp Met Asn Pro Asn Ser Gly Asn Thr Gly Tyr Ala Gln Lys Phe Gln Gly" (SEQ ID №: 34); и гипервариабельный участок 3 (CDR3) тяжелой цепи, имеющий аминокислотную последовательность "Asp Pro Tyr Tyr Tyr Tyr Tyr Gly Met Asp Val" (SEQ ID №: 35).
Дополнительные воплощения включают полностью человеческие моноклональные антитела, или их связывающий фрагмент, содержащий гипервариабельный участок 1 (CDR1) легкой цепи, имеющий аминокислотную последовательность "Ser Gly Ser Ser Ser Asn Ile Glu Asn Asn His Val Ser" (SEQ ID №: 36); гипервариабельный участок 2 (CDR2) легкой цепи, имеющий аминокислотную последовательность "Asp Asn Asn Lys Arg Pro Ser" (SEQ ID №: 37); и гипервариабельный участок 3 (CDR3) легкой цепи, имеющий аминокислотную последовательность "Glu Thr Trp Asp Thr Ser Leu Ser Ala Gly Arg Val" (SEQ ID №: 38).
В других воплощениях, изобретение обеспечивает полностью человеческие моноклональные антитела, bkb их связывающий фрагмент, которые связывают инсулиноподобный фактор роста-II (IGF-II) и имеют перекрестную реактивность к инсулиноподобному фактору роста-I (IGF-I), и содержат гипервариабельный участок 1 (CDR1) тяжелой цепи, имеющий аминокислотную последовательность "Ser Ser Ser Tyr Tyr Trp Gly" (SEQ ID №: 81); гипервариабельный участок 2 (CDR2) тяжелой цепи, имеющий аминокислотную последовательность "Gly Ile Tyr Tyr Ser Gly Ser Thr Tyr Tyr Asn Pro Ser Leu Lys Ser" (SEQ ID №: 82); и гипервариабельный участок 3 (CDR3) тяжелой цепи, имеющий аминокислотную последовательность "Gln Arg Gly His Ser Ser Gly Trp Trp Tyr Phe Asp Leu" (SEQ ID №: 83).
Дополнительные воплощения включают полностью человеческие моноклональные антитела, или их связывающий фрагмент, содержащий гипервариабельный участок 1 (CDR1) легкой цепи, имеющий аминокислотную последовательность "Arg Ala Ser Gln Gly Ile Ser Ser Tyr Leu Ala" (SEQ ID №: 84); гипервариабельный участок 2 (CDR2) легкой цепи, имеющий аминокислотную последовательность "Ala Ala Ser Ser Leu Gln Ser" (SEQ ID №: 85); и гипервариабельный участок 3 (CDR3) легкой цепи, имеющий аминокислотную последовательность "Gln Gln Ala Asn Asn Phe Pro Phe Thr" (SEQ ID №: 86).
В других воплощениях, изобретение обеспечивает полностью человеческие моноклональные антитела, или их связывающий фрагмент, которые связывают инсулиноподобный фактор роста-II (IGF-II) и имеют перекрестную реактивность к инсулиноподобному фактору роста-I (IGF-I), и содержат гипервариабельный участок 1 (CDR1) тяжелой цепи, имеющий аминокислотную последовательность "Ser Ser Ser Asn Tyr Trp Gly" (SEQ ID №: 87); гипервариабельный участок 2 (CDR2) тяжелой цепи, имеющий аминокислотную последовательность "Gly Ile Tyr Tyr Ser Gly Ser Thr Tyr Tyr Asn Pro Ser Leu Arg Ser" (SEQ ID №: 88); и гипервариабельный участок 3 (CDR3) тяжелой цепи, имеющий аминокислотную последовательность "Gln Arg Gly His Ser Ser Gly Trp Trp Tyr Phe Asp Leu" (SEQ ID №: 89).
Дополнительные воплощения включают полностью человеческие моноклональные антитела, или их связывающий фрагмент, содержащие гипервариабельный участок 1 (CDR1) легкой цепи, имеющий аминокислотную последовательность "Arg Ala Ser Arg Gly Ile Ser Ser Trp Leu Ala" (SEQ ID №: 90); гипервариабельный участок 2 (CDR2) легкой цепи, имеющий аминокислотную последовательность "Thr Ala Ser Ser Leu Gln Ser" (SEQ ID №: 91); и гипервариабельный участок 3 (CDR3) легкой цепи, имеющий аминокислотную последовательность "Gln Gln Ala Asn Ser Phe Pro Phe Thr" (SEQ ID №: 92).
Некоторые воплощения обеспечивают использование специфических связывающих протеинов, описанных в этой заявке, для получения лекарственных средств для лечения злокачественных опухолей. В некоторых аспектах, специфический связывающий протеин может представлять собой полностью человеческое моноклональное антитело. В определенных аспектах, связывающий протеин представляет собой mAb 7.251.3 (номер доступа АТСС РТА-7422) или mAb 7.34.1 (номер доступа АТСС РТА-7423) или mAb 7.159.2 (номер доступа АТСС РТА-7424). В некоторых аспектах, лекарственное средство предназначено для использования в комбинации со вторым антинеопластическим агентом, который выбирают из группы, состоящей из антитела, химиотерапевтического агента, или радиоактивного средства. В некоторых аспектах, лекарственное средство предназначено для использования в сочетании или после проведения традиционной хирургии, трансплантации стволовых клеток костного мозга или трансплантации периферических стволовых клеток.
Злокачественной опухолью может быть, например, меланома, немелкоклеточный рак легких, глиома, печеночно-клеточный рак, опухоль щитовидной железы, рак желудка, рак простаты, рак молочной железы, рак яичников, рак мочевого пузыря, рак легких, глиобластома, рак эндометрия, рак почек, рак толстой кишки, рак поджелудочной железы и плоскоклеточный рак.
Другие воплощения обеспечивают использование специфических связывающих протеинов, описанных в данной заявке, для получения лекарственного средства для лечения заболеваний, зависящих от фактора роста. В некоторых аспектах, специфический связывающий протеин представляет собой полностью человеческое моноклональное антитело и может быть выбран из группы, состоящей из mAb 7.251.3 (номер доступа АТСС РТА-7422), mAb 7.34.1 (номер доступа АТСС РТА-7423) и mAb 7.159.2 (номер доступа АТСС РТА-7424).
Заболеваниями, зависящими от фактора роста, могут быть, например, остеопороз, диабет и сердечно-сосудистые заболевания.
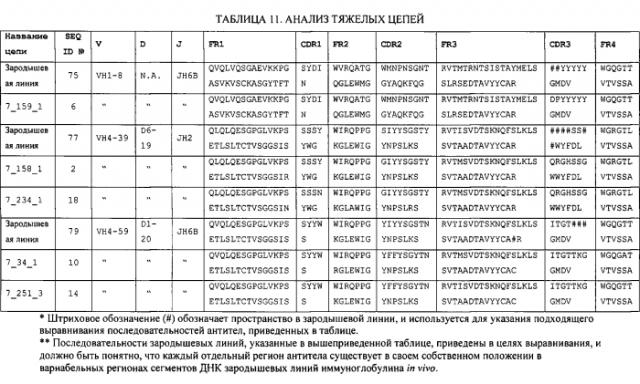
Преимущественно, антитело содержит аминокислотную последовательность тяжелой цепи, имеющую гипервариабельный участок (CDR) с одной или более последовательностями, приведенными в Таблице 11. Например, антитело может содержать аминокислотную последовательность тяжелой цепи, имеющую CDR1, CDR2, или CDR3 одной или более последовательностей, приведенных в Таблице 11, или их комбинацию. Отметим, что специалист в данной области сможет легко выполнить определения CDR. См., например, Kabat et al., Sequences of Proteins of Immunological Interest, Fifth Edition, NIH Publication 91-3242, Bethesda MD (1991), vols. 1-3.
Воплощения в соответствии с данным изобретением, описанные в данной заявке, относятся к моноклональным антителам, связывающим IGF-I/II и влияющим на функцию IGF-I/II. Другие воплощения относятся к полностью человеческим анти-IGF-I/II антителам и получению анти-IGF-I/II антител с желаемыми свойствами, с точки зрения терапевтической перспективы, включая высокую афинность связывания с IGF-I/II, способность к нейтрализации IGF-I/II in vitro и in vivo, и способность к ингибированию клеточной пролиферации, вызванной IGF-I/II.
ПОДРОБНОЕ ОПИСАНИЕ
Воплощения в соответствии с данным изобретением, описанные в данной заявке, относятся к связывающим протеинам, которые специфически связывают IGF-II и имеют перекрестную реактивность к IGF-I (в данной заявке называются "IGFI/II"). В некоторых воплощениях, связывающие протеины являются антителами, или их связывающими фрагментами, и связывают IGF-II и имеют перекрестную реактивность к IGF-I и ингибирую связывание этих протеинов с их рецептором, IGF-IR. Остальные воплощения в соответствии с данным изобретением включают полностью человеческие нейтрализующие анти-IGF-I/II антитела, и препараты антител, терапевтически полезные и связывают оба инсулиноподобные факторы роста. Такие препараты анти-IGF-I/II антител, преимущественно, имеют желательные терапевтические свойства, включая сильную афинность связывания IGF-I/II, способность к нейтрализации IGF-I/II in vitro, и способность к ингибированию вызванной IGF-I/II клеточной пролиферации in vivo.
Воплощения в соответствии с данным изобретением также включают выделенные связывающие фрагменты анти-IGF-I/II антител. Преимущественно, связывающие фрагменты получают из полностью человеческих анти-IGF-I/II антител. Иллюстративные фрагменты включают Fv, Fab(или другие хорошо известные фрагменты антител, как более подробно описано ниже. Воплощения в соответствии с данным изобретением также включают клетки, которые экспрессируют полностью человеческие антитела к IGF-I/II. Примеры клеток включают гибридомы, или рекомбинантно созданные клетки, такие, как клетки яичников хомячков (СНО), которые производят антитела к IGF-I/II.
Кроме того, воплощения в соответствии с данным изобретением включают способы использования данных антител для лечения заболеваний. Анти-IGF-I/II антитела полезны для профилактики IGF-I/II опосредованной IGF-I/II передачи сигналов, ингибируя, таким образом, клеточную пролиферацию. Механизм действия такого ингибирования IGF-I/II вследствие связывания его рецептора, IGF-IR, ингибирования IGF-I/II-вызванной IGF-IR передачи сигнала, или усиленного клиренса IGF-I/II, что приводит к понижению эффективной концентрации IGF-I/II для связывания IGF-IR. Болезни, поддающиеся лечения благодаря этому механизму ингибирования включают, не ограничиваясь приведенным, неопластические заболевания, такие как меланома, немелкоклеточный рак легких, глиома, печеночно-клеточный рак, гинекологические опухоли, рак головы и шеи, рак пищевода, глиобластома, и различные виды рака и опухолей щитовидной железы, желудка, простаты, молочной железы, яичников, мочевого пузыря, легких, матки, почек, толстой кишки и поджелудочной железы, слюнной железы и ободочной и прямой кишки.
Другие воплощения в соответствии с данным изобретением включают диагностические анализы для специфического определения количества IGF-I/II в биологической пробе. Аналитический набор может включать анти-IGF-I/II антитела наряду с необходимыми маркировками для метки таких антител. Эти диагностические анализы полезны для скрининга заболеваний, связанных с фактором роста, включая, но не ограничиваясь приведенным, такие неопластические заболевания, как меланома, немелкоклеточный рак легких, глиома, печеночно-клеточный рак, гинекологические опухоли, рак головы и шеи, рак пищевода, глиобластома и карцинома щитовидной железы, желудка, простаты, молочной железы, яичников, мочевого пузыря, легких, матки, почек, толстой кишки, и поджелудочной железы, слюнной железы, и ободочной и прямой кишки. Другими не-неопластическими состояниями могут быть акромегалия и гигантизм, псориаз, остеопороз, атеросклероз и рестеноз гладкой мускулатуры кровяных сосудов, а также диабет.
Дополнительные воплощения, характеристики и т.п., относительно анти-IGF-I/II антител дополнительно подробно описаны ниже.
Перечень последовательностей
Воплощения в соответствии с данным изобретением включают специфические анти-IGF-I/II антитела, приведенные ниже в Таблице 1. В данной таблице сообщается идентификационный номер каждого анти-IGF-I/II антитела, наряду с SEQ ID номер соответствующих генов легких и тяжелых цепей. Кроме того, последовательности зародышевых линий каждой производной легкой и тяжелой цепи также приведены ниже в Таблице 1.
Каждому антителу был присвоен идентификационный номер, который включает два или три номера, разделенные одной или двумя десятичными точками. В таких случаях, получают несколько клонов одного антитела. Хотя клоны содержат те же нуклеиновокислотные и аминокислотные последовательности, что и родительские последовательности, они также могут быть перечислены отдельно, а номер клона показан номером справа от второй десятичной точки. Таким образом, например, нуклеиновокислотные и аминокислотные последовательности антитела 7.159.2 идентичны последовательностям антитела 7.159.1.
Как можно увидеть путем сравнения последовательностей в перечне последовательностей, SEQ ID №№: 1-20 отличаются от SEQ ID №№: 39-58, поскольку SEQ ID №№: 39-58 включает нетранслированный сигнальный пептид и константный регион для каждой секвенированной тяжелой и легкой цепи.
| ТАБЛИЦА 1 | ||
| mAb ID №: | Последовательность | SEQ ID №: |
| 7.158.1 | Нуклеотидная последовательность, кодирующая вариабельный регион тяжелой цепи | 1 |
| Аминокислотная последовательность, кодирующая вариабельный регион тяжелой цепи | 2 | |
| Нуклеотидная последовательность, кодирующая вариабельный регион легкой цепи | 3 | |
| Аминокислотная последовательность, кодирующая вариабельный регион легкой цепи | 4 |
| 7.159.2 | Нуклеотидная последовательность, кодирующая вариабельный регион тяжелой цепи | 5 |
| Аминокислотная последовательность, кодирующая вариабельный регион тяжелой цепи | 6 | |
| Нуклеотидная последовательность, кодирующая вариабельный регион легкой цепи | 7 | |
| Аминокислотная последовательность, кодирующая вариабельный регион легкой цепи | 8 | |
| 7.34.1 | Нуклеотидная последовательность, кодирующая вариабельный регион тяжелой цепи | 9 |
| Аминокислотная последовательность, кодирующая вариабельный регион тяжелой цепи | 10 | |
| Нуклеотидная последовательно |