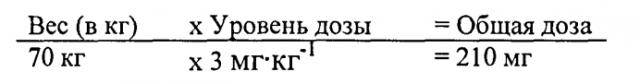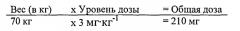Использование кислой лизосомной липазы для лечения дефицита кислой лизосомной липазы у больных
Иллюстрации
Показать всеИзобретение относится к медицине и может быть использовано для лечения пациента-человека с дефицитом кислой лизосомной липазы (КЛЛ). Для этого указанному пациенту-человеку вводят рекомбинантную КЛЛ человека в количестве, эффективном для снижения уровня трансаминазы печени в сыворотке или крови до нормального уровня. При этом указанную рекомбинантную КЛЛ человека вводят от одного раза примерно каждые 7 дней до одного раза примерно каждые 30 дней и указанное введение является достаточным для уменьшения поражения печени у указанного пациента-человека. Изобретение обеспечивает лечение дефицита КЛЛ, таких как болезнь Вольмана, болезнь накопления эфиров холестерина (БНЭХ), как на ранних, так и на поздних этапах развития заболевания. 31 з.п. ф-лы, 19 ил., 12 табл., 18 пр.
Реферат
УРОВЕНЬ ТЕХНИКИ
Дефицит кислой лизосомной липазы (КЛЛ) представляет собой редкую лизосомную болезнь накопления (ЛБН), характеризующуюся отсутствием расщепления холестеринового эфира (ХЭ) и триглицеридов (ТГ) в лизосомах вследствие дефицита фермента. Дефицит КЛЛ имеет сходство с другими лизосомными болезнями накопления с аккумуляцией субстрата в ряде типов тканей и клеток. При дефиците КЛЛ аккумуляция субстрата наиболее заметна в клетках ретикулоэндотелиальной системы, включая клетки Купфера в печени, гистиоциты в селезенке и в собственной пластинке слизистой оболочки тонкой кишки. Ретикулоэндотелиальные клетки выражают рецептор глюкозамина маннозы/N-ацетила макрофага (также известный как рецептор маннозы макрофага, РММ или CD206), который стимулирует связывание, включение клеткой вещества и лизосомную интернализацию протеинов с N-ацетилглюкозамином или завершенными N-гликанами маннозы и обеспечивает путь для возможной коррекции дефицита фермента в этих типах ключевых клеток.
Дефицит КЛЛ представляет собой мультисистемное заболевание, которое наиболее часто проявляется при желудочно-кишечных, печеночных и сердечнососудистых осложнениях и ассоциируется со значительной болезненностью и смертностью. Клинические последствия дефицита КЛЛ возникают вследствие обширной аккумуляции липидного материала в лизосомах в ряде тканей и кардинальных нарушений в механизмах регулирования холестерина и липидного гистиоцитоза, включая существенное увеличение синтеза печеночного холестерина. Дефицит КЛЛ представляет, по меньшей мере, два фенотипа: болезнь Вольмана (БВ) и болезнь накопления эфиров холестерина (БНЭХ).
Болезнь Вольмана, названная так в честь врача, первым описавшего ее, является наиболее агрессивным проявлением дефицита КЛЛ. Этот фенотип характеризуется желудочно-кишечными и печеночными проявлениями, включая нарушение роста, малабсорбцию, стеаторею, значительную потерю веса, лимфаденопатию, спленомегалию и гепатомегалию. Болезнь Вольмана быстро прогрессирует и неизменно приводит к смертельному исходу обычно в первый год жизни. Анализ историй болезни показывает, что выживание после 12-месячного возраста наблюдается чрезвычайно редко для больных, поступающих с нарушением роста вследствие тяжелой формы дефицита КЛЛ в первый год жизни. При такой наиболее агрессивной форме нарушение роста является доминирующим клиническим признаком и вносит основной вклад в смертность в раннем возрасте. Поражение печени, проявляющееся в форме ее увеличения и повышения уровня трансаминазы, также является общим проявлением у младенцев.
Диагноз болезни Вольмана ставится на основании как физических показателей, так и результатов лабораторных анализов. Младенцы обычно госпитализируются в первые два месяца жизни вследствие диареи, упорной рвоты, затруднениях при кормлении, отсталого роста, отсутствия развития. Физические показатели включают вздутие живота вследствие гепатомегалии и спленомегалии, и рентгенографическое исследование часто выявляет кальцификацию надпочечных желез. Лабораторные исследования обычно выявляют повышенные уровни сывороточной трансаминазы и отсутствие или значительное снижение активности эндогенного фермента КЛЛ. У некоторых больных наблюдаются повышенные уровни холестерина и триглицеридов в крови.
Больные с дефицитом КЛЛ также могут выявляться при большем возрасте в основном по поражению печени и сердечнососудистой системы, и это состояние часто называется болезнью накопления эфиров холестерина (БНЭХ). При БНЭХ, печень сильно поражена вследствие гепатомегалии, некроза клеток печени, повышения уровня трансаминазы, цирроза и фиброза печени. Вследствие повышенных уровней ХЭ и ТГ поражение сердечнососудистой системы может характеризоваться гиперлипидемией. Аккумуляция жировых отложений на стенках артерий (атеросклероз) была обнаружена у некоторых больных, страдающих БНЭХ. Отложения сужают артериальный просвет и могут привести к закупорке сосудов, повышая риск сердечнососудистых осложнений, включая инфаркт миокарда и внезапные приступы. Однако не у всех больных, страдающих дефицитом КЛЛ, развивается атеросклероз. Например, у пациентов с болезнью Вольмана наблюдаются другие симптомы, связанные с болезнью, включая увеличение печени и селезенки, лимфаденопатию и нарушение всасывания тонкой кишкой, но БВ в общем не характеризуется возникновением атеросклероза (The Metabolic and Molecular Bases of Inherited Disease (Метаболические и молекулярные основы наследственных болезней) (Scriver, С.R., Beaudet, A.L., Sly, W.S., Valle D., и др.) 7-е издание. Том 2, с.2570, McGraw-Hill, 1995). Также не у всех пациентов с БНЭХ наблюдается атеросклероз, см. Di Bisceglie и др., Hepatology (Гепатология 11: 764-772 (1990), Ameis и др., J, Lipid Res. (Исследование липидов) 36: 241-250 (1995). Проявление БНЭХ очень переменчиво, и у некоторых пациентов эта болезнь не диагностируется до наступления осложнений в позднем взрослом возрасте, в то время как у других пациентов наблюдается нарушение функции печени в раннем детском возрасте. БНЭХ ассоциируется с сокращенной продолжительностью жизни и значительным ухудшением состояния здоровья. Ожидаемая продолжительность жизни людей с БНЭХ зависит от серьезности связанных с болезнью осложнений.
В настоящее время способы лечения болезни Вольмана очень ограничены. Младенцам с гипертермией и/или признаками инфекции назначаются антибиотики. Может быть назначена стероидозамещающая терапия при недостаточности надпочечников и специальное парентеральное питание, и пока нет доказательств, что эти меры предотвращают наступление смертельного исхода, неясно, оказывают ли они какое-либо влияние на короткий срок выживания. В серии, состоящей из четырех пациентов с дефицитом КЛЛ, при лечении посредством пересадки костного мозга все четверо умерли вследствие осложнений в течение нескольких месяцев после пересадки. Хотя некоторый успех был описан в последующих историях болезни, коэффициент смертности остается высоким, и многим больным трансплантация не выполняется по причине их очень плохого состояния и низкой вероятности выживания при подготовке к трансплантации. Очень небольшое количество долгожителей, о которых сообщается, указывает на то, что коррекция дефицита фермента в гемопоэтических клетках является достаточным условием существенного улучшения клинического состояния при этой болезни. Обычно клиническая поддержка предоставляется через диетические ограничения при попытке ограничить накопление нетранспортабельных и неразлагающихся липидов, связанных с острыми проявлениями болезни, приводящими к смертельному исходу.
В настоящее время способы лечения фенотипа БНЭХ сосредоточены на симптоматической терапии через контроль аккумуляции липидов посредством диеты, исключающей продукты с высоким содержанием холестерина и триглицеридов, и подавления синтеза холестерина и образования аполипопротеина В через назначение лекарственных препаратов, понижающих уровень холестерина (например, статины и холестирамин). Хотя можно наблюдать некоторое клиническое улучшение, лежащая в основе проявления болезнь остается и развитие болезни продолжается.
Было предположено, что ферментозамещающая терапия с использованием рекомбинантной КЛЛ может быть жизнеспособным способом лечения дефицита кислой лизосомной липазы и соответствующих состояний (см. Meyers и др. (1985) Nutrition Res. (Исследование питания) 5(4):423-442; WO 9811206; и Besley (1984) Clinical Genetics (Клиническая генетика) 26:195-203). Некоторые исследования дефицита КЛЛ с использованием мышей продемонстрировали коррекцию некоторых отклонений от нормы у мышей с дефицитом КЛЛ (КЛЛ-/-) при введении высоких доз (более 1 миллиграмма на 1 килограмм массы тела) рекомбинантной человеческой КЛЛ один раз в каждые 3 дня (см., например, Grabowski US 2007/0264249). При проведении предыдущих исследований для коррекции отклонений у мышей с дефицитом КЛЛ предполагалось, что относительно большие количества и частое введение протеина рекомбинантной КЛЛ требуются для коррекции основных фенотипов. Также важно отметить, что в отличие от модели, использующей крыс с КЛЛ-/- и первоначально описанной Yoshida и Kuriyama (1990) Laboratory Animal Science (Исследование лабораторных животных), том 40, с.486-489, модель, использующая мышей с КЛЛ -/-, используемая в исследованиях выше, не имеет близкого сходства с БВ у людей в том смысле, что дефицит КЛЛ у мышей не приводит к нарушениям роста, наблюдающимся у людей.
На сегодняшний день экзогенная КЛЛ не назначалась людям и эффективная терапия, доступная для лечения дефицита КЛЛ, включая БВ, БНЭХ и другие болезни, отсутствует. Поэтому существует острая необходимость в способах лечения с минимизированной частотой введения лекарственных средств для повышения качества жизни пациентов. Дополнительно, желательно определение терапевтически эффективных доз для восстановления роста, нормализации функции печени, повышения концентрации КЛЛ в тканях и повышения активности КЛЛ у больных людей.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение основано на первых клинических случаях, когда пациентам-людям были успешно введены дозы экзогенной КЛЛ. Младенец, страдающий смертельной формой дефицита КЛЛ (болезнь Вольмана или ранняя стадия дефицита КЛЛ), был эффективно вылечен посредством введения экзогенной КЛЛ, и оценка безопасности замещающей терапии с использованием фермента КЛЛ была выполнена на группе пациентов-людей, страдающих поздней формой дефицита КЛЛ. Младенцу с ранним началом дефицита КЛЛ вводились еженедельно низкие дозы без проявления каких-либо неблагоприятных явлений или реакций. Резкие улучшения основных показателей состояния организма и клинических/лабораторных проверок эффективности наблюдались через одну-две недели после начального введения. Через 4 месяца еженедельного введения доз наблюдалось восстановление нормального роста младенца и значительное улучшение всех показателей, относящихся к дефициту КЛЛ, включая малабсорбцию, гепатомегалию и функцию печени. Взрослым больным с поздней формой болезни также вводились еженедельно дозы с небольшим количеством экзогенной КЛЛ без признаков неблагоприятных проявлений. Таким образом, клинические данные, собранные на сегодняшний день, показывают, что ферментозамещающая терапия с использованием экзогенной КЛЛ настоящего изобретения обеспечивает безопасное и эффективное лечение дефицита КЛЛ.
Соответственно, настоящее изобретение предоставляет способы лечения болезней или состояний, связанных с дефицитом КЛЛ у пациентов-людей, посредством введения эффективного количества экзогенной кислой лизосомной липазы (КЛЛ). Экзогенная КЛЛ может представлять собой рекомбинантную КЛЛ человека, имеющую структуру N-линейного гликана, содержащую, по меньшей мере, одну маннозу и/или маннозу-6-фосфат. Экзогенная КЛЛ эффективно интернализируется в лизосому, например, лимфоцитов, макрофагов и/или фибробластов.
В некоторых вариантах воплощения у пациента, страдающего дефицитом КЛЛ, диагностируется болезнь Вольмана (БВ). В одном варианте воплощения введение является достаточным для улучшения роста пациента с БВ. В одном варианте воплощения введение является достаточным для восстановления нормального роста пациента с БВ. В других вариантах воплощения у человека, страдающего дефицитом КЛЛ, диагностируется болезнь накопления эфиров холестерина (БНЭХ). Способы лечения в соответствии с настоящим изобретением могут применяться к пациентам-людям любого возраста.
В этой заявке также предоставляются способы лечения больного, страдающего дефицитом КЛЛ, введением ему рекомбинантной КЛЛ человека в эффективном количестве для улучшения функции печени. В некоторых вариантах воплощения введение является достаточным для нормализации результатов проверки печени. В одном варианте воплощения введение является достаточным для снижения уровней трансаминаз печени. Например, трансаминазы печени могут содержать сывороточную аспартатаминотрансферазу (ACT) и/или сывороточную аланинаминотрансферазу (АЛТ). В одном варианте воплощения введение является достаточным для минимизации гепатомегалии. В одном варианте воплощения введение является достаточным для уменьшения размера печени больного. В одном варианте воплощения введение является достаточным для снижения уровней ферритина сыворотки крови.
В одном варианте воплощения введение является достаточным для снижения уровней ферритина сыворотки крови, включая, например, уровни холестеринового эфира (ХЭ) и/или триглицеридов (ТГ).
Также предоставляется способ повышения активности КЛЛ у больного с дефицитом КЛЛ. Такой способ включает введение рекомбинантной КЛЛ человека больному для повышения активности КЛЛ, которая может быть определена, например, в лимфоцитах и/или фибробластах.
В одном варианте воплощения описывается способ лечения состояния, связанного с дефицитом КЛЛ, у больного посредством введения эффективного количества протеина экзогенной КЛЛ больному от одного раза каждые 5 дней до одного раза каждые 30 дней.
В некоторых вариантах воплощения больному, страдающему дефицитом КЛЛ, вводится доза от примерно 0,1 мг до примерно 50 мг экзогенной КЛЛ на килограмм массы тела. В одном варианте воплощения больному вводится доза от примерно 0,1 мг до примерно 10 мг экзогенной КЛЛ на килограмм массы тела. В одном варианте воплощения больному вводится доза от примерно 0,1 мг до примерно 5 мг экзогенной КЛЛ на килограмм массы тела.
В одном варианте воплощения доза введения составляет от примерно 0,1 мг/кг/ч до примерно 4 мг/кг/ч.
В некоторых вариантах воплощения больной лечится с использованием второго лекарственного средства. Второе лекарственное средство может включать, например, средство для снижения уровня холестерина (например, статин или эзетимиб), антигистамин (например, дифенгидрамин) или иммунодепрессант.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
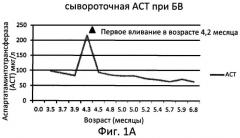
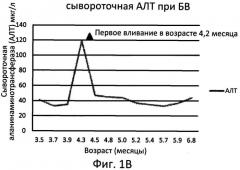
На Фигуре 1А показаны уровни сывороточной аспартатаминотрансферазы (ACT) у младенца-мальчика с болезнью Вольмана (т.е. с ранней формой дефицита КЛЛ), который получал еженедельно дозу экзогенной КЛЛ (SBC-102) (доза: 0,2 мг/кг (первоначальное введение; неделя 0); 0,3 мг/кг (неделя 1); 0,5 мг/кг (неделя 2); и 1,0 мг/кг (недели 3-8)). На Фигуре 1Б показаны уровни сывороточной аланинаминотрансферазы (АЛТ) у этого же больного. Возраст больного при первоначальном введении составлял 4 месяца и 1 неделю.
На Фигуре 2 показаны уровни ферритина сыворотки крови пациента с болезнью Вольмана, который получал еженедельно дозу экзогенной КЛЛ (SBC-102) (доза: 0,2 мг/кг (первоначальное введение; неделя 0); 0,3 мг/кг (неделя 1); 0,5 мг/кг (неделя 2); и 1,0 мг/кг (недели 3-8)). Возраст больного при первоначальном введении составлял 4 месяца и 1 неделю. Уровни ферритина сыворотки крови показаны с недели 1 после первоначального введения дозы в неделю 0.
На Фигуре 3 показана скорость роста пациента с болезнью Вольмана, который получал еженедельно дозу экзогенной КЛЛ (SBC-102) (доза: 0,2 мг/кг (первоначальное введение; неделя 0); 0,3 мг/кг (неделя 1); 0,5 мг/кг (неделя 2); и 1,0 мг/кг (недели 3-8)).
На Фигуре 4 показан график роста пациента с болезнью Вольмана (кг, проценты возрастной массы для мальчиков).
На Фигуре 5 показаны уровни сывороточной аспартатаминотрансферазы (ACT) у 41-летнего белого мужчины с БНЭХ, который получал еженедельные дозы 0,35 мг/кг экзогенной КЛЛ.
На Фигуре 6 показаны уровни сывороточной (АЛТ) у 41-летнего белого мужчины с БНЭХ, который получал еженедельные дозы 0,35 мг/кг экзогенного КЛЛ.
На Фигуре 7 показаны уровни сывороточного альбумина у 41-летнего белого мужчины с БНЭХ, который получал еженедельные дозы 0,35 мг/кг экзогенной КЛЛ.
На Фигуре 8 показаны уровни ферритина сыворотки крови у 41-летнего белого мужчины с БНЭХ, который получал еженедельные дозы 0,35 мг/кг экзогенной КЛЛ.
На Фигуре 9 показана скорость увеличения веса у четырех крыс-самцов одинакового возраста, каждой из которых вводилась экзогенная КЛЛ в соответствии с одним из следующих режимов введения: 1 мг на килограмм один раз в неделю, 5 мг на килограмм один раз в неделю, 5 мг на килограмм один раз в 2 недели или плацебо. Числа в колонках показываю возраст в днях.
На Фигуре 10 показаны результаты патологического и гистопатологического исследования крысы с дефицитом КЛЛ после лечения экзогенной КЛЛ и крысы с дефицитом КЛЛ после лечения плацебо. Макропатологическое исследование показало нормализацию цвета и размера печени у крыс после лечения экзогенной КЛЛ. Гистопатологическое исследование ткани печени крыс после лечения экзогенной КЛЛ показало существенно нормальную гистологию печени, резко отличающуюся от значительной аккумуляции пенистых макрофагов у животных, которым вводилось плацебо.
На Фигуре 11 показаны колокализация рекомбинантной КЛЛ человека (SBC-102) и лизосомный маркер в лизосомах ячеек, исследованных способом флуоресцентной микроскопии с использованием режима последовательного сканирования
На Фигуре 12 показана специфичность связи рекомбинантной КЛЛ человека (SBC-102) с рецептором N-ацетилглюкозамина/маннозы, оцениваемая посредством конкурентно-связывающего анализа с использованием клеточной линии макрофага, NR8383.
На Фигуре 13 показана активность рекомбинантной КЛЛ человека в нормальных клетках и клетках с дефицитом КЛЛ, in vitro.
На Фигуре 14 показано влияние лечения введением рекомбинантной КЛЛ человека на массу внутренних органов крыс с дефицитом КЛЛ. Размер органов представлен в процентах от массы тела, определенной в возрасте 8 недель, у крыс КЛЛ-/- и КЛЛ+/+ после еженедельного введения среды или SBC-102 в количестве 5 мг/кг в течение 4 недель.
На Фигуре 15 показана масса тела у дикого типа и крыс с дефицитом КЛЛ после введения среды или SBC-102 в количестве 5 мг/кг-1 в течение 4 недель. Введение доз показано на оси Х ромбиками, начиная с 4 недели.
На Фигуре 16 показаны уровни холестерина, холестеринового эфира и триглицерида в печени, определенные в возрасте 8 недель у крыс с БВ и дефицитом КЛЛ после еженедельного введения среды или SBC-102 в количестве 5 мг/кг-1 в течение 4 недель.
На Фигуре 17 показано увеличение массы тела в процентах у крыс с дефицитом КЛЛ.
На Фигуре 18 показана масса печени в процентах от массы тела у крыс с дефицитом КЛЛ после введения SBC-102 в течение 4 недель.
На Фигуре 19 показаны уровни холестеринового эфира в тканях крыс с дефицитом КЛЛ после введения SBC-102 в течение 4 недель.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение предоставляет способы лечения человека, страдающего болезнью или состоянием, чувствительными к введению экзогенной кислой лизосомной липазы.
Определения
Для удобства определенные термины, используемые в описании, примерах и прилагаемой формуле изобретения, формулируются в этой заявке для иллюстрирования и определения значений и границ применения различных терминов, используемых для описания настоящего изобретения.
«КЛЛ» в соответствии с использованием в данной заявке относится к «кислой лизосомной липазе», и два термина используются взаимозаменяемо в описании. КЛЛ может представлять собой протеин человека, т.е. кислую лизосомную липазу человека. Термин «SBC-102» в соответствии с использованием в данной заявке относится к рекомбинантной кислой лизосомной липазе человека. Термин КЛЛ также относится к таким веществам, представленным в литературе, как гидролаза кислого холестерилового эфира, эстераза холестерила, Липаза А, ЛИП А, и эстераза стерола.
КЛЛ катализирует гидролиз холестериновых эфиров и триглицеридов до свободного холестерина, глицерина и свободных жирных кислот. Таким образом, «активность КЛЛ» может быть измерена, например, как расщепление флуорогенного субстрата, 4-метилумбеллиферилового олеата (4МУО). Расщепление 4МУО может быть обнаружено, например, посредством возбуждения при длине волны 360 нм и эмиссии при 460 нм свободного флюорофора, 4-метилумбеллиферила (4МУ). Результаты могут быть представлены в относительных единицах флуоресценции (ОЕФ). Например, количество субстрата, расщепленного при 30-минутном исследовании по конечной точке, может быть определено количественно относительно эталонной кривой 4МУ, и одна единица (Е) активности может быть определена как количество фермента, необходимого для расщепления 1 микромоля 4МУО в минуту при 37°С. Соответственно, функциональные фрагменты вариантов КЛЛ включают фрагменты, содержащие активность КЛЛ, например, способность гидролизовать эфиры холестерина и/или триглицериды.
В соответствии с использованием в данной заявке «экзогенная КЛЛ» относится к КЛЛ, которая не вырабатывается больным естественным образом. Например, экзогенная КЛЛ включает протеин рекомбинантной КЛЛ, который вводится больному, протеин КЛЛ, который выделяется у человека или животного и вводится больному, и протеин КЛЛ, который вырабатывается (т.е. выражается) у больного в результате введения КЛЛ-кодирующей РНК и/или ДНК или другого лечения, повышающего экспрессию протеина экзогенной КЛЛ.
«Внутривенная инъекция» часто рассматривается как внутривенное струйное введение или быстрое введение дозы вещества и относится к способу введения, когда шприц подсоединяется к устройству доступа к вене, и препарат вводится непосредственно, обычно быстро, но иногда до 15 минут, если введение может привести к раздражению вены или эффекту слишком быстрого введения. После введения препарата в это устройство необходимы некоторые средства для обеспечения его введения в организм пациента. Обычно это достигается обеспечением условия свободного протекания жидкой среды, переносящей препарат в кровяное русло. Однако в некоторых случаях после первого введения используется вторая инъекция жидкой среды, часто называемая «промыванием», для облегчения попадания препарата в кровяное русло.
«Внутривенное вливание» относится к способу введения, при котором препарат вводится в течение продолжительного периода времени. Например, препарат может вводиться больному в течение от 1 до 8 часов. Препарат также может вводиться больному в течение примерно 1, примерно 2, примерно 3, примерно 4, примерно 5, примерно 6, примерно 7 или примерно 8 часов. Для осуществления внутривенного вливания может использоваться капельница для введения препарата самотеком или насос для внутривенного вливания. Внутривенное вливание обычно используется в тех случая, когда больному требуется введение препарата только в определенные периоды времени и не требуется введение дополнительных веществ (например, водных растворов, которые могут содержать натрий, хлорид, глюкозу или их какую-либо комбинацию), которые восстанавливают уровень электролиты, содержание сахара в крови, компенсируют потери воды.
Термин «птичий» в соответствии с использованием в данной заявке относится к каким-либо видам, подвидам или расам организма птиц таксономического класса, таких как, но ограничиваясь ими, курицы, индюки, утки, гуси, перепелки, фазаны, попугаи, вьюрки, ястребы, вороны и бескилевые птицы, включая страусов, эму и казуаров. Термин включает различные известные расы Gallus gallus, или куриц (например, белый леггорн, бурый леггорн, полосатый рок, Суссекс, нью-гемпшир, род-айленд, австралорп, минорка, амрокс, калифорнийская серая), так же как и расы индюков, фазанов, перепелок, уток, страусов и другой домашней птицы, обычно разводимой в товарных количествах. Термин также включает индивидуальный организм птицы на всех этапах развития, в том числе зародышевое и плодное состояние.
Термин «полученный из домашней птицы» или «полученный из птицы» относится к композиции или веществу, произведенному или полученному из домашней птицы. Термин «домашняя птица» относится к птицам, которые можно содержать в качестве домашних животных, включая, но ограничиваясь ими, куриц, уток, индюков, перепелок и бескилевых птиц. Например, термин «полученный из домашней птицы» может относиться к веществу, полученному из курицы, полученному из индюка и/или полученному из перепелки.
Термин «пациент» в соответствии с использованием в данной заявке относится к любому человеку, который получает, или получил, или будет получать медицинскую помощь или лечение, например, в соответствии с предписанием провайдера медицинской помощи.
Термин «терапевтически эффективная доза» в соответствии с использованием в данной заявке относится к дозе (например, количеству и/или интервалу) лекарственного средства, которая должна обеспечить намеченную терапевтическую реакцию. Терапевтически эффективная доза относится к дозе, результатом введения которой при сравнении с соответствующим субъектом, который не получил такую дозу, является улучшение процесса лечения, излечение, предотвращение или снижение интенсивности болезни, расстройства или побочного эффекта, или снижение частоты проявления, или предупреждение болезни или расстройства. Термин также включает в своих границах применения дозы, являющиеся эффективными для улучшения физиологических функций.
Термины «лечить», «врачевание» и «лечение» относятся к способам облегчения, смягчения или улучшения течения болезни или ее проявления, предотвращения дополнительного симптома, смягчение или предотвращение лежащей в основе причины проявления, подавления болезни или состояния, купирования развития болезни или состояния, облегчения болезни или состояния, стимулирование обратного развития болезни или состояния, облегчение состояния, вызванного болезнью или состоянием или прекращения симптома болезни или состояния профилактически и/или после проявления симптома.
В соответствии с использованием в данной заявке с указанием конкретной дозы «кг-1», «на кг», «/кг» и «на килограмм» означает «на килограмм массы тела» млекопитающего, и эти термины могут использоваться взаимозаменяемо.
В соответствии с использованием в данной заявке термин «полипептид» предназначен для охвата «полипептида» в единственном числе, а также «полипептидов» во множественном числе и относится к молекуле, состоящей из мономеров (аминокислот), линейно связанных амидными связями (также известными как пептидные связи). Термин «полипептид» относится к любой цепи или цепям из двух или более аминокислот и не относится к конкретной длине продукта. Таким образом, пептиды, дипептиды, трипептиды, олигопептиды, «протеины», «цепи аминокислот» или какие-либо другие термины, используемые для цепи или цепей из двух или более аминокислот, включены в рамки понятия «полипептид» и термин «полипептид» может использоваться вместо любого из этих терминов или взаимозаменяемо. Термин «полипептид» также предназначен для продуктов модификации полипетида после экспрессии, включая без ограничения гликозилирование, ацетилирование, фосфорилирование, амидирование, дериватизацию известными защищающими/блокирующими группами, протеолитическим расщеплением или модификацией аминокислот неестественного происхождения. Полипептид может быть получен из естественного биологического источника или произведен с использованием рекомбинантной технологии, но не обязательно путем трансляции с назначенной последовательности нуклеиновой кислоты. Он может генерироваться любым способом, включая химический синтез.
В соответствии с использованием в данной заявке относительная гомология между двумя аминокислотными последовательностями или двумя нуклеотидными последовательностями эквивалентна относительной идентичности двух последовательностей. Относительная идентичность двух последовательностей является функцией количества идентичных позиций, общих для последовательностей (т.е. % гомология = количество идентичных позиций / общее количество позиций × 100), учитывая количество разрывов и длину каждого разрыва, которые необходимо ввести для оптимального совмещения двух последовательностей. Сравнение последовательностей и определение относительной идентичности двух последовательностей может быть осуществлено с использованием математического алгоритма, как описано в примерах ниже, не имеющих ограничительного характера.
Относительная идентичность двух аминокислотных последовательностей может быть определена с использованием алгоритма Мейера и Миллера (Е. Meyers и W. Miller (Comput. Appl. Biosci, 4:11-17 (1988)), который был введен в программу ALIGN (версия 2.0), используя весовую таблицу остатка РАМ 120, коэффициент длины разрыва 12 и коэффициент разрыва 4. В дополнение, относительная идентичность двух аминокислотных последовательностей может быть определена, используя алгоритм Нидльмана и Ванша (Needleman и Wunsch (J. Mol, Biol. 48:444-453 (1970)), который был введен в программу GAP пакета программного обеспечения GCG (http://www.gcg.com), используя или матрицу Блоссома 62 или матрицу РАМ250 и весовой коэффициент разрыва 16, 14, 12, 10, 8, 6, или 4 весовой коэффициент длины 1, 2, 3, 4, 5 или 6.
«Изолированный» полипептид или фрагмент, вариант или производный продукт является назначенным полипептидом, который не находится в естественной среде. Конкретный уровень очистки не требуется. Например, изолированный полипептид может быть извлечен из собственной или естественной среды. Произведенные рекомбинантно полипептиды и протеины, выраженные в клетках-хозяевах, рассматриваются как изолированные, как раскрывается в данной заявке, как собственные или рекомбинантные полипептиды, которые были сепарированы, фракционированы или частично или в основном очищены любым пригодным способом.
Другие полипептиды, раскрываемые в данной заявке, представляют собой фрагменты, производные, аналоги или варианты вышеупомянутых полипептидов и их любых комбинаций. Термины «фрагмент», «вариант», «производная» и «аналог» при обращении к любому из полипептидов, раскрываемых в данной заявке, включают любые полипептиды, которые сохраняют, по меньшей мере, некоторую активность соответствующего собственного полипептида (например, фрагменты, варианты, производные и аналоги полипептидов КЛЛ, которые сохраняют способность гидролизовать эфиры холестерина и/или триглицериды). Фрагменты полипептидов включают, например, протеолитические фрагменты, а также фрагменты делеций. Варианты полипептида включают фрагменты, как описано выше, а также полипептиды с измененными аминокислотными последовательностями вследствие аминокислотных замещений, удалений или вставок. Варианты могут иметь естественное или неестественное происхождение. Варианты неестественного происхождения могут быть произведены, используя известные способы мутагенеза. Вариантные полипептиды могут включать консервативные или неконсервативные аминокислотные замещения, удаления или вставки. Производные представляют собой полипептиды, которые были изменены до появления дополнительных свойств, отсутствующих и собственных полипептидов. Примеры включают гибридные белки. Вариантные полипептиды могут также именоваться как «полипептидные аналоги». В соответствии с использованием в данной заявке, «производная» исходного полипептида может содержать один или более остатков, полученных химическим способом посредством реакции функциональной боковой группы. К «производным» также относятся пептиды, содержащие одну или более аминокислотных производных естественного происхождения двадцати стандартных аминокислот. Например, 4-гидроксипролин может быть замещен пролином; 5-гидроксилизин может быть замещен лизином; 3-метилгистидин может быть замещен гистидином; гомосерин может быть замещен серином; и/или орнитин может быть замещен лизином.
Термин «полинуклеотид» предназначен для охвата нуклеиновой кислоты в единственном числе, а также нуклеиновых частот во множественном числе и относится к изолированной молекуле или конструкции нуклеиновой кислоты, например информационной РНК (иРНК) или плазмидной ДНК (пДНК). Полинуклеотид может включать традиционную фосфодиэфирную связь или нетрадиционную связь (например, амидную связь, такую как обнаруженную в пептидной нуклеиновой кислоте (ПНК). Термин «нуклеиновая кислота» относится к какому-либо одному или более сегментам нуклеиновой кислоты, например фрагментам ДНК или РНК, присутствующим в полинуклеотиде. «Изолированная» нуклеиновая кислота или «изолированный» нуклеотид представляет собой молекулу нуклеиновой кислоты, ДНК или РНК, которая была извлечена из собственной среды. Например, рекомбинантный полинуклеотид, кодирующий КЛЛ, содержащуюся в векторе, рассматривается как изолированный для целей настоящего изобретения. Дополнительные примеры изолированного полинуклеотида включают рекомбинантные полинуклеотиды, содержащиеся в гетерологичных клетках-хозяевах, или очищенные (частично или в основном) полинуклеотиды в растворе. Изолированные молекулы РНК включают in vivo или in vitro транскрипты РНК полинуклеотидов в соответствии с настоящим изобретением. Изолированные полинуклеотиды или нуклеиновые кислоты в соответствии с настоящим изобретением дополнительно включают такие молекулы, полученные искусственно. В дополнение, полинуклеотид или нуклеиновая кислота может быть регуляторным элементом или включать такой элемент, например промотор, участок связывания рибосом или терминатор транскрипции.
В соответствии с использованием в данной заявке «кодирующая область» представляет собой часть нуклеиновой кислоты, состоящую из кодонов, транслируемых в аминокислоты. Хотя «стоп-кодон» (ТАГ, ТГА или ТАА) не транслируется в аминокислоту, он может рассматриваться как часть кодирующей области, но какие-либо фланкирующие последовательности, например промоторы, участки связывания рибосом, терминаторы транскрипции, интроны и подобные им, не являются частью кодирующей области. Две или более кодирующие области в соответствии с настоящим изобретением могут быть представлены в одной полинуклеотидной конструкции, например на одиночном векторе, или в отдельных полинуклеотидных конструкциях, например на отдельных (разных) векторах. Кроме того, любой вектор может содержать одну кодирующую область или может включать две или более кодирующие области. В дополнение, вектор, полинуклеотид или нуклеиновая кислота в соответствии с настоящим изобретением может кодировать гетерологичные кодирующие области, слившиеся или неслившиеся с нуклеиновой кислотой, кодирующей полипептид КЛЛ или фрагмент, вариант или производную от них. Гетерологичные кодирующие области включают без ограничения специальные элементы или мотивы, такие как секреторный сигнальный пептид или гетерологичный функциональный домен.
Различные области управления транскрипцией известны специалистам в этой области. Эти области включают, без ограничения, области управления транскрипцией, функционирующие в клетках позвоночных, такие как, но не ограничивающиеся ими, сегменты промотора и усилителя с цитомегаловируса (непосредственный ранний промотор, совместно с итроном-А), вакуолизирующего обезьяньего вируса 40 (ранний промотор) и ретровирусов (таких, как вирус саркомы Рауса). Другие области управления транскрипцией включают области, полученные с генов позвоночных, такие как актин, белок теплового шока, гормон роста крупного рогатого скота, В-глобин кролика, а также другие последовательности, способные управлять экспрессией гена эукариотических клеток. Дополнительные подходящие области управления транскрипцией включают тканеспецифичные промоторы и усилители, а также лимфокин-индуцируемые промоторы (например, промоторы, индуцируемые интерферонами или интерлейкинами).
Подобно этому различные элементы управления транскрипцией известны специалистам в этой области. Эти элементы включают, но не ограничиваются ими, участки связывания рибосом, кодоны инициирования и прекращения трансляции и элементы, полученные с пикорнавирусов (в частности, с внутреннего участка связывания рибосом (ВУСР), также называемого последовательностью CITE).
В других вариантах воплощения изобретения полинуклеотид в соответствии с настоящим изобретением представляет собой РНК, например, в виде информационной РНК (иРНК).
Кодирующие области полинуклеотида и нуклеиновой кислоты в соответствии с настоящим изобретением могут быть связаны с дополнительными кодирующими областями, которые кодируют секреторные или сигнальные пептиды, направляющие секрецию полипептида, кодированного полинук