Способ получения дисульфанилтетрациклоалкенов
Иллюстрации
Показать всеИзобретение относится к способу получения дисульфанилтетрациклоалкенов общей формулы (1). Сущность способа заключается в том, что к предварительно полученной при 20°C в течение 30 мин смеси формальдегида с сероводородом или α,ω-дитиолом добавляют дициклопентадиен и катализатор Hf(acac)4 при мольном соотношении формальдегид : сероводород : ДЦПД : Hf(acac)4 = 20:10:10:(0.3-0.7) или формальдегид : α,ω-дитиол: ДЦПД : Hf(acac)4 = 10:10:10:(0.3-0.7) с последующим перемешиванием при температуре 75-85°C и атмосферном давлении в смеси растворителей хлороформ - этанол (объемн. 1:1) в течение 5-7 ч. 1 табл., 2 пр.
Реферат
Предлагаемое изобретение относится к области органической химии, в частности к способу получения дисульфанилтетрациклоалкенов общей формулы (1
(1), где n=1 (1а), 2 (1б), 3 (1в), 4 (1г).
Подобные S-содержащие тетрациклические соединения могут найти применение в качестве присадок к каучукам, товарным смолам, циклическим сополимерам олефинов, а также в качестве норборненовых химических веществ со свойствами антипиренов, агрохимикатов, антиоксидантов для резин [R.E. Kirk, D.F. Othmer. Dicyclopentadiene. Kirk-Othmer encyclopedia of chemical technology. New York: Wiley-Interscience. 1978, V.7, p.417-429. М.Б. Чепурнов, В.Т. Мельников, В.М. Школьников. Состояние производств пластичных смазок в России. Мир нефтепродуктов. Вестник нефтяных компаний. М.: Техинформ, 2005, №3. С.3].
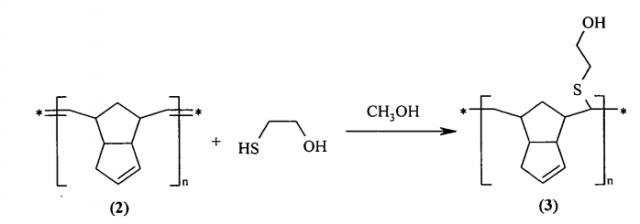
Известен способ [A.D. Martina, L. Garamszegi, J.G. Hilborn. Surface functionalization of cross-linked poly(dicyclopentadiene). Reactive & Functional Polymers, 2003, 57, 49-55] присоединения к двойной связи полидициклопентадиена (2) гидроксиэтантиола в присутствии 0.2% масс. перекиси бензоила в кипящем метаноле с образованием привитого полимера (3), имеющего поперечный сульфидный мостик с алкилгидроксильной группой на конце.
Известным способом не могут быть получены дисульфанилтетрациклоалкены общей формулы (1).
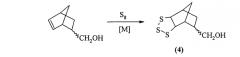
Известен способ [Г.Н. Кириченко, В.И. Глазунова, А.А. Десяткин, А.Г. Ибрагимов, У.М. Джемилев. Синтез новых полифункциональных присадок к смазочным маслам. ЖПХ, 2009, Т.82, №1. С.94-98] получения 8-метилол-3,4,5-трисульфанилтрицикло-[5.2.1.02,6]декана (4) взаимодействием 2-метилолбицикло[2.2.1.]гепт-2-ена с трехкратным избытком циклооктасульфана (S8) в присутствии каталитического количества (3 мол%) 1-(N,N-диметиламинометил)-1,2,4-триазола или (2 мол.%) комплекса нитрата самария и пиридина с выходом 65-90% по схеме:
Известный способ не позволяет получать дисульфанилтетрациклоалкены общей формулы (1).
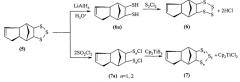
Известен многостадийный способ [М. Kustos, R. Steudel. J. Org. Chem., 1995, 60, 8056-8061] получения тетрасульфанилтетрациклодецена (6) и нестабильного тетрациклического полисульфида (7) из трисульфанилтетрациклодецена (5), который трансформируют под действием литий алюмогидрида в димеркапто- (6а) и под действием тионилдихлорида в дихлордисульфидные (7а) производные ДЦПД. Реакцией (6а) с дихлордисульфидом в диэтиловом эфире при 0°C получают тетрасульфанилтетрациклодецен (6) и реакцией (7а) с титаноценпентасульфидом в CS2 при температуре 0°C получают полисульфид (7) по схеме:
Известный способ не позволяет получать дисульфанилтетрациклоалкены общей формулы (1).
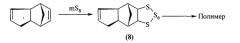
Известна реакция [М.В. Рылова, А.Я. Самуилов, Д.Р. Шарафутдинова, Ю.Я. Ефремов, Г.М. Храпковский, Я.Д. Самуилов. Взаимодействие дициклопентадиена с элементной серой. Начальные стадии реакции. Химия и компьютерное моделирование. Бутлеровские сообщения. 2002, №9. С.29-32] гетероциклизации дициклопентадиена (ДЦПД) с элементной серой, протекающая с участием норборненовой двойной связи с образованием циклического полисульфида (8), который легко превращается в полимер по схеме:
Известный способ не позволяет получать дисульфанилтетрациклоалкены общей формулы (1).
Известен способ [P.D. Bartlett, Т. Grosh, Sulfuration of the norbornene double bond. J. Org. Chem., 1987, 52, 4937-4943] получения трисульфанилтетрациклодецена (5) реакцией ДЦПД с элементной серой в присутствии каталитического количества аммиака (10 мол.%) в диметилформамиде при температуре 110°C по схеме:
Известный способ не позволяет получать дисульфанилтетрациклоалкены общей формулы (1).
Таким образом, в литературе отсутствуют сведения о получении дисульфанилтетрациклоалкенов общей формулы (1).
Предлагается новый способ получения дисульфанилтетрациклоалкенов общей формулы (1).
Сущность способа заключается в предварительном перемешивании формальдегида (37% водный раствор) с сероводородом или α,ω-дитиолом общей формулы R-SH, где R=H, C2H4SH, C3H6SH, C4H8SH, при комнатной температуре (~ 20°C) в течение 30 мин с последующим добавлением дициклопентадиена (ДЦПД) и катализатора ацетилацетоната гафния Hf(acac)4, взятых в мольном соотношении формальдегид : сероводород : ДЦПД : Hf(acac)4 = 20:10:10:(0.3-0.7), предпочтительно 20:10:10:0.5 или формальдегид : дитиол : ДЦПД : Hf(acac)4 = 10:10:10:(0.3-0.7), предпочтительно 10:10:10:0.5, в растворителе CHCl3:C2H5OH (объемн. 1:1). Смесь перемешивают при температуре 75-85°C, предпочтительно при 80°C, и атмосферном давлении в течение 5-7 ч, выделяют дисульфанилтетрациклоалкены общей формулы (1) с выходом 53-79%. Реакция протекает по схеме:
Дисульфанилтетрациклоалкены общей формулы (1) образуются только лишь с участием формальдегида, сероводорода или α,ω-дитиола и ДЦПД, взятых в стехиометрическом соотношении. При другом соотношении исходных реагентов снижается выход целевого продукта (1). Без катализатора выход продукта (1) не превышает 40%.
Проведение указанной реакции в присутствии катализатора Hf(acac)4 больше 7 мол.% не приводит к существенному увеличению выхода целевого продукта (1). Использование катализатора Hf(acac)4 менее 3 мол% снижает выход (1), что связано, возможно, со снижением каталитически активных центров в реакционной массе. Реакцию проводили при температуре 80°C. При температуре ниже 75°C (например, 40°C), снижается скорость реакции. При температуре выше 85°C (например, 100°C) увеличиваются энергозатраты.
Существенные отличия предлагаемого способа.
В предлагаемом способе в качестве исходных реагентов применяются коммерчески доступные дициклопентадиен (ДЦПД), формальдегид, сероводород или α,ω-дитиол, а в качестве катализатора - ацетилацетонат гафния. Способ позволяет получать дисульфанилтетрациклоалкены общей формулы (1). В известном способе в качестве исходных реагентов применяются ДЦПД и элементная сера S8, а в качестве катализатора - аммиак. В результате реакции образуется трисульфанилтетрациклодецен (5). Известным способом не могут быть получены дисульфанилтетрациклоалкены общей формулы (1).
Способ поясняется следующими примерами
Пример 1: В стеклянный реактор, установленный на магнитной мешалке, снабженный газоподводящей трубкой при комнатной температуре (~ 20°C) помещают 2.5 мл CHCl3 и 2.5 мл C2H5OH, 1.47 мл (20 ммоль) формальдегида (37% водный раствор), насыщают сероводородом (20 ммоль) в течение 30 мин, добавляют 1.32 г (10 ммоль) ДЦПД и 0.29 г (0.5 ммоль) Hf(acac)4, перемешивают при 80°C в течение 6 ч. Из реакционной массы выделяют 4,6-дисульфанилтетрацикло [6.5.1.0.2,7.09,13]тетрадец-11-ен (1а) с выходом 69%.
Пример 2. В сосуд Шленка, установленный на магнитной мешалке, в атмосфере аргона при комнатной температуре (~ 20°C) помещают 0.74 мл (10 ммоль) формальдегида (37% водный раствор), 0.84 мл (10 ммоль) 1,2-этандитиола и перемешивают в течение 30 мин, добавляют 1.5 мл CHCl3 и 1.5 мл C2H5OH, 1,32 г (10 ммоль) дициклопентадиена, и 0.29 г (0.5 ммоль) Hf(acac)4, нагревают до 80°C, перемешивают в течение 6 ч. Из реакционной массы выделяют 4,7-дисульфанилтетрацикло[7.5.1.02,8.010,14]пентадец-12-ен (1б) с выходом 74%.
Другие примеры, подтверждающие способ, приведены в таблице:
| № п/п | Исходный H2S или α,ω-дитиол | Соотношение формальдегид: H2S или α,ω-дитиол : ДЦПД : Hf(acac)4, ммоль | Время реакции, ч | Температура, °C | Выход (1), % |
| 1 | H2S | 20:20:10: 0.5 | 6 | 80 | 69 |
| 2 | 1,2-этандитиол | 10:10:10:0.5 | 6 | 80 | 74 |
| 3 | -//- | 10:10:10:0.7 | 6 | 80 | 79 |
| 4 | -//- | 10:10:10:0.3 | 6 | 80 | 53 |
| 5 | -//- | 10:10:10:0.5 | 5 | 80 | 61 |
| 6 | -//- | 10:10:10:0.5 | 6 | 75 | 65 |
| 7 | -//- | 10:10:10:0.5 | 6 | 85 | 76 |
| 8 | -//- | 10:10:10:0.5 | 7 | 80 | 77 |
| 9 | 1,3-пропандитиол | 10:10:10:0.5 | 6 | 80 | 78 |
| 10 | 1,4-бутандитиол | 10:10:10:0.5 | 6 | 80 | 67 |
Все опыты проводились в смеси растворителей хлороформ - этанол (объемн. 1:1).
Спектральные характеристики соединений дисульфанилтетрациклоалкенов
Контроль реакции осуществляли методом ТСХ на пластинках Silufol W-254, проявляли парами I2. Для колоночной хроматографии использовали силикагель КСК (100-200 мкм). Спектры ЯМР 1D (1H, 13C) и 2D (COSY, NOESY, HSQS, HMBC) сняты на спектрометре Bruker Avance 400 (100.62 МГц для 13C и 400.13 для 1H) по стандартным методикам фирмы Bruker, внутренний стандарт Me4Si, растворитель - CDCl3. Масс-спектры высокого разрешения получены на приборе MALDI TOF AUTOFLEX III фирмы Bruker.
4,6-Дисульфанилтетрацикло[6.5.1.02,7.09,l3]тетрадец-11-ен (1а):
Элюент гексан : этилацетат : хлороформ (2:4:1), Rf 0.7. ИК-спектр (ν, см-1): 685-738, 947, 1268, 1439, 2951, 3042, 3401. Спектр ЯМР 1H, δ, м.д.: 1.21 (м., 2H, CH2 (14)); 1,74 (кв., H, CH (2)); 1.83 (д., H, CH (7)); 2.17 (м., H, CH (1)); 2.30 (м., 2H, CH2 (10)); 2.61 (м., H, CH (8)); 2.66 (м., H, CH (2)); 2.78 (уш. с., 2H, CH2 (3)); 2.95 (м., H, CH (13)); 3.03-3.14 (с., 2H, CH2 (5)); 5.55 (уш. с., H, CH (11)); 5.70 (уш. с., H, CH (12). Спектр ЯМР 13C, δ, м.д.: 31.67 (т., C-14); 32.33 (т., C-3); 34.72 (т., C-10); 35.54 (т., C-2); 37.91 (т., C-8); 38.71 (т., C-1); 45.14 (т., C-9); 47.23 (т., C-5); 52.08 (д., C-7); 53.31 (к., C-13); 130.42 (т., C-13); 132.57 (т., C-14). MALDI TOF, m/z: 228.207 [М+3H]+. C12H26S2. M 224.357.
4,7-Дисульфанилтетрацикло[7.5.1.02,8.010,14]пентадец-12-ен (1б):
Элюент гексан : этилацетат : хлороформ (2:4:1), Rf 0.7. ИК-спектр (ν, см-1): 687-738, 944, 1268, 1441, 2951, 3042, 3407. Спектр ЯМР 1H δ, м.д.: 1.56 (т., 2H, CH2 (15)); 2,05 (кв., H, CH (2)); 2.10 (д., H, CH (8)); 2.21 (м., H, CH (1)); 2.27 (т., 2H, CH2 (11)); 2.38 (м., H, CH (9)); 2.64 (м., H, CH (2)); 2.70 (т., 2H, CH2 (5)); 2.91 (т., 2H, CH2 (6)); 5.50 (кв., H, CH (12)); 5.67 (т., H, CH (13). Спектр ЯМР 13C, δ, м.д.: 31.55 (т., C-15); 32.44 (т., C-3); 42.95 (д., C-2); 45.79 (д., C-10); 50.05 (д., C-8); 58.32 (д., C-14); 130.36 (д., C-12); 133.19 (д., C-13). MALDI TOF, m/z : 239.009 [M+H]+. C13H18S2. M 238.415.
4,8-Дисульфанилтетрацикло[8.5.1.02,9.011,15]гексадец-13-ен (1в):
Элюент гексан : этилацетат : хлороформ (2:4:1), Rf 0.6. ИК-спектр (ν, см-1): 662-737, 944, 1260, 2950, 3402. Спектр ЯМР 1H, δ, м.д.: 1.45 (т., 2H, CH2 (16)); 1.83 (м., 2H., CH2 (6)); 2.14 (кв., H, CH (2)); 2.14 (д., H, CH (9)); 2.29 (м., H, CH (1)); 2.31 (м., H, CH (10)); 2.55 (д., 2H, CH2 (12)); 2.62 (т., 2H, CH2 (5)); 2.77 (т., 2H, CH2 (7)); 2.80 (д., 2H, CH2 (3)); 5.52 (кв., H, CH (13)); 5.67 (т., H, CH (14)). Спектр ЯМР 13C, δ, м.д.: 31.35 (т., C-6); 31.89 (т., C-5); 32.09 (т., C-7); 35.12 (т., C-16); 38.60 (д., C-10); 41.53 (д., C-1); 45.30 (д., C-2); 52.04 (д., C-9); 130.44 (д., C-13); 132.54 (д., C-14). MALDI TOF, m/z : 253.311 [М+Н]+. C14H20S2. M 252.443.
4,9-Дисульфанилтетрацикло[9.5.1.02,10.012,16]гептадец-14-ен (1 г):
Элюент гексан : этилацетат : хлороформ (2:4:1), Rf 0.6. ИК-спектр (ν, см-1): 661-738, 945, 1276, 1454, 2949, 3042. Спектр ЯМР 1H, δ, м.д.: 1.10 (т., 2H, CH2 (17)); 1.78 (м., 4H, CH2 (6, 7)); 2.17 (т., H, CH (10)); 2.19 (м., H, CH (2)); 2.23 (т., 2H, CH2 (13)); 2.26 (м., H, CH (1)); 2.33 (м., H, CH (11)); 2.69 (м., H, CH (12)); 2.76 (т., 2H, CH2 (5)); 2.77 (т, 2H, CH2 (8)); 2.77 (д., 2H., CH2 (3)); 5.52 (кв., H, CH (14)); 5.54 (т., H, CH (15)). Спектр ЯМР 13C, δ, м.д.: 31.58 (т., C-6); 31.65 (т., C-7); 31.88 (т., C-8); 32.09 (т., C-5); 33.14 (т., C-17); 35.12 (д., C-11); 38.61 (т., C-3); 41.53 (д., C-1); 45.27 (д., C-2); 47.27 (д., C-12); 53.30 (д., C-10); 130.42 (д., C-14); 132.56 (д., C-15). MALDI TOF, m/z: 266.207 [M]+. C15H22S2. M 266.469.
Способ получения дисульфанилтетрациклоалкенов общей формулы (1): (1), где n=1 (1a), 2 (1б), 3 (1в), 4 (1г),отличающейся тем, что к предварительно полученной при комнатной температуре (~20°C) в течение 30 мин смеси формальдегида с сероводородом или α,ω-дитиолом добавляют дициклопентадиен (ДЦПД) и катализатор Hf(acac)4 при мольном соотношении формальдегид : сероводород : ДЦПД : Hf(acac)4 = 20:10:10:(0.3-0.7) или формальдегид : α,ω-дитиол: ДЦПД : Hf(acac)4 = 10:10:10:(0.3-0.7) с последующим перемешиванием при температуре 75-85°C и атмосферном давлении в смеси растворителей хлороформ - этанол (объемн. 1:1) в течение 5-7 ч.