Аминопиразол триазолотиадиазольные ингибиторы протеинкиназы с-мет
Иллюстрации
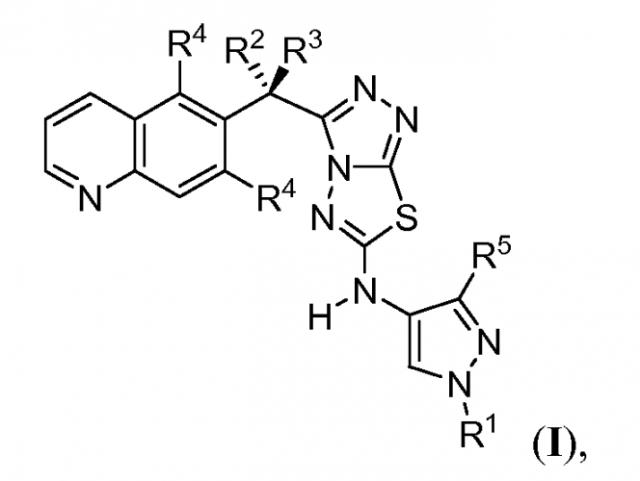
Показать всеИзобретение относится к соединениям формулы (I), в которой R1 представляет собой метил или этил, R2 представляет собой водород, фтор или метил, R3 представляет собой водород, фтор или метил, каждый R4 представляет собой водород и R5 представляет собой водород, метил. Также изобретение относится к фармацевтической композиции для лечения или уменьшения степени тяжести пролиферативного нарушения на основе соединений формулы (I). Технический результат - соединения полезны при получении лекарственного средства для лечения или уменьшения степени тяжести метастатического рака, глиобластомы, карциномы желудка или рака, выбранного из рака толстой кишки, груди, простаты, мозга, печени, поджелудочной железы или легкого и гепатоцеллюлярной карциномы. 3 н. и 13 з.п. ф-лы, 4 табл., 6 пр.
Реферат
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к селективным ингибиторам c-Met. Изобретение также обеспечивает фармацевтически приемлемые композиции, содержащие ингибитор c-Met, и способы применения композиций при лечении различных пролиферативных нарушений.
УРОВЕНЬ ТЕХНИКИ
Фактор роста гепатоцитов (HGF), также известный как рассеивающий фактор, представляет собой многофункциональный фактор роста, который увеличивает превращение и развитие опухоли, вызывая митогенез и подвижность клеток. Дополнительно HGF обеспечивает метастаз, стимулируя подвижность клетки и инвазию с помощью различных сигнальных путей. Для получения клеточных эффектов HGF должен связаться с его рецептором, рецептором тирозинкиназы c-Met. c-Met, широко экспрессированный гетеродимерный протеин, содержащий 50 килодальтон (кДа) α-субъединицы и 145 кДа альфа-субъединицы (Maggiora et al., J. Cell Physiol., 173:183-186, 1997), сверхэкспрессирован в значительном процентном соотношении раковых образований человека и амплифицируется в течение перехода между первичными опухолями и метастазами. Различные раковые образования, с которыми связана сверхэкспрессия c-Met, включают, но не ограничиваются ими, аденокарциному желудка, рак почек, мелкоклеточный рак легкого, колоректальный рак, рак простаты, рак мозга, рак печени, рак поджелудочной железы и рак груди. c-Met также связан с атеросклерозом и фиброзом легких.
Соответственно, существует большая потребность в развитии соединений, пригодных в качестве ингибиторов рецептора протеинкиназы c-Met. В частности, предпочтительные соединения должны иметь высокую аффинность к рецептору c-Met и проявлять функциональную активность в качестве антагонистов, при этом обладая небольшой аффинностью к другим рецепторам киназы или целям, которые, как известно, связаны с побочными эффектами.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Было обнаружено, что 3-(хинолин-6-ил)метил-N-(1H-пиррол-3-ил)-[1,2,4]триазоло[3,4-b][1,3,4]тиадиазол-6-амины эффективны при ингибировании c-Met.
Соответственно, изобретение обеспечивает соединение, имеющее формулу:
или его фармацевтически приемлемую соль, в которой каждый или R1, R2, R3, R4 и R5 представляет собой, как определено в другом месте в настоящем описании.
Изобретение также обеспечивает фармацевтические композиции, которые включают соединение формулы I и фармацевтически приемлемый носитель, адъювант или наполнитель. Кроме того, изобретение обеспечивает способы лечения или уменьшения степени тяжести пролиферативного заболевания, состояния или нарушения у пациента, которые включают стадию введения пациенту терапевтически эффективной дозы соединения формулы I или его фармацевтической композиции.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Определения и общая терминология
Используемые в настоящем описании следующие определения следует применять, если не указано иначе. В целях данного изобретения химические элементы идентифицированы в соответствии с Периодической Системой Химических Элементов, версией CAS и Handbook of Chemistry and Physics, 75th Ed. 1994. Дополнительно, общие принципы органической химии описаны в «Organic Chemistry», Thomas Sorrell, University Science Books, Sausalito: 1999 и «March's Advanced Organic Chemistry», 5th Ed., Smith, M.B. and March, J., eds. John Wiley & Sons, New York: 2001, все содержание которых включено в настоящее описание в полном объеме посредством ссылки.
Описание соединения изобретения
В первом аспекте изобретение обеспечивает следующие соединения формулы I:
или их фармацевтически приемлемую соль, в которой
R1 представляет собой C1-3алифатическую группу;
R2 представляет собой водород, фтор или метил;
R3 представляет собой водород, фтор или метил;
каждый R4 представляет собой независимо водород или фтор; и
R5 представляет собой водород, хлор, циклопропил или C1-4алифатическую группу, необязательно замещенную 1-3 атомами фтора.
В одном варианте осуществления R2 представляет собой метил и R3 представляет собой водород. В другом варианте осуществления R2 представляет собой водород и R3 представляет собой метил.
В другом варианте осуществления каждый из R2 и R3 представляет собой фтор.
В другом варианте осуществления соединений изобретения R4 представляет собой водород.
В другом варианте осуществления соединений изобретения R1 представляет собой метил и R5 представляет собой водород.
В дополнительном варианте осуществления R1 представляет собой метил, каждый из R2 и R3 представляет собой фтор и каждый из R4 и R5 представляет собой водород.
В другом варианте осуществления соединение представляет собой соль гидрохлорида.
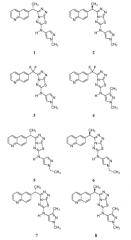
Соединения формулы I включают следующие:
В другом аспекте изобретение обеспечивает фармацевтическую композицию, содержащую соединение формулы I или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель, адъювант или наполнитель. В одном варианте осуществления композиция содержит дополнительный химиотерапевтический или антипролиферативный агент, противовоспалительный агент, агент для лечения атеросклероза или агент для лечения фиброза легких.
В другом аспекте изобретение обеспечивает способ лечения или уменьшения степени тяжести пролиферативного нарушения у пациента, включающий введение соединения формулы I в количестве, достаточном для лечения или уменьшения степени тяжести пролиферативного нарушения у указанного пациента. В одном варианте осуществления пролиферативное нарушение представляет собой метастатический рак. В другом варианте осуществления пролиферативное нарушение представляет собой глиобластому; гепатоцеллюлярную карциному, карциному желудка или рак, выбранный из рака толстой кишки, груди, простаты, мозга, печени, поджелудочной железы или легкого.
В другом варианте осуществления пролиферативное нарушение представляет собой метастатический рак.
Композиции, составы и введение соединений изобретения
В другом аспекте изобретение обеспечивает композицию, содержащую соединение формулы I или его фармацевтически приемлемое производное и фармацевтически приемлемый носитель, адъювант или наполнитель. В одном варианте осуществления количество соединения в композиции этого изобретения представляет собой такое, которое является эффективным в известной мере для ингибирования c-Met в биологическом образце или у пациента. Предпочтительно композицию этого изобретения получают для введения пациенту, нуждающемуся в такой композиции. Наиболее предпочтительно композицию этого изобретения получают для перорального введения пациенту.
Используемый в настоящем описании термин «пациент» означает животное, предпочтительно млекопитающее и наиболее предпочтительно человека.
Следует также отметить, что соединения формулы I могут существовать в свободной форме для лечения или при необходимости в качестве его фармацевтически приемлемого производного. Согласно настоящему изобретению, фармацевтически приемлемое производное включает, но не ограничивается ими, фармацевтически приемлемые пролекарства, соли, сложные эфиры, соли таких сложных эфиров или любой другой аддукт или производное, которое при введении пациенту, нуждающемуся в таком лечении, является способным к получению, прямо или косвенно, соединения формулы I, как иначе описано в настоящем изобретении, или его метаболита или остатка.
Используемый в настоящем описании термин «фармацевтически приемлемая соль» относится к таким солям, которые в рамках результатов тщательной медицинской оценки являются подходящими для применения при взаимодействии с тканями людей и низших животных без неспецифической токсичности, болезненной чувствительности, аллергического ответа и подобного.
Фармацевтически приемлемые соли хорошо известны в данной области техники. Например, S. М. Berge и др. описывают фармацевтически приемлемые соли подробно в J. Pharmaceutical Sciences, 66:1-19, 1977, который включен в настоящее описание посредством ссылки. Фармацевтически приемлемые соли соединений формулы I включают полученные из подходящих неорганических и органических кислот и оснований. Примеры фармацевтически приемлемых нетоксичных кислотно-аддитивных солей представляют собой соли аминогруппы, полученные с неорганическими кислотами, такими как хлористоводородная кислота, бромистоводородная кислота, фосфорная кислота, серная кислота и хлорная кислота или с органическими кислотами, такими как уксусная кислота, щавелевая кислота, малеиновая кислота, винная кислота, лимонная кислота, янтарная кислота или малоновая кислота или при использовании других способов, применяемых в данной области техники, таких как ионный обмен. Другие фармацевтически приемлемые соли включают адипат, альгинат, аскорбат, аспартат, бензолсульфонат, бензоат, бисульфат, борат, бутират, камфорат, камфорсульфонат, цитрат, циклопентанпропионат, диглюконат, додецилсульфат, этансульфонат, формиат, фумарат, глюкогептонат, глицерофосфат, глюконат, гемисульфат, гептаноат, гексаноат, гидроиодид, 2-гидроксиэтансульфонат, лактобионат, лактат, лаурат, лаурилсульфат, малат, малеат, малонат, метансульфонат, 2-нафталинсульфонат, никотинат, нитрат, олеат, оксалат, пальмитат, памоат, пектинат, персульфат, 3-фенилпропионат, фосфат, пикрат, пивалат, пропионат, стеарат, сукцинат, сульфат, тартрат, тиоцианат, п-толуолсульфонат, ундеканоат, валерат соли и подобные. Соли, полученные из соответствующих оснований, включают соли щелочного металла, щелочноземельного металла, аммония и N+(C1-4алкила)4.
Выше описано, что фармацевтически приемлемые композиции настоящего изобретения дополнительно включают фармацевтически приемлемый носитель, адъювант или наполнитель, который, как используется в настоящем описании, включает всевозможные растворители, разбавители или другой жидкий наполнитель, дисперсионные или суспензионные вспомогательные средства, поверхностно-активные вещества, изотонические агенты, загущающие или эмульгирующие агенты, консерванты, твердые связующие вещества, смазывающие вещества и подобные, как подходящие для определенной желательной формы дозировки. В Remington: The Science and Practice of Pharmacy, 21st edition, 2005, ed. D.B. Troy, Lippincott Williams & Wilkins, Philadelphia и Encyclopedia of Pharmaceutical Technology, eds. J. Swarbrick and J. C. Boylan, 1988-1999, Marcel Dekker, New York, содержание каждого из которых включено в настоящее описание посредством ссылки, раскрыты различные носители, используемые в составе фармацевтически приемлемых композиций и известные методики их получения. За исключением случаев, когда любая стандартная среда носителя является несовместимой с соединением формулы I так, как получение любого нежелательного биологического эффекта или иначе взаимодействия во вредной манере с любым другим компонентом(ами) фармацевтически приемлемой композиции, его использование рассматривают, чтобы находиться в объеме данного изобретения.
Некоторые примеры материалов, которые могут служить в качестве фармацевтически приемлемых носителей, включают, но не ограничиваются ими, ионообменную смолу, оксид алюминия, стеарат алюминия, лецитин, сывороточные белки, такие как человеческий сывороточный альбумин, буферные вещества, такие как фосфаты, глицин, сорбиновая кислота или сорбат калия, смеси неполных глицеридов насыщенных растительных жирных кислот, воду, соли или электролиты, такие как протаминсульфат, гидрофосфат натрия, гидрофосфат калия, хлорид натрия, соли цинка, диоксид кремния, трисиликат магния, поливинилпирролидон, полиакрилаты, воски, блок полимеры полиэтилен-полиоксипропилен, ланолин, сахара, такие как лактоза, глюкоза и сахароза; крахмалы, такие как кукурузный крахмал и картофельный крахмал; целлюлозу и ее производные, такие как натрий карбоксиметилцеллюлоза, этилцеллюлоза и ацетат целлюлозы; порошковый трагакант; солод; желатин; тальк; эксципиенты, такие как масло какао и воски для суппозиторий; масла, такие как арахисовое масло, хлопковое масло; сафлоровое масло; сезамовое масло; оливковое масло; кукурузное масло и соевое масло; гликоли; такие как пропиленгликоль или полиэтиленгликоль; сложные эфиры, такие как этилолеат и этиллаурат; агар; буферные агенты, такие как гидроксид магния и гидроксид алюминия; альгиновую кислоту; апирогенную воду; изотонический солевой раствор; раствор Рингера; этиловый спирт и фосфатные буферные растворы, так же как другие нетоксичные совместимые смазывающие вещества, такие как лаурилсульфат натрия и стеарат магния, так же как красители, высвобождающие агенты, покрывающие агенты, подслащивающие агенты, ароматизаторы и ароматизирующие добавки, консерванты и антиоксиданты могут также присутствовать в композиции согласно решению разработчика рецептур.
Композиции настоящего изобретения могут вводить перорально, парентерально, с помощью ингаляции, местно, ректально, назально, буккально, вагинально или с помощью имплантированного резервуара. Используемый в настоящем описании термин «парентеральный» включает подкожную, внутривенную, внутримышечную, внутрисуставную, интрасиновиальную, надчревную, интратекальную, внутриглазную, внутрипеченочную, вводимую внутрь пораженных тканей и внутричерепную инъекцию или методы инфузии. Предпочтительно, композиции вводят перорально, внутрибрюшинно или внутривенно. Стерильные инъекционные формы композиций данного изобретения могут быть водной или маслянистой суспензией. Эти суспензии могут получить согласно способам, известным в данной области техники, используя подходящие диспергирующие или смачивающие агенты и суспендирующие агенты. Стерильное инъекционное лекарственное средство может также быть стерильным инъекционным раствором или суспензией в нетоксичном парентерально приемлемом разбавителе или растворителе, например, как раствор в 1,3-бутандиоле. Среди приемлемых наполнителей и растворителей, которые могут применять, находятся вода, раствор Рингера и изотонический раствор хлорида натрия. Кроме того, стерильные нелетучие масла традиционно используют в качестве растворителя или суспендирующей среды.
С этой целью могут использовать любое мягкое нелетучее масло, включая синтетические моно- или диглицериды. Жирные кислоты, такие как олеиновая кислота и ее производные глицериды пригодны при получении инъекционных лекарственных средств, поскольку представляют собой природные фармацевтически приемлемые масла, такие как оливковое масло или касторовое масло, особенно в их полиоксиэтилированных вариантах. Эти масляные растворы или суспензии могут также содержать длинноцепочечный спиртовой разбавитель или диспергирующее вещество, такое как карбоксиметилцеллюлоза или подобные диспергирующие агенты, которые обычно используют в составе фармацевтически приемлемых форм дозировки, включая эмульсии и суспензии. Другие обычно используемые поверхностно-активные вещества, такие как твины, спаны и другие эмульгирующие агенты или увеличивающие биодоступность агенты, которые обычно используют при получении фармацевтически приемлемого твердого вещества, жидкости или других форм дозировки, могут также применять для целей состава.
Фармацевтически приемлемые композиции этого изобретения могут вводить перорально в любой перорально приемлемой форме дозировки, включая но, не ограничиваясь ими, капсулы, таблетки, водные суспензии или растворы. В случае таблеток для перорального применения, стандартно используемые носители включают лактозу и кукурузный крахмал. Также обычно добавляют скользящие вещества, такие как стеарат магния. Для перорального введения в форме капсул пригодные разбавители включают лактозу и высушенный кукурузный крахмал. Когда требуются водные суспензии для перорального применения, активный ингредиент объединяют с эмульгирующими и суспендирующими агентами. При желании могут также добавить определенные подслащивающие агенты, ароматизаторы или красители.
Альтернативно, фармацевтически приемлемые композиции этого изобретения могут вводить в форме суппозиторий для ректального введения. Их могут получить с помощью смешивания агента с подходящим не раздражающим эксципиентом, который представляет собой твердое вещество при комнатной температуре, но является жидкостью при ректальной температуре и следовательно, будет таять в прямой кишке для высвобождения лекарственного средства. Такие материалы включают масло какао, воск и полиэтиленгликоли.
Фармацевтически приемлемые композиции этого изобретения могут также вводить местно, особенно когда цель лечения включает области или органы, легко доступные для местного применения, включая заболевания глаз, кожи или нижней части кишечника. Подходящие местные составы легко получают для каждого из этих областей или органов.
Местное применение для нижней части кишечника могут осуществить в составе ректальной суппозитории (см. выше) или в составе подходящей клизмы. Могут также применять местно-трансдермальные пластыри.
Для местного применения фармацевтически приемлемые композиции могут получить в форме подходящей мази, содержащей активный компонент, суспендированный или растворенный в одном или более носителях. Носители для местного введения соединений формулы I включают, но не ограничиваются ими, минеральное масло, жидкий петролатум, белый петролатум, пропиленгликоль, полиоксиэтилен, соединение полиоксипропилена, эмульгирующий воск и воду. Альтернативно, фармацевтически приемлемые композиции могут получить в форме подходящего лосьона или крема, содержащего активные компоненты, суспендированные или растворенные в одном или более фармацевтически приемлемых носителях. Подходящие носители включают, но не ограничиваются ими, минеральное масло, сорбитан моностеарат, полисорбат 60, цетиловый сложноэфирный воск, цетеариловый спирт, 2-октилдодеканол, бензиловый спирт и воду.
Для офтальмологического применения фармацевтически приемлемые композиции могут получить, например, в виде тонкодисперсных суспензий в изотоническом с установленным pH стерильном солевом растворе или другом водном растворе или предпочтительно, в виде растворов в изотоническом с установленным pH стерильном солевом растворе или другом водном растворе; в присутствии или в отсутствии консерванта, такого как бензилалкония хлорид. Альтернативно, для офтальмологических применений фармацевтически приемлемые композиции могут получить в форме мази, такой как петролатум. Фармацевтически приемлемые композиции этого изобретения могут также вводить с помощью назального аэрозоля или ингаляции. Такие композиции получают согласно методам, хорошо известным в области фармацевтических составов, и могут получить в качестве растворов в солевом растворе, используя бензиловый спирт или другие подходящие консерванты, способствующие абсорбции вещества для увеличения биодоступности, фторуглероды и/или другие стандартные солюбилизирующие или диспергирующие агенты.
Наиболее предпочтительно фармацевтически приемлемые композиции этого изобретения получают для перорального введения.
Жидкие формы дозировки для перорального введения включают, но не ограничиваются ими, фармацевтически приемлемые эмульсии, микроэмульсии, растворы, суспензии, сиропы и эликсиры. В дополнение к активным соединениям, жидкие формы дозировки могут содержать инертные разбавители, обычно используемые в данной области техники, такие как, например, вода или другие растворители, солюбилизирующие агенты и эмульгирующие агенты, такие как этиловый спирт, изопропиловый спирт, этилкарбонат, этилацетат, бензиловый спирт, бензилбензоат, пропиленгликоль, 1,3-бутиленгликоль, диметилформамид, масла (в частности, хлопковое, арахисовое, кукурузное, зародышевое, оливковое, касторовое и сезамовое масла), глицерин, тетрагидрофурфуриловый спирт, полиэтиленгликоль и сложные эфиры сорбитана и жирных кислот и их смеси. Помимо инертных разбавителей пероральные композиции могут также включать адъюванты, такие как смачивающие агенты, эмульгирующие и суспендирующие агенты, подслащивающие агенты, ароматизаторы и ароматизирующие агенты.
Инъекционные лекарственные средства, например, стерильные инъекционные водные или маслянистые суспензии могут получить согласно способу, известному в данной области техники, используя подходящие диспергирующие или смачивающие агенты и суспендирующие агенты. Стерильное инъекционное лекарственное средство может также быть стерильным инъекционным раствором, суспензией или эмульсией в нетоксичном парентерально приемлемом разбавителе или растворителе, например, как раствор в 1,3-бутандиоле. Среди приемлемых наполнителей и растворителей, которые могут применять, находятся вода, раствор Рингера, U.S.P. и изотонический раствор хлорида натрия. Кроме того, стерильные нелетучие масла традиционно используют в качестве растворителя или суспендирующей среды. С этой целью могут использовать любое мягкое нелетучее масло, включая синтетические моно- или диглицериды. Кроме того, жирные кислоты, такие как олеиновая кислота, используют при получении инъекционных лекарственных средств.
Инъекционные составы могут стерилизовать, например, с помощью фильтрования через сдерживающий бактерии фильтр или с помощью внедрения стерилизующих агентов в форме стерильных твердых композиций, которые могут быть растворены или диспергированы в стерильной воде или другой стерильной инъекционной среде до использования.
Для продления эффекта соединения формулы I часто желательно замедлить абсорбцию этого соединения из подкожной или внутримышечной инъекции. Это может быть достигнуто при помощи использования жидкой суспензии кристаллического или аморфного материала с плохой растворимостью в воде. Скорость абсорбции соединения формулы I тогда зависит от его скорости растворения, которая, в свою очередь, может зависеть от размера кристаллов и кристаллической формы. Альтернативно, растворение или суспендирование соединения формулы I в маслянистом наполнителе обеспечивает замедленную абсорбцию парентерально вводимой формы соединения. Инъекционные формы депо получают с помощью образования микроинкапсулированных матриц соединения формулы I в биоразлагаемых полимерах, таких как полилактид-полигликолид. В зависимости от соотношения соединения к полимеру и природы применяемого определенного полимера могут контролировать скорость высвобождения соединения. Примеры других биоразлагаемых полимеров включают поли(ортоэфиры) и поли(ангидриды). Инъекционные составы депо также получают с помощью захватывания соединения формулы I в липосомах или микроэмульсиях, которые являются совместимыми с тканями тела.
Композиции для ректального или вагинального введения представляют собой предпочтительно суппозитории, которые могут получить с помощью смешивания соединение формулы I с подходящими нераздражающими эксципиентами или носителями, такими как масло какао, полиэтиленгликоль или воск для суппозиторий, которые представляют собой твердые вещества при температуре окружающей среды, но являются жидкостями при температуре тела и, следовательно, тают в прямой кишке или вагинальной полости и высвобождают активное соединение.
Твердые формы дозировки для перорального введения включают капсулы, таблетки, пилюли, порошки и гранулы. В таких твердых формах дозировки активное соединение смешивают, по меньшей мере, с одним инертным фармацевтически приемлемым эксципиентом или носителем, таким как цитрат натрия или фосфат дикальция и/или a) наполнителями или утяжелителями, такими как крахмалы, лактоза, сахароза, глюкоза, маннит и кремневая кислота, b) связующими веществами, такими как, например, карбоксиметилцеллюлоза, альгинаты, желатин, поливинилпирролидон, сахароза и акация, c) увлажняющими веществами, такими как глицерин, d) дезинтегрирующими агентами, такими как агар-агар, карбонат кальция, картофельный или маниоковый крахмал, альгиновая кислота, определенные силикаты и карбонат натрия, e) замедляющими растворение агентами, такими как парафин, f) ускоряющими абсорбцию агентами, такими как соединения четвертичного аммония, g) смачивающими агентами, такими как, например, цетиловый спирт и моностеарат глицерина, h) абсорбентами, такими как каолин и бентонитовая глина и i) скользящими агентами, такими как тальк, стеарат кальция, стеарат магния, твердые полиэтиленгликоли, лаурилсульфат натрия и их смеси. В случае капсул, таблеток и пилюль форма дозировки может также включать буферные агенты.
Твердые композиции подобного типа могут также использовать в качестве наполнителей в мягких и твердо-заполненных желатиновых капсулах, используя такие эксципиенты, как лактоза или молочный сахар, так же как полиэтиленгликоли с высокой молекулярной массой и подобные. Твердые формы дозировки таблеток, драже, капсул, пилюль и гранул могут получить с покрытиями и оболочками, такими как энтеросолюбильные покрытия и другие покрытия, хорошо известные в области фармацевтических составов. Они могут необязательно содержать рентгеноконтрастные агенты и могут также быть из композиции, из которой они высвобождают активный ингредиент(ы) только, или предпочтительно, в определенной части кишечного тракта, необязательно, замедленным способом. Примеры капсулирующих композиций, которые могут использовать, включают полимерные вещества и воски. Твердые композиции подобного типа могут также использовать в качестве наполнителей в мягких и твердо-заполненных желатиновых капсулах, используя такие эксципиенты, как лактоза или молочный сахар, так же как полиэтиленгликоли с высокой молекулярной массой и подобные.
Активные соединения могут также быть в микроинкапсулированной форме с одним или более эксципиентами, как отмечено выше. Твердые формы дозировки таблеток, драже, капсул, пилюль и гранул могут получить с покрытиями и оболочками, такими как энтеросолюбильные покрытия, контролирующие высвобождение покрытия и другие покрытия, хорошо известные в области фармацевтических составов. В таких твердых формах дозировки активное соединение могут смешать, по меньшей мере, с одним инертным разбавителем, таким как сахароза, лактоза или крахмал. Такие формы дозировки могут также содержать, что является обычной практикой, дополнительные вещества, кроме инертных разбавителей, например, таблетирующие скользящие вещества и другие таблетирующие вспомогательные вещества, такие как стеарат магния и микрокристаллическая целлюлоза. В случае капсул, таблеток и пилюль формы дозировки могут также содержать буферные агенты. Они могут необязательно содержать рентгеноконтрастные агенты и могут также быть из композиции, из которой они высвобождают активный ингредиент(ы) только, или предпочтительно, в определенной части кишечного тракта, необязательно, замедленным способом. Примеры капсулирующих композиций, которые могут использовать, включают полимерные вещества и воски.
Формы дозировки для местного или трансдермального введения соединения формулы I включают мази, пасты, кремы, лосьоны, гели, порошки, растворы, спреи, ингаляторы или пластыри. Активный компонент смешивают при стерильных условиях с фармацевтически приемлемым носителем и любыми необходимыми консервантами или буферными агентами, как может потребоваться. Офтальмологический состав, ушные капли, и глазные капли также рассматривают в рамках этого изобретения. Дополнительно, настоящее изобретение рассматривает использование трансдермальных пластырей, которые имеют дополнительное преимущество обеспечения контролируемой доставки, соединения формулы I к телу. Такие формы дозировки могут получить с помощью растворения или распределения соединения формулы I в соответствующей среде. Усиливающие абсорбцию агенты могут также использовать для увеличения потока соединения формулы I через кожу. Скорость могут контролировать или с помощью обеспечения мембраны, контролирующей скорость, или с помощью диспергирования соединения формулы I в полимерной матрице или геле.
Соединения формулы I предпочтительно получают в форме единицы дозировки для простоты введения и однородности дозировки. Используемое в настоящем описании выражение «форма единицы дозировки» относится к физически дискретной единице агента, соответствующего для пациента, которого лечат. Следует понимать, однако, что полное ежедневное применение соединения формулы I и композиций, содержащих соединение формулы I, будет решено лечащим врачом по результатам тщательной медицинской оценки. Определенный эффективный уровень дозы для любого определенного пациента или организма будет зависеть от разнообразия факторов, включая нарушение, которое лечат, и степень тяжести нарушения; активность определенного применяемого соединения; определенное применяемое соединение; возраст, массу тела, общее состояние здоровья, пол и режим питания пациента; время введения, путь введения и скорость экскреции определенного применяемого соединения; продолжительность лечения; лекарственные средства, используемые в комбинации или совпадающие с определенным применяемым соединением, и подобные факторы, хорошо известные в области медицины.
Количество соединения формулы I, которое могут объединить с материалами носителя для получения композиции в единичной форме дозировки, будет изменяться в зависимости от хозяина, которого лечат, определенного режима введения. Предпочтительно, композиции должны быть составлены так, что дозировку от 0,01 до на 100 мг/кг массы тела/сутки ингибитора могут вводить пациенту, получающему эти композиции. В одном примере композиции получены так, что дозировка соединения формулы I может быть от 3 до 30 мг/кг массы тела/сутки. В другом примере композиции получены так, что дозировка соединения формулы I может быть от 5 до 60 мг/кг массы тела/сутки.
В зависимости от определенного состояния или заболевания, которое лечат или предотвращают, дополнительные терапевтические агенты, которые обычно вводят для лечения или предотвращения такого состояния, могут также присутствовать в композициях этого изобретения. Используемые в настоящем описании дополнительные терапевтические агенты, которые обычно вводят для лечения или предотвращения определенного заболевания или состояния, известны как «соответствующие для заболевания или состояния, которое лечат». Примеры дополнительных терапевтических агентов обеспечивают ниже.
Количество дополнительного терапевтического агента, присутствующего в композициях этого изобретения, будет не более, чем количество, которое обычно вводили бы в композицию, содержащую такой терапевтический агент в качестве единственного активного агента. Предпочтительно количество дополнительного терапевтического агента в настоящее время в раскрытых композициях располагается приблизительно от 50% до 100% количества, обычно присутствующего в композиции, содержащей такой агент в качестве единственного терапевтически активного агента.
Применения соединений Формулы I и композиций, содержащих соединения Формулы I
Согласно одному варианту осуществления изобретение относится к способу ингибирования активности протеинкиназы c-Met в биологическом образце, включающему стадию взаимодействия указанного биологического образца с соединением формулы I или композицией, содержащей указанное соединение. Используемый в настоящем описании термин «биологический образец» означает типовой внешний живой организм и включает, не ограничивается ими, клеточные культуры или их экстракты; биопсийный материал, полученный от млекопитающего или его экстракты; и кровь, слюну, мочу, экскременты, сперму, слезы или другие жидкости тела или их экстракты. Ингибирование активности киназы в биологическом образце полезно для разнообразия целей, известных специалисту в данной области техники. Примеры таких целей включают, но не ограничиваются ими, хранение биологического образца и биологические исследования. В одном варианте осуществления способ ингибирования активности киназы в биологическом образце ограничивают не терапевтическими способами.
Термин «c-Met» является синонимичным «c-MET», «cMet», «MET», «Met» или другим обозначениям, известным специалисту в данной области техники.
Согласно другому варианту осуществления изобретение относится к способу ингибирования активности киназы c-Met у пациента, включающему стадию введения указанному пациенту соединения формулы I или композиции, содержащей указанное соединение.
Используемый в настоящем описании термин «c-Met-опосредованное заболевание» или «c-Met-опосредованное состояние» означает любое состояние заболевания или другое болезнетворное состояние, при котором известно, что c-Met играет роль. Термины «c-Met-опосредованное заболевание» или «c-Met-опосредованное состояние» также означают такие заболевания или состояния, симптомы которых смягчаются при лечении с помощью ингибитора c-Met. Такие состояния включают, но не ограничиваются ими, рак почек, желудка, толстой кишки, мозга, груди, простаты, печени, поджелудочной железы или легких, глиобластому, атеросклероз или фиброз легких.
В одном аспекте настоящее изобретение обеспечивает способ лечения пролиферативного нарушения у пациента, включающий стадию введения пациенту терапевтически эффективной дозы соединения формулы I или композиции, содержащей соединение формулы I.
Согласно одному варианту осуществления пролиферативное нарушение представляет собой рак, такой как, например, рак почек, желудка, толстой кишки, мозга, груди, печени, простаты и легких или глиобластому.
В другом варианте осуществления настоящее изобретение относится к способу лечения или уменьшения степени тяжести гепатоцеллюлярной карциномы у пациента, нуждающегося в таком лечении, включающему введение указанному пациенту соединения формулы I или его композиции.
В другом варианте осуществления пролиферативное нарушение представляет собой истинную полицитемию, эссенциальную тромбоцитемию, хронический идиопатический миелофиброз, миелоидную метаплазию с миелофиброзом, хронический гранулоцитарный лейкоз (CML), хронический миеломоноцитарный лейкоз, хронический эозинофильный лейкоз, гипереозинофильный синдром, системный мастоцитоз, нетипичный CML или ювенильный миеломоноцитарный лейкоз.
В другом варианте осуществления пролиферативное нарушение представляет собой атеросклероз или фиброз легких.
Другой аспект настоящего изобретения относится к способу ингибирования метастаза опухоли у пациента, нуждающегося в таком лечении, включающему введение указанному пациенту соединения формулы I или его композиции.
В зависимости от определенного состояния или заболевания, которое лечат, дополнительные терапевтические агенты, которые обычно вводят для лечения такого состояния, могут также присутствовать в композициях этого изобретения. Используемые в настоящем описании дополнительные терапевтические агенты, которые обычно вводят для лечения определенного заболевания или состояния, известны как «соответствующие для заболевания или состояния, которое лечат».
В одном варианте осуществления химиотерапевтические агенты или другие антипролиферативные агенты могут объединить с соединением формулы I для лечения пролиферативных заболеваний и рака. Примеры известных химиотерапевтических агентов включают, но не ограничиваются ими, алкилирующие агенты, такие как, например, циклофосфамид, ломустин, бусульфан прокарбазин, ифосфамид, алтретамин, мелфалан, эстрамустина фосфат, гексаметилмеламин, хлорметин, тиотепа, стрептозоцин, хлорамбуцил, темозоломид, дакарбазин, семустин или кармустин; платиновые агенты, такие как, например, цисплатин, карбоплатин, оксалиплатин, ZD-0473 (AnorMED), спироплатин, лобаплатин (Aeterna), карбоксифталатоплатин