Композиции прокариотической фенилаланин-аммиак-лиазы и способы лечения рака с использованием таких композиций
Иллюстрации
Показать всеГруппа изобретений относится к области фармацевтики, в частности, к фармацевтичекой композиции для лечения фенилкетонурии, которая содержит эффективное количество варианта фенилаланин-аммиак-лиазы Anabaena variabilis (AvPAL), где указанный вариант дополнительно содержит полиэтиленгликоль, а также фармацевтически приемлемый носитель, содержащий стабилизатор, где стабилизатор представляет собой L-фенилаланин, транс-коричную кислоту или бензойную кислоту. Заявлены также способ лечения фенилкетонурии и способ снижения концентрации фенилаланина в крови у субъекта. Группа изобретений обеспечивает использование прокариотического PAL, который обладает более высокой фенилаланин-конвертирующей активностью и/или более низкой иммуногенностью, по сравнению с PAL дикого типа. 3 н. и 53 з.п.ф-лы, 19 пр., 11 табл., 19 фиг.
Реферат
Область, к которой относится изобретение
Настоящее изобретение относится к прокариотической фенилаланин-аммиак-лиазе (PAL) и к ее композициям, а также к оптимизации таких композиций для повышения каталитической активности и/или стабильности прокариотической PAL и, тем самым, снижения иммуногенности и/или протеолитической чувствительности прокариотической PAL. Настоящее изобретение также относится к применению указанных оптимальных композиций прокариотической PAL для лечения рака.
Предшествующий уровень техники
PAL представляет собой фермент, отсутствующий у млекопитающих и широко распространенный в растениях (Koukol, et al., J. Biol. Chem. 236:2692-2698 (1961); Hanson, et al., The Enzymes 7:75-166 (1972); Poppe, et al., Curr. Org. Chem. 7: 1297-1315 (2003)), в некоторых грибах (Rao, et al., Can. J. Biochem. 4512:1863-1872 (1967); Abell, et al., Methods Enzymol. 142:242-253 (1987)) и в бактериях (Bezanson, et al., Can. J. Microbiol. 16:147-151 (1970); Xiang, et al., J. Biol. Chem. 277:32505-32509 (2002); Hill, et al., Chem. Commun. 1358-1359 (2003)), и такой фермент может быть рекомбинантно продуцирован в Escherichia coli.
Репрезентативный список PAL включает следующие ферменты: Q9ATN7 Agastache rugosa; 093967 Amanita muscaria (мухомора); P35510, P45724, P45725, Q9SS45, Q8RWP4 Arabidopsis thaliana (резушки Таля); Q6ST23 Bambusa oldhamii (дендрокаламуса); Q42609 Bromheadia finlaysoniana (орхидеи); P45726 Camellia sinensis (чая); Q9MAX1 Catharanthus roseus (розового барвинка) (Мадагаскарского барвинка); Q9SMK9 Cicer arietinum (турецкого гороха); Q9XFX5, Q9XFX6 цитрусового гибрида Citrus Clementina x Citrus reticulate; Q42667 Citrus limon (лимона); Q8H6V9, Q8H6W0 Coffea canephora (кофе робуста); Q852S1 Daucus carota (моркови); О23924 Digitalis lanata (наперстянки); О23865 Daucus carota (моркови); P27991 Glycine max (сои); О04058 Helianthus annuus (подсолнечника однолетнего); P14166, Q42858 Ipomoea batatas (сладкого картофеля); Q8GZR8, Q8W2E4 Lactuca sativa (садового латука); О49835, О49836 Lithospermum erythrorhizon; P35511, P26600 Lycopersicon esculentum (томата); P35512 Malus domestica (яблони) (Malus sylvestris); Q94C45, Q94F89 Manihot esculenta (кассавы) (маниоки); P27990 Medicago sativa (люцерны); P25872, P35513, P45733 Nicotiana tabacum (табака настоящего); Q6T1C9 Quercus suber (пробкового дуба); P14717, P53443, Q7M1Q5, Q84VE0, Q84VE0 Oryza sativa (риса); P45727 Persea americana (авокадо); Q9AXI5 Pharbitis nil (фиалки) (японской ипомеи); P52777 Pinus taeda (сосны ладанной); Q01861, Q04593 Pisum sativum (садового гороха); P24481, P45728, P45729 Petroselinum crispum (петрушки огородной) (Petroselinum hortense); Q84LI2 гибридного сорта Phalaenopsis x Doritaenopsis; P07218, P19142, P19143 Phaseolus vulgaris (фасоли обыкновенной) (французских бобов); Q7XJC3, Q7XJC4 Pinus pinaster (приморской сосны); Q6UD65 гибридного бальзамического тополя подвида trichocarpa x Populus deltoides; P45731, Q43052, О24266 Populus kitakamiensis (осины); Q8H6V5, Q8H6V6 Populus tremuloides (тополя осинообразного); P45730 Populus trichocarpa (американского бальзамического тополя); О64963 Prunus avium (вишни); Q94EN0 Rehmannia glutinosa; Pl1544 Rhodosporidium toruloides (дрожжей) (Rhodotorula gracilis); P10248 Rhodotorula rubra (дрожжей) (Rhodotorula mucilaginosa); Q9M568, Q9M567 Rubus idaeus (малины); P31425, P31426 Solanum tuberosum (картофеля); Q6SPE8 Stellaria longipes (девясила высокого); P45732 Stylosanthes humilis (таунсвильской люцерны); P45734 Trifolium subterraneum (средиземноморского клевера); Q43210, Q43664 Triticum aestivum (пшеницы); Q96V77 Ustilago maydis (головневых грибов); P45735 Vitis vinifera (винограда); и Q8VXG7 Zea mays (кукурузы).
Многочисленные исследования были направлены на возможность применения фермента фенилаланин-аммиак-лиазы (PAL, EC 4.3.1.5) для ферментной заместительной терапии фенилкетонурии (PKU) (Hoskins, et al., Lancet l(8165):392-394 (1980); Gilbert, et al., Biochem. J. 199(3):715-723 (1981); Hoskins, J.A., et al., Res. Commun. Chem. Pathol. Pharmacol. 35(2):275-282 (1982); Sarkissian, et al., Proc. Natl. Acad. Sci. USA 96(5):2339-2344 (1999); Liu, et al., Artif. Cells Blood Substit. Immobil. Biotechnol. 30(4):243-257 (2002); Wieder, et al., J Biol. Chem. 254(24): 12579-12587 (1979); Gamez, et al., Mol. Ther. 11(6):986-989 (2005); Ambrus, et al., J. Pharmacol. Exp. Ther. 224(3):598-602 (1983); Ambrus, et al., Science 201(4358):837-839 (1978); Kalghatgi, Res. Commun. Chem. Pathol. Pharmacol. 27(3):551-561 (1980); Ambrus, Res. Commun. Chem. Pathol. Pharmacol. 37(l):105-111 (1982); Gilbert, et al., Biochem. Biophys. Res. Commun. 131(2):557-563 (1985); Pedersen, Res. Commun. Chem. Pathol. Pharmacol. 20(3):559-569 (1978); Marconi, et al., Biochimie 62(8-9):575-580 (1980); Larue, et al., Dev. Pharmacol. Ther. 9(2):73-81 (1986); Ambrus, et al., Ann. Intern. Med. 106(4):531-537 (1987); Bourget, et al., Appl. Biochem. Biotechnol. 10:57-59 (1984); Bourget, et al., FEBS Lett. 180(l):5-8 (1985); Bourget, et al., Biochim. Biophys. Acta 883(3):432-438 (1986); Chang, et al., Artif. Cells Blood Substit. Immobil. Biotechnol. 23(1):1-21 (1995); Chang, et al., Mol. Biotechnol. 17(3):249-260 (2001); патент США № 5753487).
Было высказано предположение, что исходя из способности фермента PAL ограничивать поступление питательного вещества, а именно, фенилаланина в раковые клетки и, тем самым, ингибировать рост опухоли, такой фермент может быть использован для лечения рака (Fritz, et al., J. Biol. Chem. 251(15):4646-4650 (1976); Roberts, et al., Cancer Treat. Rep. 60(3):261-263 (1976); Shen, et al., Cancer Res. 37(4):1051-1056 (1977); Shen, et al., Cancer Treat. Rep. 63(6):1063-1068 (1979); Wieder, et al., J. Biol. Chem. 254(24):12579-12587 (1979)). Кроме того, PAL-опосредуемое снижение уровня фенилаланина приводит к предупреждению пролиферации клеток мышиного лейкоза и метастатической меланомы. Однако, внутривенно инъецированный ПЭГилированный PAL быстро выводится из кровотока уже после 13-й инъекции (Abell, et al., Cancer Res. 33:2529-2532 (1973); Roberts, et al., (1976), там же; Shen, et al., (1977), там же; (Shen, et al., J. Reticuloendothelial Soc. 23:167-175 (1978)).
Некоторые опухолевые или раковые клетки имеют более высокую скорость метаболизма и большую потребность в незаменимых аминокислотах, таких как фенилаланин, чем нормальные клетки. В литературе имеются данные, которые позволяют предположить, что ограничение или снижение уровня конкретных аминокислот, например, фенилаланина, благодаря использованию ферментов, разлагающих аминокислоты, например, PAL, может приводить к снижению роста некоторых опухолевых клеток у человека, страдающего раком, и у животных с моделями рака. Так, например, в некоторых лейкозных клетках отсутствует фермент аспарагин-синтетаза, которая синтезирует заменимую аминокислоту аспарагин из глутамина, а поэтому выживаемость этих клеток зависит от аспарагина. Онкаспар (пегаспаргаза, Enzon Pharmaceuticals, Inc.), то есть, ПЭГилированная L-аспарагиназа, был с успехом использован для лечения острого лимфобластного лейкоза (ОЛЛ) (Graham, Adv. Drug Del. Rev. 55:1293-1302 (2003)). Другими примерами аминокислот, служащими в качестве потенциальных мишеней для ферментативного истощения фермента в противораковой терапии, являются глутамин (глутаминдезаминаза, Medical Enzymes AG), аргинин (аргининдезиминаза, Phoenix Pharmacologies, Inc.) и метионин (метиониназа, Anticancer, Inc.) (см., например, патенты США №№ 6312939, 6737259 и 5690929).
Было показано, что ограничение поступления фенилаланина с пищей приводит к ингибированию роста и метастазирования в высокой степени инвазивной метастатической меланомы и андроген-независимых клеток рака предстательной железы у животных-моделей, а также к стимуляции апоптоза опухолевых, но не здоровых клеток в культуре, к повышению выживаемости мышей с опухолью, к повышению чувствительности опухолевых клеток к химиотерапевтическим средствам и к повышению цитотоксичности под действием токсинов (Fu, et al., Nutr. Cancer 31:1-7 (1998); Fu, et al., Cancer Res. 59:758-765 (1999); Fu, et al., Nutr. Cancer 45:60-73 (2003); Fu, et al., J. Cell. Physiol. 209:522-534 (2006); Meadows, et al., Cancer Res. 42:3056-3063 (1982); Elstad, et al., Anticancer Res. 13:523-528 (1993); Elstad, et al., Nutr. Cancer 25:47-60 (1996); Nunez, et al., Cancer Lett. 236:133-141 (2006)).
Ферментативное истощение фенилаланина под действием фермента PAL, происходящего от дрожжей Rhodosporidium toruloides (также известных как Rhodotorula glutinis) (RtPAL), приводит к ингибированию роста лейкозных лимфоцитов в культуре in vitro (Abell, et al., Cancer Res. 32:285-290 (1972); Stith, et al., Cancer Res. 33:966-971 (1973)) и у мышей in vivo (Abell, et al., Cancer Res. 33:2529-2532 (1973)). Однако, после повторных инъекций RtPAL мышам, выведение этого фермента из плазмы значительно ускоряется, и скорость его клиренса у мышей с опухолью была выше, чем у мышей, не имеющих опухоли (Fritz, et al., J. Biol. Chem. 251:4646-4650 (1976); Shen, et al., Cancer Res. 37:1051-1056 (1977)). После множества введений, время полужизни RtPAL снижалось примерно до 1 часа в результате увеличения титра антител, что указывало на то, что для замедления клиренса и увеличения времени полужизни может потребоваться радиоактивное облучение всего организма (Shen, et al. , J. Reticuloendothelial Soc. 23:167-175 (1978).
В целях снижения иммуногенности фермента RtPAL и скорости его клиренса in vivo, этот фермент был ПЭГилирован. (Wieder, et al., J. Biol. Chem. 254:12579-12587 (1979)). После одной внутривенной инъекции или после множества внутривенных инъекций мышам, время полужизни ПЭГилированного RtPAL в крови превышало время полужизни не-ПЭГилированного RtPAL; но, тем не менее, ПЭГилированый RtPAL все же быстро выводился из кровотока после тринадцатой внутривенной инъекции.
Хотя PAL может быть использован в различных терапевтических целях, однако применение PAL может быть ограничено из-за его пониженной удельной активности и протеолитической нестабильности. Применение PAL, аналогично применению других терапевтических белков в ферментной терапии, связано с некоторыми проблемами, такими как иммуногенность этих ферментов и их чувствительность к протеолизу (см. Vellard, Curr. Opin. Biotechnol. 14:1-7 (2003)). До настоящего времени, совместные усилия, направленные на улучшение таких параметров, не дали желаемого результата, что обусловлено малым количеством информации о структуре и биохимических свойствах этого белка.
Таким образом, необходимость в получении молекул PAL с оптимальными кинетическими свойствами, включая высокую каталитическую активность, продолжительное время биологической полужизни, повышенную биохимическую стабильность и/или ослабленную иммуногенность, требуемыми для терапевтического применения, включая лечение рака, остается актуальной.
Описание сущности изобретения
Настоящее изобретение основано на обнаружении того факта, что прокариотический или бактериальный PAL может служить в качестве эффективного средства для лечения рака. В настоящем изобретении рассматриваются композиции прокариотического PAL и его биологически активных фрагментов, мутантов, вариантов или аналогов, обладающие улучшенными свойствами, такими как повышенная каталитическая активность и повышенная биохимическая стабильность, а также при применении таких композиций в терапии, ослабленная иммуногенность и/или увеличенное время биологической полужизни. Настоящее изобретение относится к фармацевтическим композициям и препаратам, содержащим прокариотический фермент PAL и его биологически активные фрагменты, мутанты, варианты или аналоги, и фармацевтически приемлемый носитель, включая стабилизаторы. Настоящее изобретение также относится к способам получения и очистки прокариотического PAL и его биологически активных фрагментов, мутантов, вариантов или аналогов, а также к способам применения таких композиций в терапевтических целях, включая лечение опухолевого заболевания и рака.
Используемые здесь термины «бактериальный PAL» и «прокариотический PAL» являются взаимозаменяемыми и означают: (1) PAL дикого типа, происходящий от организма-прокариота, включая, но не ограничиваясь ими, PAL от Streptomyces maritimus (также известного как EncP, SEQ ID NO:5, фигура 4), Nostoc punctiforme (SEQ ID NO:2, фигура 4), Anabaena variabilis (SEQ ID NO:4, фигура 4), Anacystis nidulans (Lofflehardt, Z. Naturforsch. 31(l1-12):693-9 (1976), Photorabdus luminescens TT0l (Williams, et al., Microbiology 151:2543-2550 (2005), и Streptomyces verticillatus (Bezanson, et al., Can. J. Microbiol. 16(3):147-51 (1970)); (2) фрагменты, мутанты, варианты или аналоги таких ферментов PAL дикого типа, которые сохраняют аналогичную (то есть, по меньшей мере 50%-ую) каталитическую активность по отношению к фенилаланину, и предпочтительно обладают повышенной каталитической активностью и повышенной биохимической стабильностью, а также имеют увеличенное время полужизни и/или обладают пониженной иммуногенностью, и (3) химически модифицированные варианты таких ферментов PAL дикого типа или их фрагментов, мутантов, вариантов или аналогов, которые связаны с другими химическими молекулами, сообщающими другие преимущественные свойства, такие как, например, но не ограничивающиеся ими, увеличенное время полужизни и/или пониженная иммуногенность. Так, например, все упоминаемые способы получения или использования прокариотического PAL и его фрагментов, мутантов, вариантов, аналогов или химически модифицированных вариантов, и композиций такого(их) фермента(ов) в терапевтических целях относятся к способам получения, использования или приготовления всех указанных прокариотических PAL дикого типа или их фрагментов, мутантов, вариантов, аналогов или химических модификаций.
В своем первом аспекте настоящее изобретение относится к фармацевтическим композициям, содержащим бактериальный PAL или его биологически активные фрагменты, мутанты, варианты или аналоги, и фармацевтически приемлемый носитель. В своем предпочтительном варианте, настоящее изобретение относится к бактериальному PAL, происходящему от Nostoc punctiforme (SEQ ID NO:2), или к его биологически активному фрагменту, мутанту, варианту или аналогу. В другом своем предпочтительном варианте настоящее изобретение относится к бактериальному PAL, происходящему от Anabaena variabilis (SEQ ID NO:4), или к его биологически активному фрагменту, мутанту, варианту или аналогу. В настоящем изобретении рассматриваются прокариотические варианты PAL, которые обладают более высокой фенилаланин-конвертирующей активностью и/или более низкой иммуногенностью, по сравнению с ферментом PAL дикого типа.
Предпочтительно, варианты прокариотического PAL сохраняют остатки активного центра дикого типа в положениях, соответствующих положениям Ser210, триады Ala-Ser-Gly (211-213), Asp214, Leu215, Asn270, Val269, Leu266, Leul34, His 137, Lys468, Glu496, Gln500 в PAL, происходящем от Rhodosporidium toruloides (RtPAL), или консервативную(ые) замену(ы) остатка(ов) активного центра, из которых остатки триады Ala-Ser-Gly в положениях 211-213, очевидно, являются сайтом связывания с фенилаланином.
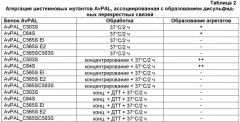
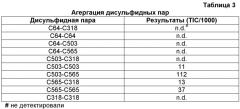
Желательные варианты прокариотического PAL могут включать белки, в которых один или несколько аминокислотных остатков были заменены другими аминокислотными остатками, способствующими снижению агрегации белка, которая может быть ассоциирована со снижением ферментативной активности, повышением иммуногенности и/или с другими нежелательными эффектами, такими как пониженная биологическая доступность in vivo. В настоящем изобретении рассматривается фармацевтическая композиция, в которой один или несколько аминокислотных остатков варианта прокариотичесого PAL были заменены другой аминокислотой, где указанная замена, по сравнению с PAL дикого типа, приводит к повышению фенилаланин-конвертирующей активности и/или к снижению иммуногенности.
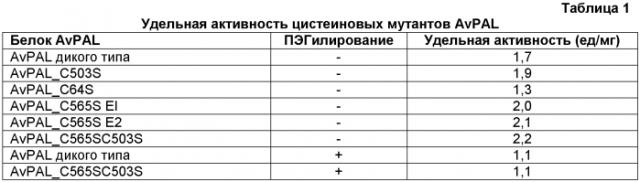
В некоторых вариантах изобретения один или несколько аминокислотных остатков варианта прокариотического PAL были заменены другим аминокислотным остатком. В некоторых вариантах изобретения один или несколько цистеиновых остатков варианта прокариотического PAL были заменены сериновым остатком. В предпочтительных вариантах изобретения вариантом прокариотического PAL является PAL Anabaena variabilis (AvPAL). В более предпочтительных вариантах изобретения один или несколько цистеиновых остатков варианта AvPAL, выбранных из группы, состоящей из цистеиновых остатков в положениях 64, 318, 503 и 565, были заменены сериновым остатком. В более предпочтительном варианте изобретения цистеиновый остаток в положении 565 варианта AvPAL был заменен сериновым остатком. В наиболее предпочтительном варианте изобретения цистеиновые остатки в положениях 503 и 565 варианта AvPAL были заменены сериновыми остатками.
Желательными вариантами прокариотического PAL могут быть гибридные белки, в которых фермент PAL был присоединен к другому гетерологичному полипептиду, такому как нативная или модифицированная константная область иммуноглобулина или его фрагмента, сохраняющие эпитоп «спасения», который, как известно, увеличивает время полужизни или распознается белками, специфичными к конкретным формам рака.
В настоящем изобретении также рассматриваются химически модифицированные варианты таких полипептидов прокариотического PAL, которые были присоединены к химической молекуле, сообщающей другие преимущественные эффекты. Так, например, известно, что неспецифическое или сайт-специфическое (например, N-концевое) присоединение водорастворимых полимеров, например, полиэтиленгликоля, к полипептидам приводит к увеличению времени полужизни, а связывание химических молекул может также приводить к снижению иммуногенности и/или к повышению резистентности к протеазе.
В некоторых вариантах изобретения вариант прокариотического PAL включает водорастворимый полимер. В предпочтительных вариантах изобретения вариант прокариотического PAL включает полиэтиленгликоль. В более предпочтительном варианте изобретения вариант прокариотического PAL представляет собой PAL Anabaena variabilis (AvPAL), а отношение AvPAL к полиэтиленгликолю составляет примерно 1:3 (AvPAL:ПЭГ=1:3). В наиболее предпочтительном варианте изобретения вариантом прокариотического PAL является вариант AvPAL, отношение варианта AvPAL к полиэтиленгликолю составляет примерно 1:3 (AvPAL:ПЭГ=1:3), а цистеиновые остатки в положениях 503 и 565 варианта AvPAL были заменены сериновыми остатками.
В некоторых вариантах изобретения один или несколько аминокислотных остатков варианта прокариотического PAL были заменены лизиновым остатком. ПЭГилирование дополнительного(ых) лизинового(ых) остатка(ов) в варианте прокариотического PAL может приводить к образованию фермента, обладающего пониженной иммуногенностью, повышенной каталитической активностью и/или повышенной биохимической стабильностью. Не ограничиваясь какой-либо конкретной теорией можно лишь высказать предположение, что тирозиновый остаток, находящийся в активном центре прокариотического PAL (например, в положении 78 в AvPAL) или расположенный рядом с этим центром, может представлять собой сайт для ПЭГилирования, способствующий снижению ферментативной активности. В предпочтительном варианте изобретения одна или несколько аминокислот, расположенных в активном центре или рядом с активным центром варианта прокариотического PAL и не требующихся для ферментативной активности, заменены лизиновым остатком. Не ограничиваясь какой-либо конкретной теорией, можно лишь высказать предположение, что ПЭГилирование замененного лизинового остатка, расположенного в активном центре или рядом с активным центром, приводит к стерическому затруднению ПЭГилирования тирозинового остатка (например, в положении 78 в AvPAL).
Такие варианты прокариотического PAL выделяют и очищают способами согласно изобретению, и полученные таким образом варианты присутствуют в количествах, достаточных для применения прокариотического фермента PAL в терапевтических целях. В некоторых вариантах изобретения используется кДНК, кодирующая полноразмерный прокариотический PAL или прокариотический PAL дикого типа. Однако, в других вариантах изобретения может быть использована кДНК, кодирующая биологически активный фрагмент, мутант, вариант или аналог такого фермента. Кроме того, настоящее изобретение относится к композициям оптимизированного прокариотического PAL, полученным методами структурного молекулярного конструирования, и/или химически модифицированных (например, ПЭГилированных) форм PAL. В конкретных вариантах изобретения рассматриваются оптимальные композиции прокариотического PAL, которые обладают повышенной удельной активностью, повышенной стабильностью, пониженной иммуногенностью и/или пониженной чувствительностью к протеолизу, и которые могут быть использованы в терапевтических целях. Предпочтительным вариантом является ПЭГилированная форма PAL Nostoc punctiforme, обладающая повышенной удельной активностью, повышенной стабильностью, пониженной иммуногенностью и/или пониженной чувствительностью к протеолизу. Другим предпочтительным вариантом является ПЭГилированная форма PAL Anabaena variabilis, обладающая повышенной удельной активностью, повышенной стабильностью, пониженной иммуногенностью и/или пониженной чувствительностью к протеолизу.
В некоторых вариантах изобретения биологически активные центры прокариотического PAL дикого типа согласно изобретению могут быть модифицированы, если это необходимо, для оптимизации кинетических свойств PAL. В предпочтительном варианте изобретения модифицированный прокариотический PAL, после его введения индивидууму, обладает активностью, достаточной для снижения уровней фенилаланина в плазме и составляющей в пределах от нижнего детектируемого уровня и примерно до 20 мкМ-60 мкМ, предпочтительно, примерно менее чем 20 мкМ, а еще более предпочтительно, примерно менее чем 10 мкМ, как было определено стандартными методами детектирования, хорошо известными специалистам. В других предпочтительных вариантах изобретения биологически активный модифицированный прокариотический PAL имеет kcat по меньшей мере примерно 0,1 с-1, предпочтительно, более чем примерно 0,5 с-1, а еще более предпочтительно, более чем примерно 1,0 с-1. В более предпочтительных вариантах изобретения биологически активный модифицированный прокариотический PAL имеет kcat по меньшей мере примерно 0,4 с-1, предпочтительно, более чем примерно 2,0 с-1, а еще более предпочтительно, более чем примерно 4,0 с-1. В других предпочтительных вариантах изобретения биологически активный модифицированный прокариотический PAL имеет Km примерно от 10 мкМ до 2000 мкМ. В более предпочтительных вариантах изобретения биологически активный модифицированный прокариотический PAL имеет Km примерно от 10 мкМ до 1000 мкМ. В еще более предпочтительных вариантах изобретения биологически активный модифицированный прокариотический PAL имеет Km примерно от 10 мкМ до 500 мкМ. В других предпочтительных вариантах изобретения биологически активный модифицированный прокариотический PAL обладает ферментативной активностью, которая составляет по меньшей мере примерно 50% от ферментативной активности PAL дикого типа, и примерно до величины, в 10 раз превышающей активность PAL дикого типа. В других предпочтительных вариантах изобретения биологически активный модифицированный прокариотический PAL обладает ферментативной активностью, которая по меньшей мере примерно на 50%-100% превышает ферментативную активность PAL дикого типа. Такие биологически активные модифицированные прокариотические белки PAL могут быть получены методами, хорошо известными специалистам, такими как сайт-направленный мутагенез.
В других своих вариантах настоящее изобретение относится к использованию прокариотического PAL или его биологически активного фрагмента, мутанта, варианта или аналога, участвующих в метаболизме фенилаланина (то есть, превращают фенилаланин в другое вещество), в целях приготовления лекарственного препарата для предупреждения или лечения рака у индивидуума, а предпочтительно, у человека, а также для приготовления фармацевтической композиции, содержащей прокариотический PAL или его биологически активный фрагмент, мутант, вариант или аналог, для предупреждения или лечения рака у индивидуума, а предпочтительно, у человека. В некоторых вариантах изобретения указанный лекарственный препарат может быть использован для предупреждения рака у человека. В других вариантах изобретения указанный лекарственный препарат может быть использован для лечения рака у человека. В предпочтительном варианте изобретения фармацевтическая композиция содержит в высокой степени очищенный PAL, происходящий от бактерий, или его биологически активный фрагмент, мутант, вариант или аналог и фармацевтически приемлемый носитель. Предпочтительные препараты содержат прокариотический PAL или его биологически активный фрагмент, мутант, вариант или аналог с чистотой более чем 90%, 95%, 96%, 97%, 98%, 99%, 99,2%, 99,5%, 99,6%, 99,7%, 99,8% или 99,9%. Относительная удельная активность прокариотического PAL или его биологически активного фрагмента, мутанта, варианта или аналога согласно изобретению, предпочтительно, составляет по меньшей мере примерно 50%, а более предпочтительно, более чем примерно 110% от удельной активности прокариотического PAL дикого типа.
Во втором своем аспекте настоящее изобретение относится к новым способам применения композиций варианта прокариотического PAL в терапевтических целях. В настоящем изобретении рассматриваются способы лечения различных форм рака.
В одном из своих вариантов настоящее изобретение относится к способам лечения рака путем введения индивидууму, нуждающемуся в таком лечении, терапевтически эффективного количества фармацевтической композиции, содержащей вариант прокариотического PAL и фармацевтически приемлемый носитель, где указанный вариант прокариотического PAL обладает более высокой фенилаланин-конвертирующей активностью и/или более низкой иммуногенностью по сравнению с PAL дикого типа, и является эффективным для снижения концентрации фенилаланин в крови, сыворотке или в плазме, а предпочтительно, в плазме индивидуума до уровня, составляющего в пределах от нижнего детектируемого уровня и примерно до 20 мкМ-60 мкМ, предпочтительно, примерно менее чем 20 мкМ, а еще более предпочтительно, примерно менее чем 10 мкМ. В некоторых вариантах изобретения один или несколько аминокислотных остатков варианта прокариотического PAL были заменены другим аминокислотным остатком, где указанная замена приводит к повышению фенилаланин-конвертирующей активности и/или к снижению иммуногенности по сравнению с PAL дикого типа. В некоторых вариантах изобретения один или несколько цистеиновых остатков варианта прокариотического PAL были заменены другим аминокислотным остатком. В некоторых вариантах изобретения один или несколько цистеиновых остатков варианта прокариотического PAL были заменены сериновым остатком. В предпочтительном варианте изобретения вариантом прокариотического PAL является вариант PAL Anabaena variabilis (AvPAL). В особенно предпочтительном варианте изобретения один или несколько цистеиновых остатков варианта AvPAL были заменены сериновым остатком, то есть, один из указанных цистеиновых остатков, выбранных из группы, состоящей из цистеиновых остатков в положениях 64, 318, 503 и 565, был заменен сериновым остатком в положении 565, или два из указанных цистеиновых остатков были заменены сериновыми остатками в положениях 503 и 565. В некоторых вариантах изобретения вариант прокариотического PAL содержит водорастворимый полимер. В некоторых вариантах изобретения указанным водорастворимым полимером является полиэтиленгликоль. В предпочтительном варианте изобретения указанным вариантом прокариотического PAL является вариант PAL Anabaena variabilis (AvPAL), а отношение варианта AvPAL к полиэтиленгликолю составляет примерно 1:3 (AvPAL:ПЭГ=1:3). В более предпочтительном варианте изобретения указанным вариантом прокариотического PAL является вариант PAL Anabaena variabilis (AvPAL), отношение варианта AvPAL к полиэтиленгликолю составляет примерно 1:3 (AvPAL:ПЭГ=1:3), а цистеиновые остатки в положениях 503 и 565 варианта AvPAL были заменены сериновыми остатками.
В более конкретном предпочтительном варианте настоящее изобретение относится к способу лечения рака, включающему введение индивидууму, нуждающемуся в таком лечении, терапевтически эффективного количества фармацевтической композиции, содержащей вариант AvPAL и фармацевтически приемлемый носитель, где указанные цистеиновые остатки в положениях 503 и 565 варианта AvPAL были заменены сериновыми остатками, вариант AvPAL также содержит водорастворимый полимер полиэтиленгликоля, где отношение варианта AvPAL к полиэтиленгликолю составляет примерно 1:3, а вариант AvPAL является эффективным для снижения концентрации фенилаланина в крови, сыворотке или плазме, а предпочтительно, в плазме индивидуума, до уровня, составляющего в пределах от нижнего детектируемого уровня и примерно до 20 мкМ-60 мкМ, предпочтительно, примерно менее чем 20 мкМ, а еще более предпочтительно, примерно менее чем 10 мкМ.
В широком варианте изобретения раковым заболеванием является раковое заболевание, при котором пролиферация и/или выживание раковых клеток являются чувствительными к ограничению уровня или к дефициту фенилаланина. В предпочтительных вариантах изобретения указанным раковым заболеванием является рак легких, рак головного мозга или центральной нервной системы, рак толстой кишки, рак предстательной железы, рак почек или метастатическая меланома. В других предпочтительных вариантах изобретения указанным раковым заболеванием является рак головы и шеи, рак яичника, рак матки, лейкоз (например, острый миелоидный лейкоз или острый лимфобластный лейкоз) или миелома. В других предпочтительных вариантах изобретения указанным раковым заболеванием является рак у детей или резистентный рак (то есть, рак, который, как было обнаружено, является резистентным к противораковым терапевтическим средствам или к противораковым терапевтическим средствам направленного действия).
В настоящем изобретении описаны способы лечения рака у индивидуума, включающие введение индивидууму прокариотического PAL или его биологически активного фрагмента, мутанта, варианта или аналога, где указанное введение прокариотического PAL является эффективным для снижения концентрации фенилаланина (Phe) в крови, сыворотке или в плазме, а предпочтительно, в плазме индивидуума, по сравнению с концентрацией в отсутствие прокариотического PAL. Индивидуум, подвергаемый лечению способами согласно изобретению, может иметь любую концентрацию Phe в плазме, например, примерно от 40 мкМ до 2000 мкМ, или концентрацию Phe в плазме в нормальных пределах, например, такая концентрация может составлять в пределах примерно от 40 мкМ до 80 мкМ, а обычно, примерно от 50 мкМ до 70 мкМ, а у большинства людей такая концентрация составляет примерно от 55 мкМ до 65 мкМ. Концентрация Phe в плазме у индивидуума после лечения снижается до пределов от нижнего уровня детекции и примерно до 20 мкМ-60 мкМ, предпочтительно, до менее чем примерно 20 мкМ, а еще более предпочтительно, до менее чем примерно 10 мкМ, как было определено стандартными методами детектирования, хорошо известными специалистам.
В настоящем изобретении также рассматриваются способы лечения рака путем введения индивидууму, нуждающемуся в таком лечении, терапевтически эффективного количества фармацевтической композиции, содержащей вариант прокариотического PAL и фармацевтически приемлемый носитель в комбинации с пищей с ограниченным содержанием белка (то есть, не содержащей фенилаланина), где указанное лечение является эффективным для снижения концентрации Phe в плазме у указанного индивидуума в отличие от лечения, проводимого в отсутствие комбинированного введения. Концентрация Phe в плазме у индивидуума после лечения снижается в пределах от нижнего детектируемого уровня и примерно до 20 мкМ-60 мкМ, предпочтительно, до менее чем примерно 20 мкМ, а еще более предпочтительно, до менее чем примерно 10 мкМ, как было определено стандартными методами детектирования, хорошо известными специалистам.
В другом варианте изобретения прокариотический PAL или его биологически активный фрагмент, мутант, вариант или аналог могут быть также введены в комбинации с пищей с ограниченным содержанием белка. Пищей с ограниченным содержанием белка, вводимой описанным здесь способами, является пища с ограниченным содержанием фенилаланина, где общее потребление Phe данным индивидуумом ограничено до менее чем 600 мг в день. В других вариантах изобретения пищей с ограниченным содержанием белка является пища с ограниченным содержанием фенилаланина, где общее потребление Phe ограничено до менее чем 300 мг в день. В других вариантах изобретения пищей с ограниченным содержанием белка является пища, в которую добавлены одна или несколько аминокислот, таких как, например, но не ограничивающихся ими, тирозин, валин, изолейцин и/или лейцин.
В настоящем изобретении также рассматривается фармацевтическая композиция, содержащая прокариотический PAL или его биологически активный фрагмент, мутант, вариант или аналог, и фармацевтически приемлемый носитель, разбавитель или наполнитель. Фармацевтическая композиция может также содержать белковую лечебную добавку. В других вариантах изобретения такой белковой добавкой является добавка, не содержащая фенилаланина. Указанная белковая добавка, предпочтительно, обогащена L-тирозином, L-глутамином, L-карнитином, содержащимися в концентрации 20 мг/100 г добавки, L-таурином, содержащимся в концентрации 40 мг/100 г добавки, и селеном. Такая добавка может также содержать рекомендованные суточные дозы минералов, например, кальция, фосфора и магния. Указанная добавка может также содержать рекомендованную суточную дозу одной или нескольких аминокислот, выбранных из группы, состоящей из L-лейцина, L-пролина, ацетата L-лизина, L-валина, L-изолейцина, L-аргинина, L-аланина, глицина, моногидрата L-аспарагина, L-триптофана, L-серина, L-треонина, L-гистидина, L-метионина, L-глутаминовой кислоты и L-аспарагиновой кислоты. Кроме того, такая добавка может содержать рекомендованную суточную дозу витаминов A, D и E. Указанная добавка, предпочтительно, имеет содержание жира, которое обеспечивает по меньшей мере 40% энергетической ценности данной добавки. Такая добавка может быть приготовлена в форме порошка или белкового брикета.
В настоящем изобретении также рассматриваются способы лечения рака путем введения индивидууму, нуждающемуся в таком лечении, терапевтически эффективного количества фармацевтической композиции, содержащей вариант прокариотического PAL и фармацевтически приемлемый носитель в комбинации с противораковым терапевтическим средством или с противораковым терапевтическим средством направленного действия, где указанное лечение является эффективным для снижения концентрации фенилаланина в плазме у указанного индивидуума в отличие от лечения, проводимого в отсутствие комбинированного введения. Концентрация Phe в плазме у индивидуума после лечения снижается в пределах от нижнего детектируемого уровня и примерно до 20 мкМ-60 мкМ, предпочтительно, до менее чем примерно 20 мкМ, а еще более предпочтительно, до менее чем примерно 10 мкМ, как было определено стандартными методами детектирования, хорошо известными специалистам.
Предпочтительные варианты включают оптимизацию дозы, вводимой в организм, подвергаемый лечению, а предпочтительно, млекопитающему или человеку, до уровней, которые являются эффективными для предупреждения или ослабления симптомов заболевания. Прокариотический PAL может быть введен в виде одной суточной дозы, дробных суточных доз, одной еженедельной дозы, дробных еженедельных доз, одной ежемесячной дозы или дробных ежемесячных доз. В некоторых вариантах изобретения PAL-терапия не является непрерывной, но тем не менее, PAL может вводиться ежедневно до тех пор, пока концентрация PAL в плазме индивидуума не будет снижаться в пределах от нижнего детектируемого уровня и примерно до 20 мкМ-60 мкМ, предпочтительно, до менее чем примерно 20 мкМ, а еще более предпочтительно, до менее чем примерно 10 мкМ, как было определено стандартными методами детектирования, хорошо известными специалистам. Мониторинг концентрации Phe в плазме индивидуума предпочтительно проводят ежедневно, а PAL вводят в том случае, если наблюдается 10%-20%-ое увеличение концентрации Phe в плазме. В других предпочтительных вариантах изобретения дозы вводят один раз в неделю. В настоящем изобретении рассматриваются дозы, составляющие по меньшей мере 0,001 мг/кг, 0,005 мг/кг, 0,01 мг/кг, 0,05 мг/кг, и такие дозы могут составлять до 0,1 мг/кг, 0,5 мг/кг, 1,0 мг/кг, 5,0 мг/кг, 12 мг/кг в неделю или выше. Предпочтительной дозой является доза 1 мг/кг/неделю, более предпочтительной дозой является доза 0,1 мг/кг/неделю, а еще более предпочтительной дозой является доза 0,01 мг/кг/неделю.
В настоящем изобретении рассматриваются парентеральные или непарентеральные способы введения, включая пероральное введение, чрескожное введение, введение через слизистую, внутрилегочное введение (включая введение с помощью аэрозоля), внутримышечное введение, подкожное введение или внутривенное введение, которые позволяют доставлять эквивалентные дозы. Также конкретно рассматривается инъекция или инфузия ударной дозы непосредственно в суставы или в цереброспинальную жидкость, такая как интратекальная, интрацеребральная, интравентрикулярная инъекция или инфузия, инъекция или инфузия, вводимая посредством люмбальной пункции или через мозжечково-мозговую цистерну. Предпочтительные дозы вводят подкожно или перорально.
Рассматриваются также и другие способы повышения активности прокариотического PAL у человека, включая генотерапию. Перенос гена прокариотического PAL может быть осуществлен различными методами, известными специалистам, включая перенос с использованием вирусных векторов, гомологичную рекомбинацию или прямую инъекцию ДНК. В объем данного аспекта изобретения входят варианты, отличающиеся тем, что они имеют последовательности нуклеиновой кислоты, кодирующие весь прокариотический PAL или его часть или его биологически активный фрагмент, мутант, вариант или аналог, которые могут быть введены in vivo в клетки, которыми являются, например, но не ограничиваются ими, клетки, пораженные раком; клетки, находящиеся