Определение чувствительности клеток к обработке ингибитором b-raf путем детекции мутации k-ras и уровней экспрессии rtk
Иллюстрации
Показать всеИзобретение относится к области медицины. Предложен способ, включающий определение наличия или отсутствия мутации K-rasG12D. Наличие мутации K-rasG12D указывает на то, что пациент не ответит на лечение ингибитором В-Raf. Изобретение обеспечивает эффективный способ идентификации пациента, не отвечающего на лечение ингибитором B-Raf. 5 з.п. ф-лы, 34 ил., 12 табл., 3 пр.
Реферат
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
По настоящей заявке испрашивается в соответствии с 35 U.S.C. § 119(e) приоритет предварительных заявок США серийный номер 61/236466, поданной 24 августа 2009 г., и 61/301149, поданной 3 февраля 2010 г., которые приводятся в настоящем документе в качестве ссылки в полном объеме для всех целей.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Изобретение относится к диагностике и лечению рака и, в частности, определению мутаций или сверхэкспрессии RTK, которые являются диагностически и/или прогностически значимыми, и выбору лечения рака в зависимости от определения.
УРОВЕНЬ ТЕХНИКИ
Рецепторные тирозинкиназы (RTK) и их лиганды являются важными регуляторами пролиферации опухолевых клеток, ангиогенеза и метастазирования. Например, к семейству RTK ErbB относятся EGFR (HER1 и ErbB1), HER2 (neu или ErbB2), HER3 (ErbB3) и HER4 (ErbB4), и они обладают явными лиганд-связывающей и сигнальной активностями. К лигандам, которые связываются с рецепторами ErbB, относятся эпидермальный фактор роста (EGF), трансформирующий фактор роста а (TGFa), гепарин-связывающий EGF-подобный лиганд (HB-EGF), амфирегулин (AR), бетацеллюлин (BTC), эпирегулин (EPR), эпиген (EPG), херегулин (HRG) и нейрегулин (NRG). Эти лиганды связываются непосредственно с EGFR, HER3 или HER4 и запускают большое число последующих сигнальных каскадов, к которым относятся пути RAS-ERK и PI3K-Akt. EGF и другие факторы роста и цитокины, такие как тромбоцитарный фактор роста (PDGF), передают сигнал через Ras. Мутации Ras прочно блокируют Ras в его активном, связанном с GTP состоянии (Wislez, M., et al., Cancer Drug Discovery and Development: EGFR Signaling Networks in Cancer Therapy, Eds: J.D. Haley and W.J.Gullick, Humana Press, pp.89-95, 2008).
Другой RTK является МЕТ, активация которой с помощью ее лиганда - фактора роста гепатоцитов (HGF) - индуцирует каталитическую активность киназы МЕТ, что запускает трансфосфорилирование тирозинов Tyr 1234 и Tyr 1235. Эти два тирозина запускают большое число сигнальных трансдукторов, таким образом, инициируя целый спектр биологических активностей, вызванных МЕТ. HGF индуцирует длительную активацию RAS и, таким образом, пролонгированную активность МАРК.
Одним из генов ras является K-ras, который подвергается мутации в большом числе видов рака. Мутация гена K-ras в кодонах 12 и 13 вносит вклад в онкогенез, приводя к функциональной модификации белка р21-ras, продукта гена K-ras, результатом чего является перенос избыточных сигналов роста в ядро клетки, стимулируя рост и деление клетки. Поэтому идентификация мутаций гена K-ras была широко использована в качестве удобного средства в диагностике рака, например, рака поджелудочной железы, колоректального и немелкоклеточного рака легких, и исследованиями было показано, что она могла бы быть ассоциирована с несколькими фенотипами опухолей (Samowitz W. S., et al., Cancer Epidemiol. Biomarkers Prev. 9: 1193-1197, 2000; Andreyev H. J., et al., Br. J. Cancer 85: 692-696, 2001; и Brink M., et al., Carcinogenesis 24: 703-710, 2003).
Ras имеет существенное значение в онкогенной трансформации и генезе. Онкогенные Н-, К- и N-Ras возникают из-за точечных мутаций, ограниченных небольшим количеством сайтов (аминокислоты 12, 13, 59 и 61). В отличие от нормальных Ras онкогенные белки ras лишены присущей им GTPазной активности и поэтому остаются постоянно активированными (Trahey, M., и McCormick, F. (1987) Science 238: 542-5; Tabin, C.J. et al. (1982) Nature. 300: 143-9; Taparowsky, E. et al. (1982) Nature. 300: 762-5). Вклад онкогенного ras при раке человека оценивают в 30% (Almoguera, C. et al. (1988) Cell. 53:549-54).
Мутации часто ограничиваются лишь одним из генов ras, и частота является ткане- и опухолеспецифичной. Самым распространенным мутированным онкогеном при раке человека является K-ras, особенно часто встречается мутация в кодоне 12. В то время как онкогенная активация Н-, К- и N-Ras, возникающая из-за однонуклеотидных замен, была обнаружена в 30% случаев рака человека (Bos, J.L. (1989) Cancer Res 49, 4682-9), мутация K-ras по кодону 12 обнаруживается в более чем 90% случаев рака поджелудочной железы человека (Almoguera, C. et al. (1988) Cell 53, 549-54; Smit, V.T. et al. (1988) Nucleic Acids Res 16, 7773-82; Bos, J.L. (1989) Cancer Res 49, 4682-9). Протоковая аденокарцинома поджелудочной железы, самый распространенный рак поджелудочной железы, печально известна по причине ее быстрого возникновения и резистентности к лечению. Высокая частота мутаций K-ras при опухолях поджелудочной железы человека указывает на то, что постоянная активация Ras имеет решающее значение в процессе онкогенеза поджелудочной железы. Аденокарцинома экзокринной части поджелудочной железы представляет четвертую причину связанной с раком смертности в странах Запада. Лечение имело ограниченный успех, и пятилетняя выживаемость остается меньше чем 5% со средней выживаемостью 4 месяца для пациентов с неоперабельными опухолями (Jemal, A. et al. (2002) CA Cancer J Clin 52, 23-47; Burris, H.A., 3rd et al. (1997) J Clin Oncol 15, 2403-13). Данная точечная мутация может быть рано идентифицирована в течение заболевания при прогрессировании нормального кубического эпителия протоков поджелудочной железы в плоский гиперпластический очаг, и как полагают, является причиной заболевания в патогенезе рака поджелудочной железы (Hruban, R.H. et al (2000) Clin Cancer Res 6, 2969-72; Tada, M. et al. (1996) Gastroenterology 110, 227-31). Регуляция сигналинга онкогенного K-ras при раке поджелудочной железы человека, тем не менее, остается главным образом неизвестной.
Мутации К-ras находят в 50% случаев рака толстого кишечника и легких (Bos, J.L. et al. (1987) Nature. 327: 293-7; Rodenhuis, S. et al. (1988) Cancer Res. 48: 5738-41). В случаях рака мочевыводящих путей и мочевого пузыря мутации в основном находятся в гене Н-ras (Fujita, J. et al. (1984) Nature. 309: 464-6; Visvanathan, K.V. et al. (1988) Oncogene Res. 3: 77-86). Мутации гена N-ras встречаются в 30% случаев лейкоза и рака печени. Приблизительно в 25% случаев повреждений кожи у человека вовлечены мутации Ha-Ras (25% для плоскоклеточной карциномы и 28% для меланом) (Bos, J.L. (1989) Cancer Res. 49: 4683-9; Migley, R.S, and Kerr, D.J. (2002) Crit Rev Oncol Hematol. 44: 109-20). 50-60% случаев карцином щитовидной железы уникальны, имея мутации во всех трех генах (Adjei, A.A. (2001) J Natl Cancer Inst. 93: 1062-74).
Постоянная активация Ras может быть достигнута посредством онкогенных мутаций или через гиперактивированные рецепторы факторов роста, такие как EGFR. Повышенная экспрессия и/или амплификация членов семейства EGFR, особенно EGFR и HER2, могут быть задействованы в большом числе форм злокачественных опухолей человека (как показано в статье Prenzel, N. et al. (2001) Endocr Relat Cancer. 8: 11-31). При некоторых из этих видов рака (к которым относятся рак поджелудочной железы, толстого кишечника, мочевого пузыря, легких) сверхэкспрессия EGFR/HER2 усугубляется наличием онкогенных мутаций Ras. Аномальная активация этих рецепторов в опухолях может быть объяснена сверхэкспрессией, амплификацией гена, мутациями, приводящими к постоянной активации, или аутокринными петлями факторов роста (Voldborg, B.R. et al. (1997) Ann Oncol. 8: 1197-206). В отношении рецепторов факторов роста, особенно рецепторов EGFR, амплификация или/и сверхэкспрессия этих рецепторов часто обнаруживается при раке молочных желез, яичников, желудка, пищевода, поджелудочной железы, легких, толстого кишечника и нейробластоме.
Сигнальный путь RAS-MAPK контролирует рост, дифференциацию и жизнеспособность клетки. Этот сигнальный путь долгое время считался перспективным путем для противораковой терапии вследствие его центральной роли в регуляции роста и жизнеспособности клеток широкого спектра опухолей человека, и мутации в компонентах этого сигнального пути лежат в основе инициации опухоли в клетках млекопитающих (Sebolt-Leopold et al (2004) Nat Rev Cancer 4, pp 937-47).
Сигнальный путь RAS-MAPK активируется большим числом внеклеточных сигналов (гормонами и факторами роста), которые активируют RAS путем замены GDP на GTP. Ras затем привлекает RAF к плазматической мембране, где происходит его активация. Как отмечалось выше, в основе инициации опухоли в клетках млекопитающих лежат мутации в компонентах сигнального пути, приводящие к постоянной активации. Например, рецепторы факторов роста, такие как рецептор эпидермального фактора роста (EGFR), при многих типах рака подвергаются амплификациям и мутациям, составляя до 25% случаев немелкоклеточного рака легких и 60% случаев глиобластом. Также часто мутирует Braf, особенно при меланомах (приблизительно в 70% случаев) и карциномах толстого кишечника (приблизительно в 15% случаев). Более того, самым часто мутированным онкогеном, присутствующим приблизительно в 30% всех типов рака человека, является ras. Частота и тип мутированных генов ras (Н-ras, К-ras или N-ras) широко варьируют в зависимости от типа опухоли. К-ras, тем не менее, является наиболее часто мутированным геном, причем наибольшее число случаев детектировалось при раке поджелудочной железы (приблизительно 90%) и колоректальном раке (приблизительно 45%). Это делает его, а также другие компоненты сигнального пути подходящей мишенью противораковой терапии. Действительно, прошли клинические испытания низкомолекулярные ингибиторы, созданные для нацеливания большого числа стадий этого пути. Более того, недавно был одобрен для лечения почечно-клеточной карциномы ингибитор RAF-киназы, приводящий к ингибированию передачи сигнала RAS, сорафениб (Nexavar.RTM., Bayer HealthCare Pharmaceuticals). На основании этих данных сохраняется повышенный интерес к нацеливанию пути RAS-МАРК для разработки улучшенных способов лечения рака.
Описанные в статье Downward, J. (2002) Nature Reviews Cancer, volume 3, pages 11-22, белки RAS являются членами большого суперсемейства низкомолекулярных GTP-связывающих белков, которые могут быть подразделены на несколько семейств согласно степени консерватизма последовательностей. Различные семейства важны для различных клеточных процессов. Например, семейство RAS контролирует рост клетки, и семейство RHO контролирует актиновый цитоскелет. Обычно семейство RAS описывают как состоящее из трех членов Н-, N- и К-RAS, причем К-RAS продуцирует большой (4В) и малый (4А) сплайсированный вариант (Ellis, C.A. and Clark, G. (2000) Cellular Signalling, 12: 425-434). Обнаружено, что члены семейства RAS активируются мутацией в опухолях человека и обладают сильным трансформирующим потенциалом.
Члены RAS являются очень близкородственными, имея гомологию аминокислотных последовательностей 85%. Несмотря на то, что белки RAS функционируют в очень схожих путях, недавно стали известны некоторые указания на тонкие различия между ними. Белки Н-ras, К-ras и N-ras широко экспрессируются, причем К-ras экспрессируется почти во всех типах клеток. Исследования с нокаутом показали, что для нормального развития мыши не требуются Н-ras и N-ras ни самостоятельно, ни в сочетании, тогда как К-ras существенен (Downward, J (2002) на странице 12).
Более того, как описано в статье Downward, J (2002), нарушенная передача сигнала через пути RAS происходит в результате нескольких различных классов мутационного повреждения в опухолевых клетках. Самые наглядные из этих мутаций находятся в самих генах ras. Приблизительно 20% опухолей человека имеют в ras активирующие точечные мутации, чаще в К-ras (около 85% всех), затем N-ras (около 15%), затем Н-ras (менее 1%). Все эти мутации компромитируют GTPазную активность RAS, предотвращая стимулированный GAP-белками гидролиз GTP на RAS и таким образом вызывая аккумуляцию RAS в GTP-связанной, активной форме. Активация почти всех RAS в опухолях объясняется мутациями в кодонах 12, 13 и 61 (страница 15 статьи Downward, J (2002)).
Было бы эффективно, если бы лечение рака можно было подбирать для конкретного рака. В частности настоящее изобретение относится к способам определения, не окажутся ли некоторые утвержденные и доступные способы лечения все-таки неэффективными для конкретного типа рака.
КРАТКАЯ СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к прогностическим способам идентификации опухолей, которые не чувствительны к лечению ингибитором В-Raf, путем определения мутаций в гене или белке К-ras. К способам относится определение наличия или отсутствия в образце мутированного гена или белка К-ras, таким образом, идентифицируя опухоль, которая не отвечает на лечение ингибитором В-Raf. Для осуществления способов также описаны наборы.
В другом аспекте настоящее изобретение относится к прогностическим способам идентификации опухолей, которые не чувствительны к лечению ингибитором В-Raf, путем определения аберрантных уровней экспрессии RTK. К способам относится определение уровней экспрессии некоторых RTK в образце, причем сверхэкспрессия RTK коррелирует с отсутствием ответа на лечение ингибитором В-Raf. К примерам RTK, которые коррелируют с ответом на лечение В-Raf, относятся, но ими не ограничиваются, EGFR и cMet. К способам также относится определение уровней индукции некоторых лигандов RTK в образце, причем аномально высокие уровни индукции лигандов коррелируют с отсутствием ответа на лечение ингибитором В-Raf. К примерам лигандов, которые коррелируют с ответом на лечение В-Raf, относятся, но ими не ограничиваются, EGF и HGF. К способам также относится определение в образце уровней Ras-GTP, причем аномально высокие уровни Ras-GTP коррелируют с отсутствием ответа на лечение ингибитором В-Raf. Для осуществления способов также описаны наборы.
В другом аспекте настоящее изобретение относится к способам лечения опухоли, которая не отвечает на лечение ингибитором В-Raf. К способам относится введение ингибитора В-Raf в сочетании с ингибитором EGFR.
ОПИСАНИЕ ФИГУР
На фигуре 1 представлены данные биохимического ферментативного анализа. Данные указывают на то, что при физиологическом уровне [ATP] лишь у GDC-0879 сохраняется эффективность как против В-RafV600E, так и Raf WT изоформ.
На фигуре 2 представлены анализы жизнеспособности на линиях опухолей с различным статусом мутирования Raf/Ras.
На фигуре 3 показана длительная индукция рМЕК посредством ингибиторов Raf лишь на линиях, отличных от В-RafV600E. Уровни рМЕК достигают определенного уровня относительно IC50 ингибиторов против Raf WT.
На фигуре 4 показано, что с-Raf представляет собой изоформу Raf, главным образом ответственную за индукцию рМЕК ингибиторами Raf на линиях, отличных от В-RafV600E.
На фигуре 5 представлена специфическая активность с-Raf, индуцированная обоими ингибиторами лишь на линиях, отличных от В-RafV600E. Не оказалось снижения уровней прорастания в условиях индукции Raf.
На фигуре 6 показано отсутствие индукции уровней pERK. Относительная эффективность ингибиторов коррелирует с их биохимическими IC50.
На фигуре 7 показано колоколообразное влияние на уровни рМЕК в исходных условиях. Ингибирующее влияние GDC-0879 преобладает после стимуляции сывороткой.
На фигуре 8А показано, что продолжительность и величину ингибирования пути BRAF определяет ингибитор В-Raf, эффективность GDC-0879 на основных моделях ксенотрансплантатов опухоли человека. График Каплана-Мейера, показывающий время удвоения опухоли для моделей полученных от пациентов опухолей: меланомы и немелкоклеточного рака легких, обработанных ежедневно с помощью GDC-0879 в количестве 100 мг/кг или носителем. Генотипы BRAF, N-ras и K-ras указаны. Статистически значимое (P<0,05) замедление опухолевой прогрессии отмечалось для опухолей MEXF 989, MEXF 276 и MEXF 355. Введение GDC-0879 существенно усилило рост некоторых K-ras-мутантных немелкоклеточных опухолей легких, таких как LXFA 1041 и LXFA 983.
На фигуре 8В показано, что обработка с помощью GDC-0879 снижает фосфорилирование ERK1/2 в основных ксенотрансплантированных опухолях человека BRAFV600E. Во время курсовых фармакодинамических исследований мышей обрабатывали с помощью GDC-0879 в количестве 100 мг/кг и забивали через 1 или 8 ч после последней дозы (21-24 дни). Представлены иммуноблоты фосфорилированной и суммарной ERK1/2. Сильное ингибирование фосфо-ERK1/2, продолжавшееся через 8 ч, в значительной степени коррелировало со статусом BRAFV600E и противоопухолевой эффективностью GDC-0879. В качестве контроля нагрузки во всех образцах оценивали экспрессию суммарной ERK1/2.
На фигурах 9А, В, С и D показано, что у линий K-ras-мутантных опухолевых клеток наблюдается различная чувствительность к ингибитору RAF GDC-0879 и ингибитору МЕК in vivo и in vitro. На фигурах А и В, ингибирование МЕК, но не RAF, предотвратило рост in vivo K-RAS-мутантных опухолей НСТ116. При достижении опухолями размера ~200 мм3 мышей отбирали случайным образом и начинали обработку либо ингибитором GDC-0879 в количестве 100 мг/кг (А), либо ингибитором МЕК в количестве 25 мг/кг (МЕК Inh; B) по ежедневной схеме. Точки, среднее; черточки, SE. C, величины ЕС50 GDC-0879 130 линий клеток представлены в виде функции статуса мутирования BRAF и К-RAS. GDC-0879-опосредованное ингибирование роста клеток в значительной степени коррелировало с мутацией BRAF. D, точечные диаграммы величин ЕС50 ингибитора МЕК сгруппированы согласно генотипу. Ингибирование МЕК также влияло на значительную фракцию линий клеток, экспрессирующих BRAF дикого типа. Данные представляют среднее четырехкратных измерений.
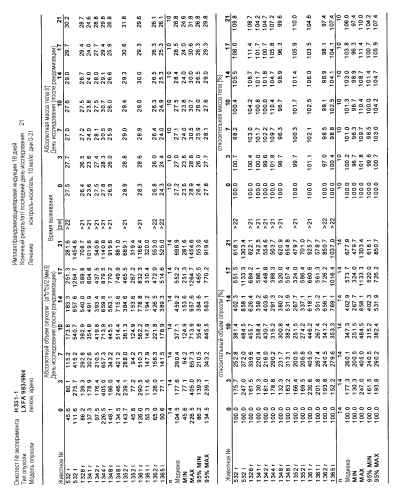
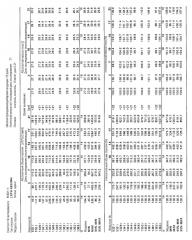
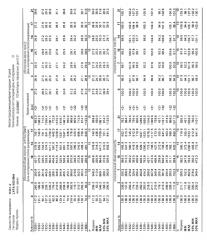
На фигурах 10-18 показан рост в ксенотрансплантатах опухолей легких после введения дозы GDC-0879.
На фигурах 19А и В представлены ингибиторы Raf, индуцирующие RAS-зависимую транслокацию RAF дикого типа в плазматическую мембрану в клетках, отличных от B-RAFV600E. (A) Клетки MeWo (RAS/RAFWT) обрабатывали с помощью GDC-0879 (2-{4-[(1E)-1-(гидроксиимино)-2,3-дигидро-1H-инден-5-ил]-3-(пиридин-4-ил)-1H-пиразол-1-ил}этан-1-ол), PLX4720 (N-[3-[(5-хлор-1Н-пирроло[2,3-b]пиридин-3-ил)карбонил]-2,4-дифторфенил]-1-пропансульфонамид) или AZ-628 (3-(2-цианопропан-2-ил)-N-(4-метил-3-(3-метил-4-оксо-3,4-дигидрохиназолин-6-иламино)фенил)бензамид) (все в концентрации 0,1, 1, 10 мМ) в течение 1 часа и фракционировали на мембранную (Р100) и цитозольную (S100) фракции. Аликвоты мембранной и цитозольной фракций подвергали иммуноблоттингу с указанными антителами. (В) Клетки НЕК293Т временно трансфицировали с помощью Venus-C-RAF (зеленый), CFP-K-RAS (красный) и mCherry-H2B (голубой). Меченный с помощью Venus C-RAF локализуется рядом с CFP-KRAS на плазматической мембране в клетках, обработанных в течение 4 часов с помощью GDC-0879 или AZ-628, взятых в концентрации 10 мМ, с последующим изображением жизнеспособных клеток, используя конфокальную флуоресцентную микроскопию. Транслокация на мембране блокируется при трансфекции доминантного негативного меченного CFP KRASS17N вместо KRASWT (правая панель).
На фигурах 20А, В, С и D показана важность роли, которую активный Ras играет в активации C-RAF и индукции фосфо-МЕК посредством ингибиторов RAF. (А) Клетки А375 (B-RAFV600E) обрабатывали с помощью GDC-0879 или PLX4720 в течение 1 часа и лизировали в гипотоничном буфере для фракционирования мембраны. Обе фракции, мембранную (Р100) и цитозольную (S100), подвергали иммуноблоттингу с указанными антителами. (В) Клетки MeWo временно трансфицировали с помощью KRASWT или KRASS17N, обрабатывали с помощью GDC-0879 или PLX4720 (в концентрациях 0,1, 1, 10 мМ) в течение 1 часа и фракционировали на мембранную (Р100) и цитозольную (S100) фракции. Аликвоты мембранной и цитозольной фракций подвергали иммуноблоттингу с антителами против фосфо- и против суммарной МЕК. (С) Из лизатов клеток MeWo (RAS/RAFWT), A375 (B-RAFV600E) и H2122 (KRASMT) измеряли уровни RAS-GTP с помощью протокола ELISA Ras-GTP, используя иммобилизованный C-RAF-RBD в качестве приманки для захвата RAS-GTP. Относительные единицы люминесценции представляют детекцию RAS антителом против RAS, связанным с RBD. По RAS-GTP H2122>>Mewo>A375. (D) Трансфекция мутантного KRASG12D (но не KRASWT) в клетки А375 (B-RAFV600E) дает возможность клеткам индуцировать гетеродимеры B-RAF:С-RAF и активировать киназу С-RAF при наличии ингибитора RAF GDC-0879 (дозированного по 0,1, 1, 10 мМ). С-RAF иммонопреципитировали из контрольных и обработанных ингибитором клеток и анализировали в отношении активности белка и гетеродимеризации B-RAF. Показанные с помощью WB суммарные уровни С-RAF в иммунопреципитате указывают загрузку каждой полосы.
На фигурах 21А, В, С и D представлены измерения исходного и стимулированного EGF нокдауна pERK с помощью ингибиторов Raf в линиях клеток B-RAFV600E и В-Raf WT. (A) Таблица генотипа и уровней EGFR среди протестированных линий. (В) Измерение исходных и стимулированных уровней pERK: клетки обрабатывали с помощью соединения, взятого в концентрации 0,0004-10 мМ, в бессывороточных средах в течение 1 часа. Для стимуляции за 5 мин до лизиса клеток добавляли EGF в количестве 20 нг/мл. Лизаты переносили в плашку MSD, на которой измеряли уровни фосфо- и суммарной ERK. (C) Данные по IC50 pERK наносили на графики для двух ингибиторов Raf (CHR-265, 1-метил-5-[[2-[5-(трифторметил)-1H-имидазол-2-ил]-4-пиридинил]окси]-N-[4-(трифторметил)фенил]-1H-бензимидазол-2-амина, и GDC-0879) в исходных и стимулированных с помощью EGF условиях. (D) Графики доза-ответ индукции pERK при 1-часовой обработке указанных линий B-Raf WT с помощью ингибиторов Raf.
На фигурах 22А и В показана стимуляция с помощью EGF уровней фосфо-МЕК и клеточной пролиферации линий мутантных клеток B-RAF V600E, резистентных к ингибитору RAF. (А) Клетки обрабатывали соединением в концентрации 0,0004-10 мМ в бессывороточных средах в течение 1 часа. Для стимуляции за 5 мин до лизиса клеток добавляли EGF в количестве 20 нг/мл. Лизаты переносили в плашку MSD, на которой измеряли уровни фосфо- и суммарной MEK. Данные по IC50 фосфо-МЕК наносили на график для двух указанных ингибиторов Raf в исходных и стимулированных EGF условиях. GDC-0879 более эффективен в нокдауне уровней фосфо-МЕК, поскольку он обладает меньшей доведенной величиной IC50 в отношении изоформ C-RAF и B-RAF дикого типа, чем PLX4720. (B) Обработка EGF выявляет клетки B-RAFV600E, резистентные к ингибиторам RAF, но комбинация с тарцева (или ингибитором МЕК, например, PD-0325901) преодолевает эту устойчивость. В клетки вводили указанные ингибиторы либо самостоятельно, либо в комбинации при наличии в среде EGF в концентрации 20 нг/мл.
На фигуре 23 показана стимуляция EGF, индуцирующая активность B-RAF и С-RAF в мутантных линиях B-RAFV600E (LOX, 888 представляют собой меланому, тогда как НТ29 представляет собой рак толстого кишечника). Все линии клеток экспрессируют уровни поверхностных EGFR. 888 гомозиготен по аллелю B-RAFV600E, все другие линии гетерозиготны, поэтому также несут аллель B-RAF дикого типа. Гетерозиготные клеточные линии индуцируют активность как B-RAF, так и С-RAF, тогда как гомозиготная линия индуцирует активность лишь С-RAF. Эта активность RAF дикого типа не может быть ингибирована с помощью селективных ингибиторов RAF B-RAF V600E, поэтому в этих линиях уровни фосфо-МЕК, индуцированные с помощью EGF, резистентны к ингибированию RAF, тогда как эндогенные уровни фосфо-МЕК, вызванные B-RAF V600E, чувствительны к селективным ингибиторам RAF B-RAF V600E.
На фигуре 24 показана тенденция к отрицательной корреляции между высокими уровнями мРНК EGF (ось х) и величиной IC50 ингибитора RAF (мкМ, по оси у). Данные по клеточной эффективности показаны для линий клеток меланомы B-RAF V600E и представляют ингибиторы RAF, которые биохимически селективны в отношении изоформы B-RAF V600E с меньшими соответствующими биохимическими и клеточными эффектами в отношении изоформ RAF дикого типа.
На фигуре 25 показаны уровни RAS-GTP в большом числе типов опухолей. Уровни RAS-GTP являются низкими в опухолях К-RASWT и высокими в опухолях, несущих мутантный К-RAS, например, опухолях Н2122. Уровни Ras-GTP определяли с помощью анализа RBD-Elisa.
На фигуре 26 показаны уровни Ras-GTP в клетках B-Raf V600E при наличии (+EGF) и в отсутствие (NI) индукции EGF. Стимуляция EGF в клетках BRAF V600E повышает уровни Ras-GTP.
На фигуре 27 показаны уровни pERK в клетках B-Raf V600E при наличии (stim) и в отсутствие (unstim) индукции EGF. Стимуляция EGF в клетках BRAF V600E повышает уровни Ras-GTP, приводя к повышению уровней pERK в линиях клеток B-RAF V600E посредством активации С-Raf (см. активацию С-Raf, показанную на фигуре 23). Все 4 линии клеток являются мутантами В-Raf V600E, но среди них А375 имеет самые низкие уровни Ras-GTP (самые низкие уровни активного Ras) и у нее не наблюдается устойчивой индукции уровней рМЕК и pERK в ответ на EGF. Известно, что клетки А375 чувствительны к ингибиторам Raf.
На фигуре 28 показаны уровни рМЕК в клетках B-Raf V600E при наличии (stim) и в отсутствие (unstim) индукции EGF. Стимуляция EGF в клетках BRAF V600E повышает уровни Ras-GTP, приводя к повышению уровней pMEK в линиях клеток B-RAF V600E посредством активации С-Raf (см. активацию С-Raf, показанную на фигуре 23).
На фигуре 29 суммируются эффекты некоторых ингибиторов RAF (GDC-0879, PLX-4720 и “Raf inh a”, который представляет собой 2,6-дифтор-N-(3-метокси-1Н-пиразоло[3,4-b]пиридин-5-ил)-3-(пропилсульфонамидо)бензамид) по блокированию клеточной индукции pERK в ответ на стимуляцию с помощью EGF. Клетки BRAF V600E, экспрессирующие EGFR, помещали в бессывороточную среду и затем либо оставляли без стимуляции (-EGF), либо стимулировали с помощью EGF (+EGF) при наличии указанных ингибиторов RAF в различных дозах. Строили графики ингибирования pERK и графически представляли величины IC50. GDC-0879, как показано на фигуре 1, может эффективнее блокировать передачу сигнала через RAF дикого типа, в то время как остальные два ингибитора являются селективными в отношении BRAF V600E.
На фигуре 30 показано, как стимуляция HGF (+HGF) приводит к индукции pERK в клетках, сверхэкспрессирующих с-МЕТ. Эта индукция не блокируется ингибиторами RAF. Тем не менее, исходные уровни pERK, которые вызываются BRAF V600E, эффективно блокируются ингибиторами RAF. Это демонстрирует, что передача сигнала через с-МЕТ также происходит при участии изоформ RAF дикого типа.
Таким образом, аберрантная экспрессия рецепторных тирозинкиназ (RTK), к которым относится EGFR, или аберрантная индукция соответствующими лигандами может выявить клетки, устойчивые к ингибиторам RAF.
На фигуре 31 показано, как среди клеток B-RAFV600E экспрессия EGFR ассоциируется с устойчивостью к ингибиторам RAF. Этот график представляет величины ЕС50, отражающие клеточную жизнеспособность, (мкМ) линий мутантных клеток B-RAF V600E меланомы и толстого кишечника, которые обрабатывали ингибитором RAF за 4 дня до определения жизнеспособности. Уровни EGFR определяли вестерн-блотом и классифицировали как отрицательные в случае отсутствия полосы при проведении вестерн-блота лизатов клеток с антителом против EGFR. Между EGFR-позитивными линиями клеток существует диапазон экспрессии от низкого к среднему и высокому. Единственной EGFR-негативной линией клеток, которая устойчива (>20 мкМ ЕС50), является линия клеток PTEN null.
На фигурах 32А-С показаны комбинированные исследования ингибитора RAF и ингибитора EGFR (тарцева) в линиях опухолей толстого кишечника с различными уровнями экспрессии EGFR.
На фигуре 32А вестерн-блотом лизатов двух линий рака толстого кишечника BRAF V600E показаны их различные уровни суммарного EGFR: COLO201 имеет низкие уровни EGFR, тогда как СХ-1 имеет относительно высокие уровни EGFR.
На фигуре 32В показано влияние комбинированной обработки клеток COLO201 либо ингибитором RAF самостоятельно, тарцева самостоятельно, либо комбинацией ингибитора RAF и тарцева.
На фигуре 32С показано влияние комбинированной обработки клеток CX-1 либо ингибитором RAF самостоятельно, тарцева самостоятельно, либо комбинацией ингибитора RAF и тарцева. Ни ингибитор RAF самостоятельно, ни тарцева самостоятельно не супрессируют пролиферацию настолько эффективно, как комбинация. У обоих ингибиторов при совместном введении в клетки СХ-1 наблюдается удовлетворительный синергизм.
Таким образом, среди клеток BRAFV600E, экспрессирующих EGFR, высокие уровни EGFR прогнозируют сильный синергизм между ингибиторами RAF и ингибиторами EGFR. В частности, при раке толстого кишечника, когда среди опухолей BRAFV600E преобладает высокая экспрессия EGFR, у комбинации этих ингибиторов RAF и тарцева наблюдается синергизм в отношении ингибирования пролиферации опухолевых клеток.
На фигуре 33 показана механистическая основа синергизма между ингибиторами RAF и тарцева в клетках опухолей BRAFV600E, экспрессирующих высокие уровни EGFR. Вестерн-блот осуществляли, взяв клетки, обработанные либо в течение 1 часа, либо 24 часов или без ингибиторов (ряды 1, 5, 9, 13), или ингибитором RAF самостоятельно (ряды 2, 6, 10, 14), тарцева самостоятельно (ряды 3, 7, 11, 15) или комбинацией ингибитора RAF и тарцева (ряды 4, 8, 12, 16) в концентрации, равной величине их клеточной ЕС50. Временная точка 24 часа показывает, что фосфорилирование ERK в мутантных клетках B-RAFV600E с высокой экспрессией EGFR (СХ-1) снизило чувствительность к ингибированию ингибиторами RAF, и для максимальной эффективности требуется комбинация ингибитора RAF и ингибитора EGFR. Часть сигнала активации ERK поступает от RAF дикого типа, который активируется после EGFR и не может быть блокирован селективным ингибитором BRAF V600E.
На фигурах 34А-С показаны результаты взаимодействия и эффективность ингибитора RAF а и эрлотиниба (тарцева), вводимых в комбинации мышам NCR nude (Taconic), несущим подкожные ксенотрансплантаты колоректальной карциномы человека НТ-29 BRAF V600E. На фигуре 34А RAF inh a получали в количестве 100 мг/кг с возрастающими дозами тарцева. На фигуре 34В все животные получали тарцева с возрастающими концентрациями RAF inh a. Повышенную эффективность наблюдали при введении обоих соединений в комбинации. На фигуре 34С лизаты опухолей, обработанных указанными дозами ингибиторов на фигурах 34А и В, анализировали с помощью вестерн-блота в отношении уровней фосфо-ERK (pERK). Ингибитор RAF а и тарцева у мышей при совместном введении действовали синергистично в отношении снижения в опухолях уровней фосфо-ERK.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В одном из вариантов осуществления объект изобретения, описанный в настоящем документе, относится к способу идентификации пациента, не отвечающего на лечение ингибитором B-Raf, включающему определение величины экспрессии или индукции RTK и/или их лигандов. К способам относится определение в образце уровней экспрессии или индукции некоторых RTK и/или их лигандов, причем сверхэкспрессия RTK и/или их лигандов коррелирует с отсутствием ответа на лечение ингибитором B-Raf. В одном из вариантов осуществления образец экспрессирует мутант B-Raf V600E. К примерам RTK, которые коррелируют с ответом на лечение B-Raf, относятся, но ими не ограничиваются, EGFR и cMet. К способам также относится определение в образце уровней экспрессии некоторых лигандов RTK, причем аномально высокие уровни экспрессии лигандов коррелируют с отсутствием ответа на лечение ингибитором B-Raf. К примерам лигандов, которые коррелируют с ответом на лечение B-Raf, относятся, но ими не ограничиваются, EGF и HGF.
В одном из вариантов осуществления объект изобретения, описанный в настоящем документе, относится к способу идентификации пациента, не отвечающего на лечение ингибитором B-Raf, включающему определение в образце количества Ras-GTP, причем повышенные количества указывают на то, что пациент не ответит на лечение указанным ингибитором B-Raf. В одном из примеров повышенные количества выше, чем количества, обнаруживаемые в нормальных не стимулированных образцах. Способы измерения уровней Ras-GTP в образце известны, например, используются анализы ELISA (например, анализы ELISA Ras-GTPазы, продукция фирмы Upstate, Inc.). В одном из примеров способ дополнительно включает введение указанному не отвечающему пациенту эффективного количества ингибитора МЕК или ERK. В другом примере способ дополнительно включает введение эффективного количества ингибитора передачи сигнала через EGFR. В другом примере способ дополнительно включает введение эффективного количества ингибитора передачи сигнала через EGFR в сочетании с ингибитором B-Raf.
В одном из вариантов осуществления объект изобретения, описанный в настоящем документе, относится к способу идентификации пациента, не отвечающего на лечение ингибитором B-Raf, включающему определение в образце уровня экспрессии EGF или EGFR, причем сверхэкспрессируемые уровни либо EGF, либо EGFR указывают на то, что пациент не ответит на лечение указанным ингибитором B-Raf. В одном из примеров определяют количество мРНК EGF. Способы измерения уровней экспрессии EGF и EGFR в образце известны, например, используют иммуноанализы ELISA (например, иммуноанализы QUANTIKINE®, продукция фирмы R&D Systems, Inc.). В одном из примеров способ дополнительно включает введение указанному не отвечающему пациенту эффективного количества ингибитора МЕК или ERK. В другом примере способ дополнительно включает введение эффективного количества ингибитора передачи сигнала через EGFR. В другом примере способ дополнительно включает введение эффективного количества ингибитора передачи сигнала через EGFR в сочетании с ингибитором B-Raf.
В одном из вариантов осуществления объект изобретения, описанный в настоящем документе, относится к способу идентификации пациента, не отвечающего на лечение ингибитором B-Raf, включающему определение в образце уровня экспрессии HGF или сМЕТ, причем сверхэкспрессируемые уровни либо HGF, либо сМЕТ указывают на то, что пациент не ответит на лечение указанным ингибитором B-Raf. В одном из примеров пациент экспрессирует B-Raf V600E. В одном из примеров определяют количество мРНК HGF. Способы измерения уровней экспрессии HGF и сМЕТ в образце известны, например, используются анализы количественной ПЦР RT-RealTime. В другом примере используют иммуноанализы ELISA (например, наборы для проведения ELISA cMET PhosphoDetect®, продукция фирмы EMD Chemicals, Inc или набор для проведения ELISA cMET Human, продукция фирмы Invitrogen, Inc.). В одном из примеров способ дополнительно включает введение указанному не отвечающему пациенту эффективного количества ингибитора сМЕТ или HGF. В другом примере способ дополнительно включает введение эффективного количества ингибитора сМЕТ или HGF в комбинации с ингибитором B-Raf.
В одном из вариантов осуществления объект изобретения, описанный в настоящем документе, относится к способу идентификации пациента, не отвечающего на лечение ингибитором B-Raf, включающему определение наличия или отсутствия мутации K-ras, причем наличие мутации K-ras указывает на то, что пациент не ответит на лечение указанным ингибитором B-Raf. В одном из примеров способ дополнительно включает введение указанному не отвечающему пациенту эффективного количества ингибитора МЕК или ERK. В другом примере способ дополнительно включает введение эффективного количества ингибитора передачи сигнала через EGFR. В другом примере способ дополнительно включает введение эффективного количества ингибитора передачи сигнала через EGFR в комбинации с ингибитором B-Raf.
В некоторых вариантах осуществления объект изобретения, описанный в настоящем документе, относится к способу определения, ответит ли опухоль на лечение ингибитором B-Raf, включающему определение в образце указанной опухоли наличия мутантного белка или гена K-ras, причем наличие мутантного белка или гена K-ras указывает на то, что опухоль не ответит на лечение ингибитором B-Raf. В одном из примеров способ дополнительно включает введение в указанную не отвечающую опухоль эффективного количества ингибитора МЕК или ERK. В другом примере способ дополнительно включает введение эффективного количества ингибитора передачи сигнала через EGFR. В другом примере способ дополнительно включает введение эффективного количества ингибитора передачи сигнала через EGFR в комбинации с ингибитором B-Raf.
В некоторых вариантах осуществления предлагается способ прогноза, ответит ли пациент на лечение ингибитором B-Raf. В некоторых вариантах осуществления способ включает определение наличия или отсутствия в опухоли пациента мутации K-ras, где мутация K-ras находится в кодоне 12 или кодоне 13. В некоторых вариантах осуществления при наличии мутации K-ras прогнозируют, что пациент не ответит на лечение ингибитором B-Raf.
В некоторых вариантах осуществления предлагается способ прогноза, ответит ли опухоль на лечение ингибитором B-Raf. В некоторых вариантах осуществления способ включает определение наличия или отсутствия в образце указанной опухоли мутации K-ras, где мутация K-ras находится в кодоне 12 или кодоне 13. В некоторых вариантах осуществления наличие мутации K-ras указывает на то, что опухоль не ответит на лечение ингибитором B-Raf.
В некоторых вариантах осуществления предлагается способ классификации индивидуума человека в протоколе лечения. Способ включает определение наличия в образце индивидуума мутантного гена K-ras или его белка, причем наличие мутантного гена или белка K-ras указывает на то, что индивидуум не ответит на лечение ингибитором B-Raf, и исключение у индивидуума лечения ингибитором B-Raf. К этому способу может относиться отнесение индивидуума к определенной подгруппе, например, в клиническом испытании. В другом варианте осуществления способ дополнительно включает введение указанному индивидууму, имеющему указанный мутантный ген или белок K-ras, эффективного количества ингибитора МЕК или ERK. В другом примере способ дополнительно включает введение эффективного количества ингибитора передачи сигнала через EGFR. В другом примере способ дополнительно включает введение эффективного количества ингибитора передачи сигнала через EGFR в комбинации с ингибитором B-Raf.
В одном из вариантов осуществления предлагается способ классификации опухоли молочных желез, легких, толстого кишечника, яичников, щитовидной железы, меланомы или опухоли поджелудочной железы.