Варианты crig с созревшей аффинностью
Иллюстрации
Показать всеИзобретение относится к области биохимии, в частности к вариантам CRIg с созревшей аффинностью. Заявлен вариант CRIg, который является по меньшей мере в 2 раза более сильным ингибитором альтернативного пути активации комплемента, чем CRIg человека с нативной последовательностью, и необязательно обладает повышенным по меньшей мере в 2 раза сродством связывания с C3b. Также заявлены содержащие указанный вариант CRIg химерная молекула и фармацевтическая композиция. Вариант CRIg может применяться для получения лекарственного средства для лечения комплемент-ассоциированного заболевания или состояния. Изобретение позволяет улучшить терапевтическую эффективность полипептидов CRIg. 4 н. и 13 з.п. ф-лы, 17 ил., 4 табл., 1 пр.
Реферат
2420-171930RU/010
ВАРИАНТЫ CRIg С СОЗРЕВШЕЙ АФФИННОСТЬЮ
Описание
Область техники, к которой относится изобретение
Настоящее изобретение относится к вариантам CRIg с созревшей аффинностью. В частности, настоящее изобретение относится к вариантам CRIg, обладающим более высоким сродством связывания с C3b и сохраняющим способность избирательного связывания с C3b по сравнению с С3.
Уровень техники
Система комплемента
Система комплемента представляет собой сложный каскад ферментов, состоящий из серии сывороточных гликопротеинов, которые обычно находятся в форме неактивных проферментов. Существуют три основных пути активации комплемента: классический путь, альтернативный путь и путь, опосредуемый манноза-связывающим лектином, которые соединяются на уровне С3, где две подобные конвертазы расщепляют С3 с образованием С3а и C3b.
Макрофаги являются специализированными клетками, обладающими природной способностью распознавать едва различимые отличия в структуре экспрессированных на поверхности клеток идентифицирующих меток, так называемых молекулярных паттернов (Taylor, et al., Eur. J. Immunol. 33, 2090-1097 (2003); Taylor, et al., Annu. Rev. Immunol. 23, 901-944 (2005)). Хотя прямое распознавание таких поверхностных структур является основным признаком врожденного иммунитета, опсонизация позволяет рецепторам родовых макрофагов опосредовать поглощение клеткой частиц в процессе фагоцитоза, повышая эффективность и расширяя спектр распознавания фагоцита (Stuart and Ezekowitz, Immunity 22, 539-550 (2005)). Процесс фагоцитоза включает многочисленные взаимодействия рецепторов с лигандами, и в настоящее время известно, что разные опсонины, включая иммуноглобулины, коллектины и компоненты комплемента, управляют активностью клеток, необходимой для интернализации патогенных микроорганизмов в результате взаимодействия с рецепторами макрофагов на поверхности клеток (обзор в публикации Aderem and Underhill, Annu. Rev. Immunol. 17, 593-623 (1999); Underhill and Ozinsky, Annu. Rev. Immunol. 20, 825-852 (2002)). Несмотря на то, что природные иммуноглобулины, кодированные генами зародышевых клеток, могут распознавать целый ряд патогенных микроорганизмов, большинство опсонизирующих IgG образуется в результате приобретенного иммунитета, поэтому эффективный клиренс, опосредованный Fc-рецепторами, не является немедленным (Carroll, Nat. Immunol. 5, 981-986 (2004)). Комплемент, с другой стороны, быстро распознает молекулы на поверхности патогенного микроорганизма и стимулирует поглощение такой частицы рецепторами комплемента (Brown, Infect. Agents Dis. 1, 63-70 (1991)).
Комплемент состоит из более чем 30 сывороточных белков, которые опсонизируют целый ряд патогенных микроорганизмов, благодаря чему их могут распознавать рецепторы комплемента. В зависимости от исходного пускового механизма каскада можно различить три пути (обзор в публикации Walport, N., Engl. J. Med. 344, 1058-1066 (2001)). Все три пути характеризуются общей стадией активации центрального компонента С3, но отличаются характером распознавания и исходными стадиями биохимических процессов, вызывающих активацию С3. Классический путь активируется антителами, связанными с поверхностью патогенного микроорганизма, которые в свою очередь связываются с компонентом комплемента C1q, активируя каскад сериновых протеаз, которые в конце концов расщепляют С3 с образованием его активной формы C3b. Путь, опосредуемый лектином, активируется после распознавания углеводных фрагментов белками лектина. В настоящее время идентифицированы три члена указанного пути: манноза-связывающие лектины (MBL), семейство SIGN-R1 лектинов и фиколины (Pyz et al., Ann. Med. 38, 242-251 (2006)). Как MBL, так и фиколины связаны с сериновыми протеазами, которые действуют подобно С1 в классическом пути, активируя компоненты С2 и С4, вызывающие главную стадию С3. Альтернативный путь отличается от классического пути и пути, опосредуемого лектином, тем, что его активация происходит в результате прямого взаимодействия внутреннего сложного эфира С3 с узнаваемыми фрагментами на поверхности патогенного микроорганизма. Первоначальное связывание С3 с активирующей поверхностью вызывает быструю амплификацию отложения C3b под воздействием протеаз альтернативного пути, фактора В и фактора D. Важно отметить, что классический путь или путь, опосредуемый лектином, также может вызывать амплификацию отложения C3b под воздействием факторов В и D. Во всех трех путях активации комплемента основной стадией в опсонизации является превращение компонента С3 в C3b. Расщепление С3 ферментами каскадов комплемента вызывает нуклеофильную атаку сложного тиоэфира, обеспечивающую ковалентное связывание C3b с поверхностями антигена при помощи домена сложного тиоэфира. Указанное связывание является начальной стадией в опсонизации комплемента. Последующий протеолиз связанного C3b вызывает образование фрагментов iC3b, С3с и C3dg, которые распознаются разными рецепторами (Ross and Medof, Adv. Immunol. 37, 217-267 (1985)). Такое расщепление устраняет способность C3b далее амплифицировать отложение C3b и активирует последующие компоненты каскада комплемента, включая мембраноатакующий комплекс, способный непосредственно разрушать мембрану. Однако фагоцитарные рецепторы макрофага предпочтительно распознают C3b и его фрагменты; благодаря разнообразию образования сложноэфирных связей С3-опосредуемая опсонизация имеет главное значение для распознавания патогенных микроорганизмов (Holers et al., Immunol. Today 13, 231-236 (1992)), поэтому рецепторы для разных продуктов расщепления С3 играют важную роль в иммунном ответе хозяина.
С3 представляет собой сложный и гибкий белок, состоящий из 13 разных доменов. Ядро молекулы состоит из 8 так называемых доменов макроглобулина (MG), которые образуют плотно упакованные α- и β-цепи С3. В указанную структуру встроены домены CUB (C1r/C1s, Uegf и Bone морфогенетический белок-1) и TED, при этом последний домен содержит сложную тиоэфирную связь, которая делает возможным ковалентное связывание C3b с поверхностями патогенных микроорганизмов. Остальные домены содержат С3а или действуют в качестве линкеров и спейсеров внутренних доменов. Сравнение структур C3b и С3а с С3 показывает, что данная молекула подвергается значительной конформационной перестройке с каждым протеолизом, в результате чего обнажается не только домен TED, но также дополнительные новые поверхности молекулы, которые могут взаимодействовать с клеточными рецепторами (Janssen and Gros, Mol. Immunol. 44, 3-10 (2007)).
Рецепторы комплемента С3 на фагоцитарных клетках
Известны три надсемейства генов рецепторов комплемента: модули короткого консенсусного повтора (SCR), кодирующего CR1 и CR2, члены CR3 и CR4 семейства бета-2 интегринов и член CRIg надсемейства иммуноглобулинов Ig.
CR1 является гликопротеином с молекулярной массой 180-210 кДа, состоящим из 30 коротких консенсусных повторов (SCR), и играет важную роль в клиренсе иммунного комплекса. Короткие консенсусные повторы (SCR) являются модульными структурами, состоящими примерно из 60 аминокислот, каждая из которых имеет две пары дисульфидных связей, обеспечивающих жесткость структуры. Высокое сродство связывания с C3b и C4b определяется двумя отдельными сайтами, состоящими из 3 SCR (обзор в публикации Krych-Goldberg and Atkinson, Immunol. Rev. 180, 112-122 (2001)). Структура сайта связывания C3b, находящегося внутри коротких консенсусных повторов (SCR) 15-17 гликопротеина CR1 (сайт 2), была определена методом MRI (Smith et al., Cell 108, 769-780 (2002)), показавшим, что три модуля расположены в направлении от глобулярного участка к концевому участку, при этом гибкость обеспечивает сочленение на сайтах 16-17. Определяемый структурой мутагенез позволил идентифицировать положительно заряженную поверхностную область на модуле 15, которая имеет важное значение для связывания C4b. Указанный участок вместе с основными боковыми цепями модуля 16, находящимися на той же поверхности CR1, необходим для связывания C3b. Основная функция CR1, первоначально описанного как рецептор иммунной адгезии (Rothman et al., J. Immunol. 115, 1312-1315 (1975)), состоит в улавливании IC на эритроцитах с целью переноса в печень для клиренса (Taylor et al., Clin. Immunol. Immunopathol. 82, 49-59 (1997)). В процессе фагоцитоза CR1 воздействует на нейтрофилы, а не на тканевые макрофаги (Sengelov et al., J. Immunol. 153, 804-810 (1994)). Помимо участия в клиренсе иммунных комплексов, гликопротеин CR1 является сильным ингибитором активации классического и альтернативного пути в результате его взаимодействия с соответствующими конвертазами (Krych-Goldberg and Atkinson, 2001, см. выше; Krych-Goldberg et al., J. Biol. Chem. 274, 31160-31168 (1999)). У мыши CR1 и CR2 являются двумя продуктами одного гена, образующимися в результате альтернативного сплайсинга, которые связаны главным образом с В-лимфоцитами и фолликулярными дендритными клетками и в основном регулируют реакции В-клеток (Molina et al., 1996). Мышиный функциональный эквивалент CR1, Crry, инактивирует ферменты классического и альтернативного путей и действует скорее в качестве природного регулятора активации комплемента, а не фагоцитарного рецептора (Molina et al., Proc. Natl. Acad. Sci. USA 93, 3357-3361 (1992)).
CR2 (CD21) связывает iC3b и C3dg и является основным рецептором комплемента, усиливающим В-клеточный иммунитет (Carroll, Nat. Immunol. 5, 981-986 (2004); Weis et al., Proc. Natl. Acad. Sci. USA 81, 881-885 (1984)). Поглощение C3b-покрытого антигена родственными В-клетками вызывает усиление сигнала, передаваемого рецептором В-клеточного антигена. Таким образом, связывание корецептора CD21-CD19-CD81 с рецептором В-клеточного антигена снижает порог активации В-клеток и формирует важный сигнал выживания (Matsumoto et al., J. Exp. Med. 173, 55-64 (1991)). Сайт связывания CR2 на iC3b был картирован частично на границе между доменами TED и MG1 (Clemenza and Isenman, J. Immunol. 165, 3839-3848 (2000)).
CR3 и CR4 являются трансмембранными гетеродимерами, состоящими из альфа-субъединицы (соответственно CD11b или αМ и CD11c или αХ) и общей бета-цепи (CD18 или β2), которые участвуют в адгезии с внеклеточным матриксом и другими клетками, а также в распознавании iC3b. Указанные рецепторы относятся к семейству интегринов и выполняют определенные функции не только в фагоцитозе, но также в процессе направленной миграции и перемещении лейкоцитов, формировании и костимуляции синапса (обзор в публикации Ross, Adv. Immunol. 37, 217-267 (2000)). Адгезивность интегрина регулируется процессом, именуемым передачей перевернутого сигнала, трансформирующего интегрины из низкоаффинного в высокоаффинное состояние связывания (Liddington and Ginsberg, J. Cell Biol. 158, 833-839 (2002)). Кроме того, связывание с лигандом вызывает передачу сигналов из внеклеточного домена в цитоплазму. Сайты связывания iC3b картированы в нескольких доменах альфа-цепи CR3 и CR4 (Diamond et al., J. Cell Biol. 120, 1031-1043 (1993); Li and Zhang, J. Biol. Chem. 278, 34395-34402 (2003); Xiong and Zhang, J. Biol. Chem. 278, 34395-34402 (2001)). Несколько лигандов для CR3: iC3b, бета-глюкан и ICAM-1, по-видимому, связываются с частично перекрывающимися сайтами, находящимися в I домене CD11b (Balsam et al., 1998; Diamond et al., 1990; Zhang and Plow, 1996). Специфическое распознавание протеолитически инактивированной формы C3b, iC3b, было предсказано на основании структурных исследований, которые позволили локализовать сайты связывания CR3 в остатках, открываемых при развертывании домена CUB в C3b (Nishida et al., Proc. Natl. Acad. Sci. USA 103, 19737-19742 (2006)), что происходит при расщеплении α'-цепи регуляторной протеазой комплемента, фактором I.
CRIg является ассоциированным с макрофагом рецептором, гомологичным антигену А33 и JAM1, который необходим для клиренса патогенных микроорганизмов из кровотока. Белок CRIg человека был первоначально клонирован из библиотеки плодной кДНК человека при использовании вырожденных затравок, узнающих консервативные домены Ig JAM1 человека. Секвенирование нескольких клонов выявило открытую рамку считывания, состоящую из 400 аминокислот. Исследования при помощи Blast подтвердили сходство с Z39Ig, трансмембранным белком типа 1 (Langnaese et al., Biochim. Biophys. Acta 1492 (2000) 522-525). Было установлено, что внеклеточная область данной молекулы состоит из двух Ig-подобных доменов, включающих N-концевой домен V-популяции и С-концевой домен С2-популяции. Новый белок человека первоначально был определен как ”единичный трансмемблранный член надсемейства Ig, ассоциированный с макрофагом (huSTIgMA)”. Затем при использовании 3'- и 5'-концевых затравок был клонирован сплайсированный вариант huSTIgMA, в котором отсутствует близкий к мембране домен IgC и который короче на 50 аминокислот. Более короткий сплайсированный вариант данного белка человека получил название huSTIgMAкороткий. Аминокислотная последовательность huSTIgMA (определяемая как PRO362) и кодирующая полинуклеотидная последовательность описаны в патенте США № 6410708, выданном 25 июня 2002 г. Кроме того, huSTIgMA и huSTIgMAкороткий, а также мышиный белок STIgMA (muSTIgMA) и последовательности нуклеиновой кислоты описаны в публикации РСТ WO 2004031105, опубликованной 15 апреля 2004 г.
Кристаллическая структура CRIg и комплекс C3b:CRIg описаны в публикации заявки на патент США № 2008/0045697, опубликованной 21 февраля 2008 г.
Клетки Купфера (КС), находящиеся в синусоидальной полости печени, образуют самую большую популяцию макрофагов в теле. Несмотря на то, что клетки Купфера имеют маркеры аналогично другим тканевым макрофагам, они выполняют специальные функции, обеспечивающие эффективный клиренс кишечных бактерий, микробных остатков, бактериальных эндотоксинов, иммунных комплексов и мертвых клеток, присутствующих в крови воротной вены, поступающей из системы микрососудов пищеварительного тракта (Bilzer et al., Liver Int. 26, 1175-1186 (2006)). Эффективное связывание патогенных микроорганизмов с поверхностью клеток Купфера является важной стадией первичной иммунной защиты от патогенных микроорганизмов (Benacerraf et al., J. Exp. Med. 110, 27-48 (1959)). Центральная роль клеток Купфера в быстром клиренсе патогенных микроорганизмов из кровотока проиллюстрирована значительным увеличением смертности у мышей с отсутствием клеток Купфера (Hirakata et al., Infect. Immun. 59, 289-294 (1991)). Идентификация CRIg еще больше подтвердила важную роль комплемента и клеток Купфера в первичной иммунной защите от патогенных микроорганизмов, циркулирующих в кровотоке.
Единственными рецепторами комплемента С3, идентифицированными в клетках Купфера мышей, являются CRIg и CR3 (Helmy et al., Cell 124, 915-927 (2006)), в то время как в клетках Купфера человека выявлена дополнительная экспрессия CR1 и CR4 (Hinglais et al., 1989). Рецепторы CRIg и CR3 в клетках Купфера способствуют связыванию с опсонизированными частицами iC3b in vitro (Helmy et al., Lab. Invest. 61, 509-514 (2006)). In vivo роль КС-экспрессируемого рецептора CR3 в связывании с iC3b-покрытыми патогенными микроорганизмами является менее очевидной. Было сделано предположение, что CR3 косвенно способствует клиренсу патогенных микроорганизмов путем рекрутинга нейрофилов и взаимодействия с экспрессирующим нейтрофилы ICAM1 (Conlan and North, Exp. Med. 179, 259-268 (1994); Ebe et al., Pathol. Int. 49, 519-532 (1999); Gregory et al., J. Immunol. 157, 2514-2520 (1996); Gregory and Wing, J. Leukoc. Biol. 72, 239-248 (2002); Rogers and Unanue, Infect. Immun. 61, 5090-5096 (1993)). В отличие от этого CRIg непосредственно участвует в улавливании патогенных микроорганизмов, проходящих через синусоидальную полость печени (Helmy et al., 2006, см. выше). Различие в биологии CRIg и CR3 частично нашло отражение в различии характеристик связывания двух указанных рецепторов. CRIg, экспрессированный на клетках Купфера, конститутивно связывается с мономерными фрагментами С3, в то время как CR3 связывается только с iC3b-опсонизированными частицами (Helmy et al., 2006, см. выше). Способность CRIg эффективно улавливать мономерные компоненты C3b и iC3b, а также C3b/iC3b-покрытые частицы отражает повышенную авидность, созданную множественным взаимодействием между молекулами CRIg, сконцентрированными на конце удлинений мембраны макрофагов (Helmy et al., 2006, см. выше), и многомерами C3b и iC3b, присутствующими на поверхности патогенного микроорганизма. В то время как CR3 связывается только с iC3b-покрытыми частицами, CRIg дополнительно связывается с C3b, первым продуктом расщепления С3, образованным на патогенных микроорганизмах, опсонизированных сывороткой (Croize et al., Infect. Immun. 61, 5134-5139 (1993)). Так как большое число молекул C3b, связанных с поверхностью патогенного микроорганизма, защищено от расщепления факторами Н и I (Gordon et al., J. Infect. Dis. 157, 697-704 (1988)), узнавание лигандов C3b рецептором CRIg обеспечивает быстрое связывание и клиренс. Таким образом, несмотря на то, что на клетках Купфера экспрессированы как CRIg, так и CR3, указанные рецепторы характеризуются разной специфичностью к лигандам, разными свойствами связывания и разной кинетикой клиренса патогенных микроорганизмов.
Примерами патогенных микроорганизмов, использующих рецепторы на поверхности клеток для проникновения в клетку, являются вирусы, такие как вирус иммунодефицита человека (ВИЧ), внутриклеточные бактерии, такие как Mycobacterium tuberculosum, Mycobacterium leprae, Yersinia pseudotuberculosis, Salmonella typhimurium и Listeria Monocytogenes, и паразиты, такие как простигматоид Leishmania major (Cossart and Sansonetti, Science 304:242-248 (2004); Galan, Cell 103:363-366 (2000); Hornef et al., Nat. Immunol. 3:1033-1040 (2002); Stoiber et al., Mol. Immunol. 42:153-160 (2005)).
Как было указано выше, CRIg является недавно обнаруженным рецептором комплемента С3, экспрессированным в субпопуляции тканевых макрофагов. Помимо функционирования в качестве рецептора комплемента для белков С3, внеклеточный домен IgV рецептора CRIg избирательно ингибирует альтернативный путь активации комплемента путем связывания с C3b и ингибирования протеолитической активации С3 и С5. Однако сродство связывания CRIg с субъединицей конвертазы C3b является низким (IC50>1 мкМ), требуя относительно высокой концентрации белка для достижения почти полного ингибирования комплемента. Поэтому существует потребность в полипептидах CRIg, обладающих улучшенной терапевтической эффективностью. Настоящее изобретение относится к таким полипептидам.
Сущность изобретения
Настоящее изобретение по меньшей мере частично относится к созданию варианта CRIg с повышенным сродством связывания. Белок CRIg-ECD, содержащий комбинированные замены аминокислот Q64R и M86Y, характеризуется 30-кратным увеличением сродства связывания и 7-кратным улучшением активности ингибирования комплемента по сравнению с вариантом CRIg дикого типа. Кроме того, лечение гибридным белком CRIg с улучшенным сродством связыввния в мышиной модели артрита вызывало значительное снижение клинических оценок по сравнению с лечением белком CRIg дикого типа.
Таким образом, настоящее изобретение относится к вариантам CRIg.
Одним объектом настоящего изобретения является вариант CRIg, включающий замену аминокислот в области, выбираемой из группы, состоящей из Е8-К15, R41-T47, S54-Q64, E85-Q99 и Q105-K111 аминокислотной последовательности SEQ ID NO:2.
В одном варианте осуществления изобретения вариант избирательно связывается с C3b по сравнению с С3 или его фрагментом.
В другом варианте осуществления изобретения вариант CRIg обладает более высоким сродством связывания с C3b по сравнению с CRIg человека с нативной последовательностью SEQ ID NO:2, при этом сродство связывания может быть увеличено, например, по меньшей мере в 2 раза, по меньшей мере в 3 раза, по меньшей мере в 4 раза, по меньшей мере в 5 раз, по меньшей мере в 6 раз, по меньшей мере в 7 раз, по меньшей мере в 9 раз, по меньшей мере в 10 раз, по меньшей мере в 15 раз, по меньшей мере в 20 раз, по меньшей мере в 30 раз, по меньшей мере в 40 раз, по меньшей мере в 50 раз, по меньшей мере в 70 раз, по меньшей мере в 80 раз, по меньшей мере в 90 раз или по меньшей мере в 100 раз.
В другом варианте осуществления изобретения вариант CRIg является более сильным ингибитором альтернативного пути активации комплемента по сравнению с CRIg человека с нативной последовательностью SEQ ID NO:2.
В другом варианте осуществления изобретения вариант CRIg включает замену аминокислот в одном или нескольких положениях, выбираемых из группы, состоящей из положений 8, 14, 18, 42, 44, 45, 60, 64, 86, 99, 105 и 110 в аминокислотной последовательности SEQ ID NO:2.
В еще одном варианте осуществления изобретения вариант CRIg включает замену аминокислот в одном или нескольких положениях 60, 64, 86, 99, 105 и 110 в аминокислотной последовательности SEQ ID NO:2.
В дополнительном варианте осуществления изобретения вариант CRIg включает одну или несколько замен, выбираемых из группы, состоящей из E8W, W14F, E84Y/W14F; P45F; G42D/D44H/P45F; Q60I; Q64R; Q60I/Q64R; M86Y; M86W, M86F, M86W/Q9R; M86F/Q99R; K110D, K11N; Q105R/K110N; Q105R/K110Q и Q105K/K110D.
В другом варианте осуществления изобретения вариант CRIg включает одну или несколько замен, выбираемых из группы, состоящей из Q64R/M86Y; Q60I/Q64R/E8Y; Q60I/Q64R/G42D; Q60I/Q64R/P45F; Q60I/Q64R/G42D/D44H/P45F; Q60I/Q64R/M86Y; Q60I/Q64R/Q105R; Q60I/Q64R/Q105K; Q60I/Q64R/K110N; Q60I/Q105R/K110N; M86Y/E8Y; M86Y/G42D/D44H/P45F; M86Y/P45F; M86Y/G42D/D44H/P45F и M86Y/Q99K/M86Y/Q99R/M86Y/Q105R/M86Y/Q105K/M86Y/Q105R/K110N.
В еще одном варианте осуществления изобретения вариант CRIg включает одну или несколько замен, выбираемых из группы, состоящей из Q60I, Q64R, Q60I/Q64R, M86Y, Q99L, Q105K/K110D, E8W/Q105R/K110N, Q64R/M86Y, Q60I/Q64R/E8Y, Q60I/Q64R/G42D, Q60I/Q64R/P45F, Q60I/Q64R/G42D/D44H/P45F, Q60I/Q64R/M86Y, Q60I/Q64R/Q105R, Q60I/Q64R/Q105K, Q60I/Q64R/K110N, M86Y/P45F и M86Y/Q105K.
В более конкретном варианте осуществления изобретения вариант CRIg включает замену Q60I/Q64R/M86Y или Q60I/Q64R/G42D/D44H/P45F.
Другим объектом настоящего изобретения является химерная молекула, включающая вариант CRIg по настоящему изобретению.
В одном варианте осуществления изобретения химерная молекула является иммуноадгезином.
В другом варианте осуществления изобретения иммуноадгезин включает вариант CRIg, который короче непроцессированного CRIg SEQ ID NO:2.
В еще одном варианте осуществления изобретения химерная молекула включает внеклеточный домен CRIg.
Другим объектом настоящего изобретения является фармацевтическая композиция, включающая вариант CRIg или химерную молекулу, например, иммуноадгезин по настоящему изобретению, в смеси с фармацевтически приемлемым наполнителем.
Другим объектом настоящего изобретения является способ профилактики или лечения комплемент-ассоциированного заболевания или состояния, который включает введение субъекту, нуждающему в таком лечении, профилактически или терапевтически эффективного количества варианта CRIg или химерной молекулы, такой как иммуноадгезия, включающий такой вариант.
В одном варианте осуществления изобретения комплемент-ассоциированное заболевание является воспалительным заболеванием или аутоиммунным заболеванием.
В другом варианте осуществления изобретения комплемент-ассоциированное заболевание выбирают из группы, включающей ревматоидный артрит (RA), респираторный дистресс-синдром у взрослых (ARDS), поражение удаленных тканей после ишемии и реперфузии, активацию комплемента во время хирургической операции с искусственным кровообращением, дерматомиоцитоз, пемфигус, люпус-нефрит и проистекающие из него гломерулонефрит и васкулит, искусственное кровообращение, дисфункцию коронарного эндотелия, вызванную кардиоплегией, мембранозно-пролиферативный гломерулонефрит типа II, IgA-обусловленную нефропатию, острую почечную недостаточность, криоглобулемию, антифосфолипидный синдром, возрастную дегенерацию желтого пятна, увеит, диабетическую ретинопатию, аллотрансплантацию, сверхострое отторжение, гемодиализ, хроническое обструктивное заболевание легких (COPD), астму, аспирационную пневмонию, утрикарию, хроническую идиопатическую утрикарию, гемолитико-уремический синдром, эндометриоз, кардиогенный шок, ишемическую реперфузию и рассеянный склероз (MS).
В другом варианте осуществления изобретения комплемент-ассоциированное заболевание выбирают из группы, включающей воспалительное заболевание кишечника (IBD), системную красную волчанку, ревматоидный артрит, юношеский хронический артрит, спондилоартропатию, системный склероз (склеродерму), идиопатические воспалительные миопатии (дерматомиозит, полимиозит), ксеродерматоз (синдром Шегрена), системный васкулит, саркоидоз, аутоиммунную гемолитическую анемию (иммунную панцитопению, ночную пароксизмальную гемоглобинурию), аутоиммунную тромбоцитопению (идиопатическую тромботическую пурпуру, иммунную тромбоцитопению), тиреоидит (болезнь Грейвса, тиреоидит Хашимото, юношеский лимфоцитарный тиреоидит, атрофический тиреоидит), сахарный диабет, иммунное заболевание почек (гломерулонефрит, тубулоинтерстициальный нефрит), демиелинизирующие заболевания центральной и периферической нервной системы, такие как рассеянный склероз, идиопатическую полиневропатию, желчно-почечные заболевания, такие как инфекционный гепатит (гепатит А, В, С, D, Е и другие негепатотропные вирусы), аутоиммунный хронический активный гепатит, первичный билиарный цирроз печени, грануломатозный гепатит и склерозирующий холангит, воспалительные и фиброзные заболевания легких (например, муковисцидоз), глютензависимую энтеропатию, болезнь Уиппла, аутоиммунные или иммунные кожные заболевания, включающие буллезные кожные заболевания, полиморфную эритему и контактный дерматит, псориаз, аллергическмие заболевания легкого, такие как эозинофильная пневмония, идиопатический фиброз легких и аллергическая пневмония (пневмония с гиперчувствительностью), заболевания, обусловленные трансплантацией, включающие отторжение трансплантата, реакцию трансплантат-против-хозяина, болезнь Альцгеймера, ночную пароксизмальную гемоглобинурию, наследственный ангионевротический отек, атеросклероз и мембранозно-пролиферативный гломерулонефрит типа II.
В предпочтительном варианте осуществления изобретения комплемент-ассоциированное заболевание является ревматоидным артритом (RA).
В другом предпочтительном варианте осуществления изобретения комплемент-ассоциированное заболевание является комплемент-ассоциированным глазным заболеванием.
В другом варианте осуществления изобретения комплемент-ассоциированное глазное заболевание выбирают из группы, включающей все стадии возрастной дегенерации желтого пятна (AMD), увеит, диабетическую и другие обусловленные ишемией ретинопатии, эндофтальмит и другие внутриглазные заболевания, вызванные образованием новых сосудов.
В другом варианте осуществления изобретения внутриглазное заболевание, вызванное образованием новых сосудов, выбирают из группы, включающей диабетический отек желтого пятна, патологическую миопию, болезнь Гиппеля-Линдау, гистоплазмоз глаза, окклюзию центральной вены сетчатки (CRVO), образование новых сосудов в роговице и образование новых сосудов в сетчатке.
В еще одном варианте осуществления изобретения комплемент-ассоциированное глазное заболевание выбирают из группы, включающей возрастную дегенерацию желтого пятна (AMD), образование новых сосудов в сосудистой оболочке глаза (CNV), диабетическую ретинопатию (DR) и эндофтальмит, при этом возрастная дегенерация желтого пятна (AMD) включает влажную, сухую или атрофическую AMD.
В одном варианте осуществления изобретения субъект является млекопитающим, предпочтительно человеком.
Другим объектом настоящего изобретения является способ ингибирования продуцирования фрагмента комплемента C3b у млекопитающего, который включает введение указанному млекопитающему эффективного количества варианта CRIg по настоящему изобретению или иммуноадгезина, включающего такой вариант.
Другим объектом настоящего изобретения является способ избирательного ингибирования альтернативного пути активации комплемента у млекопитающего, который включает введение указанному млекопитающему эффективного количества варианта CRIg по настоящему изобретению или иммуноадгезина, включающего такой вариант.
Краткое описание чертежей
На фигурах 1А-1В показаны нуклеотидная и аминокислотная последовательности непроцессированной длинной формы нативного CRIg человека из 399 аминокислот (huCRIg, SEQ ID NO:1 и 2, соответственно).
На фигурах 2А-2В показаны нуклеотидная и аминокислотная последовательности короткой формы нативного CRIg человека (huCRIg-короткий, SEQ ID NO:3 и 4, соответственно).
На фигурах 3А-3С показаны нуклеотидная и аминокислотная последовательности нативного CRIg мыши из 280 аминокислот (muCRIg, SEQ ID NO:5 и 6, соответственно)
Фигура 4. Активность мутантов CRIg, определяемая при выполнении анализа связывания и анализа ингибирования. Сродство связывания CRIg измеряли в виде конкурентного замещения C3b (A), и биологическую активность измеряли при помощи анализа ингибирования гемолиза. PUR10680 был контрольным веществом дикого типа (красный), RIL 41 (синий) и RL41 (зеленый) были двумя мутантами (В). (С) Поэтапная оптимизация границы связывания CRIg.
Фигура 5. Корреляция между конкурентно-связывающим анализом ELISA и анализом ингибирования гемолиза.
Фигура 6. Мутант CRIg Q64R/M86Y характеризуется улучшенным сродством связывания по результатам анализа Biacore. (А) Сенсограммы SPR, полученные в результате введения C3b в возрастающих концентрациях по сравнению с CRIg дикого типа с оболочкой и белками CRIg Q64R M86Y. (В) Стационарный анализ данных связывания показывает, что значение Kd равно 0,2 микромоль для мутанта Q64R/M86Y и 1,1 микромоль для CRIg дикого типа.
Фигура 7. CRIg с улучшенным сродством связывания избирательно связывается с C3b. При помощи конкурентно-связывающего анализа Alpha Screen анализировали очищенные С3 и C3b.
Фигура 8. Улучшенная активность ингибирования комплемента мутанта CRIg Q64R/M86Y по сравнению с CRIg дикого типа. (А) Ингибирование комплемента CRIg дикого типа и мутантом CRIg Q46R/M86Y сравнивали при помощи анализа ингибирования гемолиза, специфичного к альтернативному пути, используя эритроциты кролика и сыворотку человека, не содержащую C1q. (В) Ингибирование комплемента CRIg дикого типа и мутантом CRIg Q46R/M86Y сравнивали при помощи анализа ELISA альтернативного пути с использованием микропланшета, сенсибилизированного LPS и сывороткой человека, не содержащей C1q.
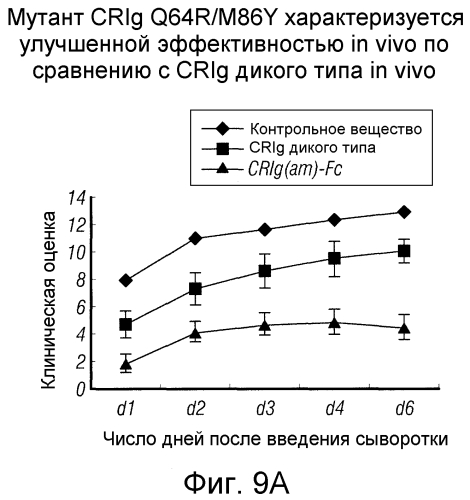
Фигура 9. Мутант CRIg Q64R/M86Y характеризуется лучшей активностью in vivo по сравнению с CRIg дикого типа.
(А) Клинические оценки мышей, которым вводили сыворотку KRN и лечили разными вариантами рекомбинантных белков CRIg человека и мыши дикого типа и с созревшей аффинностью в разных концентрациях. Данные представляют собой среднее значение для 4-7 мышей в группе. (В) Графики дисперсий клинических оценок для отдельных мышей на 6-й день после введения сыворотки. (С) Окрашенные гематоксилином и эозином срезы мышей, которым вводили CRIg дикого типа или мутант CRIg Q64R/M86Y через 6 дней после введения сыворотки. (D) Графики дисперсий гистологических оценок для мышей, которым вводили CRIg дикого типа или мутант CRIg Q64R/M86Y через 6 дней после введения сыворотки.
Таблица 1. Библиотеки фагов. Для охвата области контакта между CRIg и C3b было создано пять рандомизированных библиотек.
Таблица 2. Поэтапное создание CRIg с более высоким сродством связывания методом отображения на фаге. Мутанты CRIg против C3b, отобранные из пяти рандомизированных библиотек. В каждом блоке показаны клоны, которые были отобраны из каждой библиотеки на основании сродства связывания с C3b. Последовательность обозначена однобуквенным кодом аминокислот. В каждом блоке отдельные мутанты сравниваются с консенсусными последовательностями и исходными последовательностями дикого типа (WT). Остатки окрашены соответствующим образом: синие - рандомизированное положение; серые - не рандомизированные; желтые - отобранные остатки, отличающиеся от остатков дикого типа (WT). В таблице 2 представлены соответственно SEQ ID NO:21-63 и 63-67 в порядке следования.
Таблица 3. Сравнение сродства связывания, определенного при помощи конкурентно-связывающего анализа ELISA и ингибирования гемолиза in vivo для отобранных мутантов. Мутанты с более чем 5-кратным увеличением сродства связывания и более высокой активностью in vivo окрашены желтым цветом.
Таблица 4. Сравнение сродства связывания и ингибирования гемолиза in vivo для мутантов второго поколения (исходные последовательности окрашены серым цветом). Мутанты с более чем 5-кратным увеличением сродства связывания по сравнению с исходным мутантом выделены синим цветом, мутанты с более чем 90-кратным увеличением сродства связывания выделены желтым цветом. Аналогичным образом мутанты с более высокой активностью in vivo по сравнению с исходными последовательностями выделены оранжевым цветом.
Подробное описание изобретения
1. Определения терминов
Термины ”CRIg”, “PRO362”, “JAM4” и “STIgMA” имеют взаимозаменяемые значения и служат для определения полипептидов CRIg с нативной последовательностью и их вариантов.
“CRIg с нативной последовательностью” означает полипептид, имеющий такую же аминокислотную последовательность, что и природный полипептид CRIg независимо от способа получения. Таким образом, CRIg с нативной последовательностью может быть выделен из природного источника или получен методами рекомбинантных ДНК и/или путем синтеза. В определение термина “CRIg с нативной последовательностью” входят природные усеченные или секретированные формы CRIg (например, последовательность внеклеточного домена), природные варианты (например, альтернативно сплайсированные формы) и природные аллельные варианты CRIg. Полипептиды CRIg с нативной последовательностью включают полноразмерный (непроцессированный) полипептид CRIg человека длиной 399 аминокислот, представленный SEQ ID NO:2 (huCRIg, показанный на фигурах 1А и 1В), который имеет или не имеет N-концевую сигнальную последовательность, имеет или не имеет инициирующий метионин в положении 1 и имеет или не имеет любой или все трансмембранные домены в положениях аминокислот 277-307 SEQ ID NO:2. В другом варианте осуществления изобретения полипептид CRIg с нативной последовательностью состоит из 305 аминокислот и представляет собой короткую форму CRIg человека (huCRIg-короткий, SEQ ID NO:4, показанный на фигурах 2А и 2В), который имеет или не имеет N-концевую сигнальную последовательность, имеет или не имеет инициирующий метионин в положении 1 и имеет или не имеет любой или все трансмембранные домены в положениях 183-213 SEQ ID NO:4. В другом варианте осуществления изобретения полипептид CRIg с нативной последовательностью имеет длину 280 аминокислот и представляет собой полноразмерный полипептид CRIg мыши SEQ ID NO:6 (muCRIg, показанный на фигурах 3А-3С), который имеет или не имеет N-концевую сигнальную последовательность, имеет или не имеет инициирующий метионин в положении 1 и имеет или не имеет любой или все трансмембранные домены в положениях аминокислот 181-211 SEQ ID NO:6. В определение данного термина входят полипептиды CRIg других животных, отличных от человека, включая высших приматов и млекопитающих.
“Внеклеточный домен” CRIg или “ECD” CRIg означает форму полипептида CRIg, в которой по существу отсутствуют трансмембранные и цитоплазматические домены соответствующих полноразмерных молекул. ECD CRIg обычно содержит менее 1% таких трансмембранных и/или цитоплазматических доменов, предпочтительно менее 0,5% таких доменов. ECD CRIg может включать аминокислотные остатки в положении от 1 или примерно 21 до Х SEQ ID NO:2, 4 или 6, где Х означает любую аминокислоту в положении от около 271 до 281 в SEQ ID NO:2, любую аминокислоту в положении от около 178 до 186 в SEQ ID NO:4 и любую аминокислоту в положении от около 176 до 184 в SEQ ID NO:6.
Термин ”вариант CRIg” в использованном здесь значении означает активный полипептид CRIg, описанный ниже, в котором аминокислотная последовательность по меньшей мере примерно на 80% идентична полипептиду CRIg с нативной последовательностью и который включает, не ограничиваясь ими, непроцессированный huCRIg (SEQ ID NO:2), huCRIg-короткий (SEQ ID NO:4) и muCRIg (SEQ ID NO:6), каждый из которых имеет или не имеет N-концевой инициирующий метионин, имеет или не имеет N-концевую сигнальную последовательность, имеет или не имеет все или часть трансмембранных доменов и имеет или не имеет внутриклеточный домен. В конкретном варианте осуществления изобретения вариант CRIg имеет аминокислотную последовательность, которая по меньшей мере примерно на 80% гомологична аминокислотной последовательности зрелого, непроцессированного пептида, представленного SEQ ID NO:2. В другом варианте осуществления изобретения вариант CRIg имеет аминокислотную последовательность, которая по меньшей мере примерно на 80% гомологична аминокислотной последовательности зрелого, непроцессированного пептида, представленного SEQ ID NO:4. В еще одном варианте осуществления изобретения вариант CRIg имеет аминокислотную последовательность, которая по меньшей мере примерно на 80% гомологична аминокислотной последовательности зрелого, непроцессированного пептида, представленного SEQ ID NO:6. Вариант CRIg обычно имеет аминокислотную последовательность, которая по меньшей мере примерно на 80%, по меньшей мере примерно на 85%, по меньшей мере примерно на 90%, по меньшей мере примерно на 95%, по меньшей мере примерно на 98% или по меньшей мере примерно на 99% идентична зрелой аминокислотной последовательности, представленной SEQ ID NO:2, 4 или 6. В описании изобретения, включая примеры, термин ”дикого типа” или “WT” означает зрелую, непроцессированную короткую форму CRIg человека (CRIg(S)) (SEQ ID NO:4), п