Нанокристаллы кальципотриола моногидрита
Иллюстрации
Показать всеИзобретение относится к области фармацевтики и представляет собой суспензию для лечения псориаза, включающую кальципотриол моногидрата в форме нанокристаллов с распределением размера частиц в диапазоне 200-600 нм, которые диспергированы в водной фазе, включающей неионное, полимерное ПАВ, выбранное из группы, состоящей из ПАВ в виде полоксамеров или полисорбатов, в количестве 0,01-5 мас.% в расчете на суспензию для предотвращения образования агрегатов и/или роста кристаллов нанокристаллов кальципотриола моногидрата, причем нанокристаллы кальципотриола моногидрата получены в суспензии путем обработки суспензии способом, включающим стадии уменьшения размеров частиц кристаллического кальципотриола моногидрата в водной фазе с образованием микрочастиц с распределением размера частиц в диапазоне примерно 5-20 мкм и средним размером частиц примерно 10 мкм и воздействия на суспензию трех циклов гомогенизации под высоким давлением, каждый в течение 7-15 минут, причем на первом, втором и третьем циклах давление составляет 300-800 бар, 800-1200 бар и 1200-1700 бар соответственно. Изобретение обеспечивает создание местной композиции, включающей кальципотриол в качестве активного агента, но не содержащей пропиленгликоль в качестве растворителя. 3 н. и 31 з.п. ф-лы, 8 пр., 5 табл., 9 ил.
Реферат
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к кальципотриолу моногидрату в форме нанокристаллов и к включению нанокристаллов в фармацевтическую композицию, предназначенную для предупреждения или лечения кожных заболеваний и состояний.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Псориаз представляет собой хроническое воспалительное заболевание кожи, которое проявляется в виде эритематозных сухих шелушащихся бляшек, возникающих в результате гиперкератоза. Бляшки чаще всего обнаруживаются на локтях, коленях и волосистой коже головы, хотя могут появляться более распространенные поражения на других частях тела, в частности, пояснично-крестцовой области. Самое распространенное лечение псориаза от легкой до умеренной степени тяжести включает местное нанесение композиции, содержащей кортикостероид в качестве активного ингредиента. Кортикостероиды, хотя и являются эффективными средствами, но имеют недостаток в виде целого ряда побочных эффектов, таких как атрофия кожи, полосы, угреподобные высыпания, периоральный дерматит, разрастание кожных грибов и бактерий, гипопигментация пигментированной кожи и розовые угри.
Однако в течение многих лет предпочтительное нестероидное лечение псориаза состояло в местном лечении соединением аналога витамина D, кальципотриолом, включенным в состав мазевой композиции (продаваемой в виде мази Daivonex® или Dovonex® компанией LEO Pharma), в которой кальципотриол присутствует в растворе, или кремовой композиции (продаваемой в виде крема Daivonex® или Dovonex® компанией LEO Pharma), в которой кальципотриол присутствует в виде суспензии или микрочастиц. Растворителем в мазевой композиции является пропиленгликоль, который имеет преимущество усиления проникновения активного ингредиента в кожу, что приводит к повышению эффективности, но который также, как известно, действует в качестве раздражителя кожи. Так, сообщалось, что включение пропиленгликоля в местные композиции часто вызывает развитие у пациентов контактного дерматита (в одном исследовании сообщалось о частоте реакций раздражения на пропиленгликоль, достигающей 12,5%, см. M. Hannuksela et al., Contact Dermatitis 1, 1975, pp. 112-116), и число реакций раздражения увеличивается, когда пропиленгликоль используется в высоких концентрациях (см. обзор J. Catanzaro and J. Graham Smith, J. Am. Acad. Dermatol. 24, 1991, pp. 90-95). Вследствие улучшенного проникновения кальципотрола в кожу в результате наряду с другими причинами присутствия пропиленгликоля было обнаружено, что мазь Daivonex® более эффективна при лечении псориатических поражений, чем крем Daivonex®, но она также вызывала раздражение кожи у значительной части пациентов с псориазом.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Кожа человека, в частности наружный слой, роговой слой, обеспечивает эффективный барьер против проникновения микробных патогенов и токсических химических веществ. Хотя данное свойство кожи в целом благоприятно, оно осложняет введение фармацевтических средств через кожу тем, что большое количество, если не большая часть, активного ингредиента, нанесенного на кожу пациента, страдающего кожным заболеванием, может не проникнуть в жизнеспособные слои кожи, где он проявляет свою активность. Для обеспечения адекватного проникновения активного ингредиента в дерму и эпидермис, в целом предпочтительно включение активного ингредиента в растворенном состоянии, обычно, в присутствии растворителя в форме спирта, например, этанола, или диола, например, пропиленгликоля. Пропиленгликоль представляет собой хорошо известный усилитель проникновения, т.е. вещество, которое способно проникать через роговой слой и «увлекать с собой» низкомолекулярные компоненты, такие как терапевтически активные компоненты в носителе, в эпидермис. Сам пропиленгликоль вызывает значительное раздражение кожи и также способен «увлекать с собой» низкомолекулярные раздражающие компоненты носителя в эпидермис, приводя к общему раздражающему эффекту обычных носителей, включая пропиленгликоль. По этой причине присутствие пропиленгликоля в качестве растворителя в композициях, предназначенных для лечения воспалительных кожных заболеваний, может обострить воспалительную реакцию.
Задача исследования, положенного в основу настоящего изобретения, состояла в предоставлении местной композиции, содержащей кальципотриол в качестве активного ингредиента, которая имеет свойства проникновения через кожу и биологическую активность, сравнимые со свойствами мази Daivonex®, но которая не содержит пропиленгликоль в качестве растворителя.
Неожиданно было обнаружено, что возможно получение кальципотриола моногидрата в форме нанокристаллов, которые являются химически устойчивыми (т.е. не разлагаются в 24-эпи кальципотриол или другие продукты разложения), поскольку, неожиданно, не образуются значимые количества аморфного кальципотриола в результате высокого усилия или сил соударения или высоких температур во время доведения до наноразмеров. Кроме того, нанокристаллы являются физически устойчивыми, поскольку не наблюдается агрегация или рост кристаллов или изменение формы кристаллов (полиморфных) в суспензии нанокристаллов после получения. Нанокристаллы легко включаются в состав композиций для местного применения в виде крема и мази, из которых кальципотриол (моногидрат) может проникать в жизнеспособные слои кожи (т.е. дерму и эпидермис) в количествах, сравнимых с проникновением кальципотриола из мази Daivonex®, и приводить к аналогичным или более высоким уровням биологической активности (по данным определения активации гена-мишени in vitro) без использования включения усилителя проникновения, такого как припиленгликоль, который является потенциальным раздражителем кожи.
Соответственно, в одном аспекте настоящее изобретение относится к суспензии кальципотриола моногидрата в форме нанокристаллов с распределением размера частиц в диапазоне 200-600 нм, по данным определения динамического рассеяния света, причем суспензия дополнительно содержит водную фазу, включающую неионное, полимерное поверхностно-активное вещество в количестве, достаточном для предотвращения образования агрегатов и/или кристаллического роста нанокристаллов кальципотриола моногидрата.
В другом аспекте изобретение относится к кальципотриолу моногидрату с распределением размера частиц в диапазоне 200-600 нм, по данным определения динамического рассеяния света, причем указанные нанокристаллы могут быть получены способом, включающим стадии
(a) уменьшения кристаллического кальципотриола моногидрата в водной фазе, содержащей неионное, полимерное поверхностно-активное вещество в количестве в диапазоне от примерно 1% до примерно 5% масс. в расчете на водную фазу, с образованием микрочастиц с распределением размера частиц в диапазоне примерно 5-20 мкм и средним размером частиц примерно 10 мкм;
(b) воздействия на суспензию, полученную на стадии (a), первого цикла гомогенизации под высоким давлением, составляющим примерно 300-800 бар, в течение периода времени, достаточного для получения примерно 15-40% кристаллов кальципотриола моногидрата с распределением размера частиц в диапазоне 200-600 нм;
(c) воздействия на суспензию, полученную на стадии (b), второго цикла гомогенизации под высоким давлением, составляющим примерно 800-1200 бар, в течение периода времени, достаточного для получения примерно 40-80% кристаллов кальципотриола моногидрата с распределением размера частиц в диапазоне 200-600 нм;
(d) воздействия на суспензию, полученную на стадии (c), третьего цикла гомогенизации под высоким давлением, составляющим примерно 1200-1700 бар, в течение периода времени, достаточного для получения примерно 90% или более кристаллов кальципотриола моногидрата с распределением размера частиц в диапазоне 200-600 нм; и
(e) необязательно, выделения полученных нанокристаллов кальципотриола моногидрата из водной фазы.
В еще одном аспекте изобретение относится к фармацевтической композиции, содержащей описанные выше нанокристаллы кальципотриола моногидрата и фармацевтически приемлемый носитель.
В еще одном аспекте изобретение относится к применению композиции, содержащей нанокристаллы или наносуспензию кальципотриола моногидрата, для лечения заболеваний или состояний кожи, таких как псориаз, себопсориаз, ладонно-подошвенный пустулез, дерматит, ихтиоз или угревая сыпь.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг.1 представлен график, показывающий распределение размера частиц нанокристаллов кальципотриола моногидрата, полученных способом по настоящему изобретению, по данным определения динамическим рассеянием света.
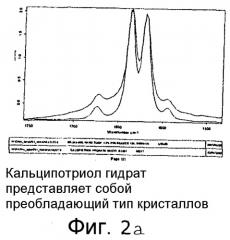
На фиг.2a представлен график, сравнивающий рамановский спектр наносуспензии кальципотриола моногидрата в 2% полоксамере 188 с рамановским спектром кальципотриола моногидрата, не подвергнутого доведению до наноразмеров. На графике показано, что способ доведения до наноразмеров в соответствии с изобретением не приводит к какому-либо изменению формы кристаллов кальципотриола моногидрата.
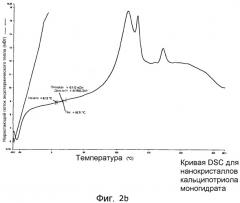
На фиг.2b и 2c представлены графики, показывающие результаты анализа дифференциальной сканирующей калориметрией (DSC) двух партий нанокристаллов кальципотриола моногидрата, полученных способом по настоящему изобретению. DSC проводили при 100ºC/мин (фиг.2b) и при 100ºC/мин (сплошная линия), 300ºC/мин (точечная линия) и при 500ºC/мин (пунктирная линия) (фиг.2c). Несколько более толстая линия на графике отражает экзотермическое явление, возникающее примерно при 8ºC и, как считают, вследствие кристаллизации аморфного кальципотриола.
На фиг.3 представлен график, показывающий скорость высвобождения кальципотриола из наносуспензий по настоящему изобретению, по сравнению со скоростью высвобождения из мази Daivonex®. Из графика представляется, что скорость высвобождения значительно выше из препаративных форм в виде наносуспензии, чем из мази Daivonex®. «Крем в форме наносуспензии» представляет собой крем в соответствии с примером 3. «Наносусп. мазев. вода» соответствует Композиции A примера 2 без глицерола, тогда как «Наносусп. мазев. гли» представляет собой Композицию A примера 2.
На фиг.4a представлен график, показывающий проникновение в кожу и ток через кожу из двух мазей в форме наносуспензий, Композиции A и C Примера 2. «Мазь WSP» представляет собой Композицию A, тогда как «мазь Соннекон» представляет собой Композицию C.
На фиг.4b представлен график, показывающий проникновение в кожу и ток через кожу кальципотриола из мазей в форме наносуспензий, Композиции A, C и D по изобретению, по сравнению с мазью Daivonex®. Из графика представляется, что проникновение в жизнеспособную кожу из мазей в форме наносуспензий сравнимо с проникновением из мази Daivonex®, хотя ток значительно ниже, что приводит к меньшему системному воздействию кальципотриола.
На фиг.5 представлен график, показывающий проникновение в кожу и ток через кожу кальципотриола из крема в форме наносуспензии по изобретению, по сравнению с кремом Daivonex®. Из графика представляется, что проникновение кальципотриола из крема в виде наносуспензии в жизнеспособную кожу значительно выше из крема в виде наносуспензии, чем из крема Daivonex®.
На фиг.6 схематически показана активация гена, кодирующего кателицидин витамином D3, в человеческих кератиноцитах. Механизм активации гена кателицидина используется в биологическом анализе с использованием реконструированного человеческого эпидермиса (человеческие кератиноциты, культивированные с тем, чтобы образовать эпидермальные слои, характерные для кожи человека), на который наносятся содержащие кальципотриол композиции по изобретению, для активации кателицидина, как подробно описано ниже в примере 8.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Определения
В настоящем контексте термин «нанокристаллы» предназначен для обозначения кристаллических частиц кальципотриола моногидрата, которые находятся в наноразмерном диапазоне, т.е. диаметром от 1 до 1000 нм. Нанокристаллы предпочтительно имеют такое распределение размера частиц, что ≥90% нанокристаллов имеют размер частиц от 100 до 900 нм, в частности от 200 до 600 нм.
Термин «наносуспензия» предназначен для обозначения нанокристаллов, как определено выше, суспендированных в водной фазе.
Термин «распределение размера частиц» предназначен для обозначения промежутка между самым маленьким и самым большим кристаллом кальципотриола моногидрата, определенных динамическим рассеянием света (также известным как фотонная корреляционная спектроскопия) с использованием аппаратов Zetasizer Nano ZS или ZS90 (выпускаемых компанией Malvern Instruments, UK) в соответствии с инструкциями производителя. Динамическое рассеяние света определяет размер твердых частиц, суспендированных в жидкости, путем освещения частиц лазером и анализа колебаний интенсивности в рассеянном свете в результате броуновского движения частиц в жидкости. Колебания интенсивности коррелируются с размером частиц в том, что более крупные частицы движутся медленнее, чем меньшие частицы, т.е. колебание интенсивности происходит медленнее.
Термин «аморфное» предназначен для обозначения твердого вещества без упорядоченного расположения его молекул, т.е. противоположность кристаллического.
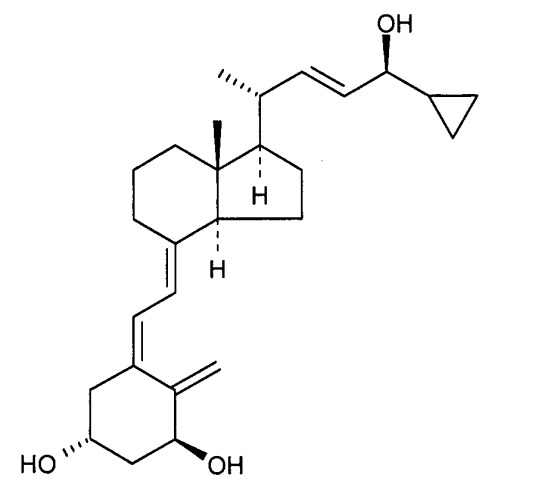
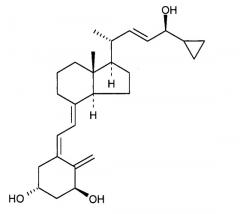
«Кальципотриол» представляет собой аналог витамина D формулы
Было обнаружено, что кальципотриол существует в двух кристаллических формах, ангидрата и моногидрата. Кальципотриол моногидрат и его получения раскрыты в WO 94/15912.
Термин «химическая устойчивость» или «химически устойчивые» предназначен для обозначения того, что нанокристаллы кальципотриола моногидрата значимо не разлагаются с течением времени в 24-эпи кальципотриол или другие продукты разложения кальципотриола в суспензии или в готовом фармацевтическом продукте. В случае последнего, «химическая устойчивость» указывает на то, что не более чем 10%, предпочтительно не более чем 6%, кальципотриола моногидрата распадается в течение срока хранения продукта, обычно 2 лет, при комнатной температуре. Аппроксимацию химической устойчивости при комнатной температуре получают, подвергая нанокристаллы или композицию, содержащую их, ускоренным исследованиям устойчивости при 40ºC. Если менее чем примерно 10% вещества разложилось после 3 месяцев хранения при 40ºC, это обычно принимается как соответствующее сроку хранения 2 года при комнатной температуре.
Термин «физическая устойчивость» или «физически устойчивые» предназначен для обозначения того, что нанокристаллы кальципотриола моногидрата имеют по существу форму кристаллов, идентичную контрольному кальципотриола моногидрату, который не был подвергнут доведению до наноразмеров, по данным определения романовской спектроскопией, т.е. он не проявляет полиморфизма в результате доведения до наноразмеров. Кроме того, «физическая устойчивость» указывает на то, что нанокристаллы не проявляют агрегацию или рост кристаллов в заявленных суспензиях или фармацевтических композициях, в которые они включены.
Термин «по существу неводный» предназначен для обозначения того, что содержание свободной воды (в отличие от связанной с кристаллом воды) в лиофилизированном или подвергнутом распылительной сушке нанокристаллах кальципотриола моногидрата составляет менее чем примерно 2% масс., предпочтительно менее чем примерно 1% масс., например менее чем примерно 0,5% масс. нанокристаллов. Аналогичным образом, содержание свободной воды в «по существу неводной» мазевой композиции составляет менее чем примерно 3% масс., предпочтительно менее чем примерно 2% масс., например, менее чем примерно 1% или 0,5% масс. композиции.
Термин «солюбилизационная способность» предназначен для обозначения способности растворителя или смеси растворителей растворять данное вещество, выраженную в виде количества, требуемого для осуществления полной солюбилизации вещества.
Термин «проникновение в кожу» предназначен для обозначения диффузии активного ингредиента в различные слои кожи, т.е. роговой слой, эпидермис и дерму.
Термин «проникновение через кожу» предназначен для обозначения тока активного ингредиента через кожу в системную циркуляцию или, в случае исследований in vitro, таких как исследования, описанные ниже в примере 7, в рецепторную жидкость аппарата с ячейкой Франца, использованной в данном эксперименте.
Термин «биологическая активность» предназначен для обозначения активности производного или аналога витамина D при нанесении на кожу в композиции по изобретению. Биологическая активность композиций определяется в анализе in vitro измерением активации гена-мишени, кодирующего биологический маркер кателицидин в реконструированном человеческом эпидермисе, включающем культивированные человеческие кератиноциты, как подробно описано ниже в примере 8.
Получение нанокристаллов кальципотриола моногидрата
В последние годы проводилось все больше исследований получения нанокристаллов или наносуспензий терапевтически активных ингредиентов как способа обеспечения улучшенной скорости растворения слаборастворимых лекарственных средств. Большая площадь поверхности нанокристаллов обеспечивает более высокую скорость растворения при введении лекарственного средства. Данная технология до настоящего времени главным образом использовалась при включении активных ингредиентов в состав препаративных форм для перорального или внутривенного введения.
В литературе было описано несколько способов получения нанокристаллов лекарственных средств. В широком смысле, способы могут быть разделены на две категории, т.е. размол и гомогенизация под высоким давлением.
В публикации US № 5145684 раскрыт способ получения кристаллических наночастиц размолом в шаровой мельнице в течение 4-5 дней в присутствии модификаторов поверхности, таких как поливинилпирролидон, поливиниловый спирт, лецитин или другое поверхностно-активное вещество. Вероятно, что размол в шаровой мельнице кальципотриола моногидрата в этих условиях приведет или прямо к химическому разрушению кальципотриола моногидрата, или к образованию больших количеств аморфного кальципотриола, что было бы неблагоприятно для достаточной устойчивости при хранении/сроке годности фармацевтической композиции, содержащей его, поскольку аморфный материал относительно более уязвим для химического разрушения, чем кристаллический материал.
В публикации Са № 2375992 раскрыт способ получения частиц лекарственных средств с размером частиц менее чем 5 мкм, предпочтительно менее чем 1 мкм, гомогенизацией под высоким давлением в поршневом гомогенизаторе с давлением, регулируемым через зазор, в безводной среде при температуре ниже 20ºC, в частности ниже 0ºC. Доведение до наноразмеров проводится воздействием на микронизированные частицы лекарственного средства 10-20 циклов гомогенизации под высоким давлением при 1500 бар. В способе по настоящему изобретению заявители используют водную среду для уменьшения частиц кальципотриола, поскольку использование безводной среды (жидкого парафина) не привело к какому-либо значимому уменьшению размера кристаллов кальципотриола моногидрата.
В публикации WO 2004/054549 раскрыта местная препаративная форма наночастиц спиронолактона в кремовой основе, содержащей моноглицериды в воде. Наночастицы получают с использованием гомогенизации под высоким давлением в поршневом гомогенизаторе с подачей давления через регулируемый зазор.
Было обнаружено, что гомогенизация под высоким давлением при 1500 бар в течение нескольких циклов не подходит для уменьшения частиц кальципотриола моногидрата, поскольку данная процедура ведет к агрегации кристаллов кальципотриола моногидрата даже в присутствии подходящего поверхностно-активного вещества.
В публикации WO 2008/058755 раскрывается получение нанокристаллов косметически активного вещества размолом с использованием голлендра или шаровой мельницы с последующей гомогенизацией под высоким давлением. Указано, что комбинация этих двух способов имеет преимущества перед одной гомогенизацией под высоким давлением, поскольку последняя требует много циклов гомогенизации при высоком давлении (1500 бар). Комбинированный способ обеспечивает возможность использования только одного цикла гомогенизации при более низком давлении для получения частиц наноразмера.
В предпочтительном варианте осуществления изобретение относится к способу получения нанокристаллов кальципотриола моногидрата с распределением размера частиц в диапазоне 200-600 нм, по данным определения динамическим рассеиванием света, причем способ включает стадии
(a) уменьшения размера частиц кристаллического кальципотриола моногидрата в водной фазе, содержащей неионное полимерное поверхностно-активное вещество в количестве от примерно 1% до примерно 5% масс. в расчете на водную фазу с образованием микрочастиц с распределением размера частиц в диапазоне примерно 5-20 мкм и средним размером частиц примерно 10 мкм;
(b) воздействия на суспензию, полученную на стадии (a), первого цикла гомогенизации под высоким давлением, составляющим примерно 300-800 бар, в течение периода времени, достаточного для получения примерно 15-40% кристаллов кальципотриола моногидрата с распределением размера частиц в диапазоне 200-600 нм;
(c) воздействия на суспензию, полученную на стадии (b) второго цикла гомогенизации под высоким давлением, составляющим примерно 800-1200 бар, в течение периода времени, достаточного для получения примерно 40-80% кристаллов кальципотриола моногидрата с распределением размера частиц в диапазоне 200-600 нм;
(d) воздействия на суспензию, полученную на стадии (c) третьего цикла гомогенизации под высоким давлением, составляющим примерно 1200-1700 бар, в течение периода времени, достаточного для получения примерно 90% или более кристаллов кальципотриола моногидрата с распределением размера частиц в диапазоне 200-600 нм; и
(e) необязательно, выделения полученных нанокристаллов кальципотриола моногидрата из водной фазы.
В конечной суспензии (после стадии (d)) количество нанокристаллов кальципотриола моногидрата с распределением размера частиц в диапазоне 200-600 нм составляет предпочтительно 95% или более.
Способ по настоящему изобретению отличается от способа, раскрытого в публикации WO 2008/058755, комбинированием стадии первоначального уменьшения размера частиц (a) с тремя последовательными циклами гомогенизации под высоким давлением, причем каждый цикл проводится при увеличивающемся давлении. Это отличается от процедуры, раскрытой в публикации WO 2008/058755, где за размолом в шаровой мельнице активного ингредиента следует один цикл гомогенизации под высоким давлением при низком давлении (таком как 100 бар, см. Примеры 8 и 9), что приводит к желательному уменьшению размера частиц. Было обнаружено, что такая процедура недостаточна для обеспечения удовлетворительного размера частиц и распределения размера частиц кристаллов кальципотриола моногидрата, т.е. только примерно 15-40% кристаллов были бы в пределах желательного распределения размера частиц.
Кроме того, было обнаружено, что нет необходимости в проведении способа по настоящему изобретению с регулированием температуры, в отличие от процедуры, раскрытой в WO 2008/058755, где для двух из трех активных ингредиентов температуру требовалось поддерживать ниже 20ºC, а в идеале от 0ºC до 5ºC. Отсутствие необходимости в применении регулировки температуры предоставляет преимущество упрощенной процедуры. Однако удивительно, что в способе по настоящему изобретению не требуется регулирование температуры, поскольку кальципотриол чувствителен к увеличениям температуры, и следовало бы ожидать, что он был бы подвергнут химическому распаду без регулирования температуры способа уменьшения размера частиц.
Варианты осуществления изобретения
Суспензия по настоящему изобретению может содержать неионное, полимерное поверхностно-активное вещество, которое добавляется для предотвращения агрегации нанокристаллов кальципотриола и/или для предотвращения роста кристаллов. Поверхностно-активное вещество предпочтительно представляет собой такое, которое не вызывает никакой значимой солюбилизации нанокристаллов кальципотриола моногидрата, т.е. оно должно иметь низкую способность солюбилизации и может быть благоприятно выбрано из группы, состоящей из поверхностно-активных веществ в виде полоксамеров или полисорбатов и простых C6-24 алкиловых эфиров полиоксиэтилена. Полоксамер может быть выбран из группы, состоящей из полоксамера 124, полоксамера 188, полоксамера 237, полоксамера 338 и полоксамера 407. В частности, было обнаружено, что полоксамер 188 обладает низкой способностью солюбилизации в отношении солюбилизации кальципотриола, и поэтому в настоящее время является предпочтительным ПАВ для использования в наносуспензии по настоящему изобретению. При использовании полисорбата в качестве ПАВ он может быть выбран из группы, состоящей из полисорбата 20, полисорбата 40, полисорбата 60, полисорбата 61, полисорбата 80 и полисорбата 81. Предпочтительным в настоящее время простым C6-24 алкиловым эфиром полиоксиэтилена является цетомакрогол 1000.
Количество ПАВ в водной фазе может находиться в диапазоне от примерно 0,01% до примерно 5% масс. суспензии. В целом, предпочтительно, чтобы количество ПАВ в указанной водной фазе находилось в диапазоне примерно 0,6-1,2% масс. суспензии.
В зависимости от условий, применяемых во время уменьшения размеров частиц и гомогенизации под высоким давлением, нанокристаллы кальципотриола моногидрата, присутствующие в полученной суспензии, могут иметь средний размер частиц 200-350 нм, 350-400 нм или 400-500 нм, по данным определения динамическим рассеянием света.
Наносуспензия может быть лиофилизирована или подвергнута распылительной сушке до нанокристаллов, содержащих ПАВ на поверхности. Лиофилизированные или подвергнутые распылительной сушке нанокристаллы могут затем использоваться для включения в неводные композиции.
Неожиданно было обнаружено, что процедуры доведения до наноразмеров по настоящему изобретению приводят к генерированию незначительных количеств лишь аморфного кальципотриола. Специалисту в данной области техники хорошо известно, что присутствие аморфного соединения делает материал неустойчивым вследствие отсутствия молекулярного расположения в кристаллической решетке, которое подвергает материал химическому разрушению или перестройке кристаллической структуры в другую полиморфную форму (см. Chow et al., J. Pharm. Sci. 97(8), 2008, pp. 2855-2877). По данным определения дифференциальной сканирующей калориметрией с использованием прибора Perkin-Elmer DSC 8500 в соответствии с инструкциями производителя было невозможно выявить значимых количеств аморфного кальципотриола до предела выявления прибора (примерно 5%), см. фиг.2b.
В способе по настоящему изобретению кристаллы кальципотриола первоначально подвергаются размолу или предразмолу в водной фазе с использованием шариков или бусин диаметром в диапазоне 1-4 мм, например 2-3 мм. Шарики или бусины могут быть составлены из стекла или аналогичного твердого материала, такого как оксид циркония. Размол может подходящим образом выполняться в течение 2-5 часов, например 3 часов, примерно при 500-4000 об/мин, такой как скорость примерно 1000-3000 об/мин, например около 2000 об/мин.
ПАВ, используемый для размола, может подходящим образом представлять собой неионное полимерное ПАВ, которое добавляется к водной фазе, в количестве в диапазоне от примерно 1,5 до примерно 3% масс. суспензии, в частности, примерно 2% масс. суспензии. ПАВ может быть предпочтительно выбрано из группы полоксамерных или полисорбатных ПАВ, как описано выше. Суспензия в последующем используется непосредственно на стадиях гомогенизации под высоким давлением, и особенно благоприятный результат в отношении распределения размера частиц после гомогенизации под высоким давлением был получен с использованием полоксамера 188. Следует отметить, что ввиду использования в способе получения по настоящему изобретению промывания оборудования для размола водой на стадии (a) и промывания водой оборудования для гомогенизации под высоким давлением после стадии (d), концентрация ПАВ в конечной суспензии находится в диапазоне примерно 0,6-1,2% масс. суспензии.
Стадии гомогенизации под высоким давлением (b)-(d) проводятся с использованием поршневого гомогенизатора с давлением, регулируемым через зазор, например, гомогенизатора Emulsiflex C3 (выпускаемого компанией Avestin), в соответствии с инструкциями производителя.
Было обнаружено, что для доведения до наноразмеров кристаллов кальципотриола моногидрата благоприятно, чтобы первый цикл гомогенизации под высоким давлением стадии (b) проводился при давлении примерно 500-650 бар. Время, требуемое для получения 15-40% нанокристаллов кальципотриола моногидрата с желательным распределением размера частиц, составляет 7-15 минут, например 8-12 минут, составляя такой период, как примерно 10 минут.
Второй цикл гомогенизации под высоким давлением стадии (c) может подходящим образом проводиться под давлением примерно 1000-1100 бар. Время, требуемое для получения 40-80% нанокристаллов кальципотриола моногидрата с желательным распределением размера частиц, находится в диапазоне 7-15 минут, например 8-12 минут, составляя такой период, как примерно 10 минут.
Третий цикл гомогенизации под высоким давлением стадии (d) может подходящим образом проводиться под давлением примерно 1400-1500 бар. Время, требуемое для получения 90% или более нанокристаллов кальципотриола моногидрата с желательным распределением размера частиц, находится в диапазоне 7-15 минут, например 8-12 минут, составляя такой период, как примерно 10 минут.
Если нанокристаллы кальципотриола моногидрата предназначены для включения в неводную препаративную форму, то они могут подходящим образом быть подвергнуты лиофилизации или распылительной сушке (до содержания воды (свободной воды) менее чем примерно 2% масс., такого как менее чем примерно 1% или менее чем примерно 0,5% масс. нанокристаллов.
Нанокристаллы кальципотриола моногидрата или суспензия, содержащая нанокристаллы, могут быть включены в фармацевтическую композицию, содержащую фармацевтически приемлемый носитель, который совместим с активным ингредиентом.
При смешивании с фармацевтически приемлемыми эксципиентами для получения композиции, как описано ниже, количество неионного полимерного ПАВ находится предпочтительно в диапазоне примерно 0,03-0,06% масс. композиции.
В одном варианте осуществления композиция по настоящему изобретению представляет собой мазь. В соответствии с современной классификацией FDA (Администрации пищевых продуктов и лекарственных средств США) мазь представляет собой полутвердую лекарственную форму, которая может содержать воду и летучие вещества в количестве до 20% масс. и которая содержит более чем 50% масс. углеводородов, восков или полиолов в носителе. Таким образом, в соответствии с изобретением мазь может представлять собой композицию вода-в-масле, и в этом случае сама наносуспензия может добавляться к липофильным компонентам композиции с тем, чтобы композиция содержала до 10% масс. или, предпочтительно, до 5% масс. водной фазы. Альтернативно, композиция может представлять собой неводную мазь, которая содержит менее чем примерно 2%, предпочтительно менее чем 1% свободной воды по массе композиции.
Мазевый носитель может подходящим образом содержать парафин, выбранный из парафинов, состоящих из углеводородов с длинами цепей в диапазоне C5-60 и их смесей. Часто используемый мазевый носитель представляет собой вазелин или белый мягкий парафин, который составлен из углеводородов с различной длиной цепи, достигающей пика примерно при C40-44, или смеси вазелина и жидкого парафина (состоящего из углеводородов с различной длиной цепи, достигающей пика примерно при C28-40). Хотя вазелин обеспечивает окклюзию обрабатываемой поверхности кожи, снижая трансдермальную потерю воды и потенцируя терапевтический эффект активного ингредиента в композиции, он имеет тенденцию вызывать ощущение маслянистости и/или липкости, которое сохраняется достаточно длительное время после нанесения, и он нелегко распределяется по поверхности кожи. Поэтому может быть предпочтительным использование парафинов, состоящих из углеводородов с несколько меньшей длиной цепи, таких как парафин, состоящий из углеводородов с длинами цепей, достигающих пика при C14-16, C18-22, C20-22, C20-26, или их смесей. Было обнаружено, что такие парафины более косметически приемлемы в том, что они менее липкие и/или маслянистые после нанесения и легче распределяются по поверхности кожи. Поэтому ожидается, что они приведут к лучшему соблюдению пациентами назначенного лечения. Подходящие парафины этого типа выпускаются компанией Sonneborn и продаются под торговым названием Соннекон, например, Соннекон CM, Соннекон DM1, Соннекон DM2 и Соннекон HV. Данные парафины подробнее описываются и характеризуются в WO 2008/141078, которая включена в настоящее описание путем ссылки. (Углеводородная композиция парафинов была определена газовой хроматографией.)
Для придания желательной вязкости композиции по настоящему изобретению она может подходящим образом включать липофильный увеличивающий вязкость ингредиент, такой как воск. Воск может представлять собой минеральный воск, составленный из смеси углеводородов с высокой молекулярной массой, например, насыщенных C35-70 алканов, таких как микрокристаллический воск. Альтернативно, воск может представлять собой растительный или животный воск, например сложные эфиры C14-32 жирных кислот и C14-32 жирные спирты, такие как пчелиный воск. Количество увеличивающего вязкость ингредиента может варьироваться в соответствии с придающей вязкость силой ингредиента, но может обычно находиться в диапазоне примерно 1-20% масс. композиции. Когда увеличивающий вязкость ингредиент представляет собой микрокристаллический воск, то он обычно присутствует в количестве в диапазоне примерно 5-15% масс., например, примерно 10% масс. композиции.
Для поддержания достаточной физической устойчивости композиции, в частности во избежание разделения в ней водной и липидной фаз, может быть предпочтительным включение эмульгатора вода-в-масле с величиной HLB (водно-липидного баланса) 3-8. Примерами таких эмульгаторов являются простые C8-22 алкиловые эфиры полиоксиэтилена, например, простой стеариловый эфир полиоксиэтилена, простой цетиловый эфир полиоксиэтилена, простой олеиловый эфир полиоксиэтилена или простой лауриловый эфир полиоксиэтилена. Количество эмульгатора обычно находится в диапазоне 2-10% масс./масс. композиции.
Композиция может дополнительно содержать смягчающий агент, который может действовать для смягчения утолщенного эпидермиса псориатических бляшек. Подходящий смягчающий агент для включения в композицию по настоящему изобретению может представлять собой силиконовый воск или летучее силиконовое масло, поскольку было дополнительно обнаружено, что присутствие силикона содействует проникновению кальципотриола в кожу. Было также обнаружено, что композиции, включающие силикон, приводят к меньшему раздражению кожи. Подходящие силиконовые масла для включения в композицию по настоящему изобретению, могут быть выбраны из циклометикона и диметикона. Количество силиконового масла, включенное в композицию по настоящему изобретению, обычно находится в диапазоне от примерно 1 до примерно 10% масс., например, примерно 5% масс. композиции.
Считается, что присутствие в мази Daivonex® пропиленгликоля является основным фактором, вызывающим раздражение кожи, испытываемое многими пациентами. Однако было обнаружено, что сам кальципотриол может у некоторых пациентов вызвать небольшое раздражение (A. Fullerton and J. Serup, Br. J. Dermatol. 137, 1997, pp. 234-240 и A. Fullerton et al., Br. J. Dermatol. 138, 1998, pp. 259-265). Поэтому может быть благоприятным включение в композицию по настоящему изобретению соединения против раздражения, такого как глицерол, сорбит, сахароза, сахарин, ментол, эвкалиптол или никотинамид. Глицерол был описан в качестве вещ