Способ индикации состояния воды
Иллюстрации
Показать всеИзобретение относится к исследованию и анализу материалов и может быть использовано для определения структурного состояния талой воды в разное время после таяния. Представлен способ индикации структурного состояния воды, в котором определяют потенциал стеклоуглеродного электрода, погруженного в исходную воду, затем определяют потенциал электрода, погруженного в талую воду, за время релаксации талой воды до состояния исходной воды по полученным тестовым релаксационным зависимостям потенциала от времени, температуры и значению потенциала φ в данный момент времени τ судят о структурном состоянии воды и времени возврата t в исходное структурное состояние. Достигается повышение точности, достоверности, экспрессности и информативности индикации. 5 табл., 2 ил.
Реферат
Изобретение относится к исследованию и анализу материалов и может быть использовано для определения структурного состояния талой воды в разное время после таяния.
Известно применение методов потенциометрического, кондуктометрического титрирования, диэлектрометрии для индикации состояния активированной воды (Плакатина О.С., Борбат В.Ф., Мухин В.А., Андреева А.Л., //Известия ВУЗОов. Химия и химическая технология. 1992, т.35, вып.11-12, с.142-143, Плакатина О.С., Борбат В.Ф., Мухин В.А. // Известия ВУЗОов. Химия и химическая технология. 1993, т.36, вып.6, с.44-47). Сравнение кривых потенциометрического и кондуктометрического титрирования растворами электролитов, тангенсов диэлектрических потерь, расходов электролита на основе неактивированной и электрохимически активированной воды показало их достоверное отличие.
Недостатком данных методов является большая подготовительная работа, заключающаяся в выборе электролита, концентрации электролита. Кроме того, в данных методах необходимо устанавливать диапазон частот, в котором наблюдаются наибольшие диэлектрические потери. Также на проведение потенциометрического и кондуктометрического титрирования влияет объем пробы титранта. В титриметрических методах концентрация растворов титрантов составляла 10-4 моль/л. Для определения тангенса диэлектрических потерь готовились растворы сульфата натрия концентрацией 10-3 экв./л. Такие очень разбавленные растворы электролитов находятся на пределе чувствительности данных методов измерений, что отрицательно влияет на точность и достоверность результатов. Для получения достоверных результатов необходимо проведение дополнительных параллельных серий измерений.
Наиболее близким по технической сущности к заявляемому является способ по патенту РФ №2284521, в котором определяют состояния электрохимически активированной воды при установлении тестовых значений, соответствующих неактивированному и электрохимически активированному состоянию воды в виде величин Δf1 и Δf2 изменения собственной частоты колебаний пьезокварцевого датчика АТ-среза при нанесении на него пробы неактивированной и активированной воды, определении величины изменения собственной частоты колебаний указанного датчика при нанесении на него пробы исследуемой воды и определении ее состояния по изменению структурно-чувствительных свойств в разное время после активации при сравнении полученной величины Δf изменения собственной частоты колебаний вышеуказанного датчика после нанесения на него исследуемого образца с тестовыми значениями Δf1 и Δf2.
Недостатком указанного способа является низкая достоверность результатов измерений, находящаяся на пределе чувствительности данного метода, а также большая длительность измерения.
Задачей изобретения является повышение достоверности, точности и экспрессности измерений структурного состояния талой воды и определение времени релаксации структурного состояния талой воды к исходному состоянию.
Указанный технический результат достигается тем, что предложен способ индикации структурного состояния воды, в котором определяют потенциал электрода, погруженного в исходную воду, затем определяют потенциал электрода, погруженного в талую воду, за время релаксации талой воды до состояния исходной воды по полученным тестовым релаксационным зависимостям потенциала от времени и температуры и значению потенциала φ в данный момент времени τ судят о структурном состоянии воды и времени возврата t в исходное состояние.
Для демонстрации преимуществ заявляемого способа перед методами потенциометрического, кондуктометрического титрования, диэлектрометрии в таблице 1 приводится их сравнение по воспроизводимости и правильности определения состояния талой воды, причем приводятся средние значения коэффициентов вариации (n=6; P=0,95)
| Таблица 1 | |||
| Название способа | Электролит | Концентрация, экв/л | Коэффициентвариации, % |
| Заявляемый способ | - | - | 1,5 |
| Пьезокварцевое микровзвешивание | - | - | 1,8 |
| Кондуктометрическое титрование | KCl | 8,0 | |
| HCl | 10-4 | 13 | |
| AlCl3 | 6,0 | ||
| Потенциометрическое титрование | KCl | 18 | |
| HCl | 10-4 | 19 | |
| AlCl3 | 13 | ||
| Метод диэлектрометрии | |||
| Na2SO4 | 10-3 | 10 |
Из таблицы 1 следует, что в заявляемом способе:
1) нет загрязнения исследуемой воды электролитами;
2) коэффициент вариации в среднем меньше в 1,2 раза, чем в наилучшем из других способов.
Кроме того, вышеуказанные методы предполагают длительную подготовку самих измерений не менее 20 минут, в то время как заявляемый метод требует не более 3-5 минут. При использовании специальной компьютерной программы запись значений потенциала стеклоуглеродного электрода может осуществляться каждые 0,5 секунды.
Следовательно, предлагаемый прямой способ индикации состояния талой воды кроме экспрессности имеет еще более высокие воспроизводимость, точность и позволяет оценивать структурные изменения непосредственно растворителя (воды) без загрязнения его посторонними электролитами.
В таблице 2 представлены результаты измерения электродного потенциала φ стеклоуглеродного электрода (патент РФ №2039975) в исходной (дистиллированная) и талой (размороженная дистиллированная) воде, при T=24°C.
| Таблица 2 | ||
| Параметр | Исходная (дистиллят) вода | Талая вода |
| Потенциал φ, мВ | 334±2 | 306±5 |
| Границы доверительного интервала Δφ, мВ | 332÷336 | 301÷311 |
| Значение pH | 5,8 | 5,7 |
Аналогичные измерения были проведены с бидистиллированной водой. Результат представлен в таблице 3.
| Таблица 3 | ||
| Параметр | Исходная (бидистиллят) вода | Талая вода |
| Потенциал φ, мВ | 317±3 | 305±3 |
| Границы доверительного интервала Δφ, мВ | 314÷320 | 302÷308 |
| Значение pH | 5,5 | 5,6 |
Таким образом, так как не менялся химический состав воды и границы доверительных интервалов не перекрываются, следовательно, можно предположить, что структура талой воды отличается от структуры исходной воды, поскольку электродный потенциал стеклоуглерода в талой воде достоверно ниже такового в исходной воде.
В интервале температур T=21÷24°C были проведены измерения (n=5) параметров исходной дистиллированной и размороженной - талой воды другими методами: значение pH, поверхностное натяжение σ, удельная электропроводность χ, которые не дали никаких сколько-нибудь достоверных отличий. Результаты данных измерения представлены в таблице 4.
| Таблица 4 | ||
| Параметр | Исходная (дистиллят) | Талая |
| Значение pH | 5,8±0,8 | 5,7±0,6 |
| σ·103, [Н/м] | 72,86±0 | 74,19±2,7 |
| χ·105, [См/м] | 8,9±0,8 | 7,5±0,7 |
| Потенциал φ, мВ | 334±2 | 306±5 |
| Границы доверительного интервала, Δφ мВ | 332÷336 | 301÷311 |
Аналогичные измерения были проведены для бидистиллированной и размороженной - талой - воды. Данные об этих измерениях представлены в таблице 6.
| Таблица 5 | ||
| Параметр | Исходная (бидистиллят) | Талая |
| Значение pH | 5,5±0,8 | 5,6±0,9 |
| σ·103, [Н/м] | 72,86±0 | 73,24±0,29 |
| χ·105, [См/м] | 4,6±0,5 | 3,9±0,4 |
| Потенциал φ, мВ | 317±3 | 305±3 |
| Границы доверительного интервала Δφ | 314÷320 | 302÷308 |
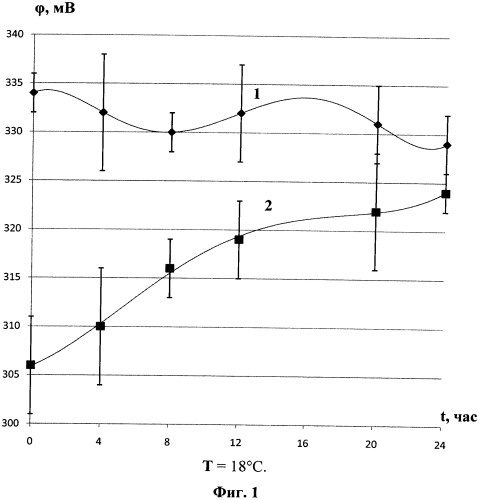
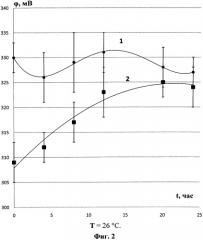
Для выявления влияния температуры на скорость релаксации талой воды к состоянию исходной были получены релаксационные зависимости потенциала стеклоуглеродного электрода в исходной дистиллированной и талой воде на большом интервале времени (0-25 часов) при разных температурах (фиг.1 и 2).
На фиг.1 представлены релаксационные зависимости потенциала стеклоуглеродного электрода в исходной дистиллированной (1) и талой воде (2) при T=18°C. На фиг.2 представлены релаксационные зависимости потенциала стеклоуглеродного электрода в исходной дистиллированной (1) и талой воде (2) при T=26°C. Из данных фигур видно, что чем выше температура, тем выше скорость структурной релаксации к исходному состоянию воды. Так, при T=18°C талая вода возвращается к исходной дистиллированной воде через 20 часов, в момент когда доверительные интервалы перекрываются. При T=26°C талая вода возвращается к исходной дистиллированной воде через 12 часов.
Таким образом, за счет прямых измерений потенциала исходной и талой воды решается задача изобретения повышение достоверности, точности и экспрессности измерений структурного состояния талой воды и определение времени ее релаксации к состоянию исходной воды.
Способ индикации структурного состояния воды, в котором определяют потенциал стеклоуглеродного электрода, погруженного в исходную воду, затем определяют потенциал электрода, погруженного в талую воду, за время релаксации талой воды до состояния исходной воды по полученным тестовым релаксационным зависимостям потенциала от времени, температуры и значению потенциала φ в данный момент времени τ судят о структурном состоянии воды и времени возврата t в исходное структурное состояние.