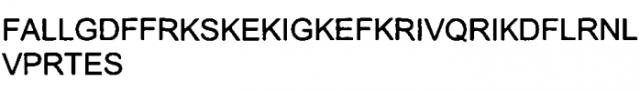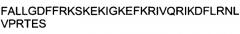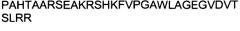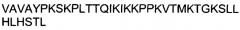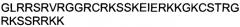Пептиды, проникающие в клетки, и их применения
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к интернализации терапевтических молекул внутрь клетки, и может быть использовано в медицине. Получают композицию для доставки молекул нуклеиновых кислот в клетки, содержащую по меньшей мере один пептид с по меньшей мере 92% идентичностью к GAAEAAARVYDLGLRRLRQRRRLRRERVRA (SEQ ID NO: 2); IREIMEKFGKQPVSLPARRLKLRGRKRRQR (SEQ ID NO: 3); или YLKVVRKHHRVIAGQFFGHHHTDSFRMLYD (SEQ ID NO: 4), присоединенный к одной или нескольким молекулам нуклеиновых кислот. Изобретение позволяет повысить эффективность доставки молекул нуклеиновых кислот внутрь клетки млекопитающего за счет пептида, способного интернализироваться внутрь клетки млекопитающего с эффективностью, составляющей по меньшей мере 200% от эффективности интернализации пептида ТАТ, имеющего аминокислотную последовательность GRKKRRQRRRPPQ (SEQ ID NO: 1). 5 н. и 3 з.п. ф-лы, 16 ил., 1 табл., 8 пр.
Реферат
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к выявлению и определению функциональных характеристик пептидов человека, проникающих в клетки (CPP), и их применению, в частности, в качестве носителей при трансфекции.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Плазматическая мембрана клетки представляет собой эффективный барьер, предотвращающий поступление в клетку большинства молекул, которые не подвергаются активному транспорту, но тем самым также затрудняется целевая доставка терапевтических субстанций. Лишь небольшой набор молекул, обладающих определенной молекулярной массой, полярностью и/или суммарным зарядом, способны (пассивно) диффундировать сквозь клеточные мембраны. Все остальные молекулы должны активно транспортироваться, например, посредством рецептор-опосредованного эндоцитоза или с помощью АТФ-связывающих транспортных молекул. Кроме того, можно также искусственно создать условия, заставляющие молекулы проходить через клеточную мембрану, например, с помощью электропорации, катионных липидов/липосом, микроинъекции, вирусной доставки или инкапсуляции в полимерах. Однако эти способы в основном применяют для доставки гидрофобных молекул. Дополнительно, существенные побочные эффекты, связанные с этими способами, и тот факт, что их применение в основном ограничено системами in vitro, не позволяют этим способам стать эффективным инструментом доставки лекарственных препаратов или других терапевтически активных агентов в клетки с целью профилактики или лечения медицинских состояний.
В частности, необходимость целевой доставки также оказалось существенной проблемой при разработке лекарственных препаратов на основе РНКi (РНК-интерференции). Такие агенты включают малые молекулы РНК (например, siРНК, miРНК или shРНК), которые препятствуют экспрессии генов, вызывающих заболевание или способствующих развитию заболевания. После того, как в 2001 г. наличие РНКi было продемонстрировано в клетках млекопитающих (Elbashir, S.M. et al. (2001) Nature 411, 494-498), быстро стало понятно, что этот сиквенс-специфичный механизм посттранскрипционного сайленсинга генов можно применять для разработки нового класса лекарственных препаратов, который также может стать многообещающим средством лечения заболеваний, которые до сих пор были недоступны для терапевтического вмешательства (De Fougerolles, A. et al. (2007) Nat. Rev. Drug Discov. 6, 443-453).
Однако, так как РНКi происходит в цитозоле, то для проявления своего терапевтического действия любые лекарственные препараты на основе РНК должны проходить через клеточную мембрану. К настоящему моменту описано несколько способов достижения этой цели, например, применение липидов (Schroeder; А. et al. (2010) J. Intern. Med. 267, 9-21), вирусных носителей (Liu, Y.P: and Berkhout, B. (2009) Curr. Top.Med. Chem. 9, 1130-1143) и поликатионных наночастиц (Howard, K.A. (2009) Adv. Drug Deliv. Rev. 61, 710-720).
Еще одним способом перемещения молекул через клеточную мембрану является применение пептидов, проникающих в клетки (CPP) (называемых также доменами белковой трансдукции (PTD) или последовательностями транслокации через мембрану (MTS); см. обзор, например, в публикации: Fonseca, S.B et al. (2009) Adv. Drug Deliv. Rev. 61, 953-964; Heitz, F. et al. (2009) Br. J. Pharmacol. 157, 195-206).
CPP представляют собой гетерогенную группу пептидных молекул - с точки зрения как их первичных аминокислотных последовательностей, так и их структур. Известные примеры CPP включают домен транслокации HIV-1 TAT (Green; M. and Loewenstein, P.M. (1988) Cell 55, 1179-1188) и гомеодомен белка Antennapedia из Drosophila (Joliot; A. et al. (1991) Proc. Natl. Acad. Sci. USA 88, 1864-1868). Точный механизм транслокации до сих пор остается спорным вопросом. Исследования мутаций белка Antennapedia выявили, что последовательность из 16 аминокислот, называемая пенетратином или pAntp (Derossi, D. et al. (1994) J. Biol. Chem. 269, 10444-10450), является необходимым и достаточным фактором для транслокации через мембрану. В дальнейшем были разработаны другие полученные из белков пептиды CPP, такие как основная последовательность белка HIV-1 Tat (Vives, E. et al. (1997) J. Biol. Chem. 272, 16010-16017). Разработан синтетический пептид - амфипатический модельный пептид MAP (Oehlke, J. et al. (1998) Biochim. Biophys. Acta 1414, 127-139).
Показано, что соединение антисмысловой ДНК или пептидо-нуклеиновых кислот (PNA) с пептидами CPP дает требуемый эффект in vivo. Однако до сих пор обсуждается, какие свойства необходимы пептиду CPP для проявления транслокационной функции. В общем случае между различными пептидами CPP было обнаружено мало сходства с точки зрения последовательности и/или структуры. На настоящий момент известно только одно общее свойство - это достаточно высокое содержание основных (положительно заряженных) аминокислот, которое обусловливает положительный суммарный заряд. Таким образом, высказано предположение, что пептиды CPP сначала связываются с отрицательно заряженными группами головки липидов или белками (протеогликанами) на клеточной мембране. Однако после связывания пептиды остаются внутри мембрано-связанных компартментов. Механизм поглощения на дальнейших этапах до сих пор активно обсуждается. Предполагают, что пептиды CPP либо «ретроградно» транспортируются в ЭПР, где они попадают под действие существующего в клетке механизма транслокации (Fischer, R. et al. (2004) J. Biol. Chem. 279, 12625-12635), либо они напрямую транслоцируются через мембрану (Rothbard, J.B. et al. (2005) Adv. Drug Deliv. Rev. 57, 495-504). В зависимости от механизма интернализации известные пептиды CPP в основном располагаются в ядре или, в случае, если они интернализируются внутри везикул, в основном остаются внутри этих везикул, и только незначительная часть высвобождается в цитоплазму.
Многие пептиды CPP оказывают серьезные побочные эффекты на клетки, на которые они действуют, и это неудивительно с учетом того факта, что большинство пептидов, от которых происходят CPP, функционируют в качестве, например, противомикробных субстанций или токсинов. Например, пептиды CPP могут вызывать вытекание цитоплазмы из-за повреждения мембраны, а также оказывать мешающее воздействие на нормальное функционирование мембранных белков. Пептиды CPP могут также демонстрировать цитотоксические эффекты, примером может служить, транспортан, который влияет на ГТФазную активность (Soomets, U. et al. (2000) Biochim. Biophys. Acta 1467, 165-176). Кроме того, накапливается все больше доказательств того, что многие пептиды CPP выполняют свою функцию только в определенных, очень специфических условиях, которые невозможно обеспечить в системе in vivo. Еще один недостаток заключается в том, что, в зависимости от клетки-мишени, пептиды CPP могут подвергаться быстрой деградации в клетках. Наконец, так как многие известные пептиды CPP происходят от белков, не являющихся белками человека, регулярно отмечались токсические и/или иммуногенные эффекты, которые могут препятствовать применению этих пептидов, например, с терапевтическими целями у человека.
Таким образом, сохраняется потребность в улучшенных пептидах, проникающих в клетки, которые позволят преодолеть все указанные выше ограничения. В частности, имеется потребность в пептидах, проникающих в клетки, которые представляют собой пригодные везикулы или носители для трансфекции, позволяющие осуществлять доставку соединений, таких как терапевтические агенты, в клетки-мишени с высокой эффективностью, но без проявления существенных цитотоксических и/или иммуногенных эффектов.
Кроме того, сохраняется потребность в композициях, содержащих такие пептиды CPP, а также в способах, в которых такие пептиды CPP применяются в качестве молекулярного инструмента для диагностических и терапевтических применений.
Соответственно, цель настоящего изобретения - предложить такие пептиды CPP и соответствующие композиции и способы.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Одной из особенностей настоящего изобретения является то, что оно относится к пептидной молекуле, которая может быть интернализирована внутрь клетки, при этом пептидная молекула (a) имеет длину по меньшей мере 10, предпочтительно - по меньшей мере 15 аминокислотных остатков; (b) содержит в своей первичной аминокислотной последовательности по меньшей мере 25%, предпочтительно - по меньшей мере 30% положительно заряженных аминокислотных остатков; и (c) интернализируется внутрь клетки с эффективностью, составляющей по меньшей мере 80%, предпочтительно - по меньшей мере 90% от эффективности интернализации пептида TAT, имеющего аминокислотную последовательность GRKKRRQRRRPPQ (SEQ ID NO: 1).
В конкретных примерах воплощения по меньшей мере часть пептида образует альфа-спиральную вторичную структуру.
Предпочтительно, пептид является пептидом млекопитающих, в частности, предпочтительно, происходит от молекулы человека.
В дополнительных предпочтительных вариантах воплощения пептид имеет аминокислотную последовательность, выбранную из группы, состоящей из:
(SEQ ID NO: 2);
(SEQ ID NO: 3);
(SEQ ID NO: 4);
(SEQ ID NO: 5);
(SEQ ID NO: 6);
(SEQ ID NO: 7);
(SEQ ID NO: 8);
(SEQ ID NO: 9);
(SEQ ID NO: 10); и при этом аминокислотная последовательность обладает по всей своей длине по меньшей мере 70%, предпочтительно - по меньшей мере 80% суммарной идентичностью последовательности относительно любой из последовательностей с SEQ ID NO: 2 по SEQ ID NO: 10.
В конкретных предпочтительных вариантах воплощения пептид имеет аминокислотную последовательность, выбранную из группы, состоящей из:
(SEQ ID NO: 2);
(SEQ ID NO: 3);
(SEQ ID NO: 4); и при этом аминокислотная последовательность обладает по всей своей длине по меньшей мере 70%, предпочтительно - по меньшей мере 80% суммарной идентичностью последовательности относительно любой из последовательностей с SEQ ID NO: 2 по SEQ ID NO: 4.
Еще одной особенностью настоящего изобретения является то, что оно относится к молекуле нуклеиновой кислоты, кодирующей пептид, указанный в этом документе выше.
Еще одной особенностью настоящего изобретения является то, что оно относится к вектору, содержащему молекулу нуклеиновой кислоты, описанную в этом документе выше.
Еще одной особенностью настоящего изобретения является то, что оно относится к клетке-хозяину, содержащей вектор, описанный в этом документе выше.
Дополнительной особенностью настоящего изобретения является то, что оно относится к способу получения пептида, указанного в этом документе выше, включающему: (a) культивирование клетки-хозяина, указанной в этом документе выше, в пригодных условиях; и (b) выделение полученного пептида.
Еще одной особенностью настоящего изобретения является то, что оно относится к композиции, содержащей по меньшей мере один пептид, указанный в этом документе выше, присоединенный к любой молекуле, выбранной из группы, состоящей из одной или нескольких молекул нуклеиновых кислот, одного или нескольких пептидов или белков, одной или нескольких малых молекул и одной или нескольких наночастиц, при этом присоединение осуществляют посредством связывания, выбранного из группы, состоящей из ковалентного связывания и нековалентного связывания.
В конкретных примерах воплощения по меньшей мере один пептид в составе композиции присоединен к одному или нескольким другим пептидам. Предпочтительно, один или несколько других пептидов образуют, по меньшей мере частично, альфа-спиральную вторичную структуру. В некоторых вариантах воплощения один или несколько других пептидов являются про-апоптотическими пептидами.
Дополнительной особенностью настоящего изобретения является то, что оно относится к способу получения композиции, указанной в этом документе выше, включающему: (a) создание по меньшей мере одного пептида, указанного в этом документе выше; и (b) осуществление контакта этого по меньшей мере одного пептида с любой молекулой, выбранной из группы, состоящей из одной или нескольких молекул нуклеиновых кислот, одного или нескольких пептидов или белков, одной или нескольких малых молекул и одной или нескольких наночастиц, для того, чтобы обеспечить осуществление присоединения.
Еще одной особенностью настоящего изобретения является то, что оно относится к способу выявления способности к интернализации у пептида, указанного в этом документе выше, или у композиции, указанной в этом документе выше, включающему: (a) введение пептида или композиции в одну или несколько клеток; и (b) выявление интернализации пептида или композиции.
Дополнительной особенностью настоящего изобретения является то, что оно относится к фармацевтической композиции, содержащей по меньшей мере один пептид, указанный в этом документе выше, или композицию, указанную в этом документе выше, и, возможно, дополнительно содержащей одно или несколько фармацевтически приемлемых вспомогательных веществ и/или добавок.
Еще одной особенностью настоящего изобретения является то, что оно относится к применению пептида, указанного в этом документе выше, или композиции, указанной в этом документе выше, для трансформации или трансфекции одной или нескольких клеток.
Еще одной особенностью настоящего изобретения является то, что оно относится к пептиду, указанному в этом документе выше, или к композиции, указанной в этом документе выше, для применения с целью профилактики и/или лечения состояния, выбранного из группы, состоящей из онкологического заболевания, иммунных заболеваний, сердечно-сосудистых заболеваний, неврологических заболеваний, инфекций и воспалительных заболеваний.
Еще одной особенностью настоящего изобретения является то, что оно относится к способу профилактики и/или лечения состояния, выбранного из группы, состоящей из онкологического заболевания, иммунных заболеваний, сердечно-сосудистых заболеваний, неврологических заболеваний, инфекций и воспалительных заболеваний, включающему: введение субъекту по меньшей мере одного пептида, указанного в этом документе выше, или композиции, указанной в этом документе выше.
Дополнительной особенностью настоящего изобретения является то, что оно относится к составному набору, содержащему по меньшей мере одно из следующего: (a) пептид, указанный в этом документе выше; (b) молекулу нуклеиновой кислоты, указанную в этом документе выше; (c) вектор, указанный в этом документе выше; (d) клетку-хозяина, указанную в этом документе выше; и (e) композицию, указанную в этом документе выше.
Другие варианты воплощения настоящего изобретения будут очевидны из детального описания, приведенного далее.
ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
ФИГУРА 1. Биоинформационный способ выявления пептидов, проникающих в клетки человека.
Представлено схематическое изображение применяемой процедуры скрининга. Были отобраны все элементы базы данных SwissProt, относящиеся к белкам человека, вместе с их описанием и аннотацией из Генной онтологии (GO) (A), и проведен их анализ с применением скользящего окна размером 30 аминокислотных остатков (B). Для выявления предполагаемых пептидов, проникающих в клетки (CPP) применяли биоинформационные фильтры (C): во-первых, отбирали только пептиды, содержащие 10 или более положительных зарядов; во-вторых, отбирали только внеклеточные белки с низкой вероятностью проявления иммуногенности («этапы 2 и 3»). Для уменьшения количества пептидов выбрали несколько подходов: сочетание наибольшего значения изоэлектрической точки (ИЭТ) и наивысшей степени гидрофобности, сходство последовательности с последовательностью полученного из ВИЧ пептида TAT, а также тщательное изучение литературных источников и результатов BLAST-анализа.
ФИГУРА 2. Диаграмма, демонстрирующая гидрофобность и ИЭТ для 500 произвольно выбранных пептидов.
На диаграмме отобразили гидрофобность и ИЭТ для 500 пептидов, произвольно выбранных из совокупности, состоящей из 10,5×106 30-мерных пептидов, принадлежащих человеку. В качестве контролей добавили пептиды TAT, поли-Arg, REV, протамин и INF7 (незакрашенные квадраты). Нетоксические и неспособные к трансфекции пептиды указаны в виде закрашенных черным кругов, трансфецирующие токсические пептиды обозначены перечеркнутым незакрашенным кругом, токсические пептиды - незакрашенным кругом с вписанным крестом и нетоксические трансфецирующие пептиды - незакрашенным кругом.
ФИГУРА 3. Диаграмма, демонстрирующая токсичность и способность к трансфекции для всех проанализированных пептидов.
Все пептиды были проанализированы на способность осуществлять трансфекцию siРНК, и их токсичность была нанесена на диаграмму как среднее значение уровней GAPDH мРНК при концентрации 20 мкМ каждой из Aha1 siРНК и siPHK люциферазы (ось y, «Токсичность»), а также были указаны относительные различия показателей Aha1/GAPDH при трансфекции siPHK люциферазы и Aha1/GAPDH при трансфекции Aha1 siРНК в концентрации 20 мкМ каждой (ось x, «Трансфекция»). Пороговые значения для токсичности (среднее содержание GAPDH мРНК на уровне 70%) и трансфекции (>TAT, 18%) указаны красными пунктирными линиями. Пунктирные линии делят диаграмму на 4 квадранта: верхний левый - нетрансфецирующий нетоксические пептиды; верхний правый - трансфецирующие нетоксические пептиды; нижний левый - токсические пептиды; нижний правый - трансфецирующие токсические пептиды. На вставке показаны токсические пептиды, попавшие в диапазон, выходящий за рамки диаграммы.
ФИГУРА 4. Анализ пептида WNT16.
WNT16 представляет собой пример нетоксического, неспособного к трансфекции (т.е., нетрансфецирующего) пептида. Применяли тот же экспериментальный подход, что и в случае фиг.3. Для демонстрации дозо-зависимых эффектов значения содержания мРНК, полученные при концентрации 1 мкМ, были приняты за 100%. Жизнеспособность выражена как процентная доля относительно контроля (среда без добавок). Данные для Aha1 siРНК обозначены в виде черных закрашенных квадратов; данные для siРНК люциферазы (Luc) показаны в виде незакрашенных кружков.
ФИГУРА 5. Анализ пептидов BPIL3 и FALL.
BPIL3 представляет собой пример токсического, неспособного к трансфекции пептида. Применяли тот же экспериментальный подход, что и в случае фиг.3. (A). Обратите внимание, что уровни Aha1 и GAPDH демонстрируют схожее поведение, при этом GAPDH показывает более высокую чувствительность. Это служит объяснением повышения значений Aha1/GAPDH. Для демонстрации потенциального терапевтического окна для токсического пептида, обладающего способностью к трансфекции, которая маскируется его токсичностью, тот же анализ провели для пептида FALL (В). Для выявления дозо-зависимых эффектов значения уровней мРНК для обоих пептидов (A, B), полученные при концентрации 1 мкМ, приняли за 100%. Жизнеспособность для обоих пептидов (A, B) выражена как процентная доля относительно контроля (среда без добавок). Данные для Aha1 siРНК обозначены в виде черных закрашенных квадратов; данные для siРНК люциферазы показаны в виде незакрашенных кружков.
ФИГУРА 6. Анализ пептида CU025.
CU025 представляет собой пример токсического, способного к трансфекции пептида. Применяли тот же экспериментальный подход, что и в случае фиг.3. Для демонстрации дозо-зависимых эффектов значения содержания мРНК, полученные при концентрации 1 мкМ, были приняты за 100%. Жизнеспособность выражена как процентная доля относительно контроля (среда без добавок). Данные для Aha1 siРНК обозначены в виде черных закрашенных квадратов; данные для siРНК люциферазы показаны в виде незакрашенных кружков.
ФИГУРА 7. Анализ нетоксических, способных к трансфекции пептидов.
CPXM2, ASM3B и NRTN представляют собой примеры нетоксических, способных к трансфекции пептидов. Применяли тот же экспериментальный подход, что и в случае фиг.3. В качестве контроля определяли соотношения Aha1/GAPDH для пептидов TAT и поли-Arg (A). Как CPXM2 (B), так и ASM3B (C) демонстрируют зависящее от концентрации снижение уровня Aha1 мРНК относительно GAPDH мРНК, не влияя существенно на жизнеспособность клеток. Подробный анализ NRTN (D) выявил существенное снижение уровня Aha1 мРНК относительно уровня GAPDH мРНК без существенных дозо-зависимых эффектов на жизнеспособность клеток. (A, B, C, D) Во всех случаях для демонстрации дозо-зависимых эффектов значения уровней мРНК, полученные при концентрации 1 мкМ, были приняты за 100%. Жизнеспособность выражена как процентная доля относительно контроля (среда без добавок). Данные для Aha1 siРНК обозначены в виде черных закрашенных квадратов; данные для siРНК люциферазы показаны в виде незакрашенных кружков.
ФИГУРА 8. Анализ сдвига электрофоретической подвижности выбранных пептидов в геле.
С целью демонстрации образования соответствующих комплексов пептидов TAT (A), NRTN (B) и WNT16 (D) инкубировали 500 мкг дуплексной siРНК с пептидом, взятым в указанном молярном соотношении, в течение одного часа и проводили анализ с применением электрофореза в агарозном геле и окрашивания бромидом этидия. Данный анализ демонстрирует образование комплексов между siРНК и пептидами TAT, NRTN и WNT16, соответственно. Для демонстрации влияния пептида NRTN на доступность siРНК для бромида этидия комплекс инкубировали в присутствии или в отсутствие протеиназы K (C).
ФИГУРА 9. Опосредованной пептидом NRTN трансфекции достаточно для воздействия на клеточный фенотип.
Специфичность пептида NRTN к последовательности siРНК исследовали с применением анализа способности пептида трансфецировать дуплекс siРНК, мишенью которой служит Eg5 мРНК человека. Индукцию апоптоза, вызванного нокдауном Eg5, определяли с помощью анализа цитотоксичности Cyto Tox-Glo (Promega Inc.) Для демонстрации дозо-зависимых эффектов значения содержания мРНК, полученные при концентрации 1 мкМ, были приняты за 100%. Индукция апоптоза выражена как процентная доля относительно контроля (среда без добавок). Данные для Aha1 siPHK обозначены в виде черных закрашенных квадратов; данные для siРНК люциферазы показаны в виде незакрашенных кружков.
ФИГУРА 10. Выравнивание последовательностей GDNF и NRTN.
Выравнивание аминокислотных последовательностей GDNF крысы и NRTN человека продемонстрировало, что они являются родственными белками. Идентичные аминокислоты показаны светло-серым цветом на белом фоне, схожие аминокислоты - черным цветом на светло-сером фоне и различающиеся аминокислоты - черным цветом на белом фоне. В GDNF крысы обозначен отрезок, соответствующий альфа-спиральной структуре. Прямоугольной рамкой в составе NRTN выделен пептид, который применяли в экспериментах.
ФИГУРА 11. NTRN содержит альфа-спиральный структурный элемент.
Анализ пептидов FALL (A), NRTN (B) и TAT (C) с применением спектроскопии кругового дихроизма в УФ диапазоне. Спектры получали в диапазоне от 195 нм до 260 нм с шагом 0,1 нм и шириной полосы пропускания 1 нм, применяя раствор пептида 0,1 мг/мл в отсутствие («H2O») или в присутствии 10%, 25% и 50% трифторэтанола (TFE), соответственно.
ФИГУРА 12. NRTN, TAT и FALL действуют в качестве пептидов, проникающих в клетки.
Применение флуоресцентно-активированного клеточного сортинга (FACS) для анализа пептидов TAT (A), WNT16 (B), FALL (C) и NRTN (D), содержащих N-концевую FITC-метку. Клетки инкубировали в течение 3 ч в присутствии пептида, обрабатывали протеиназой К в течение 30 мин. и проводили анализ с применением FACS для выявления интернализированных пептидов в канале, соответствующем FITC. Черными линиями показаны сигналы при концентрации 1 мкМ, светло-серыми линиями показаны сигналы при концентрации 5 мкМ и темно-серыми линиями показаны сигналы при концентрации 10 мкМ.
ФИГУРА 13. NRTN демонстрирует активность в условиях присутствия сыворотки.
Провели анализ способности NRTN осуществлять трансфекцию дуплексов siРНК в отсутствие (A) и в присутствии (B) сыворотки в среде для трансфекции. Применяли тот же экспериментальный подход, что и в случае фиг.3. Анализ проводили либо в нормальной питательной среде RPMI 1640, содержащей 10% FCS (сыворотки плодов крупного рогатого скота) (B), либо с инкубацией в течение трех часов в среде OptiMEM для выращивания с пониженным содержанием сыворотки с последующей заменой среды на нормальную питательную среду (A). Для демонстрации дозо-зависимых эффектов значения содержания мРНК, полученные при концентрации 1 мкМ, были приняты за 100%. Данные для Aha1 siРНК обозначены в виде черных закрашенных квадратов; данные для siРНК люциферазы показаны в виде незакрашенных кружков.
ФИГУРА 14. Поглощение NRTN эндотелиальными клетками головного мозга человека.
Конъюгированные с флуоресцеинизотиоцианатом (FITC) пептиды NRTN (с N-концевой и C-концевой конъюгацией, соответственно) инкубировали с эндотелиальными клетками головного мозга hCMEC/D3 при концентрации 5 мкМ в течение 1 ч при 37°C. После этого клетки промывали и фиксировали. Изображения получали с применением флуоресцентной микроскопии. В обоих случаях пептид располагался во внутриклеточных эндосомальных структурах.
ФИГУРА 15. NRTN-опосредованное поглощение клетками про-апоптотического пептида Nur77.
Клетки рака груди человека MCF-7 инкубировали в течение 24 ч в присутствии различных концентраций пептидов NRTN (квадраты), Nur (кружки) и NurNRTN (треугольники). Соответствующие аминокислотные последовательности приведены в нижней части фигуры. Для оценки жизнеспособности клеток (и, таким образом, индукции апоптоза) применяли тот же экспериментальный подход, что и в случае фиг.3.
ФИГУРА 16. NRTN-опосредованное поглощение клетками про-апоптотического пептида 4E-BP1.
Клетки рака груди человека MCF-7 инкубировали в течение 24 ч в присутствии различных концентраций пептидов 4E-BP1 (кружки), TAT4E-BP1 (квадраты) и NRTN4E-BP1 (треугольники) (верхняя часть фигуры). Дополнительно проводили сравнение соответствующих эффектов двух химерных пептидов (сплошные линии) с их неактивными вариантами (TATinact4E-BP1 и NRTNinact4E-BP1; пунктирные линии), соответственно (средняя часть фигуры). Соответствующие аминокислотные последовательности приведены в нижней части фигуры. Для оценки жизнеспособности клеток (и, таким образом, индукции апоптоза) применяли тот же экспериментальный подход, что и в случае фиг.3.
ДЕТАЛЬНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В основе настоящего изобретения лежит неожиданно обнаруженный факт, что с помощью сочетания биоинформационного скрининга и последующей экспериментальной оценки кандидатных пептидов можно выявить несколько пептидов CPP, которые демонстрируют улучшенный функциональный профиль, по сравнению с предшествующим «золотым стандартом» - эталонным пептидом TAT, в частности, более высокую общую эффективность трансфекции, более высокую трансфекционную активность в присутствии сыворотки, а также более низкую степень цитотоксичности. Примечательно, что эти пептиды CPP не демонстрируют существенного сходства их первичных аминокислотных последовательностей. Таким образом, эти пептиды могут служить в качестве модулей при разработке новых эффективных агентов для доставки с целью применения при терапевтическом вмешательстве.
Настоящее изобретение, наглядное описание которого приведено далее, может применяться на практике в отсутствие любого элемента или элементов, ограничения или ограничений, не раскрытых специально в этом документе.
В случаях, когда в настоящем описании и формуле изобретения используется термин «содержащий», не исключается наличие других элементов или этапов. Для целей настоящего изобретения предполагается, что термин «состоящий из» является предпочтительным вариантом воплощения термина «содержащий». Если далее в этом документе указано, что группа содержит по меньшей мере определенное количество вариантов воплощения, это также следует понимать как раскрытие группы, которая предпочтительно состоит только из этих вариантов воплощения.
В случае если используется существительное в единственном числе, оно включает в себя и форму множественного числа этого существительного, если особо не указано иначе.
В случае указания в контексте настоящего изобретения числовых значений специалисту в данной области будет понятно, что техническое действие рассматриваемой особенности гарантированно находится в интервале, определяемом с определенной точностью, который в типичном случае включает отклонение от данного числового значения на ±10% и предпочтительно - на ±5%.
Дополнительно, термины «первый», «второй», «третий», «(a)», «(b)», «(c)» и т.п. в описании и в формуле изобретения используются для отделения друг от друга схожих элементов и не обязательно для описания последовательности или хронологического порядка. При этом понимается, что используемые таким образом термины являются взаимозаменяемыми при соответствующих условиях, и что варианты воплощения изобретения, описанные в этом документе, могут быть осуществлены в последовательности, отличной от описанной или проиллюстрированной в этом документе.
Дополнительные определения терминов будут даны далее, в контексте, в котором эти термины используются. Приведенные далее термины или определения представлены исключительно для облегчения понимания изобретения. Эти определения не следует толковать как имеющие меньший объем, чем объем, понимаемый специалистом в данной области.
Первой особенностью настоящего изобретения является то, что оно относится к пептидной молекуле, которая может быть интернализирована внутрь клетки, при этом пептидная молекула:
(a) имеет длину по меньшей мере 10, предпочтительно - по меньшей мере 15 аминокислотных остатков;
(b) содержит в своей первичной аминокислотной последовательности по меньшей мере 25%, предпочтительно - по меньшей мере 30% положительно заряженных аминокислотных остатков; и
(c) интернализируется внутрь клетки с эффективностью, составляющей по меньшей мере 80%, предпочтительно - по меньшей мере 90% от эффективности интернализации пептида TAT, имеющего аминокислотную последовательность GRKKRRQRRRPPQ (SEQ ID NO: 1).
Термин «пептидная молекула» (также называемая в этом документе «пептидом») при использовании в этом документе означает любые имеющие природное происхождение или синтетические (например, полученные с применением химического синтеза или технологии рекомбинантных ДНК) линейные макромолекулы, содержащие множество природных или модифицированных аминокислотных остатков, соединенных пептидными связями. Такие пептиды могут образовывать олигомеры, состоящие по меньшей мере из двух идентичных или различных пептидных молекул.
Пептиды по изобретению имеют длину по меньшей мере 10 аминокислотных остатков (например, 10, 11, 12, 13 или 14 аминокислотных остатков) и предпочтительно имеют длину по меньшей мере 15 аминокислотных остатков, по меньшей мере 20 аминокислотных остатков, по меньшей мере 25 аминокислотных остатков, по меньшей мере 30 аминокислотных остатков, по меньшей мере 35 аминокислотных остатков, по меньшей мере 40 аминокислотных остатков или по меньшей мере 45 аминокислотных остатков. В конкретных примерах воплощения пептиды по изобретению имеют длину 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 39, 40, 41, 42, 43, 44 или 45 аминокислотных остатков.
Термин «природные аминокислотные остатки» при использовании в этом документе обозначает любую из 22 «канонических» аминокислот, которые в природе встраиваются в пептиды. Из этих двадцати двух аминокислот двадцать непосредственно кодируются при помощи универсального генетического кода. Две оставшиеся, селеноцистеин и пирролизин, встраиваются в белки с помощью уникальных механизмов синтеза. В типичном случае аминокислотные остатки пептида по изобретению представлены в форме L-изомеров. В некоторых вариантах воплощения один или несколько аминокислотных остатков пептида по изобретению представлены в форме D-изомеров. Термин «модифицированный аминокислотный остаток» при использовании в этом документе обозначает неканонические аминокислоты, такие как посттрансляционно модифицированные аминокислоты. Примеры посттрансляционных модификаций включают, среди прочего, фосфорилирование, гликозилирование, ацилирование (например, ацетилирование, миристоилирование, пальмитоилирование), алкилирование, карбоксилирование, гидроксилирование, гликирование, биотинилирование, убиквитилирование, изменения химической природы (например, деимидирование, деамидирование по механизму β-элиминирования) и структурные изменения (например, образование дисульфидных мостиков).
Аминокислотные последовательности пептидов, указанные в этом документе, представлены, в соответствии с общепринятым правилом, от амино (M)-конца до карбокси (C)-конца. Однако соответствующие «обратные» пептиды также включены в объем настоящего изобретения. Термин «обратные пептиды» при использовании в этом документе обозначает пептиды, обладающие такой же последовательностью, что и их «нормальные» аналоги, но представленные в обратной ориентации, т.е., от C-конца к N-концу. Например, «нормальный» пептид TAT имеет аминокислотную последовательность GRKKRRQRRRPPQ. Соответствующий «обратный» пептид TAT имеет аминокислотную последовательность QPPRRRQRRKKRG.
Пептиды по настоящему изобретению содержат в своих соответствующих первичных аминокислотных последовательностях (т.е. по всей своей длине) по меньшей мере 25%, предпочтительно - по меньшей мере 30% положительно заряженных аминокислотных остатков. Термин «положительно заряженные аминокислоты» (в этом документе называемые также «основными аминокислотами») при использовании в этом документе обозначает совокупность остатков лизина (K), гистидина (H) и аргинина (R), присутствующих в конкретном пептиде. В конкретных примерах воплощения пептид по настоящему изобретению содержит в своей первичной аминокислотной последовательности 25%, 26%, 27%, 28%, 29%, 30%, 31%, 32%, 33%, 34% или 35% положительно заряженных аминокислотных остатков. В других вариантах воплощения пептиды по изобретению содержат в своих соответствующих первичных аминокислотных последовательностях по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55% или по меньшей мере 60% положительно заряженных аминокислотных остатков.
Термин «может быть интернализирован внутрь клетки» при использовании в этом документе означает способность пептидов проходить сквозь клеточные мембраны (включая, среди прочего, наружную «ограничивающую» клеточную мембрану (также обычно называемую «плазматической мембраной»), эндосомальные мембраны и мембраны эндоплазматического ретикулума) и/или управлять прохождением данного агента или нагрузки сквозь эти клеточные мембраны. Такое прохождение сквозь клеточные мембраны называется в этом документе «проникновением в клетку». Соответственно, пептиды, обладающие указанной способностью проходить сквозь клеточные мембраны, называются в этом документе «пептидами, проникающими в клетки». В контексте настоящего изобретения подразумевается любой возможный механизм интернализации, включая как механизмы энергозависимого (т.е., активного) транспорта (например, эндоцтоз), так и механизм энергонезависимого (т.е., пассивного) транспорта (например, диффузию). При использовании в этом документе термин «интернализация» следует понимать как включающий локализацию по меньшей мере части пептидов, которые прошли сквозь плазматическую клеточную мембрану, в цитоплазме (в противоположность локализации в других клеточных компартментах, таких как везикулы, эндосомы или ядро). В конкретных примерах воплощения данный задействованный механизм транспорта обеспечивает, чтобы по меньшей мере 0,01%, по меньшей мере 0,05%, по меньшей мере 0,1%, по меньшей мере 0,5%, по меньшей мере 1%, по меньшей мере 2%, по меньшей мере 5% или по меньшей мере 10% интернализированных пептидов или композиций были локализированы в цитоплазме.
Пептиды по настоящему изобретению интернализируются внутрь клетки с эффективностью, составляющей по меньшей мере 80%, предпочтительно - по меньшей мере 90% от эффективности интернализации пептида ТАТ, имеющего аминокислотную последовательность GRKKRRQRRRPPQ (SEQ ID NO: 1; см. также публикацию: Vives; E. et al. (1997), см. выше). Иначе говоря, характеристика функциональной активности пептидов дается в сравнении с эталонным пептидом (пептид TAT представляет собой «золотой стандарт» для пептидов, проникающих в клетки)