Способы обнаружения контаминантов полимеров глюкозы
Иллюстрации
Показать всеНастоящее изобретение относится к медицине, а именно к иммунологии, и может быть использовано для обнаружения контаминантов полимеров глюкозы. Для этого проводят анализ воспалительного ответа in vitro с применением клеточной линии, которая представляет собой клеточную линию либо макрофагов, либо дифференцируемую в макрофаги, либо клетку, экспрессирующую один или несколько толл-подобных рецепторов (TLR) или NOD-подобных рецепторов, выбранных из TLR2, TLR4 и NOD2. Анализ содержит этапы: (a) размещение макрофагов в присутствии препарата полимеров глюкозы, которые могут содержать провоспалительные контаминанты, и измерение продуцирования цитокина RANTES, причем продуцирование цитокина RANTES указывает на то, что препарат содержит контаминанты, способные к инициации воспалительной реакции, и (b) размещение клеточной линии, которая позволяет обнаружить активность рецептора врожденного иммунитета или нескольких рецепторов врожденного иммунитета, выбранных из TLR2 и NOD2, в присутствии препарата и обнаружение сигнала репортерного гена, связанного с этим рецептором, причем обнаружение данной активности или данного сигнала указывает на присутствие в препарате контаминанта, который представляет собой агонист рецептора. Использование данного способа позволяет обнаружить контаминанты полимеров глюкозы, причем добавление компонентов, таких как MDP или LPS, в тестируемый образец позволяет действовать синергично с контаминантами, что повышает чувствительность и понижает порог обнаружения, при этом синергитический ответ отмечен для RANTES. 27 з.п. ф-лы, 5 пр., 23 ил., 5 табл.
Реферат
Настоящее изобретение относится к способам обнаружения контаминантов полимеров глюкозы, в частности, линий получения полимеров глюкозы, более конкретно, полимеров для перитонеального диализа.
В более широком смысле, данный способ также позволяет обнаружить контаминанты полимеров глюкозы, в частности, линий получения полимеров глюкозы для энтерального и парентерального питания, или даже для кормления новорожденных.
Предметом настоящего изобретения также является необходимость идентификации провоспалительных контаминантов.
Технические предпосылки изобретения
Компания-заявитель выбрала для разработки своего изобретения область, известную опасностью контаминантов, которые могут быть введены посредством полимеров глюкозы, указанные контаминанты являются ответственными за воспалительные реакции, которые чрезвычайно вредны для здоровья человека, область перитонеального диализа.
Перитонеальный диализ представляет собой тип диализа, задачей которого является удаление продуктов жизнедеятельности, таких как мочевина, креатинин, избыток калия или избытки воды, с которыми почки не справляются или более не справляются, чтобы очистить плазму крови. Такое медицинское лечение показано в случае терминальной стадии хронической почечной недостаточности.
При такой интракорпоральной очистке брюшину применяют в качестве диализной мембраны. Токсичные продукты жизнедеятельности из крови проходят через полупроницаемую мембрану брюшины в раствор, известный как диализат. Диализат вводят в брюшную полость через постоянный катетер. Существуют два типа перитонеального диализа:
- CAPD (непрерывный амбулаторный перитонеальный диализ), лечение, основанное на пропускании четырех пакетов диализата в день по медицинскому назначению,
- APD (автоматизированный перитонеальный диализ), непрерывное ночное лечение, которое соответствует примерно 15 литрам диализата на 8 часов по медицинскому назначению.
Наиболее часто применяемый диализаты состоят из буферного раствора (лактата или бикарбоната) с кислым pH (5,2-5,5) или физиологическим pH (7,4), к которому добавляют электролиты (натрий, кальций, магний, хлор) и осмотическую кислоту (глюкозу или полимер глюкозы, такой как "икодекстрин", находящийся в растворе для амбулаторного перитонеального диализа Extraneal®, выпускаемом фирмой Baxter).
Полимер глюкозы, такой как икодекстрин, упомянутый выше, предпочтительнее глюкозы в качестве осмотического средства, поскольку благодаря своему небольшому размеру глюкоза, которая быстро пересекает брюшину, приводит к потере осмотического градиента в течение 2-4 часов инфузии.
Стандартные полимеры глюкозы получают путем кислотного или ферментативного гидролиза крахмала из злаков или клубневых растений.
Кислотный гидролиз крахмала, который является полностью случайным, или его ферментативный гидролиз, который является немного более упорядоченным, обеспечивает смеси глюкозы (мономера) и цепочек глюкозы, которые включают очень короткие молекулы (олигомеры) с низкой степенью полимеризации (DP) и очень длинные молекулы (полимеры) с высокой DP. Кроме того, полимеры глюкозы имеют чрезвычайно разнообразную молекулярную массу.
В более конкретной области применения полимеров глюкозы для непрерывного амбулаторного перитонеального диализа очень быстро стало очевидным, что данные гидролизаты крахмала (смесь глюкозы, а также олигомеров и полимеров глюкозы) не могут применяться как таковые.
В европейской патентной заявке ЕР 207676 сообщают, что полимеры глюкозы, образующие прозрачные и бесцветные растворы при 10% концентрации в воде, со средневесовой молекулярной массой (Mw) от 5000 до 100000 дальтон и среднечисловой молекулярной массой (Mn) менее 8000 дальтон, являются предпочтительными.
Такие полимеры глюкозы также предпочтительно содержат по меньшей мере 80% полимеров глюкозы, молекулярная масса которых составляет от 5000 до 50000 дальтон, незначительно или совсем не содержат глюкозу или полимеры глюкозы с DP менее или равной 3 (молекулярная масса 504) и незначительно или совсем не содержат полимеры глюкозы с молекулярной массой более 100000 (DP приблизительно 600).
Другими словами, предпочтительными полимерами глюкозы являются полимеры глюкозы с низким индексом полидисперсности (значение, полученное путем расчета отношения Mw/Mn).
Предложенные в данной патентной заявке ЕР 207676 способы получения таких полимеров глюкозы с низким индексом полидисперсности из гидролизатов крахмала заключаются:
- либо в проведении фракционного осаждения мальтодекстрина с помощью водорастворимого растворителя,
- либо в проведении молекулярной фильтрации того же мальтодекстрина через различные мембраны с соответствующим порогом отсечения или исключения.
В этих двух случаях данные способы нацелены на удаление одновременно полимеров с очень высокой молекулярной массой и мономеров или олигомеров с низкой молекулярной массой.
Однако эти способы не являются удовлетворительными как с точки зрения их реализации, так и с точки зрения выхода и качества продукции, которую они позволяют получить.
В интересах разработки способа получения полностью водорастворимого полимера глюкозы с низким индексом полидисперсности, предпочтительно менее 2,5, предпочтительно с Mn менее 8000 дальтон и Mw от 12000 до 20000 дальтон, при этом в указанном способе отсутствуют недостатки предшествующего уровня техники, компания-заявитель пыталась решить эту проблему в своем патенте ЕР 667356 исходя из гидролизованного крахмала, а не из мальтодекстрина.
Полимер глюкозы, полученный путем хроматографического фракционирования, при этом предпочтительно содержит менее 3% глюкозы и полимеров глюкозы с DP менее или равной 3, и менее 0,5% полимеров глюкозы с DP более 600.
В конечном итоге с тех пор специалистами в области перитонеального диализа принято, что данные полимеры глюкозы, применяемые для их осмотической мощности, являются вполне удовлетворительными.
Однако риски микробного загрязнения данных препаратов, предназначенных для перитонеального диализа, подлежат критике.
На самом деле известно, что линии получения полимеров глюкозы могут быть загрязнены микроорганизмами или провоспалительными веществами, содержащимися в указанных микроорганизмах.
Загрязнение крахмала кукурузы или пшеницы микроорганизмами различных видов дрожжей, плесени и бактерий, а также более конкретно, ацидо-термофильными бактериями вида Alicyclobacillus acidocaldarius (экстремофильные бактерии, которые растут в горячей и кислой зонах линии) описано, например, при получении крахмала.
Основным риском для пациента, который получает такие зараженные продукты, является перитонит.
Клиническое подозрение на перитонит диагностируется, когда присутствует мутный диализат с различными клиническими проявлениями, а именно болью в животе, тошнотой, рвотой, диареей и лихорадкой.
Такие эпизоды перитонита вызваны внутрибрюшинной бактериальной инфекцией, и диагноз обычно легко устанавливается посредством положительных культур диализата.
"Стерильный перитонит", который также описан как асептический, химический или культурально-негативный перитонит, в свою очередь, как правило, вызван химическим раздражителем или инородным телом.
После внедрения икодекстрина для получения растворов для перитонеального диализа сообщалось об отдельных случаях асептического перитонита, которые могут быть связаны с различными причинами, в частности, с индуцированием потенциально присутствующими провоспалительными веществами.
Таким образом, асептические воспалительные эпизоды являются основными осложнениями, наблюдаемыми после инъекций диализных растворов.
Хотя некоторые из этих воспалительных эпизодов связаны с проблемой химической природы (случайная инъекция химических загрязнителей или неправильные дозы некоторых соединений), большинство случаев непосредственно связаны с наличием контаминантов микробного происхождения, которые присутствуют в растворах, применяемых для подготовки диализных растворов.
Липополисахариды (LPS) и пептидогликаны (PGN) являются основными контаминантами микробного происхождения, которые представляют высокий риск инициации воспаления, когда присутствуют в следовых количествах.
Стандартные анализы теоретически позволяют отбраковать партии, содержащие контаминанты данного типа и таким образом представляют риск для здоровья. Однако такие анализы не являются удовлетворительными, поскольку все еще сообщается об асептических воспалительных эпизодах, несмотря на то, что растворы были заявлены как безопасные.
Таким образом, несмотря на постоянное внимание со стороны тех, кто занимается данной областью, исходя из снижения риска загрязнений, в частности, путем улучшения их обнаружения, все еще остается необходимость в улучшении уровней производительности обнаружения контаминантов, которые могут индуцировать воспаление.
Подробное описание изобретения
Заслугой компании-заявителя стало принятие во внимание присутствия молекул, способных обострить воспалительный ответ, индуцированный другими контаминантами, в частности, LPS или PGN, особенно посредством механизма взаимодействия между TLR (толл-подобными рецепторами) и NOD (нуклеотид-связывающим белком, содержащим домен олигомеризации)-подобными рецепторами. Фактически, рассмотрение только эффекта выделенных контаминантов на воспаление является упрощенным.
В отличие от LPS, который представляет собой лиганд, распознаваемый рецепторами типа TLR4 (толл-подобный рецептор), PGN (а также многочисленные гликолипиды и липопептиды) представляет собой лиганд, распознаваемый рецепторами типа TLR2, которые индуцируют слабый воспалительный ответ на моделях in vitro и in vivo, тем самым подразумевая, что эти молекулы должны присутствовать в более высоких концентрациях для того, чтобы быть обнаруженными.
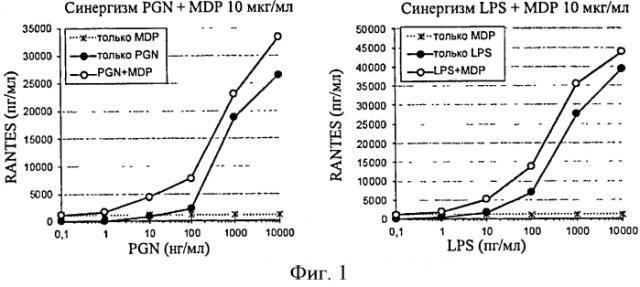
Таким образом, на моделях с применением мононуклеарных клеток (РВМС, первичные моноциты/макрофаги или линии моноцитов) LPS индуцирует существенный ответ в концентрациях от приблизительно 1 нг/мл, тогда как требуются по меньшей мере в 100 раз более высокие концентрации PGN, чтобы получить аналогичный ответ (отношение вес/вес).
Кроме того, хотя растворимые PGN (Mw≈125 кДа) индуцируют воспалительный ответ посредством активации TLR2, их продукты деполимеризации, минимальная структура которых остается биологически активной, представляющая собой мурамилдипептид (MDP), взаимодействуют с NOD-подобными внутриклеточными рецепторами.
Такие производные, рассматриваемые отдельно, не свидетельствуют однозначно о воспалении in vitro и дают существенный ответ при значениях >1 мкг/мл.
С другой стороны, присутствие этих молекул оказывает синергический эффект на воспалительный ответ посредством механизма взаимодействия TLR и NOD-подобных рецепторов независимо от применяемой экспериментальной модели (мышиная, линии моноцитов/макрофагов, мононуклеарные клетки крови).
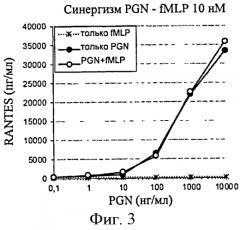
В дополнение к продуктам деполимеризации PGN формулированные микробные пептиды, прототипом которых является f-MLP (трипептид формил-Met-Leu-Phe), также обладают существенной синергической активностью. Первоначально эти пептиды были идентифицированы по их хемоаттрактантной активности относительно лейкоцитов, хотя они не способны индуцировать цитокиновый ответ per se.
Однако в комбинации с агонистами TLR они способствуют повышению продуцирования цитокинов путем сенсибилизации клеток-мишеней.
Поэтому важно не игнорировать эти "малые молекулы", поскольку они могут косвенно отвечать за асептические воспалительные эпизоды, усиливая эффекты следовых количеств PGN и/или LPS.
За последние несколько лет было разработано множество анализов с применением эмбриональных клеток для того, чтобы заменить животные модели в анализах воспалительного ответа.
Однако эти модели in vitro подвержены значительной индивидуальной вариабельности, которая может быть ответственна за систематические экспериментальные ошибки.
С другой стороны, клеточные линии моноцитов дают постоянные ответы, что объясняет таким образом, почему в анализах, находящихся в настоящее время на стадии разработки, все чаще применяют клетки данного типа в культуре. Однако эти анализы имеют недостаток, допуская общий воспалительный ответ на все контаминанты, присутствующие в виде смеси в растворе, и, следовательно, не позволяют охарактеризовать природу контаминанта.
Важно также отметить, что усиленный воспалительный ответ является видимым в отношении цитокинов острой фазы воспаления, таких как TNF-α (фактор некроза опухолей альфа), IL-1β (интерлейкин-1β), и хемокинов, таких как CCL5 (хемокиновый (С-С мотив) лиганд 5)/RANTES (регулируемый при активации, экспрессируемый нормальными Т-клетками, а также секретируемый), но совсем или почти не видим в отношении IL-6 (интерлейкин-6). Таким образом, способы на основе продуцирования последнего (US 2009/0239819 и US 2007/0184496) не подходят для обнаружения контаминантов в виде смеси в растворе.
Таким образом, компания-заявитель пришла к следующим выводам:
(i) трудно обнаружить бактериальные контаминанты, присутствующие в следовых количествах в биологических растворах,
(ii) важно не ограничиваться обнаружением PGN и LPS вследствие синергических эффектов,
(iii) необходимо разработать новые способы обнаружения, которые являются чувствительными и воспроизводимыми, и
(iv) выгодно применять чувствительные и воспроизводимые способы обнаружения, способные охарактеризовать природу контаминантов.
Таким образом, заслугой компании-заявителя стала разработка чувствительных и эффективных способов обнаружения микробных контаминантов, обладающих провоспалительным действием, ниже порога чувствительности способов, применяемых в настоящее время и/или описанных в литературе, и затем для идентификации семейства или даже природы провоспалительных молекул, присутствующих в следовых количествах в партиях, полученных на производственных линиях.
Фактически, очень чувствительный способ измерения воспалительных ответов in vitro позволит задержать или не задержать партии исходя из уровней загрязнения, которые являются "не значимыми" в том смысле, что эти уровни будут ниже, чем уровни, измеряемые в настоящее время с применением стандартных анализов.
Станет возможным предложить такие партии для изготовления композиции растворов для терапевтического применения у человека (например, растворов для перитонеального диализа).
Кроме того, идентификация молекул, ответственных за воспалительные ответы, должна позволить обнаружить источники загрязнений во время способов получения и вводить корректирующие модификации для того, чтобы снизить уровни контаминантов или даже устранить их.
Способ в соответствии с настоящим изобретением, таким образом, относится к способу обнаружения провоспалительных контаминантов полимеров глюкозы, в частности, полимеров для подготовки раствора для перитонеального диализа, включающему анализ воспалительного ответа in vitro.
Данные полимеры глюкозы могут быть предназначены для перитонеального диализа, энтерального и парентерального питания, а также кормления новорожденных. В одном предпочтительном варианте осуществления полимеры глюкозы, которые могут быть испытаны с применением способов настоящего изобретения, представляют собой икодекстрин или мальтодекстрины. Они могут быть испытаны на одной или нескольких стадиях их получения и, в частности, на уровне сырья, на любом этапе способа их получения и/или на уровне конечного продукта способа. Они также могут быть испытаны в виде образца раствора для перитонеального диализа.
Как упомянуто ранее, некоторые молекулы бактериального происхождения, такие как MDP и f-MLP, являются слабыми индукторами воспаления, но они могут действовать в комбинации или в синергии и повышать ответ, индуцированный другими контаминантами.
Это свойство основано на том, что молекулы действуют посредством вмешательства рецепторов, отличных от TLR.
Кроме LPS, который реагирует с TLR4, большинство молекул с воспалительным потенциалом, которые могут присутствовать в партиях, являются агонистами TLR2.
Такие контаминанты трудно обнаружить, так как они присутствуют в низких концентрациях, и воспалительный ответ, который они будут стимулировать, чаще всего близок к фоновому шуму.
Следовательно, присутствие молекул с синергической активностью может усиливать воспалительный ответ, индуцированный лигандами TLR2, что может быть использовано для обнаружения низких доз контаминантов.
Образцы, загрязненные MDP (агонист NOD2), f-MLP (микробный пептидный лиганд рецептора) или даже LPS (для инициирования синергии TLR4/TLR2), будут в результате стимулировать воспалительный ответ in vitro.
Таким образом, провоспалительные контаминанты, обнаруженные при помощи способа по настоящему изобретению, способны стимулировать отдельно или в комбинации воспалительную реакцию. В частности, такие контаминанты могут быть слабыми индукторами воспаления, когда рассматриваются отдельно, но могут индуцировать существенную воспалительную реакцию, когда находятся в комбинации. Способ согласно настоящему изобретению позволяет учитывать эффект набора контаминантов, присутствующих в рассматриваемом препарате полимера глюкозы, а не только конкретный эффект каждого из них.
Способ согласно настоящему изобретению включает, по меньшей мере, один анализ воспалительного ответа in vitro с применением клеточной линии, которая позволяет обнаружить по меньшей мере один фактор воспалительного ответа. Предпочтительно клеточная линия представляет собой клеточную линию макрофагов либо дифференцируемую в макрофаги, или клетки, экспрессирующие один или несколько TLR или NOD-подобных рецепторов, таких как TLR2, TLR4 или NOD2, или их комбинацию.
Согласно первому варианту осуществления клеточная линия, применяемая в анализе воспалительного ответа, является клеточной линией макрофагов либо дифференцируемой в макрофаги. В частности, данная клеточная линия продуцирует TNF-α и хемокин CCL5/RANTES. Предпочтительно анализ проводят на клетках ТНР-1, дифференцируемых в макрофаги.
В одном предпочтительном варианте осуществления макрофаги или клетки, дифференцируемые в макрофаги, в частности клетки ТНР-1, дифференцируемые в макрофаги, применяют при плотности от 0,5 до 1×106 клеток/мл культуральной среды, предпочтительно от 0,7 до 0,8×106 клеток/мл, и еще более предпочтительно приблизительно 0,75×106 клеток/мл.
Анализ воспалительного ответа in vitro может быть основан на продуцировании TNF-α и/или хемокина CCL5/RANTES макрофагами, в частности, клетками ТНР-1, дифференцируемыми в макрофаги, при условии, что синергический эффект (эффект, полученный посредством комбинации этих различных контаминантов) заметен главным образом в отношении цитокинов острой фазы воспаления (TNF-α, IL-1β, хемокинов), но не в отношении цитокинов замедленной фазы, таких как IL-6.
Таким образом, согласно одному конкретному варианту осуществления анализ воспалительного ответа заключается в размещении клеток клеточной линии, предпочтительно макрофагов, в присутствии препарата полимеров глюкозы, которые могут содержать провоспалительные контаминанты, и в измерении продуцирования цитокинов острой фазы воспаления, в частности, TNF-α, IL-1β и/или хемокинов, в частности, CCL5/RANTES, продуцирование данных цитокинов указывает на то, что данный препарат содержит контаминанты, способные стимулировать воспалительную реакцию. В одном особенно предпочтительном варианте осуществления анализ включает измерение продуцирования TNF-α и/или CCL5/RANTES, предпочтительно CCL5/RANTES. Анализ на цитокины может быть выполнен любым способом, хорошо известным специалистам в данной области техники, и, в частности, с помощью ELISA. В одном предпочтительном варианте осуществления анализ включает измерение продуцирования TNF-α через 8 ч стимуляции. В другом предпочтительном варианте осуществления анализ включает измерение продуцирования RANTES через 20 ч стимуляции, в частности, с помощью анализа ELISA.
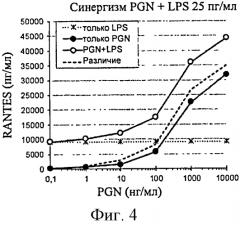
Для того чтобы увеличить клеточный ответ, индуцированный провоспалительными контаминантами, например, LPS и/или PGN, компонент, который позволяет действовать в синергизме с контаминантами, может быть добавлен к исследуемому образцу. Фактически, это может позволить обнаружить низкие дозы контаминантов. Предпочтительно данный компонент может представлять собой MDP или родственную молекулу (N-гликолил-MDP, L18-MDP), формулированный микробный пептид (f-MLP) или LPS. Предпочтительно данный компонент является MDP, f-MLP или LPS. Еще более предпочтительно данный компонент является MDP или LPS. В частности, LPS представляет собой LPS из Е. coli.
В одном предпочтительном варианте осуществления MDP, в частности, MDP из S. aureus, добавляют к образцу. Предпочтительно MDP добавляют к образцу в концентрации более 1 мкг/мл, предпочтительно в концентрации от 1 до 100 мкг/мл. В одном из наиболее предпочтительных вариантов осуществления MDP добавляют к образцу в концентрации 10 мкг/мл.
В другом предпочтительном варианте осуществления f-MLP добавляют к образцу в концентрации более 10 нМ, предпочтительно по меньшей мере 50, 100, 150, 200, 300, 400 или 500 нМ.
В еще одном предпочтительном варианте осуществления LPS, в частности LPS из E. coli, могут добавлять к образцу в концентрации по меньшей мере 10 пг/мл, например, в концентрации 25 пг/мл.
В одном предпочтительном варианте осуществления испытываемый препарат полимера глюкозы имеет концентрацию полимера глюкозы от 5 до 50 мг/мл, предпочтительно от 5 до 10, 20, 30 или 40 мг/мл. В одном конкретном варианте осуществления испытываемый препарат полимера глюкозы имеет концентрацию полимера глюкозы приблизительно 5 мг/мл. В одном предпочтительном варианте осуществления испытываемый препарат полимера глюкозы имеет концентрацию полимера глюкозы приблизительно 25 мг/мл.
Необязательно образец препарата полимера глюкозы может быть обработан мутанолизином перед анализом. Этот фермент благодаря его мурамидазной активности способен к деполимеризации PGN. Например, данный фермент в концентрации приблизительно 2500 Ед/мл может быть размещен в присутствии образца, необязательно разбавленного таким образом, чтобы концентрация полимера глюкозы составляла от 7,5 до 37,5% (масса/объем), в течение 6-16 ч, предпочтительно приблизительно 16 ч Обработанный таким образом образец затем подвергают анализу с макрофагами согласно настоящему изобретению. Необязательно результат, т.е. продуцирование цитокинов, полученное с образцом, обработанным мутанолизином, можно сравнить с результатом, полученным без обработки.
Необязательно в другой альтернативе образец препарата полимера глюкозы может быть отфильтрован перед анализом. Целью данной фильтрации по существу является удаление молекул с высоким молекулярным весом, таких как высокомолекулярный PGN, и выполнение анализа на фильтрате для того, чтобы проанализировать особым образом контаминанты малых размеров. Порог отсечения для фильтрации может составлять, например, от 30 кДа до 150 кДа, предпочтительно от 30 до 100 кДа или от 30 до 50 кДа, и, в частности, приблизительно 30 кДа. Предпочтительно фильтрацию проводят путем ультрафильтрации. Ее также можно провести любым способом, известным специалистам в данной области техники. Таким образом, профильтрованный подобным образом образец, фильтрат, будет подвергнут анализу с помощью макрофагов согласно настоящему изобретению. Необязательно результат, т.е. продуцирование цитокинов, полученное с фильтратом, можно сравнить с результатом, полученным без фильтрации или перед фильтрацией. Это позволит установить специфический вклад в воспаление молекул малых размеров.
В одном предпочтительном и конкретном варианте осуществления способ имеет одну или несколько следующих характеристик:
- клеточную линию применяют при плотности от 0,5 до 1×106 клеток/мл, предпочтительно от 0,7 до 0,8×106 клеток/мл, и еще более предпочтительно приблизительно 0,75×106 клеток/мл; и/или
- концентрация полимера глюкозы составляет менее 50 мг/мл, предпочтительно приблизительно 25 мг/мл; и/или
- продуцирование цитокинов измеряют через 20 ч стимуляции для RANTES и/или 8 ч стимуляции для TNF-α; и/или
- MDP добавляют к препарату полимера глюкозы в концентрации от 1 до 100 мкг/мл, предпочтительно приблизительно 10 мкг/мл.
Предпочтительно способ включает все характеристики.
Таким образом, в одном наиболее конкретном режиме настоящий способ включает:
- размещение макрофагов в присутствии в течение приблизительно 20 ч препарата полимера глюкозы, который может содержать провоспалительные контаминанты, в присутствии MDP, предпочтительно в концентрации от 1 до 100 мкг/мл, концентрации полимера глюкозы, составляющей менее 50 мг/мл, предпочтительно приблизительно 25 мг/мл, и макрофагов с плотностью от 0,5 до 1×106 клеток/мл, предпочтительно от 0,7 до 0,8×106 клеток/мл, и еще более предпочтительно приблизительно 0,75×106 клеток/мл; и
- измерение продуцирования CCL5/RANTES, продуцирования CCL5/RANTES, указывающего на, что препарат содержит контаминанты, способные стимулировать воспалительную реакцию.
Совершенно конкретно, этот первый вариант осуществления позволяет обнаружить загрязнение полимера глюкозы PGN и/или LPS, предпочтительно PGN среднего размера (в частности, приблизительно 120 кДа) и/или LPS, еще более конкретно LPS.
В частности, способ может включать количественное определение контаминантов. Например, это количественное определение может быть выполнено с применением кривой доза-ответ. Эта кривая доза-ответ может, в частности, быть получена на тех же клетках, в тех же условиях с возрастающими дозами контаминантов. Предпочтительно такую кривую доза-ответ можно получить с возрастающими дозами LPS.
Этот первый вариант осуществления может быть осуществлен в способах согласно настоящему изобретению индивидуально или в комбинации со вторым вариантом осуществления.
Согласно второму варианту осуществления клеточная линия, применяемая для проведения анализа воспаления in vitro, является линией, которая позволяет обнаружить активность одного или нескольких рецепторов врожденного иммунитета.
В частности, данная клеточная линия может быть получена путем стабильной трансфекции одним или несколькими векторами, кодирующими один или несколько рецепторов врожденного иммунитета.
Активность рецептора врожденного иммунитета может быть обнаружена, например, с применением репортерного гена, который находится под непосредственным контролем сигнального пути, связанного с указанным рецептором. Предпочтительно данный репортерный ген кодирует окрашенный или флуоресцирующий белок, или кодирует белок, активность которого может быть измерена с помощью субстрата или без него. В частности, репортерный ген кодирует щелочную фосфатазу.
Таким образом, способ включает размещение одной или нескольких клеточных линий, экспрессирующих один или несколько TLR или NOD-подобных рецепторов, в присутствии препарата полимеров глюкозы и измерение активности рецепторов, в частности, посредством сигнала репортерного гена. Этот сигнал репортерного гена указывает на присутствие в препарате контаминанта, который является агонистом данного рецептора.
Предпочтительно клеточная линия позволяет обнаружить активность одного или нескольких TLR или NOD-подобных рецепторов, таких рецепторов, как TLR2, 3, 4, 5, 7, 8, 9 или NOD2. Предпочтительно клеточная линия позволяет обнаружить активность одного или нескольких рецепторов, выбранных из TLR2, TLR4 и NOD2. В одном конкретном варианте осуществления клеточная линия экспрессирует рецепторы TLR2, TLR4 и NOD2, а также позволяет обнаружить их активность.
Применяемые клеточные линии могут представлять собой, например, линии HEK-Blue™ (выпускается компанией InvivoGen), модифицированные путем стабильной трансфекции векторами, кодирующими рецепторы врожденного иммунитета. Тем не менее, следует отметить, что специалисты в данной области техники могут применять и другие коммерчески доступные линии (Imgenex) или они могут приготовить их.
Такие клетки могут также быть одновременно трансфицированы репортерным геном, продуцирующим, например, секретируемую форму щелочной фосфатазы (SEAP: секретируемая эмбриональная щелочная фосфатаза), синтез которой находится под непосредственным контролем сигнального пути, связанного с рецептором (рецепторами), экспрессируемыми в той же клеточной линии. В одном предпочтительном варианте осуществления ферментативную реакцию проводят с применением отношения 1:3 анализируемой среды к реагенту SEAP (например, 50 мкл среды и 150 мкл реагента SEAP). Кроме того, время реакции по меньшей мере 60 минут будет предпочтительным.
Клеточные линии могут, например, быть выбраны из группы, состоящей из:
- линии HEK-Blue™ hTLR2 (линия, которая специфически реагирует на агонисты TLR2),
- линии HEK-Blue™ hNOD2 (линия, которая эффективно реагирует на продукты деполимеризации PGN и родственные молекулы (MDP, L18-MDP, и т.д.) и
- линии Raw-Blue™ (линия макрофагов мыши, трансфицированная таким образом, что экспрессирует щелочную фосфатазу). Линия Raw-Blue™ экспрессирует рецепторы врожденного иммунитета, а именно рецепторы TLR2, TLR4 и NOD2.
Эти линии подробно описаны ниже в данном описании.
В одном предпочтительном варианте осуществления будет использована линия, экспрессирующая TLR2 и позволяющая обнаружить его активность, и/или линия, экспрессирующая рецепторы TLR2, TLR4 и NOD2, а также позволяющая обнаружить их активность. В качестве примера будут использованы клеточные линии HEK-Blue™ hTLR2 и/или Raw-Blue™. Более конкретно, с помощью способа будут осуществлять анализ с применением клеточных линий HEK-Blue™ hTLR2 и Raw-Blue™.
В другом предпочтительном варианте осуществления будут использованы две линии, экспрессирующие, соответственно, TLR2 и NOD2, а также позволяющие обнаружить их активность (по отдельности), и одна линия, экспрессирующая рецепторы TLR2, TLR4 и NOD2, а также позволяющая обнаружить их активность. В качестве примера будут использованы клеточные линии HEK-Blue™ hTLR2, HEK-Blue™ hNOD2 и Raw-Blue™. Более конкретно, с помощью способа будут осуществлять анализ с применением клеточных линий HEK-Blue™ hTLR2, HEK-Blue™ hNOD2 и Raw-Blue™.
Применение таких линий, следовательно, позволяет заменить анализ на цитокины ферментативным анализом (фосфатазная активность), а также выявить некоторые семейства молекул бактериального происхождения в соответствии с рецептором(ами), экспрессируемым линией.
Кроме того, такие линии позволяют обнаружить контаминанты при очень низких порогах, в частности, для агонистов TLR2 (PGN, LTA (липотейхоевая кислота), LM (липоманнан), и т.д.) и агонистов NOD2 (продукты деполимеризации PGN и MDP). Таким образом, линия, экспрессирующая NOD2, в частности, HEK-Blue™ hNOD2, позволяет более конкретно обнаружить контаминацию продуктами деполимеризации PGN и MDP, предпочтительно MDP. Линия, экспрессирующая TLR2, в частности, HEK-Blue™ hTLR2 и/или Raw-Blue™, позволяет наиболее конкретно обнаружить контаминацию PGN.
Согласно этому второму варианту осуществления анализ воспалительного ответа in vitro заключается в размещении клеток клеточной линии, позволяющей обнаружить активность одного или нескольких рецепторов врожденного иммунитета, в присутствии препарата полимеров глюкозы, которые могут содержать провоспалительные контаминанты, и измерении активности рецептора или сигнала репортерного гена, который связан с ним.
Обнаружение данной активности или данного сигнала указывает на то, что препарат содержит контаминанты, способные к активации одного или нескольких рецепторов врожденного иммунитета и инициации воспалительной реакции.
В одном предпочтительном варианте осуществления испытываемый препарат полимера глюкозы имеет концентрацию полимера глюкозы от 5 до 50 мг/мл, предпочтительно от 5 до 10, 20, 30 или 40 мг/мл. В одном конкретном варианте осуществления испытываемый препарат полимера глюкозы имеет концентрацию полимера глюкозы приблизительно 5 мг/мл. В предпочтительном варианте осуществления испытываемый препарат полимера глюкозы имеет концентрацию полимера глюкозы приблизительно 37,5 мг/мл при использовании клеток HEK-Blue™ hTLR2 и/или HEK-Blue™ hNOD2. В другом предпочтительном варианте осуществления испытываемый препарат полимера глюкозы имеет концентрацию полимера глюкозы приблизительно 50 мг/мл при использовании клеток Raw-Blue™.
Необязательно образец препарата полимера глюкозы может быть обработан мутанолизином перед анализом. Этот фермент благодаря его мурамидазной активности способен к деполимеризации PGN. Например, данный фермент в концентрации приблизительно 2500 Ед/мл может быть размещен в присутствии образца, необязательно разбавленного так, чтобы концентрация полимера глюкозы составляла от 7,5% до 37,5% (масса/объем), в течение 6-16 ч, предпочтительно приблизительно 16 ч. Обработанный таким образом образец затем подвергают способам согласно второму варианту осуществления. Необязательно результат, полученный в образце, обработанном мутанолизином, можно сравнивать с результатом, полученным без обработки.
Необязательно в другой альтернативе, образец препарата полимера глюкозы может быть отфильтрован перед анализом. Целью данной фильтрации по сути является удаление молекул с высоким молекулярным весом, таких как высокомолекулярный PGN, и проведение анализа на фильтрате для того, чтобы проанализировать наиболее детально контаминанты малых размеров. Порог отсечения для фильтрации может составлять, например, от 30 кДа до 150 кДа, предпочтительно от 30 до 100 кДа или от 30 до 50 кДа, и, в частности, приблизительно 30 кДа. Предпочтительно фильтрацию проводят путем ультрафильтрации. Ее также можно выполнить любым способом, известным специалистам в данной области техники. Таким образом, профильтрованный подобным образом образец, фильтрат, будут подвергать способам согласно второму варианту осуществления. Необязательно результат, полученный с фильтратом, можно сравнивать с результатом, полученным без или до фильтрации. Это позволит установить специфический вклад в воспаление молекул малых размеров.
В одном предпочтительном и конкретном варианте осуществления этого второго варианта осуществления способ имеет одну или несколько следующих характеристик:
- клеточную линию применяют при плотности приблизительно 50000 клеток/лунку 96-луночного планшета для HEK-Blue™ hTLR2 или Raw-Blue™ и 10000 клеток/лунку 96-луночного планшета для HEK-Blue™ hNOD2; и/или
- анализируемый препарат полимера глюкозы имеет концентрацию полимера глюкозы от 5 до 50 мг/мл, предпочтительно концентрацию полимера глюкозы приблизительно 37,5 мг/мл при использовании клеток HEK-Blue™ hTLR2 и/или HEK-Blue™ hNOD2, а также концентрацию полимера глюкозы приблизительно 50 мг/мл при использовании клеток Raw-Blue™; и/или
- приведение препарата полимера глюкозы в контакт с клетками продолжительностью приблизительно от 16 до 24 ч и/или
- сигнал репортерного гена SEAP обнаруживают с отношением культуральный супернатант:субстрат SEAP 20:180, предпочтительно 50:150, предпочтительно через по меньшей мере 60 минут инкубации, в идеале 60 минут.
В одном конкретном варианте осуществления способ включает все эти характеристики.
В частности, способ может включать количественное определение контаминантов. Например, данное количественное определение может быть проведено с применением кривой доза-ответ. Эта кривая доза-ответ может, в частности, быть получена на тех же клетках, в тех же условиях с возрастающими дозами контаминантов. Предпочтительно такую кривую доза-ответ можно получить для клеток, экспрессирующих TLR2 (например, HEK-Blue™ hTLR2 и Raw-Blue™), с возрастающими дозами PGN и для клеток, экспрессирующих NOD2 (например, HEK-Blue™ hNOD2), с возрастающими дозами MDP.
Способ согласно настоящему изобретению может также включать этап, заключающийся в идентификации контаминанта(ов), способного к инициации воспалительной реакции.
Для этого клеточную линию, позволяющую обнаружить активность рецептора врожденного иммунитета или нескольких рецепторов врожденного иммунитета, как описано выше, размещают в присутствии препарата полимера глюкозы, подлежащего анализу. Измеряют активность данного рецептора или сигнал репортерного гена, связанного с этим рецептором. Обнаруже