Способ промышленного получения азотзамещенного амино-5,6,7,8-тетрагидронафтола
Иллюстрации
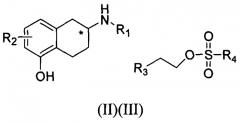
Показать всеИзобретение относится к способу получения соединения формулы (I). Способ включает реакцию соединения формулы (II) с соединением формулы (III) в щелочных условиях и в присутствии сульфита. В формулах I, II и III (*) обозначает хиральный центр; R1 представляет собой линейный или разветвленный алкил, содержащий 1-4 атома углерода; R2 представляет собой водород, линейный или разветвленный алкил, содержащий 1-4 атома углерода; R3 представляет собой линейный или разветвленный алкил, содержащий 1-6 атомов углерода, алкокси, циклоалкокси, фенил или замещенный фенил, гетероциклил; и R4 представляет собой алкил, галогеналкил, арил или замещенный арил, где заместитель включает оксо, галоген, гидрокси, циано, нитро, амино, алкиламино, диалкиламино, алкил, алкокси, галоалкил, арил, гетероциклил, -NRaRb, -NRaC(=O)Rb, NRaC(=O)NRaRb, -NRaC(=O)ORb, -NRaS(=O)2Rb, -ORa, -C(=O)Ra-C(=O)ORa, -C(=O)NRaRb, -OCH2C(=O)NRaRb, -ОС(=O)NRaRb, -SH, -SRa, -SORa, -S(=O)2NRaRb, -S(=O)2Ra, -SRaC(=O)NRaRb, -OS(=O)2Ra и -S(=O)2ORa, где Ra и Rb являются одинаковыми или различными, и независимо представляют собой водород, алкил, галогеналкил, алкокси или арил; соединение формулы (I) и соединение формулы (II) присутствуют в R или S конфигурации или рацемической смеси. При этом мольное отношение сульфита к соединению формулы (II) составляет (0,8-2,5):1, мольное отношение соединения формулы (III) к соединению формулы {II) составляет (1,1-5,0): 1. Способ является подходящим для крупномасштабного промышленного производства и позволяет получать продукт с высоким выходом. Изобретение также относится к способу получения соли указанного соединения формулы I. 2 н. и 16 з.п. ф-лы, 3 табл., 20 пр.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к способу промышленного получения N-замещенного амино-5,6,7,8-тетрагидронафтола.
Уровень техники
Способы получения N-замещенных амино-5,6,7,8-тетрагидронафтолов описаны в следующих документах.
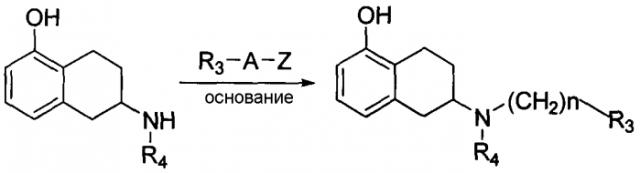
Патент США US 4410519 (опубликован: 18 октября 1983 г.) описывает реакцию, в которой аминогруппу амино-5,6,7,8-тетрагидронафтола алкилируют с образованием побочных кислотных продуктов (например, ZH). В представленной ниже реакции R4 означает алкил, содержащий 1-4 атома углерода. Алкилирующий агент представлен формулой R3-A-Z, где A означает -(CH2)n-, n означает целое число в интервале от 1 до 5, и Z означает уходящую группу, такую как алкилсульфонилокси или арилсульфонилокси. Может необязательно присутствовать основание.
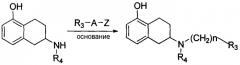
Патент США US 5382596 (опубликован: 17 января 1995 г.) описывает следующую реакцию в присутствии основания (т.е. третичного амина), где R4 представляет собой алкил с нормальной неразветвленной цепью, содержащий 1-3 атома углерода, или циклопропилметил; R6 представляет собой -(CH2)n-R3, n представляет собой целое число в интервале от 1 до 4, и R3 представляет собой алкокси, циклоалкокси или простой циклический эфир.
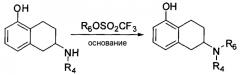
WO 01/38321 описывает следующую реакцию, в которой используемое в реакции основание представляет собой карбонат или бикарбонат щелочного металла, количество которого в молях в 1,9 раза меньше, чем исходного материала; R1 представляет собой ОА; R2 представляет собой Н или ОА, где А представляет собой Н, линейный или разветвленный алкил, содержащий 1-3 атома углерода; R3 представляет собой алкокси, циклоалкокси, необязательно замещенный фенил, 3-пиридил или 4-пиридил; n представляет собой целое число в интервале от 1 до 5; и Z представляет собой уходящую группу.
Основания, применяемые в приведенных выше реакциях, могут только нейтрализовать кислотные побочные продукты, образующиеся в реакциях алкилирования. Однако из-за того, что реакции обычно требуют высокой температуры и длительного времени проведения, исходный материал, содержащий гидроксифенильный фрагмент, может легко окисляться с образованием ряда дополнительных побочных продуктов. Таким образом, приведенные выше реакции не только требуют многочисленных стадий очистки, но и снижают выход реакции.
Согласно WO 01/38321 понижение количества карбоната щелочного металла позволяет избежать множества стадий очистки и понизить побочные реакции. Однако может потребоваться повышенное количество алкилирующего агента для улучшения выхода целевого продукта, что существенно повышает стоимость производства и значительно понижает выход при крупномасштабном производстве, делая этот способ неподходящим для промышленного производства.
Сущность изобретения
Приведен способ получения N-замещенного амино-5,6,7,8-тетрагидронафтола с высокими выходами, который может снижать стоимость производства, и, таким образом, является подходящим для крупномасштабного промышленного производства.
Заявленная выше цель настоящего изобретения достигается за счет следующих технических решений.
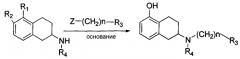
Настоящее изобретение предоставляет способ получения соединения формулы (I), включающий
реакцию соединения формулы (II) с соединением формулы (III) в щелочных условиях и в присутствии сульфита
,
где
(*) отмечает хиральный центр; каждое соединение формулы (I) и соединение формулы (II) представлено в R или S конфигурации или рацемической смеси;
R1 представляет собой линейный или разветвленный алкил, содержащий 1-4 атома углерода;
R2 представляет собой водород, линейный или разветвленный алкил, содержащий 1-4 атома углерода;
R3 представляет собой линейный или разветвленный алкил, содержащий 1-6 атомов углерода, алкокси, циклоалкокси, необязательно замещенный фенил, гетероциклил; и
R4 представляет собой алкил, галогеналкил, необязательно замещенный арил.
В одном предпочтительном варианте осуществления настоящего изобретения хиральные центры (*) соединений формулы (I) и соединения формулы (II) представлены в S конфигурации, R3 представляет собой тиенил или пиридил, R4 представляет собой метил, трифторметил, метилфенил или нитрофенил.
В другом предпочтительном варианте осуществления настоящего изобретения R1 представляет собой метил, этил или н-пропил; R2 представляет собой метил или водород; R3 представляет собой 3-пиридил или 2-тиенил; и R4 представляет собой 4-метилфенил или 4-нитрофенил.
В еще одном предпочтительном варианте осуществления настоящего изобретения R1 представляет собой н-пропил; R2 представляет собой водород; R3 представляет собой 2-тиенил; и R4 представляет собой 4-метилфенил.
Сульфит может быть выбран из сульфитов щелочных металлов, таких как сульфит натрия или сульфит калия; сульфитов щелочноземельных металлов, таких как сульфит магния или сульфит кальция; или других сульфитов, таких как сульфит аммония или сульфит цинка, предпочтительно сульфита натрия или сульфита калия.
В одном предпочтительном варианте осуществления настоящего изобретения молярное соотношение сульфита к соединению формулы (II) составляет (0,8-2,5):1, предпочтительно 1,3:1.
В другом предпочтительном варианте осуществления настоящего изобретения молярное соотношение соединения формулы (III) к соединению формулы (II) составляет (1,1-5,0):1, предпочтительно 1,5:1.
В других вариантах осуществления изобретения способ далее включает перевод соединения формулы (I) в форму соли.
Подробное описание
Настоящее описание включает способ получения N-замещенного амино-5,6,7,8-тетрагидронафтола формулы (I)
В частности, способ включает реакцию соединения формулы (II) с соединением формулы (III) в щелочных условиях и в присутствии сульфита с тем, чтобы получить соединение формулы (I),
где
(*) обозначает хиральный центр; соединение формулы (I) и соединение формулы (II) представлены в R или S конфигурации или рацемической смеси; R1 представляет собой линейный или разветвленный алкил, содержащий 1-4 атома углерода; R2 представляет собой водород, линейный или разветвленный алкил, содержащий 1-4 атома углерода; R3 представляет собой линейный или разветвленный алкил, содержащий 1-6 атомов углерода, алкокси, циклоалкокси, необязательно замещенный фенил или гетероциклил (например, тиенил или пиридил); и R4 представляет собой алкил (например, метил), галогеналкил (например, трифторметил), необязательно замещенный арил (например, метилфенил или нитрофенил).
Используемый в настоящем документе «линейный или разветвленный алкил» или просто «алкил» относится к насыщенному алифатическому углеводородному радикалу. В различных вариантах осуществления изобретения линейный или разветвленный алкил может содержать до 4 атомов углерода или до 6 атомов углерода. Типичные линейные или разветвленные алкилы с 1-6 атомами углерода включают, например, метил, этил, н-пропил, н-бутил, н-пентил, н-гексил, изопропил, втор-бутил, изобутил, трет-бутил, изопентил и подобные. Если не указано другое, линейный или разветвленный алкил может необязательно быть замещенным, в котором по меньшей мере один атом водорода алкильной группы заменен заместителем, как определено здесь.
«Алкокси» относится к радикалу: -О-алкил, такому как метокси, этокси и подобные.
«Арил» относится к ароматической моноциклической или полициклической углеводородной кольцевой системе, состоящей только из атомов водорода и углерода и содержащей от шести до восемнадцати атомов углерода, при этом кольцевая система может быть частично или полностью насыщенной. Арильные группы включают, но не ограничены ими, такие группы как флуоренил, фенил и нафтил. Если не указано другое, «арил» может быть необязательно замещен заместителем, как определено здесь. Так «необязательно замещенный арил» включает незамещенный арил (например, фенил) и замещенный арил (например, метилфенил и нитрофенил).
«Циклоалкокси» относится к радикалу: -О-циклоалкил. Циклоалкил относится к неароматическому циклическому углеводороду, имеющему 5-8 атомов углерода. Примеры циклоалкокси включают циклопентокси или циклогексокси.
«Галогеналкил» относится к алкильному радикалу, как определено выше, который замещен одним или более атомами галогена, как определено выше, например, трифторметилу, дифторметилу, трихлорметилу, 2,2,2-трифторэтилу, 1-фторметил-2-фторэтилу, 3-бром-2-фторпропилу, 1-бромметил-2-бромэтилу и подобным. Алкильная часть галогеналкильного радикала может быть необязательно замещенной, как указано выше для алкильной группы.
«Гетероциклил» означает 4-7-членное моноциклическое или 7-10-членное бициклическое гетероциклическое кольцо, которое является насыщенным, ненасыщенным или ароматическим, и которое содержит от 1 до 4 гетероатомов, независимо выбранных из азота, кислорода и серы, и где гетероатомы азота и серы могут быть необязательно в окисленной форме, и где гетероатом азота может быть необязательно кватернизован, включая бициклические кольца, в которых любые из вышеперечисленных гетероциклов сопряжены с бензольным кольцом. Гетероцикл может быть присоединен через любой гетероатом или атом углерода. Примеры гетероциклила включают, без ограничения, бензофуранил, тиенил, бензотиенил, 1,3-бензодиоксолил, пирролил, индолил, изоиндолил, азаиндолил, пиридил, хинолинил, изохинолинил, оксазолил, изооксазолил, бензоксазолил, пиразолил, имидазолил, бензимидазолил, тиазолил, бензотиазолил, изотиазолил, пиридазинил, пиримидинил, пиразинил, триазинил, морфолинил, пирролидинонил, пирролидинил, пиперидинил, гидантоинил, валеролактамил, оксиранил, оксетанил, тетрагидрофуранил, тетрагидропиранил, тетрагидропиридинил, тетрагидропиримидинил, тетрагидротиофенил, тетрагидротиопиранил и подобные. Если специально не указано другое, «гетероциклил» может быть необязательно замещен заместителем, как определено здесь. Так, «необязательно замещенный гетероциклил» включает незамещенный гетероциклил и замещенный гетероциклил.
«Заместитель» включает оксо, галоген, гидрокси, циано, нитро, амино, алкиламино, диалкиламино, алкил, алкокси, галогеналкил, замещенный алкил, арил, замещенный арил, гетероциклил, замещенный гетероциклил, -NRaRb, -NRaC(=0)Rb, -NRaC(=0)NRaRb, -NRaC(=0)ORb, -NRaS(=0)2Rb, ORa, -C(=0)Ra-C(=O)ORa, -C(=0)NRaRb, -OCH2C(=0)NRaRb, -OC(=0)NRaRb, -SH, SRa, SORa, -S(=O)2NRaRb, -S(=O)2Ra, -SRaC(=O)NRaRb, -OS(=O)2Ra и -S(=O)2ORa, где Ra и Rb одинаковые или разные и независимо представляют собой водород, алкил, галогеналкил, замещенный алкил, алкокси, арил или замещенный арил.
В различных вариантах осуществления изобретения хиральный центр имеет чистую R или S конфигурацию.
В предпочтительных вариантах осуществления изобретения хиральный центр (*) имеет S конфигурацию; R1 представляет собой метил, этил или н-пропил; R2 представляет собой метил или водород; R3 представляет собой 3-пиридил или 2-тиенил; и R4 представляет собой 4-метилфенил или 4-нитрофенил. Более предпочтительно когда R1 представляет собой н-пропил, R2 представляет собой водород, R3 представляет собой 2-тиенил и R4 представляет собой 4-метилфенил. В этом случае соединение формулы (I) представляет собой (S)-5,6,7,8-тетрагидро-6-[пропил[2-(2-тиенил)этил]амино]-1-нафтол; соединение формулы (II) представляет собой (S)-5,6,7,8-тетрагидро-6-пропиламино-1-нафтол; а соединение (III) представляет собой 2-(2-тиенил)этил 4-метилбензенсульфонат.
Схема реакции показана ниже:
Молярное отношение соединения формулы (III) к соединению формулы (II) обычно составляет (1,1-5,0):1, предпочтительно 1,5:1. Эти исходные материалы могут быть получены способами, известными в данной области, см., например, WO 01/38321.
Молярное отношение сульфита к соединению формулы (II) обычно составляет (0,8-2,5):1, предпочтительно 1,3:1. Сульфит выбирают из сульфитов щелочных металлов, включая сульфит натрия и сульфит калия; сульфитов щелочноземельных металлов, включая сульфит магния и сульфит кальция; или других сульфитов, включая сульфит аммония и сульфит цинка, предпочтительно сульфит натрия или сульфит калия.
Преимущественно сульфит нейтрализует кислотные побочные продукты, образованные алкилирующим агентом, т.е. соединением формулы (III), в реакции, препятствуя, таким образом, дальнейшему разложению соединения формулы (III) кислотными побочными продуктами. Более того, считается, что сульфит действует как антиоксидант, эффективно защищая соединение формулы (II), которое содержит лабильную фенольную гидроксильную группу, от окисления с образованием побочных продуктов в условиях высокой температуры и длительного времени реакции. В результате можно избежать различных побочных продуктов и стадий разделения и очистки, что повышает эффективность производства. При этом реакция протекает более полно без существенного повышения количества алкилирующего агента, что увеличивает выход реакции.
Способ получения N-замещенного амино-5,6,7,8-тетрагидронафтола формулы (I) в соответствии с вариантом осуществления настоящего изобретения может обеспечивать высокий выход целевого продукта в крупномасштабных промышленных производствах и снижать стоимость промышленного производства за счет снижения количества алкилирующего агента.
Растворителем в реакции в способе является ксилол, температура реакции как правило составляет от 140°С до 145°С.
В дальнейших вариантах осуществления изобретения описанные здесь способы включают превращение соединения формулы (I) в форму соли. Более подробно третичная аминогруппа соединения формулы (I) может быть превращена в четвертичную аммониевую соль в присутствии кислоты (НХ). Одним из примеров подходящей кислоты является хлористоводородная кислота, дающая хлоргидратную соль формулы (I), показанную ниже (Х представляет собой Cl-):
В дальнейших вариантах осуществления изобретения соединение формулы (I) представляет собой ротиготин.
Примеры
Настоящее изобретение будет далее проиллюстрировано следующими примерами и тест-примерами, которые ни в коей мере не ограничивают объем настоящего изобретения.
Пример 1
2,00 кг (9,74 моль) (S)-5,6,7,8-тетрагидро-6-пропиламино-1-нафтола, 4,12 кг (14,62 моль) 2-(2-тиенил)этил-4-метилбензолсульфоната (с мольным соотношением сульфонат/исходный материал 1,5/1), 0,61 кг (4,875 моль) сульфита натрия (с мольным соотношением сульфит натрия/исходный материал 0,5/1) и 25 л ксилола смешивали с образованием смеси, которую кипятили с обратным холодильником. За 48 часов реакция не прошла полностью. Реакцию продолжали 96 часов. Смесь охлаждали до комнатной температуры и промывали подходящим количеством воды. Добавляли активированный уголь для обесцвечивания смеси. Смесь отфильтровывали и оставляли стоять. Отделяли органическую фазу и концентрировали в вакууме, получая 0,40 кг продукта (S)-5,6,7,8-тетрагидро-6-[пропил[2-(2-тиенил)этил]амино]-1-нафтола, который превращали в гидрохлорат. Выход составлял 11,7%.
Пример 2
2,00 кг (9,74 моль) (S)-5,6,7,8-тетрагидро-6-пропиламино-1-нафтола, 4,12 кг (14,62 моль) 2-(2-тиенил)этил-4-метилбензолсульфоната (с мольным соотношением сульфонат/исходный материал 1,5/1), 0,98 кг (7,80 моль) сульфита натрия (с мольным соотношением сульфит натрия/исходный материал 0,8/1) и 25 л ксилола смешивали с образованием смеси, которую кипятили с обратным холодильником. Через 48 часов реакцию останавливали. Смесь охлаждали до комнатной температуры и промывали подходящим количеством воды. Добавляли активированный уголь для обесцвечивания смеси. Смесь отфильтровывали и оставляли стоять. Отделяли органическую фазу и концентрировали в вакууме, получая 2,41 кг продукта (S)-5,6,7,8-тетрагидро-6-[пропил[2-(2-тиенил)этил]амино]-1-нафтола, который превращали в гидрохлорат. Выход составлял 70,3%.
Пример 3
2,00 кг (11,28 моль) (S)-5,6,7,8-тетрагидро-6-метиламино-1-нафтола, 4,78 кг (16,94 моль) 2-(2-тиенил)этил-4-метилбензенсульфоната (с мольным соотношением сульфонат/исходный материал 1,5/1), 1,85 кг (14,68 моль) сульфита натрия (с мольным соотношением сульфит натрия/исходный материал 1,3/1) и 25 л ксилола смешивали с образованием смеси, которую кипятили с обратным холодильником. Через 48 часов реакцию останавливали. Смесь охлаждали до комнатной температуры и промывали подходящим количеством воды. Добавляли активированный уголь для обесцвечивания смеси. Смесь отфильтровывали и оставляли стоять. Отделяли органическую фазу и концентрировали в вакууме, получая 3,06 кг продукта (S)-5,6,7,8-тетрагидро-6-[метил[2-(2-тиенил)этил]амино]-1-нафтола, который превращали в гидрохлорат. Выход составлял 83,7%.
Пример 4
2,00 кг (10,46 моль) (S)-5,6,7,8-тетрагидро-6-этиламино-1-нафтола, 4,91 кг (15,70 моль) 2-(2-тиенил)этил-4-нитробензолсульфоната (с мольным соотношением сульфонат/исходный материал 1,5/1), 2,15 кг (13,60 моль) сульфита калия (с мольным соотношением сульфит калия/исходный материал 1,3/1) и 25 л ксилола смешивали с образованием смеси, которую кипятили с обратным холодильником. Через 48 часов реакцию останавливали. Смесь охлаждали до комнатной температуры и промывали подходящим количеством воды. Добавляли активированный уголь для обесцвечивания смеси. Смесь отфильтровывали и оставляли стоять. Отделяли органическую фазу и концентрировали в вакууме, получая 2,92 кг продукта (S)-5,6,7,8-тетрагидро-6-[этил[2-(2-тиенил)этил]амино]-1-нафтола, который превращали в гидрохлорат. Выход составлял 82,6%.
Пример 5
2,00 кг (9,12 моль) (S)-5,6,7,8-тетрагидро-4-метил-6-пропиламино-1-нафтола, 3,86 кг (13,70 моль) 2-(2-тиенил)этил-4-метилбензолсульфоната (с мольным соотношением сульфонат/исходный материал 1,5/1), 1,38 кг (11,87 моль) сульфита аммония (с мольным соотношением сульфит аммония/исходный материал 1,3/1) и 25 л ксилола смешивали с образованием смеси, которую кипятили с обратным холодильником. Через 48 часов реакцию останавливали. Смесь охлаждали до комнатной температуры и промывали подходящим количеством воды. Добавляли активированный уголь для обесцвечивания смеси. Смесь отфильтровывали и оставляли стоять. Отделяли органическую фазу и концентрировали в вакууме, получая 2,60 кг продукта (S)-5,6,7,8-тетрагидро-4-метил-6-[пропил[2-(2-тиенил)этил]амино]-1-нафтола, который превращали в гидрохлорат. Выход составлял 77,9%.
Пример 6
2,00 кг (9,74 моль) (S)-5,6,7,8-тетрагидро-6-пропиламино-1-нафтола, 4,12 кг (14,62 моль) 2-(2-тиенил)этил-4-метилбензолсульфоната (с мольным соотношением сульфонат/исходный материал 1,5/1), 3,07 кг (24,38 моль) сульфита натрия (с мольным соотношением сульфит натрия/исходный материал 2,5/1) и 25 л ксилола смешивали с образованием смеси, которую кипятили с обратным холодильником. Через 48 часов реакцию останавливали. Смесь охлаждали до комнатной температуры и промывали подходящим количеством воды. Добавляли активированный уголь для обесцвечивания смеси. Смесь отфильтровывали и оставляли стоять. Отделяли органическую фазу и концентрировали в вакууме, получая 2,47 кг продукта (S)-5,6,7,8-тетрагидро-6-[пропил[2-(2-тиенил)этил]амино]-1-нафтола, который превращали в гидрохлорат. Выход составлял 72,0%.
Пример 7
2,00 кг (9,74 моль) (S)-5,6,7,8-тетрагидро-6-пропиламино-1-нафтола, 4,12 кг (14,62 моль) 2-(2-тиенил)этил-4-метилбензолсульфоната (с мольным соотношением сульфонат/исходный материал 1,5/1), 3,69 кг (29,25 моль) сульфита натрия (с мольным соотношением сульфит натрия/исходный материал 3,0/1) и 25 л ксилола смешивали с образованием смеси, которую кипятили с обратным холодильником. Через 48 часов реакцию останавливали. Смесь охлаждали до комнатной температуры и промывали подходящим количеством воды. Добавляли активированный уголь для обесцвечивания смеси. Смесь отфильтровывали и оставляли стоять. Отделяли органическую фазу и концентрировали в вакууме. Остаток выделяли хроматографией на колонке с силикагелем и элюентом этилацетат:гексан 1:19, получая 1,64 кг продукта (S)-5,6,7,8-тетрагидро-6-[пропил[2-(2-тиенил)этил]амино]-1-нафтола, который превращали в гидрохлорат. Выход составлял 47,80%.
Пример 8
2,00 кг (9,74 моль) (S)-5,6,7,8-тетрагидро-6-пропиламино-1-нафтола, 4,12 кг (14,62 моль) 2-(2-тиенил)этил-4-метилбензолсульфоната (с мольным соотношением реагент/исходный материал 1,5/1), 12,28 кг (97,49 моль) сульфита натрия (с мольным соотношением сульфит натрия/исходный материал 10,0/1) и 25 л ксилола смешивали с образованием смеси, которую кипятили с обратным холодильником. Через 48 часов реакция не завершилась полностью, и ее проводили 72 часа. После того, как ее проанализировали, было выявлено большое количество побочных продуктов в полученной смеси. Из-за низкого выхода выделение целевого продукта (S)-5,6,7,8-тетрагидро-6-[пропил[2-(2-тиенил)этил]амино]-1-нафтола не проводили.
Пример 9
2,00 кг (9,74 моль) (S)-5,6,7,8-тетрагидро-6-пропиламино-1-нафтола, 2,20 кг (7,80 моль) 2-(2-тиенил)этил-4-метилбензолсульфоната (с мольным соотношением сульфонат/исходный материал 0,8/1), 1,60 кг (12,67 моль) сульфита натрия (с мольным соотношением сульфит натрия/исходный материал 1,3/1) и 25 л ксилола смешивали с образованием смеси, которую кипятили с обратным холодильником. Через 48 часов реакцию останавливали. Смесь охлаждали до комнатной температуры и промывали подходящим количеством воды. Добавляли активированный уголь для обесцвечивания смеси. Смесь отфильтровывали и оставляли стоять. Органическую фазу отделяли и концентрировали в вакууме, получая 1,51 кг продукта (S)-5,6,7,8-тетрагидро-6-[пропил[2-(2-тиенил)этил]амино]-1-нафтола, который переводили в гидрохлорат. Выход составлял 44,0%.
Пример 10
2,00 кг (9,74 моль) (S)-5,6,7,8-тетрагидро-6-пропиламино-1-нафтола, 3,02 кг (10,72 моль) 2-(2-тиенил)этил-4-метилбензолсульфоната (с мольным соотношением сульфонат/исходный материал 1,1/1), 1,60 кг (12,67 моль) сульфита натрия (с мольным соотношением сульфит натрия/исходный материал 1,3/1) и 25 л ксилола смешивали с образованием смеси, которую кипятили с обратным холодильником. Через 48 часов реакцию останавливали. Смесь охлаждали до комнатной температуры и промывали подходящим количеством воды. Добавляли активированный уголь для обесцвечивания смеси. Смесь отфильтровывали и оставляли стоять. Органическую фазу отделяли и концентрировали в вакууме, получая 2,40 кг продукта (S)-5,6,7,8-тетрагидро-6-[пропил[2-(2-тиенил)этил]амино]-1-нафтола, который переводили в гидрохлорат. Выход составлял 70,0%.
Пример 11
2,00 кг (9,74 моль) (S)-5,6,7,8-тетрагидро-6-пропиламино-1-нафтола, 3,57 кг (12,67 моль) 2-(2-тиенил)этил-4-метилбензолсульфоната (с мольным соотношением сульфонат/исходный материал 1,3/1), 1,60 кг (12,67 моль) сульфита натрия (с мольным соотношением сульфит натрия/исходный материал 1,3/1) и 25 л ксилола смешивали с образованием смеси, которую кипятили с обратным холодильником. Через 48 часов реакцию останавливали. Смесь охлаждали до комнатной температуры и промывали подходящим количеством воды. Добавляли активированный уголь для обесцвечивания смеси. Смесь отфильтровывали и оставляли стоять. Органическую фазу отделяли и концентрировали в вакууме, получая 2,60 кг продукта (S)-5,6,7,8-тетрагидро-6-[пропил[2-(2-тиенил)этил]амино]-1-нафтола, который переводили в гидрохлорат. Выход составлял 75,8%.
Пример 12
2,00 кг (9,74 моль) (S)-5,6,7,8-тетрагидро-6-пропиламино-1-нафтола, 4,12 кг (14,62 моль) 2-(2-тиенил)этил-4-метилбензолсульфоната (с мольным соотношением сульфонат/исходный материал 1,5/1), 1,60 кг (12,67 моль) сульфита натрия (с мольным соотношением сульфит натрия/исходный материал 1,3/1) и 25 л ксилола смешивали с образованием смеси, которую кипятили с обратным холодильником. Через 48 часов реакцию останавливали. Смесь охлаждали до комнатной температуры и промывали подходящим количеством воды. Добавляли активированный уголь для обесцвечивания смеси. Смесь отфильтровывали и оставляли стоять. Органическую фазу отделяли и концентрировали в вакууме, получая 2,80 кг продукта (S)-5,6,7,8-тетрагидро-6-[пропил[2-(2-тиенил)этил]амино]-1-нафтола, который переводили в гидрохлорат. Выход составлял 81,7%.
Пример 13
2,00 кг (9,74 моль) (S)-5,6,7,8-тетрагидро-6-пропиламино-1-нафтола, 13,75 кг (48,75 моль) 2-(2-тиенил)этил-4-метилбензолсульфоната (с мольным соотношением сульфонат/исходный материал 5,0/1), 1,60 кг (12,67 моль) сульфита натрия (с мольным соотношением сульфит натрия/исходный материал 1,3/1) и 25 л ксилола смешивали с образованием смеси, которую кипятили с обратным холодильником. Через 48 часов реакцию останавливали. Смесь охлаждали до комнатной температуры и промывали подходящим количеством воды. Добавляли активированный уголь для обесцвечивания смеси. Смесь отфильтровывали и оставляли стоять. Органическую фазу отделяли и концентрировали в вакууме, получая 2,46 кг продукта (S)-5,6,7,8-тетрагидро-6-[пропил[2-(2-тиенил)этил]амино]-1-нафтола, который переводили в гидрохлорат. Выход составлял 71,8%.
Пример 14
2,00 кг (9,74 моль) (±)-5,6,7,8-тетрагидро-6-пропиламино-1-нафтола, 4,12 кг (14,62 моль) 2-(2-тиенил)этил-4-метилбензолсульфоната (с мольным соотношением сульфонат/исходный материал 1,5/1), 1,60 кг (12,67 моль) сульфита натрия (с мольным соотношением сульфит натрия/исходный материал 1,3/1) и 25 л ксилола смешивали с образованием смеси, которую кипятили с обратным холодильником. Через 60 часов реакцию останавливали. Смесь охлаждали до комнатной температуры и промывали подходящим количеством воды. Добавляли активированный уголь для обесцвечивания смеси. Смесь отфильтровывали и оставляли стоять. Органическую фазу отделяли и концентрировали в вакууме, получая 2,70 кг продукта (±)-5,6,7,8-тетрагидро-6-[пропил[2-(2-тиенил)этил]амино]-1-нафтола, который переводили в гидрохлорат. Выход составлял 78,8%.
Пример 15
2,00 кг (9,12 моль) (S)-5,6,7,8-тетрагидро-4-метил-6-пропиламино-1-нафтола, 1,89 кг (13,70 моль) н-пропилметансульфоната (с мольным соотношением сульфонат/исходный материал 1,5/1), 1,49 кг (11,87 моль) сульфита натрия (с мольным соотношением сульфит натрия/исходный материал 1,3/1) и 25 л ксилола смешивали с образованием смеси, которую кипятили с обратным холодильником. Через 48 часов реакцию останавливали. Смесь охлаждали до комнатной температуры и промывали подходящим количеством воды. Добавляли активированный уголь для обесцвечивания смеси. Смесь отфильтровывали и оставляли стоять. Органическую фазу отделяли и концентрировали в вакууме, получая 2,05 кг продукта (S)-5,6,7,8-тетрагидро-4-метил-6-(дипропиламино)-1-нафтола, который переводили в гидрохлорат. Выход составлял 75,5%.
Пример 16
2,00 кг (9,12 моль) (S)-5,6,7,8-тетрагидро-4-метил-6-пропиламино-1-нафтола, 2,85 кг (13,70 моль) н-октилметансульфоната (с мольным соотношением сульфонат/исходный материал 1,5/1), 1,49 кг (11,87 моль) сульфита натрия (с мольным соотношением сульфит натрия/исходный материал 1,3/1) и 25 л ксилола смешивали с образованием смеси, которую кипятили с обратным холодильником. Через 60 часов реакцию останавливали. Смесь охлаждали до комнатной температуры и промывали подходящим количеством воды. Добавляли активированный уголь для обесцвечивания смеси. Смесь отфильтровывали и оставляли стоять. Органическую фазу отделяли и концентрировали в вакууме, получая 2,37 кг продукта (S)-5,6,7,8-тетрагидро-4-метил-6-(N-октил-N-пропиламино)-1-нафтола, который переводили в гидрохлорат. Выход составлял 70,6%.
Пример 17
2,00 кг (9,12 моль) (S)-5,6,7,8-тетрагидро-4-метил-6-пропиламино-1-нафтола, 2,11 кг (13,70 моль) 2-метоксиэтилметансульфоната (с мольным соотношением сульфонат/исходный материал 1,5/1), 1,49 кг (11,87 моль) сульфита натрия (с мольным соотношением сульфит натрия/исходный материал 1,3/1) и 25 л ксилола смешивали с образованием смеси, которую кипятили с обратным холодильником. Через 60 часов реакцию останавливали. Смесь охлаждали до комнатной температуры и промывали подходящим количеством воды. Добавляли активированный уголь для обесцвечивания смеси. Смесь отфильтровывали и оставляли стоять. Органическую фазу отделяли и концентрировали в вакууме, получая 2,05 кг продукта (S)-5,6,7,8-тетрагидро-4-метил-6-[N-(2-метоксиэтил)-N-пропиламино]-1-нафтола, который переводили в гидрохлорат. Выход составлял 71,6%.
Пример 18
2,00 кг (8,085 моль) (S)-5,6,7,8-тетрагидро-4-пропил-6-пропиламино-1-нафтола, 3,35 кг (12,14 моль) 2-(циклогексилокси)этилтрифторметансульфоната (с мольным соотношением сульфонат/исходный материал 1,5/1), 1,33 кг (10,52 моль) сульфита натрия (с мольным соотношением сульфит натрия/исходный материал 1,3/1) и 25 л ксилола смешивали с образованием смеси, которую кипятили с обратным холодильником. Через 48 часов реакцию останавливали. Смесь охлаждали до комнатной температуры и промывали подходящим количеством воды. Добавляли активированный уголь для обесцвечивания смеси. Смесь отфильтровывали и оставляли стоять. Органическую фазу отделяли и концентрировали в вакууме, получая 2,48 кг продукта (S)-5,6,7,8-тетрагидро-4-пропил-6-[N-[2-(циклогексилокси)этил]-N-пропиламино]-1-нафтола, который переводили в гидрохлорат. Выход составлял 74,8%.
Пример 19
2,00 кг (8,085 моль) (S)-5,6,7,8-тетрагидро-4-пропил-6-пропиламино-1-нафтола, 3,25 кг (12,14 моль) 2-(4-метилфенил)этилтрифторметансульфоната (с мольным соотношением сульфонат/исходный материал 1,5/1), 1,33 кг (10,52 моль) сульфита натрия (с мольным соотношением сульфит натрия/исходный материал 1,3/1) и 25 л ксилола смешивали с образованием смеси, которую кипятили с обратным холодильником. Через 48 часов реакцию останавливали. Смесь охлаждали до комнатной температуры и промывали подходящим количеством воды. Добавляли активированный уголь для обесцвечивания смеси. Смесь отфильтровывали и оставляли стоять. Органическую фазу отделяли и концентрировали в вакууме, получая 2,52 кг продукта (S)-5,6,7,8-тетрагидро-4-пропил-6-[N-[2-(4-метилфенил)этил]-N-пропиламино]-1-нафтола, который переводили в гидрохлорат. Выход составлял 77,5%.
Пример 20
2,00 кг (8,085 моль) (S)-5,6,7,8-тетрагидро-4-пропил-6-пропиламино-1-нафтола, 3,10 кг (12,14 моль) 2-(3-пиридил)этилтрифторметансульфоната (с мольным соотношением сульфонат/исходный материал 1,5/1), 1,33 кг (10,52 моль) сульфита натрия (с мольным соотношением сульфит натрия/исходный материал 1,3/1) и 25 л ксилола смешивали с образованием смеси, которую кипятили с обратным холодильником. Через 60 часов реакцию останавливали. Смесь охлаждали до комнатной температуры и промывали подходящим количеством воды. Добавляли активированный уголь для обесцвечивания смеси. Смесь отфильтровывали и оставляли стоять. Органическую фазу отделяли и концентрировали в вакууме, получая 2,41 кг продукта (S)-5,6,7,8-тетрагидро-4-пропил-6-[N-[2-(3-пиридил)этил]-N-пропиламино]-1-нафтола, который переводили в гидрохлорат. Выход составлял 76,6%.
Тест-пример 1: Результаты настоящего изобретения в сравнении с WO 01/38321
Соответствующие синтетические подходы были применены в настоящем изобретении и в WO 01/38321 для получения N-замещенных амино-5,6,7,8-тетрагидронафтолов. Сравнивали количества исходных материалов, количество карбоната натрия/сульфита натрия, масштабы реакции и конечный выход.
Источник данных: экспериментальные данные Примеров 1-4 в WO 01/38321 и экспериментальные данные Примеров 10-13 настоящего изобретения.
Из результатов, показанных в Таблице 1, можно видеть, что способ получения, описанный в WO 01/38321, требует повышенного количества алкилирующего агента (сульфоната) для улучшения выхода. Так, например, в лабораторном масштабе выход может достигать 80% и выше только при отношении сульфоната к 6-амино-5,6,7,8-тетрагидронафтолу равном 5, в то время как при крупномасштабном производстве выход значительно понизится и может достигнуть только 59%. Напротив, в способе, предложенном в настоящем изобретении, при отношении сульфоната к 6-амино-5,6,7,8-тетрагидронафтолу, равном 1,1, выход в крупномасштабном производстве может достигать 70% и выше. Таким образом, в соответствии со способом получения, предложенным в настоящем изобретении, используются относительно малые количества алкилирующего агента - сульфоната для получения конечного продукта с высокими выходами, что делает реакцию подходящей для крупномасштабного промышленного производства при разумной стоимости продукции.
| Таблица 1Сравнение тест-результатов настоящего изобретения и CN1391569 | |||||
| Тест из: | Пример | Базовое мольное отношение* | Масштаб реакции/исходный материал (г) | Мольное отношение сульфонатаΔ | Выход |
| WO 01/38321 | Пример 1 | 0,6 | 0,7 | 5 | 84% |
| Пример 2 | 0,6 | 13100 | 2,8 | 59% | |
| Пример 3 | 9,4 | 0,6 | 1,3 | Не выделен из-за низкого выхода | |
| Пример 4 | 3,1 | 388 | 1,1 | 55% | |
| Настоящееизобретение | Пример 10 | 1,3 | 2000 | 1,1 | 70,0% |
| Пример 11 | 1,3 | 2000 | 1,3 | 75,8% | |
| Пример 12 | 1,3 | 2000 | 1,5 | 81,7% | |
| Пример 13 | 1,3 | 2000 | 5,0 | 71,8% | |
| * Базовое мольное отношение относится к отношению карбонат натрия/сульфит натрия к исходному 6-амино-5,6,7,8-тетрагидронафтолу для WO 01/38321 и к отношению сульфита натрия к 6-амино-5,6,7,8-тетрагидронафтолу для настоящего изобретения.Δ - отношение 2-(2-тиенил)этил-4-метилбензолсульфоната к 6-амино-5,6,7,8-тетрагидронафтолу. |
Тест-пример 2: Выбор тестового количества сульфита натрия
При заданном соотношении 2-(2-тиенил)этил-4-метилбензолсульфоната к 6-амино-5,6,7,8-тетрагидронафтолу выходы продуктов реакции могут зависеть от количества сульфита.
Источник данных: экспериментальные данные примеров 1-2, 6-8, 12 в настоящем описании. Как можно видеть из результатов, приведенных в Таблице 2, при мольном отношении сульфита натрия к исходному 6-амино-5,6,7,8-тетрагидронафтолу, равном 0,8-2,5, выход конечного продукта может достигать около 70%.
| Таблица 2Сравнение результатов мольного отношения сульфита натрия в настоящем изобретении | |||
| Пример | Мольное отношение сульфоната Δ | Мольное отношение сульфита натрия * | Выход |
| Пример 1 | 1,5 | 0,5 | 11,7% |
| Пример 2 | 1,5 | 0,8 | 70,3% |
| Пример 12 | 1,5 | 1,3 | 81,7% |
| Пример 6 | 1,5 | 2,5 | 72,0% |
| Пример 7 | 1,5 | 3,0 | 47,8% |
| Пример 8 | 1,5 | 10,0 | Низкий выход |
| * мольное отношение сульфита натрия по отношению к исходному 6-амино-5,6,7,8-тетрагидронафтолу.Δ - отношение 2-(2-тиенил)этил-4-метилбензолсульфоната к 6-амино-5,6,7,8-тетрагидронафтолу |
Тест-пример 3: количество алкилирующего агента - сульфоната
При определенном количестве сульфита натрия выходы продуктов реакции могут зависеть от отношения 2-(2-тиенил)этил-4-метилбензолсульфоната к 6-амино-5,6,7,8-тетрагидронафтолу, т.е. относительному количеству алкилирующего агента - сульфоната.
Источник данных: экспериментальные данные Примеров 9-13 настоящего описания.
Как можно видеть из результатов, приведенных в Таблице 3, при мольном отношении 2-(2-тиенил)этил-4-метилбензолсульфоната к 6-амино-5,6,7,8-тетрагидронафтолу, равном (1,1-5,0):1, выход конечного продукта может достигать более 70%.
| Таблица 3Сравнение результатов мольного соотношения исходных материалов в настоящем изобретении | |||
| Пример | Мольное соотношение сульфита натрия * | Мольное соотношение сульфоната Δ | Выход |
| Пример 9 | 1,3 | 0,8 | 44,0% |
| Пример 10 | 1,3 | 1,1 | 70,0% |
| Пример 11 | 1,3 | 1,3 | 75,8% |
| Пример 12 | 1,3 | 1,5 | 81,7% |
| Пример 13 | 1,3 | 5,0 | 71,8% |
| * Мольное отношение сульфита натрия к отношению сульфита натрия к исходному 6-амино-5,6,7,8-тетрагидронафтолуΔ - Отношение 2-(2-тиенил)этил-4-метилбензолсульфоната к 6-амино-5,6,7,8-тетрагидронафтолу |
1. Способ получения соединения формулы (I), включающий: реакцию соединения формулы (II) с соединением формулы (III) в щелочных условиях и в присутствии сульфита, где(*) обозначает хиральный центр; соединение формулы (I) и соединение формулы (II) присутствуют в R или S конфигурации или рацемической смеси;R1 предста