Способы выявления онкогенных слитых белков, основанные на анализе близкого взаимного расположения
Иллюстрации
Показать всеГруппа изобретений раскрывает антительные матрицы для определения активационного состояния и/или общего количества одного или нескольких онкогенных слитых белков в таких биологических образцах, как цельная кровь или раковая ткань, а также способы их применения. В некоторых случаях активационное состояние и/или общее количество онкогенного слитого белка в образце может быть измерено в сочетании с одной или несколькими молекулами сигнальной трансдукции. Композиции и способы настоящего изобретения обладают преимуществами специфичности, связанной с ферментным иммуносорбентным анализом, чувствительности, связанной с амплификацией сигнала, и высокопроизводительного мультиплексирования, связанного с микроматрицами. 6 н. и 25 з.п. ф-лы, 32 ил., 10 пр., 3 табл.
Реферат
Перекрестные ссылки на родственные заявки
Настоящая заявка претендует на приоритет от Предварительной заявки на патент США No. 61/253,393, поданной 20 октября 2009 г., Предварительной заявки на патент США No. 61/305,084, поданной 16 февраля 2010 г.. Предварительной заявки на патент США No. 61/327,487, поданной 23 апреля 2010 г., и Предварительной заявки на патент США No. 61/383,037, поданной 15 сентября 2010 г., содержание которых включено путем ссылки во всей полноте на все случаи.
Уровень техники
Слитые белки, также известные как химерные белки, - это белки, созданные путем соединения двух или нескольких генов, кодирующих отдельные белки. Трансляция такого слитого гена дает один полипептид с функциональными свойствами, полученными от каждого из исходных белков. Химерные мутантные белки возникают тогда, когда крупномасштабная мутация, как правило, хромосомная транслокация, создает новую кодирующую последовательность, содержащую части кодирующих последовательностей из двух различных генов. Встречающиеся в природе слитые белки важны при раковых заболеваниях, когда они функционируют как онкобелки.
Слитый белок BCR-ABL является хорошо известным примером онкогенного слитого белка. Он считается основным онкогенным фактором хронической миелогенной лейкемии (CML), а также связан с острой лимфобластической лейкемией (ALL). Так, отличительным цитогенетическим признаком CML служит хромосома Philadelphia (Ph), которая вызывает образование слитого гена BCR-ABL, кодирующего белок в 210 кД. При этом возникающий слитый белок BCR-ABL является активной тирозинкиназой, которая играет решающую роль в патогенезе CML. Несмотря на то, что в настоящее время первейшим средством для новодиагностированных пациентов с CML является иматиниб (Gleevec®), около 20-25% больных не достигают стойких и полных цитогенетических ответов. Исследования показали, что главной причиной устойчивости при непрерывном лечении иматинибом является реактивация сигнального пути BCR-ABL. У большинства пациентов реактивация возникает вследствие мутаций в киназном домене BCR-ABL которые нарушают связывание иматиниба и вызывают устойчивость к препарату. При этом измерение активности BCR-ABL оказывается полезным для предсказания реакции на лечение такими ингибиторами тирозинкиназ, как иматиниб, а также для выявления пациентов, у которых возникает устойчивость к таким ингибиторам.
Существующие в настоящее время способы определения активности BCR-ABL основываются на измерении фосфорилированного CRKL (pCRKL), субстрата BCR-ABK. Например, в La Rosee et al. (Haematologica, 93:765-9 (2008)) описан анализ общих лизатов лейкоцитов методом Вестерн-блот с определением уровня pCRKL в качестве заменителя активности BCR-ABL (также см. Hochhaus et al., Leukemia, 16:2190-6 (2002); White et al., J. Clin. Oncol., 25:4445-51 (2007)). Аналогичным образом в Khorashad et al. (Haematologica, 94:861-4 (2009)) описан способ измерения уровня pCRKL на основе метода проточной цитометрии для оценки активности BCR-ABL (также см. Hamilton et al., Leukemia, 20:1035-9 (2006)). Однако эти способы не обладают той специфичностью и чувствительностью, которые необходимы для определения наличия или уровня активности BCR-ABL в образцах, так как они основываются на определении фосфорилирования белка-заменителя с помощью одного единственного антитела. Соответственно, необходимы специфические и чувствительные способы детектирования активности BCR-ABL, а также активности других онкогенных слитых белков для диагностических, прогностических и терапевтических целей. Настоящее изобретение удовлетворяет эту потребность, а также дает и другие связанные с этим преимущества.
Сущность изобретения
Настоящим изобретением предусмотрены антительные матрицы для определения активационного состояния и/или общего количества одного или нескольких онкогенных слитых белков в таких биологических образцах, как цельная кровь (например, в лизате, полученном из выделенных редких циркулирующих клеток или лейкоцитов) или раковая ткань (например, в тонкоигольном пункционном биоптате), и способы их применения. В некоторых случаях активационное состояние и/или общее количество онкогенного слитого белка(ов) в образце может быть измерено в сочетании с одной или несколькими молекулами сигнальной трансдукции. Композиции и способы настоящего изобретения обладают преимуществами специфичности, связанной с ферментным иммуносорбентным анализом, чувствительности, связанной с амплификацией сигнала, и высокопроизводительного мультиплексирования, связанного с микроматрицами.
В одном аспекте настоящим изобретением предусмотрен способ определения уровня или активационного состояния онкогенного слитого белка, который включает:
(а) контактирование клеточного экстракта с первой связывающей молекулой, специфичной к первому домену полноразмерного первого белка в условиях, подходящих для преобразования первого полноразмерного белка, присутствующего в клеточном экстракте, в комплекс, включающий первый полноразмерный белок и первую связывающую молекулу, причем первый домен первого полноразмерного белка отсутствует в соответствующем онкогенном слитом белке, содержащем второй другой домен первого полноразмерного белка, слитый с первым доменом второго другого полноразмерного белка;
(b) удаление из клеточного экстракта комплекса из стадии (а) с получением клеточного экстракта, лишенного первого полноразмерного белка;
(c) контактирование клеточного экстракта из стадии (b) со второй связывающей молекулой, специфичной ко второму другому домену первого полноразмерного белка в условиях, подходящих для преобразования онкогенного слитого белка, присутствующего в клеточном экстракте, в комплекс, содержащий онкогенный слитый белок и вторую связывающую молекулу; и
(d) определение уровня или активационного состояния комплекса из стадии (с), тем самым определяя уровень или активационное состояние онкогенного слитого белка.
В определенных воплощениях определение уровня или активационного состояния онкогенного слитого белка включает измерение уровня экспрессии (например, концентрации) и/или активационного состояния (например, фосфорилирования) онкогенного слитого белка (например, в клеточном экстракте).
В предпочтительных воплощениях стадии (с) и (d) способа настоящего изобретения включают ферментный иммуносорбентный анализ (ELISA), метод проточной цитометрии, метод сортировки по тегам или метод двойного детектирования сближения, как описано здесь.
В одном определенном воплощении метода двойного детектирование сближения настоящим изобретением предусмотрен способ определения уровня и/или активационного состояния онкогенного слитого белка, который включает:
(a) инкубирование клеточного экстракта с серийными разведениями захватывающих антител, специфичных к онкогенному слитому белку, с получением множества захваченных онкогенных слитых белков, причем захватывающие антитела фиксированы на твердой подложке, при этом онкогенный слитый белок содержит первый домен, соответствующий первому белку, и второй домен, соответствующий второму другому белку, и при этом захватывающие антитела специфичны к первому домену слитого белка;
(b) инкубирование множества захваченных онкогенных слитых белков с по меньшей мере двумя типами детектирующих антител, специфичных ко второму домену онкогенного слитого белка, с получением множества детектируемых захваченных онкогенных слитых белков, причем детектирующие антитела включают:
(1) множество независимых от активационного состояния антител, помеченных содействующей молекулой, и
(2) множество зависимых от активационного состояния антител, помеченных первым членом пары амплификации сигнала,
причем содействующая молекула вырабатывает окислитель, который направляется к и реагирует с первым членом пары амплификации сигнала;
(c) инкубирование множества детектируемых захваченных онкогенных слитых белков со вторым членом пары амплификации сигнала с генерированием амплифицированного сигнала; и
(d) детектирование амплифицированного сигнала, генерированного первым и вторым членами пары амплификации сигнала.
В другом определенном воплощении метода двойного детектирования сближения настоящим изобретением предусмотрен способ определения уровня и/или активационного состояния онкогенного слитого белка, который включает:
(a) инкубирование клеточного экстракта с серийными разведениями захватывающих антител, специфичных к онкогенному слитому белку, с получением множества захваченных онкогенных слитых белков, причем захватывающие антитела фиксированы на твердой подложке, при этом онкогенный слитый белок содержит первый домен, соответствующий первому белку, и второй домен, соответствующий второму другому белку, и при этом захватывающие антитела специфичны к первому домену слитого белка;
(b) инкубирование множества захваченных онкогенных слитых белков с по меньшей мере двумя типами детектирующих антител с получением множества детектируемых захваченных онкогенных слитых белков, причем детектирующие антитела включают:
(1) множество независимых от активационного состояния антител, помеченных содействующей молекулой, причем независимые от активационного состояния антитела специфичны к первому домену слитого белка, и
(2) множество зависимых от активационного состояния антител, помеченных первым членом пары амплификации сигнала, причем зависимые от активационного состояния антитела специфичны ко второму домену слитого белка,
причем содействующая молекула вырабатывает окислитель, который направляется к и реагирует с первым членом пары амплификации сигнала;
(c) инкубирование множества детектируемых захваченных онкогенных слитых белков со вторым членом пары амплификации сигнала с генерированием амплифицированного сигнала; и
(d) детектирование амплифицированного сигнала, генерированного первым и вторым членами пары амплификации сигнала.
В другом аспекте настоящим изобретением предусмотрен способ оптимизации лечения и/или снижения токсичности у субъекта, страдающего раком и получающего курс терапии для лечения рака, который включает:
(a) выделение раковых клеток после введения противоракового препарата;
(b) лизирование выделенных клеток для получения клеточного экстракта;
(c) измерение уровня экспрессии и/или активации онкогенного слитого белка в клеточном экстракте описанным здесь способом;
(d) сравнение измеренного уровня экспрессии и/или активации онкогенного слитого белка с уровнем экспрессии и/или активации онкогенного слитого белка, измеренным ранее во время курса терапии; и
(e) определение последующей дозы в курсе терапии для субъекта или же того, следует ли назначить субъекту другой курс лечения, исходя из сравнения на стадии (d).
В некоторых воплощениях определяется одна или несколько молекул сигнальной трансдукции, присутствующих в клеточном экстракте, вдобавок к одному или нескольким онкогенным слитым белкам. Примеры молекул сигнальной трансдукции включают, без ограничения, рецепторные тирозинкиназы, нерецепторные тирозинкиназы, тирозинкиназы компонентов сигнального каскада и/или субстраты для одного или нескольких онкогенных слитых белков (например, субстраты BCR-ABL). В некоторых случаях молекулы сигнальной трансдукции детектируются описанными здесь способами за исключением того, что, в зависимости от методики, на один и тот же белок направлены два антитела (т.е. захватывающее антитело и детектирующее антитело) или же три антитела (т.е. захватывающее антитело и два детектирующих антитела). В других случаях молекулы сигнальной трансдукции детектируются любым способом, известным специалистам в данной области. В некоторых воплощениях одна или несколько молекул сигнальной трансдукции, присутствующих в клеточном экстракте, детектируются в сочетании с одним или несколькими онкогенными слитыми белками, используя описанные здесь методы (например, иммуноанализа).
В некоторых воплощениях настоящим изобретением также предусмотрены наборы для выполнения описанных здесь методов двойного детектирования сближения, включающие: (а) серийные разведения одного или нескольких захватывающих антител, фиксированных на твердой подложке, причем захватывающие антитела специфичны к одному или нескольким анализируемым веществам (например, онкогенным слитым белкам или молекулам сигнальной трансдукции); и (b) несколько (например, по меньшей мере два типа) детектирующих антител для каждого анализируемого вещества. Наборы также могут необязательно содержать и другие реагенты, такие, к примеру, как первый и второй члены пары амплификации сигнала.
Другие цели, особенности и преимущества настоящего изобретения станут понятными специалистам из следующего подробного описания и фигур.
Краткое описание фигур
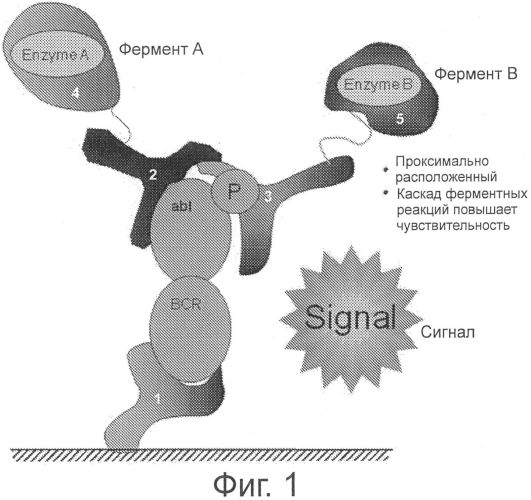
На фиг.1 представлено одно воплощение способа определения по настоящему изобретению, которое основывается на совместной локализации двух дополнительных детектирующих антител, соединенных с ферментами для последующего канализирования по каждому из связавшихся онкогенных слитых белков.
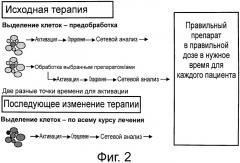
На фиг.2 представлена схема применения матриц изобретения для отбора лекарств на протяжении курса лечения рака.
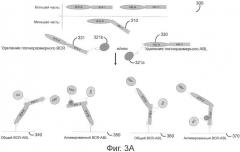
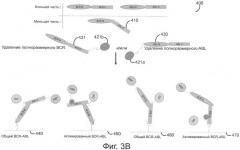
На фиг.3A-D представлены различные воплощения способа определения по настоящему изобретению для выявления уровня экспрессии и активации таких онкогенных слитых белков, как BCR-ABL.
На фиг.4 представлен сигнал BCR-ABL в клетках К562 после удаления свободного BCR.
На фиг.5 представлен сигнал BCR в клетках К562 после удаления свободного BCR.
На фиг.6 представлено детектирование общего уровня и фосфорилированного BCR-ABL в клетках К562.
На фиг.7 представлен уровень фосфорилирования ("фосфо-BCR-ABL") и общее количество («общий BCR-ABL») BCR-ABL при детектировании в клетках К562 из хронической миелогенной лейкемии человека с удалением или без удаления свободного BCR с помощью шариков, конъюгированных с антителом против С-концевого BCR.
На фиг.8 представлен сигнал фосфорилированного BCR-ABL в клетках К562 с удалением или без удаления свободного BCR с помощью шариков, конъюгированных с антителом против С-концевого BCR. В частности, на фиг.8А представлено сравнение на микроматрице сигнала фосфорилированного BCR-ABL при определении в лизатах клеток К562 с удалением или без удаления полноразмерного BCR («не обработанные шариками» = без удаления BCR в сравнении с «обработанные шариками» = с удалением BCR с помощью шариков, содержащих конъюгированное с ними антитело, специфичное к С-концевой части полноразмерного BCR). На фиг.8 В приведено графическое представление данных из микроматриц в виде относительных единиц флуоресценции (ОЕФ) в зависимости от количества клеток.
На фиг.9 представлен общий сигнал BCR-ABL в клетках К562 с удалением или без удаления свободного BCR с помощью шариков, конъюгированных с антителом против С-концевого BCR. В частности, на фиг.9А представлено сравнение на микроматрице общего сигнала BCR-ABL при определении в лизатах клеток К562 с удалением или без удаления полноразмерного BCR («не обработанные шариками» = без удаления BCR в сравнении с «обработанные шариками» = с удалением BCR с помощью шариков, содержащих конъюгированное с ними антитело, специфичное к С-концевой части полноразмерного BCR). На фиг.9 В приведено графическое представление данных из микроматриц в виде относительных единиц флуоресценции (ОЕФ) в зависимости от количества клеток.
На фиг.10 представлено удаление свободного полноразмерного BCR из экстракта клеток К562 после обработки клеточного экстракта шариками, конъюгированными с антителом против С-концевого BCR. В частности, на фиг.10А представлено сравнение на микроматрице общего сигнала BCR при определении в лизатах клеток К562 с удалением или без удаления полноразмерного BCR («не обработанные шариками» = без удаления BCR в сравнении с «обработанные шариками» = с удалением BCR с помощью шариков, содержащих конъюгированное с ними антитело, специфичное к С-концевой части полноразмерного BCR). На фиг.10 В приведено графическое представление данных из микроматриц в виде относительных единиц флуоресценции (ОЕФ) в зависимости от количества клеток.
На фиг.11 показано, что в лейкоцитах (WBCs) присутствуют свободные полноразмерные белки BCR и ABL, но не слитый белок BCR-ABL.
На фиг.12 показано, что свободный полноразмерный BCR, присутствующий в лейкоцитах, ингибирует сигнал фосфо-BCR-ABL в экстрактах клеток К562, когда в такие экстракты клеток К562 добавляли экстракты лейкоцитов (WBCs).
На фиг.13 представлен общий сигнал BCR-ABL в клетках К562 с добавлением экстрактов WBCs после удаления свободного BCR с помощью шариков, конъюгированных с антителом против С-концевого BCR. В частности, из фиг.13А видно, что сигнал свободного BCR насыщается при добавлении в экстракты клеток К562 экстрактов WBCs. После обработки шариками, конъюгированными с антителом против С-концевого BCR, свободный BCR удаляется. Из фиг.13 В видно, что в том же эксперименте сигнал BCR-ABL не изменяется при обработке или без обработки шариками.
На фиг.14 показано, что ингибитор BCR-ABL иматиниб (Gleevec®) дозозависимым образом ингибирует активацию (т.е. фосфорилирование), но не экспрессию (т.е. общий уровень) белка BCR-ABL в клетках К562.
На фиг.15 показано, что ингибитор BCR-ABL нилотиниб (Tasigna®) дозозависимым образом ингибирует активацию (т.е. фосфорилирование), но не экспрессию (т.е. общий уровень) белка BCR-ABL в клетках К562.
На фиг.16 показано, что ингибитор BCR-ABL дазатиниб (Sprycel®) дозозависимым образом ингибирует активацию (т.е. фосфорилирование), но не экспрессию (т.е. общий уровень) белка BCR-ABL в клетках К562.
На фиг.17 показано, что CRKL присутствует и активируется (т.е. фосфорилируется) в клетках К562.
На фиг.18 показано, что CRKL присутствует в клетках А431 из эпидермоидной карциномы человека и активируется (т.е. фосфорилируется) после обработки EGF.
На фиг.19 показано, что CRKL присутствует в раковых клетках T47D эпителия молочных протоков человека, но не активируется (т.е. не фосфорилируется) после обработки EGF.
На фиг.20 показано, что CRKL присутствует в клетках T47D и активируется (т.е. фосфорилируется) на низком уровне после обработки херегулином (HRG).
На фиг.21 показано, что CRKL присутствует в клетках MCF-7 из аденокарциномы молочной железы человека и активируется (т.е. фосфорилируется) на низком уровне после обработки херегулином (HRG).
На фиг.22 показано присутствие активированного (т.е. фосфорилированного) CRKL в лейкоцитах (WBCs) от различных доноров.
На фиг.23 показано, что JAK2 активируется (т.е. фосфорилируется) в клетках К562 и клетках А431.
На фиг.24 показано, что фосфорилированный BCR-ABL можно детектировать и измерять в клеточных лизатах, приготовленных из клеток К562, выделенных из крови с помощью магнитных шариков анти-СВ45.
На фиг.25 показано, что общий уровень BCR-ABL не изменяется при нанесении антитела против С-концевой части нативного полноразмерного BCR (эта С-концевая часть отсутствует в BCR-ABL) на ту же пластинку в те же самые площадки, что и антитело против N-концевой части BCR-ABL.
На фиг.26 показано, что сигнал свободного нативного BCR, детектируемый с помощью антитела, специфичного к N-концевой части BCR, снижается при нанесении на ту же пластинку в те же самые площадки антитела против С-концевой части нативного BCR.
Раскрытие сущности изобретения
I. Введение
Гематологические раковые заболевания представляют собой такие типы рака, которые затрагивают кровь, костный мозг и лимфатические узлы. Поскольку все три непосредственно связаны через иммунную систему, то заболевание, затрагивающее одно из них, часто затрагивает и всех остальных. Например, хотя лимфома технически является заболеванием лимфатических узлов, но она часто распространяется на костный мозг и на кровь. Такие заболевания обычно вызывают хромосомные транслокации, создающие слитые белки с новыми кодирующими последовательностями, содержащими части кодирующих последовательностей из двух различных генов, но они реже вызывают образование твердых опухолей. При этом для того, чтобы обеспечить надлежащий прогноз и лечение пациентов с таким типом раковых заболеваний, важно установить присутствие и/или активность онкогенных слитых белков, связанных с гематологическими раковыми заболеваниями.
Например, слитый белок BCR-ABL связан с хронической миелогенной лейкемией (CML), а также с острой лимфобластической лейкемией (ALL). В частности, белок BCR-ABL является активной тирозинкиназой, которая играет решающую роль в патогенезе CML. Несмотря на то, что в настоящее время первейшим средством для новодиагностированных пациентов с CML является иматиниб (Gleevec®), около 20-25% больных не достигают стойких и полных цитогенетических ответов. Исследования показали, что главной причиной устойчивости при непрерывном лечении иматинибом является реактивация киназной активности BCR-ABL. При этом измерение активности BCR-ABL оказывается полезным для предсказания реакции на лечение такими ингибиторами тирозинкиназ, как иматиниб, а также для выявления пациентов, у которых возникает устойчивость к таким ингибиторам.
Настоящим изобретением предусмотрен способ детектирования активационного состояния и/или общего количества одного или нескольких слитых белков (одних или в комбинации с одной или несколькими молекулами сигнальной трансдукции) в выделенных клетках с помощью системы анализа матриц на основе антител. В описанных здесь способах особенно применимы клеточные экстракты, полученные из выделенных лейкоцитов, циркулирующих клеток или других типов клеток. В некоторых воплощениях мультиплексные высокопроизводительные способы иммуноанализа по настоящему изобретению способны детектировать активационное состояние одного или нескольких онкогенных слитых белков и/или молекул сигнальной трансдукции на уровне единичных клеток. В самом деле, такие молекулы сигнальной трансдукции, как EGFR, можно детектировать с чувствительностью в 100 цептомоль и динамическим диапазоном линейности от 100 цептомоль до 100 фемтомоль. При этом детектирование в единичных клетках активационного состояния одного или нескольких онкогенных слитых белков и/или молекул сигнальной трансдукции облегчает прогнозирование и диагностику раковых заболеваний, а также разработку персонализированной прицельной терапии.
На фиг.1 представлен типичный метод двойного детектирования сближения по настоящему изобретению, в котором онкогенный слитый белок типа BCR-ABL связывается с захватывающим антителом и двумя детектирующими антителами (т.е. независимым от активационного состояния антителом и зависимым от активационного состояния антителом). Захватывающее антитело 1 связывается с BCR-частью слитого белка независимо от его активационного состояния. В то время как независимое от активационного состояния антитело 2 связывается с ABL-частью слитого белка независимо от его активационного состояния, зависимое от активационного состояния антитело 3 связывается с ABL-частью слитого белка в зависимости от его активационного состояния (например, зависимое от активационного состояния антитело будет связываться только с активированной формой BCR-ABL, содержащей фосфорилированный остаток). Независимое от активационного состояния антитело метится содействующей молекулой 4 («фермент А»), а зависимое от активационного состояния антитело метится первым членом пары амплификации сигнала 5 («фермент В»). Связывание обоих детектирующих антител с ABL-частью слитого белка приводит содействующую молекулу на достаточно близкое расстояние к первому члену пары амплификации сигнала, так что сигнал, генерированный содействующей молекулой, может канализироваться на первого члена пары амплификации сигнала, вызывая генерирование детектируемого и/или амплифицируемого сигнала. Различные методы канализирования при сближении описаны здесь, а также известны в данной области, включая, без ограничения, FRET, FRET с временным разрешением флуоресценции, LOCI и др. Преимущество канализирования при сближении в применении к способам настоящего изобретения состоит в том, что отдельный детектируемый сигнал генерируется только для тех анализируемых веществ (например, слитых белков или молекул сигнальной трансдукции), с которыми свяжутся все три антитела, что приводит к повышению специфичности определения, снижению фона и упрощению детектирования.
Как разъясняется более подробно ниже, для оценки потенциальной противораковой терапии для индивидуального пациента можно проинкубировать выделенные клетки с одним или несколькими противораковыми препаратами при различных дозах. Затем можно провести стимуляцию фактором роста в течение нескольких минут (например, 1-5 мин) или нескольких часов (например, 1-6 ч). Дифференциальная активация сигнальных путей в присутствии и в отсутствие противораковых препаратов поможет выбрать подходящую противораковую терапию в надлежащей дозе для каждого индивидуального пациента. Также можно выделить клетки у пациента во время лечения противораковым препаратом и простимулировать их одним или несколькими факторами роста, чтобы определить, не следует ли произвести изменения в терапии. При этом из фиг.2 видно, что способы настоящего изобретения наилучшим образом помогают врачам обеспечить правильный противораковый препарат в нужной дозе в нужное время для каждого пациента.
II. Определения
В настоящем изобретении следующие термины имеют приданные им значения, если не указано иначе.
Термин «рак» охватывает всех представителей класса заболеваний, характеризующихся неконтролируемым ростом аномальных клеток. Термин охватывает все известные раковые и неопластические заболевания, будь то злокачественные, доброкачественные, мягкие или твердые (солидные), а также рак на всех стадиях и всякой степени, включая пре- и пост-метастатический рак. Неограничивающими примерами различных типов рака являются гематологические злокачественности (например, лейкемия, лимфома); остеогенные саркомы (например, саркома Юинга); саркомы мягких тканей (например, выступающая дерматофибросаркома (DFSP), рабдомиосаркома); другие злокачественности мягких тканей, папиллярная карцинома щитовидной железы; рак простаты; рак желудка; рак молочной железы; рак легких (например, немелкоклеточный рак легких); рак пищеварительного тракта (например, рак толстой и прямой кишки, желудочно-кишечные стромальные опухоли, желудочно-кишечные карциноидные опухоли, рак толстой кишки, рак прямой кишки, рак заднего прохода, рак желчных протоков и рак тонкой кишки); рак пищевода; рак желчного пузыря; рак печени; рак поджелудочной железы; рак червеобразного отростка (аппендикса); рак яичников; рак почек (например, почечно-клеточная карцинома); рак центральной нервной системы; рак кожи; хориокарцинома; и рак головы и шеи. При этом «опухоль» включает одну или несколько раковых клеток.
«Гематологическая злокачественность» охватывает любые раковые заболевания, которые затрагивают кровь, костный мозг и/или лимфатические узлы. Примерами гематологической злокачественности являются, без ограничения, лейкемия, лимфома и множественная миелома. Неограничивающие примеры различных видов лейкемии включают хроническую миелогенную лейкемию (CML), острую лимфобластическую лейкемию (ALL), хроническую лимфоцитарную лейкемию (CLL), острую миелогенную лейкемию (AML) и крупно-гранулярную лимфоцитарную лейкемию. Подтипы CML включают, например, хроническую моноцитарную лейкемию. Подтипы ALL включают например, острую лимфобластическую лейкемию предшественников В-клеток, острую лимфобластическую лейкемию про-В-клеток, острую лимфобластическую лейкемию предшественников Т-клеток и острую бифенотипическую лейкемию. Подтипы CLL включают, например, пролимфоцитарную В-клеточную лейкемию. Подтипы AML включают, например, острую промиелоцитарную лейкемию, острую миелобластическую лейкемию и острую мегакариобластическую лейкемию. Примеры различных типов лимфомы включают, без ограничения, лимфому Ходжкина (четыре подтипа) и лимфому не-Ходжкина, как-то, например, малую лимфоцитарную лимфому (SLL), диффузную большую В-клеточную лимфому (DLBCL), фолликулярную лимфому (FL), мантиевидно-клеточную лимфому (MCL), волосковидно-клеточную лейкемию (HCL), лимфому маргинальной зоны (MZL), лимфому Буркитта (BL), пост-трансплантационное лимфопролиферативное заболевание (PTLD), Т-клеточную пролимфоцитарную лейкемию (T-PLL), В-клеточную пролимфоцитарную лейкемию (B-PLL), макроглобулинемию Вальденстрома (также известна как лимфоплазмацитарная лимфома) и другие NK- или Т-клеточные лимфомы.
Термин «определяемое вещество (аналит)» охватывает любые молекулы, обычно макромолекулы типа полипептидов, которых наличие, количество и/или идентичность определяется. В определенных случаях аналитом является клеточный компонент раковых клеток, предпочтительно онкогенный слитый белок или молекула сигнальной трансдукции.
Термин «преобразовывать» или «преобразование» охватывает физические и/или химические изменения аналита или образца для того, чтобы экстрагировать аналит либо изменить или модифицировать аналит определенным образом. В настоящем изобретении экстракция, обработка, химическая преципитация, ELISA, комплексирование, иммуноэкстракция, физическая или химическая модификация аналита или образца для измерения уровня или концентрации или активационного состояния аналита - все это составляет преобразование. Иными словами, если аналит или образец не идентичны до и после стадии трансформации, то изменение или модификация составляет преобразование.
В настоящем изобретении термин «серийное разведение» означает ряд понижающихся концентраций определенного образца (например, клеточного лизата) или реагента (например, антитела). Серийное разведение обычно получают смешиванием отмеренного количества образца или реагента в исходной концентрации с разбавителем (например, разбавляющим буфером) с получением меньшей концентрации образца или реагента и повторением процесса достаточное количество раз до получения нужного числа серийных разведений. Образец или реагент может быть серийно разведен по меньшей мере в 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25, 30, 35, 40, 45, 50, 100, 500 или 1000 раз, получая серийные разведения, содержащие по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 25, 30, 35, 40, 45 или 50 понижающихся концентраций образца или реагента. Например, серийные разведения, составляющие 2-кратное серийное разведение реагента захватывающего антитела при исходной концентрации в 1 мг/мл, можно получить смешиванием одного объема захватывающего антитела в исходной концентрации с равным объемом разбавляющего буфера, получая концентрацию захватывающего антитела в 0,5 мг/мл, и повторением этого процесса до получения концентраций захватывающего антитела в 0,25 мг/мл, 0,125 мг/мл, 0,0625 мг/мл, 0,0325 мг/мл и т.д.
Термин «превосходный динамический диапазон» в настоящем изобретении означает способность метода измерения детектировать специфический аналит всего лишь в одной клетке или же во многих тысячах клеток. Например, описанные здесь методы иммуноанализа обладают превосходным динамическим диапазоном, так как они хорошо детектируют определенный слитый белок или нужную молекулу сигнальной трансдукции в 1-10000 клеток (например, в 1, 5, 10, 25, 50, 75, 100, 250, 500, 750, 1000, 2500, 5000, 7500 или 10000 клеток) при использовании серийных разведении захватывающего антитела.
Термин «слитый белок» или «химерный белок» охватывает белки, образовавшиеся при соединении двух или нескольких генов, исходно кодирующих отдельные белки. Такие слияния генов обычно происходят тогда, когда хромосомная транслокация замещает терминальные экзоны одного гена интактными экзонами из второго гена. При этом образуется один ген, который может транскрибироваться, подвергаться сплайсингу и транслироваться с образованием функционального слитого белка. В определенных воплощениях слитый белок является онкогенным слитым белком, т.е. слитым белком, вовлеченным в онкогенез. Примеры онкогенных слитых белков включат, без ограничения, BCR-ABL, DEK-CAN, E2A-PBX1, RARα-PML, IREL-URG, CBFβ-MYHll, AML1-MTG8, EWS-FLI, LYT-10-Cα1, HRX-ENL, HRX-AF4, NPM-ALK, IGH-MYC, RUNX1-ETO, TEL-TRKC, TEL-AML1, MLL-AF4, TCR-RBTN2, COL1A1-PDGF, E2A-HLF, PAX3-FKHR, ETV6-NTRK3, RET-PTC, TMRSS-ERG и TPR-MET.
Термин «молекула сигнальной трансдукции» или «передатчик сигналов» включает белки и другие молекулы, осуществляющие процесс, посредством которого клетка превращает внеклеточный сигнал или раздражитель в ответ, обычно включающий упорядоченную последовательность биохимических реакций внутри клетки. Примеры молекул сигнальной трансдукции включают, без ограничения, тирозинкиназы рецепторов, таких как EGFR (например, EGFR/HER-1/ErbB1, HER-2/Neu/ErbB2, HER-3/ЕrbВ3, HER-4/ErbB4), VEGFR-l/FLT-1, VEGFR-2/FLK-1/KDR, VEGFR-3/FLT-4, FLT-3/FLK-2, PDGFR (например, PDGFRA, PDGFRB), c-Met, c-KIT/SCFR, INSR (инсулиновый рецептор), IGF-IR, IGF-IIR, IRR (рецептор, родственный инсулиновому рецептору), CSF-1R, FGFR 1-4, HGFR 1-2, CCK4, TRK A-C, MET, RON, EPHA 1-8, EPHB 1-6, AXL, MER, TYR03, TIE 1-2, ТЕК, RYK, DDR 1-2, RET, c-ROS, V-кадгерин, LTK (тирозинкиназа лейкоцитов), ALK (киназа анапластической лимфомы), ROR 1-2, MUSK, AATYK 1-3, RTK 106, и укороченные формы тирозинкиназ рецепторов, такие как р95ЕrbВ2; нерецепторные тирозинкиназы, такие как Src, Frk, Btk, Csk, Abl, Zap70, Fes/Fps, Fak, Jak, Ack, и LIMK; тирозинкиназы компонентов сигнального каскада, такие как Akt, MAPK/ERK, MEK, RAF, PLA2, МЕКК, JNKK, JNK, p38. She (p66), PI3K, Ras (например, K-Ras, N-Ras, H-Ras), Rho, Raci, Cdc42, PLC, PKC, киназа p70 S6, p53, циклин Dl, STAT1, STAT3, PIP2, PIP3, PDK, mTOR, BAD, p21, p27, ROCK, IP3, TSP-1, NOS, PTEN, RSK 1-3, JNK, c-Jun, Rb, CREB, Ki67 и паксиллин; ядерные гормональные рецепторы, такие как эстрогенный рецептор (ER), прогестероновый рецептор (PR), андрогенный рецептор, глюкокортикоидный рецептор, минералокортикоидный рецептор, рецептор витамина А, рецептор витамина D, ретиноидный рецептор, рецептор тиреоидного гормона и рецепторы-»сироты», коактиваторы и репрессоры ядерных рецепторов и их комбинации.
Термин «образец» в настоящем изобретении охватывает любые биологические образцы, полученные от пациента. Образцы включают, без ограничения, цельную кровь, плазму, сыворотку, смывную жидкость протоков, аспират из сосков, лимфу (например, рассеянные опухолевые клетки лимфатических узлов), аспират костного мозга, слюну, мочу, кал (т.е. фекалии), мокроту, смывную жидкость бронхов, слезы, тонкоигольный аспирационный биоптат (например, взятый при случайной периареолярной тонкоигольной аспирации) и любые другие жидкости организма, образцы тканей (например, опухолевой ткани), как-то биоптаты опухолей (например, игольные биоптаты) или лимфатических узлов (например, биоптат «сторожевого» лимфоузла) и клеточные экстракты из них. В некоторых воплощениях образец представлен цельной кровью или ее фракционированным компонентом, таким как плазма, сыворотка, эритроциты, лейкоциты, как-то мононуклеары периферической крови и/или редкие циркулирующие клетки. В некоторых воплощениях образец получают путем выделения лейкоцитов или циркулирующих клеток твердой опухоли из цельной крови или ее клеточных фракций, используя любые известные способы. В других воплощениях образцом является фиксированный формалином заключенный в парафин (FFPE) образец раковой ткани, например, из твердой опухоли.
В настоящем изобретении термин «циркулирующие клетки» охватывает внеопухолевые клетки, которые метастазировали или микрометастазировали из твердой опухоли. Примеры циркулирующих клеток включают, без ограничения, циркулирующие опухолевые клетки, раковые стволовые клетки и/или клетки, которые мигрируют в опухоль (например, циркулирующие эндотелиальные клетки-предшественники, циркулирующие эндотелиальные клетки, циркулирующие про-ангиогенные миелоидные клетки, циркулирующие дендритные клетки и др.).
«Биопсия» означает процесс взятия образца ткани для диагностической или прогностической оценки, а также сам образец ткани. В отношении способов и композиций настоящего изобретения можно применять любые методы биопсии, известные в данной области. Применяемые методы биопсии в общем зависят от типа ткани, подлежащей исследованию, и от размера и типа опухоли (т.е. твердой или суспендированной (т.е. кровь или асциты), среди других факторов. Репрезентативные методы биопсии включают эксцизионную биопсию, инцизионную биопсию, игольную биопсию (например, пункционную игольную биопсию, тонкоигольную аспирационную биопсию и др.), хирургическую биопсию и биопсию костного мозга. Методы биопсии приведены, к примеру, в Harrison's Principles of Internal Medicine, Kasper et al., eds., 16th ed., 2005, Chapter 70, включая Part V. Специалистам должно быть известно, что методы биопси