Способы предсказания ответа трижды негативного рака молочной железы на терапию
Иллюстрации
Показать всеНастоящее изобретение предоставляет способ предсказания ответа трижды негативного рака молочной железы на терапию противоопухолевым средством. Способ включает: (a) лизирование опухолевых клеток, взятых от трижды негативной опухоли молочной железы, для получения клеточного экстракта; (b) определение уровня экспрессии VEGFR2 в клеточном экстракте; и (c) сравнение уровня экспрессии VEGFR2 в клеточном экстракте, полученном на стадии (b), с эталонным уровнем экспрессии VEGFR2. Наличие низкого уровня экспрессии VEGFR2 предсказывает ответ на терапию противоопухолевым средством, где противоопухолевое средство представляет собой комбинацию бевацизумаба (Авастин®), карбоплатина и паклитакселя. 15 з.п. ф-лы, 14 ил., 7 пр.
Реферат
Перекрестные ссылки на родственные заявки
Эта заявка заявляет приоритет по предварительной заявке США №61/294,433, поданной 12 января 2010, предварительной заявке США №61/325,624, поданной 19 апреля 2010, предварительной заявке США №61/328,602, поданной 27 апреля 2010, и предварительной заявке США №61/351,838, поданной 4 июня 2010, раскрытия которых включаются в описание путем отсылки полностью во всех отношениях.
Уровень техники
Процесс сигнальной трансдукции в клетках обуславливает целый ряд биологических функций, включая деление и смерть клеток, обмен веществ (метаболизм), активацию иммунных клеток, нейропередачу и сенсорное восприятие, и многие другие. Следовательно, нарушение нормальной сигнальной трансдукции в клетках может приводить к целому ряду болезненных состояний, таких как диабет, сердечная недостаточность, аутоиммунные реакции и рак.
Одним хорошо охарактеризованным путем сигнальной трансдукции является МАР-киназный путь (митоген-активируемый протеинкиназный путь), отвечающий за передачу сигнала от эпидермального фактора роста (EGF) для стимулирования пролиферации клеток (см. Фигуру 1 РСТ публикации №WO 2009/108637, раскрытие которой включается в описание путем отсылки полностью во всех отношениях). EGF связывается тирозинкиназой, связанной с трансмембранным рецептором, рецептором эпидермального фактора роста (EGFR), который активируется при связывании с EGF. Связывание EGF с EGFR вызывает тирозинкиназную активность цитоплазматического домена рецептора. Одним результатом этой киназной активности является аутофосфорилирование остатков тирозина EGFR. Фосфорилированные остатки тирозина на активированном EGFR обеспечивают сайты «стыковки» (докинга) для связывания содержащих домен SH2 адапторных белков, таких как GRB2. Функционируя в качестве адаптора, GRB2 дополнительно связывается с гуанин-нуклеотид заменяющим фактором, SOS, с помощью SH3 домена, находящегося на GRB2. Образование комплекса EGFR-GRB2-SOS приводит к SOS-активации фактора обмена гуанин-нуклеотида, что способствует удалению GDP от Ras. После удаления GDP, Ras связывает GTP и становится активированным.
После активации Ras связывается с и активирует протеинкиназную активность RAF-киназы, серин-треонин-специфичссюой протеинкиназы. За этим следует активация протеинкиназного каскада, приводящего к пролиферации клеток. В общих чертах, затем RAF-киназа фосфорилирует и активирует МЕК, другую серин-треониновую киназу. Активированная МЕК фосфорилирует и активирует митоген-активируемую протеинкиназу (МАРК). В число мишеней для дальнейшего фосфорилирования МАРК входит 40S рибосомальная протеинкиназа S6 (RSK). МАРК-фосфорилирование RSK приводит к активации RSK, которая в свою очередь фосфорилирует рибосомальный белок S6. Другой известной мишенью МАРК является протоонкоген, ген с-Мус, необходимый для пролиферации клеток, который является мутированным в целом ряде видов рака. МАРК также фосфорилирует и активирует другую протеинкиназу MNK, которая в свою очередь фосфорилирует транскрипционный фактор CREB. Косвенно МАРК также регулирует транскрипцию гена Fos, кодирующего еще один транскрипционный фактор, вовлеченный в пролиферацию клеток. Изменяя уровни и активность таких транскрипционных факторов, МАРК преобразовывает первоначальный внеклеточный сигнал от EGF в измененную транскрипцию генов, которые важны для продвижения по клеточному циклу.
Учитывая центральную роль, которую играют пути сигнальной трансдукции в клеточном росте, не удивительно, что многие виды рака возникают как результат мутаций и других изменений в компонентах сигнальной трансдукции, что приводит к неправильной активации путей клеточной пролиферации. Например, сверхэкспрессия или сверхактивность EGFR может быть связана с целым рядом раковых заболеваний, включая мультиформную глиобластому, рак толстой кишки и рак легкого. Это вызвало развитие противораковых видов терапии, направленных против EGFR, включая гефитиниб и эрлотиниб для лечения рака легкого и цетуксимаб для колоректального рака.
Цетуксимаб является примером ингибитора в виде моноклональных антител, которые связываются с внеклеточным лиганд-связывающим доменом EGFR, таким образом предотвращая связывание лигандов, активирующих EGFR-тирозинкиназу. В противоположность этому, гефитиниб и эрлотиниб представляют собой небольшие молекулы, ингибирующие EGFR-тирозинкиназу, расположенную внутри клетки. В отсутствие киназной активности, EGFR не может подвергаться аутофосфорилированию по остаткам тирозина, которое является предварительным условием для связывания ниже расположенных адапторных белков, таких как GRB2. В результате остановки (сбоя) сигнального каскада в клетках, рост которых зависит от этого пути, уменьшается опухолевая пролиферация и миграция.
Кроме того, другие исследования показали, что около 70% меланом человека и более мелкие фракции других опухолей имеют точечную мутацию (V599E) в гене Raf, приводящую к постоянной активации МАРК-пути (см., например, Davies et al., Nature, 417:949-954 (2002)). Такие результаты говорят о том, что мутации в определенных путях сигнальной трансдукции могут быть характерными для отдельных типов опухолей, и что такие специфические, измененные пути сигнальной трансдукции могут быть перспективными мишенями для химиотерапевтического вмешательства.
Принимая во внимание тот факт, что разные виды лечения рака, в частности химиотерапия рака, могут действовать или прямо или косвенно путем или блокировки или активации клеточных путей сигнальной трансдукции, вовлеченных в пролиферацию или смерть клетки, соответственно, активность данного пути сигнальной трансдукции в конкретной форме рака может служить в качестве подходящего индикатора эффективности разных видов лечения рака. Соответственно, в дополнение к удовлетворению других потребностей, настоящее изобретение предоставляет способы предсказания и оценки эффективности предполагаемой противоопухолевой терапии для отдельного пациента. По существу, настоящее изобретение предоставляет способы, помогающие врачу в выборе подходящей терапии рака в правильной дозе и в правильное время для каждого пациента.
Раскрытие изобретения
Настоящее изобретение предоставляет композиции и способы определения состояния (статуса) (например, уровней экспрессии и/или активации) компонентов путей сигнальной трансдукции в опухолевых клетках (например, клетках трижды негативного рака молочной железы). Сведения о состоянии экспрессии и/или активации компонентов путей сигнальной трансдукции, полученные из осуществления на практике настоящего изобретения, могут использоваться для диагностирования рака, прогноза и при планировании противоопухолевой терапии.
В определенных аспектах настоящее изобретение предоставляет молекулярные маркеры (биомаркеры), что способствует определению или предсказанию, может ли определенный вид рака реагировать или предположительно благоприятно реагировать на одно или более противоопухолевых средств, таких как, например, комбинация бевацизумаба (Авастина®), карбоплатина и паклитакселя (например, Абраксан® или nabP) ("триплетная терапия"). Как описывается здесь, было неожиданно обнаружено, что такие биомаркеры как VEGFR2, c-KIT, HER1 и IGF-1R являются особенно пригодными при определении или предсказании чувствительности, эффективности или ответа опухолевых клеток, таких как клетки трижды негативного рака молочной железы, на противоопухолевую терапию, например триплетную терапию.
В одном аспекте настоящее изобретение предоставляет способ определения чувствительности клеток трижды негативной опухоли к терапии противоопухолевым средством, причем способ включает:
(a) лизирование клеток опухоли для получения клеточного экстракта;
(b) определение уровня экспрессии VEGFR2, c-KIT, HER1 и/или IGF-1R в клеточном экстракте; и
(c) сравнение уровня экспрессии VEGFR2, c-KIT, HER1 и/или IGF-1R в клеточном экстракте, полученном на стадии (b) с эталонным уровнем экспрессии VEGFR2, c-KIT, HER1 и/или IGF-1R,
при этом наличие низкого уровня экспрессии VEGFR2, низкого уровня экспрессии c-KIT, высокого уровня экспрессии HER1 и/или низкого уровня экспрессии IGF-1R в клеточном экстракте по сравнению с эталонным уровнем экспрессии указывает, что клетка опухоли является чувствительной к противоопухолевому средству.
В некоторых вариантах осуществления способы настоящего изобретения могут быть полезны для облегчения или оказания содействия при определении или предсказании чувствительности клеток трижды негативной опухоли к терапии противоопухолевым средством. В других вариантах осуществления способы настоящего изобретения могут быть полезны для улучшения определения или предсказания чувствительности клеток трижды негативной опухоли к терапии противоопухолевым средством.
В другом аспекте настоящее изобретение предоставляет способ предсказания ответа трижды негативного рака молочной железы на терапию противоопухолевым средством, причем способ включает:
(a) лизирование опухолевых клеток, взятых от трижды негативной опухоли молочной железы, для получения клеточного экстракта;
(b) определение уровня экспрессии VEGFR2, c-KIT, HER1 и/или IGF-1R в клеточном экстракте; и
(c) сравнение уровня экспрессии VEGFR2, c-KIT, HER1 и/или IGF-1R в клеточном экстракте, полученном на стадии (b), с эталонным уровнем экспрессии VEGFR2, c-KIT, HER1 и/или IGF-1R,
при этом наличие низкого уровня экспрессии VEGFR2, низкого уровня экспрессии c-KIT, высокого уровня экспрессии HER1 и/или низкого уровня экспрессии IGF-1R в клеточном экстракте по сравнению с эталонным уровнем экспрессии предсказывает ответ на терапию противоопухолевым средством.
В некоторых вариантах осуществления способы настоящего изобретения могут быть полезны для облегчения или оказания содействия при определении или предсказании ответа трижды негативного рака молочной железы на терапию противоопухолевым средством. В других вариантах осуществления способы настоящего изобретения могут быть полезны для улучшения определения или предсказания ответа трижды негативного рака молочной железы на терапию противоопухолевым средством.
В дополнительном аспекте настоящее изобретение предоставляет способ контролирования ответа на терапию противоопухолевым средством у субъекта, имеющего трижды негативный рак молочной железы и получающего противоопухолевое средство, причем способ включает:
(a) лизирование опухолевых клеток, взятых от трижды негативной опухоли молочной железы, для получения клеточного экстракта;
(b) определение уровня экспрессии VEGFR2, c-KIT, HER1 и/или IGF-1R в клеточном экстракте;
(c) сравнение уровня экспрессии VEGFR2, c-KIT, HER1 и/или IGF-1R в клеточном экстракте, полученном на стадии (b), с эталонным уровнем экспрессии VEGFR2, с-К1Т, HER1 и/или IGF-1R или уровнем экспрессии VEGFR2, c-KIT, HER1 и/или IGF-1R во время терапии на более раннем сроке; и
(d) установление, должно ли продолжаться лечение противоопухолевым средством или его следует скорректировать, исходя из сравнения на стадии (с).
В некоторых вариантах осуществления способы настоящего изобретения могут быть полезны для облегчения или оказания содействия при контролировании ответа трижды негативного рака молочной железы на терапию противоопухолевым средством. В других вариантах осуществления, способы настоящего изобретения могут использоваться для улучшения контролирования ответа трижды негативного рака молочной железы на лечение противоопухолевым средством. В некоторых вариантах осуществления корректировка терапии на стадии (d) включает изменение последующей дозы противоопухолевого средства или выбор альтернативного противоопухолевого средства.
Другие цели, признаки и преимущества настоящего изобретения станут понятны квалифицированному специалисту в данной области техники из следующего подробного описания и фигур.
Краткое описание чертежей
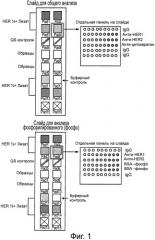
Фигура 1 показывает схему типичного чипа в формате слайда для исследования уровней общего и фосфорилированного HER1 и HER2.
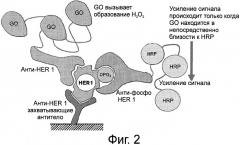
Фигура 2 представляет схему характерного метода анализа «сближения» для обнаружения фосфорилированного HER1. GO, глюкозоксидаза; HRP, пероксидаза хрена.
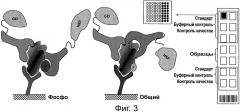
Фигура 3 представляет схему Совместного усиленного ферментом иммуноанализа (Collaborative Enzyme Enhanced Reactive ImmunoAssay (CEER)), также известного как иммуноанализ совместного «сближения» (Collaborative proximityJmmunoAssay (COPIA)). Когда белки-мишени связываются со специфическими захватывающими антителами, нанесенными на поверхность нитроцеллюлозы, после инкубирования с клеточным лизатом, несвязанные белки, не являющиеся мишенями, удаляются со слайда. Один вид детекторных антител к альтернативному эпитопу на "захваченном" белке-мишени является конъюгированным с GO. Связывание других конъюгированных с HRP детекторных антител, специфических к фосфорилированным сайтам на белке-мишени (Р), или другом неперекрывающемся эпитопе (р), завершает образование иммунокомплекса, необходимого для порождения сигнала и последующего усиления сигнала, опосредованного тирамидом, через «образование ферментного канала» GO-HRP в присутствии глюкозы. Захватывающие и детекторные антитела были выбраны таким образом, чтобы свести к минимуму конкуренцию между ними (т.е. все антитела могут одновременно связывать свой соответствующий эпитоп на белке сигнальной трансдукции).
Фигура 4 показывает титрационные кривые, полученные в результате CEER для ERBB2-T и ERBB2-P. Эти значения используются в качестве стандартов для получения количественных значений для клинических образцов.
Фигура 5 показывает определение t-ERBB2 в клетках ВТ474. Анализ ERBB2-CEER проводили с использованием клеточных лизатов, приготовленных из клеток ВТ474. Анализ полноразмерного p185-ERBB2 проводили на лизатах, содержащих ~25 ВТ474 клеток, а уровень t-ERBB2 был определен при исследовании клеточных лизатов, приготовленных из ~250 клеток ВТ474 после иммуномагнитного удаления p185-ERBB2.
Фигура 6 показывает экспрессию и фосфорилирование t-ERBB2s в опухолях пациентов. ERBB2, t-ERBB2, фосфорилированный t-ERBB2. Показан порядок размещения проб. CEER не только дает возможность различения экспрессии полноразмерного и укороченного ERBB2 в клинических образцах, но также предоставляет ценную информацию об уровне фосфорилирования в количественном выражении.
Фигура 7 показывает типичный пример IP-Вестерн анализа ERBB2 в клинических образцах. Для иммунопреципитации ERBB2 рецепторов использовали анти-ICD-ERBB2 антитела, а последующий Вестерн-блот-анализ был проведен с использованием вторичных анти-ICD-ERBB2 антител, чтобы различить полноразмерный t-ERBB2 от полноразмерного p185-ERBB2.
Фигура 8 показывает, что в 174 образцах ВСА наблюдалась экспрессия и активация разнообразных белков пути.
Фигура 9 показывает пример анализа профиля функционального пути с помощью CEER на образце пункционной биопсии трижды негативного рака молочной железы по сравнению с контрольными клетками рака молочной железы T47D и эндотелиальными клетками пупочной вены человека (HUVEC).
Фигура 10 показывает результаты сравнения выживаемости без прогрессирования (PFS) между группами образцов с «высоким» и «низким» значениями каждого маркера.
Фигура 11 показывает результаты другого сравнения PFS между группами образцов с «высоким» и «низким» значениями каждого маркера.
Фигура 12 показывает, что измерение уровней экспрессии и c-KIT и VEGFR2 увеличивает прогностическую ценность выяснения ответа на триплетную терапию при TNMBC.
Фигура 13 показывает, что измерение уровней экспрессии и VEGFR2 и HER1 увеличивает прогностическую ценность выяснения ответа на триплетную терапию при TNMBC.
Фигура 14 показывает корреляцию между увеличением уровней (А) общего VEGFR2, (В) общего c-KIT и (С) общего HER1 и ответом на триплетную терапию.
Фигуры и таблицы из РСТ публикации №WO 2010/132723 включаются путем отсылки полностью во всех смыслах.
Подробное описание изобретения
I. Введение
Как описано выше, активирование путей сигнальной трансдукции, вовлеченных в клеточную пролиферацию, и инактивирование путей, вовлеченных в клеточную смерть,
являются неограничивающими примерами молекулярных признаков, характеризующих различные типы рака. Во многих случаях активность определенных путей сигнальной трансдукции и их компонентов может служить «молекулярным портретом» данного типа рака. Подобные активированные компоненты могут дополнительно обеспечивать подходящие мишени для терапевтического вмешательства. Таким образом, знание уровня активности определенной системы сигнальной трансдукции в раковой клетке до, во время или после лечения дает врачу высокозначимую информацию, которую можно использовать для выбора соответствующего курса лечения. Более того, непрерывное контролирование путей сигнальной трансдукции, которые являются активными в раковых клетках, по мере продвижения лечения может предоставить врачу дополнительную информацию об эффективности лечения, побуждая врача или продолжать определенный курс лечения или переключиться на другой курс лечения, например, в том случае, когда раковые клетки становятся резистентными к лечению по причине дополнительных отклонений, которые активизируют или тот же самый или другой путь сигнальной трансдукции.
Соответственно, настоящее изобретение предоставляет способы и композиции для обнаружения состояния экспрессии и/или активации одной или некоторого количества не поддающихся регулированию молекул сигнальной трансдукции в опухолевой ткани или в неопухолевых клетках, таких как редкие циркулирующие клетки солидной опухоли, с помощью специфического мультиплексного высокопроизводительного анализа. Изобретение также предоставляет способы и композиции для выбора подходящей терапии (отдельных лекарственных средств или комбинаций лекарственных средств) с целью подавить или выключить не поддающийся регулированию сигнальный путь. Таким образом, изобретение может использоваться для облегчения планирования персонализированных методов лечения раковых пациентов.
В некоторых вариантах осуществления возможность обнаружить и распознать опухолевые клетки в кровотоке посредством определения активности путей сигнальной трансдукции на уровне одиночных клеток является важным преимуществом настоящего изобретения. Во многих случаях опухолевые клетки обнаруживаются в крови пациентов с ранними стадиями рака как "микрометастазы" (диссеминированные опухолевые клетки), а также при метастатических формах рака. Число опухолевых клеток в крови будет зависеть от стадии и типа опухоли. Как правило, на первичных опухолях биопсия всегда проводится, в то время как большинство метастатических опухолей не подвергается изучению с помощью биопсии, что делает молекулярный анализ таких опухолей очень трудным. В процессе метастазирования наиболее агрессивные опухолевые клеток покидают первичную опухоль и путешествуют по кровеносной и лимфатической системе до достижения отдаленного местоположения. Таким образом, циркулирующие опухолевые клетки из крови представляют собой самую агрессивную и однородную популяцию опухолевых клеток. Однако количество метастатических опухолевых клеток в крови часто является очень низким, варьируя от одной до нескольких тысяч клеток на миллилитр крови. Возможность выделить и проанализировать пути сигнальной трансдукции по таким редким клеткам и использовать эту информацию для более эффективного лечения рака является одной из целей настоящего изобретения.
В отдельных вариантах осуществления мультиплексный иммуноанализ с высокой пропускной способностью настоящего изобретения (например, Совместный усиленный ферментом иммуноанализ (CEER)), также известный как иммуноанализ совместного «сближения» (COPIA)) может обнаружить уровень экспрессии и/или активации одной или более молекул сигнальной трансдукции в клетках, полученных из опухолевой ткани (например, из образцов FNA), или в циркулирующих клетках солидной опухоли на уровне одиночной клетки. Фактически, молекулы сигнальной трансдукции, такие как EGFR, могут быть обнаружены с чувствительностью около 100 зептомолей и линейным динамическим диапазоном примерно от 100 зептомолей до 100 фемтомолей. По существу, обнаружение на уровне одиночной клетки уровней экспрессии и/или активации одного или нескольких сигнальных трансдукторов в опухолевых клетках облегчает прогнозирование и диагностику рака, а также разработку персонализированных, нацеленных методов лечения.
Что касается исследования рака молочной железы, существующие в настоящее время варианты тестирования являются неудовлетворительными, потому что лечение и первичных и метастатических опухолей у пациентов с раком молочной железы основывается на одноразовой диагностике по биопсийному образцу, взятому на ранней стадии болезни. В частности, терапевтическое вмешательство в отношении и ранних и метастатических стадий рака молочной железы основывается только на первоначальном диагнозе по биопсийному образцу, взятому на ранней стадии болезни, вследствие невозможности получения биопсийного образца от пациента с метастатическим раком. Однако опухоли молочной железы развиваются в зависимости от времени и лечения, так что контролирование с течением времени (временной мониторинг) опухолей молочной железы имеет решающее значение для оптимального ведения пациентов с раком молочной железы. Например, изменение состояния активации одной или более рецепторных тирозинкиназ из семейства ErbB (HER) может влиять на выбор терапии при рецидиве. Действительно, несоответствие в статусе HER-2 между первичным и метастатическим раком является обычным явлением, потому что примерно у 37% всех пациентов с раком молочной железы статус изменяется от HER-2-негативной первичной опухоли до HER-2-позитивного метастатического рака. В дополнение к этому, у пациентов может уже быть резистентность de novo или может развиться приобретенная резистентность к гормональной терапии вследствие активации HER-1 и/или HER-2. В некоторых случаях у пациентов может наблюдаться резистентность de novo или может развиться приобретенная резистентность к ErbB-таргентным видам терапии вследствие наличия опухолевых клеток, экспрессирующих p95HER-2. Существующим в настоящее время способам не хватает чувствительности и специфичности и они не могут использоваться для мониторинга пациентов во время терапии, кроме того, они не используют анализ профиля метаболического пути для проведения индивидуализированного лечения. В связи с этим существует неудовлетворенная клиническая потребность в методах анализа, оказывающих помощь клиницисту в назначении соответствующего лечения в оптимальное время.
В отличие от доступных в настоящее время средств тестирования рака молочной железы способы настоящего изобретения делают возможным мониторинг (контролирование) пациентов с раком молочной железы на протяжении всех стадий болезни путем обеспечения "биопсии в реальном времени" солидных опухолей молочной железы при использовании таких образцов, как тонкоигольные пунктаты (FNAs) из опухоли, и/или циркулирующих опухолевых клеток (CTCs) из крови. В качестве неограничивающего примера методы анализа рака молочной железы, описанные здесь, могут использоваться при постановке первоначального диагноза рака молочной железы у пациента на ранней стадии болезни. Выбор подходящей терапии рака руководствуется анализом профиля уровней экспрессии и/или активации одного или более специфических сигнальных путей в присутствии противоопухолевых средств или при их отсутствии с помощью методов одиночного обнаружения и двойного обнаружения «сближения» (например, CEER), описанных здесь. Кроме того, способы настоящего изобретения могут использоваться для того, чтобы контролировать прогрессирование и/или регрессию болезни, так как терапевтическое вмешательство может основываться на образцах, взятых на любой стадии болезни и проанализированных с помощью методов одиночного обнаружения и двойного обнаружения «сближения» (например, CEER), описанных здесь. По существу, предсказание, определение и/или выбор подходящих способов лечения ранних и метастатических стадий рака молочной железы руководствуется диагностикой в режиме реального времени и анализом статуса экспрессии и/или активации специфических молекул сигнальной трансдукции.
Способы настоящего изобретения специально направлены на решение ключевых проблем при лечении рака и обеспечивают более высокий стандарт лечения пациентов с раком молочной железы (например, пациентов с трижды негативным метастатическим раком молочной железы (TNMBC)), потому что они: (1) обеспечивают повышенную чувствительность (например, обнаружение отдельной клетки может достигаться обнаружением всех и/или фосфорилированных молекул сигнальной трансдукции, таких как HER1 (EGFR), VEGFR2 и/или c-KIT); (2) обеспечивают повышенную специфичность (например, анализ «сближения» трех антител повышает специфичность обнаружения всех и/или фосфорилированных молекул сигнальной трансдукции); (3) дают возможность анализа профиля метаболического пути (например, статус экспрессии и/или активации одной или более молекул сигнальной трансдукции может определяться в FNA или CTCs, полученных от пациентов); и (4) устраняют любые ограничения, связанные с получением образцов от пациента (например, анализ может проводиться на незначительном количестве опухолевых клеток). Несмотря на то, что в новых, описанных здесь методах анализа может использоваться любой образец, особенно пригодными являются CTCs, так как они представляют самые агрессивные опухолевые клетки, и известно, что каждая опухоль распространяет CTCs, причем они могут быть единственным источником резидуальных опухолей или труднодоступных метастатических опухолей и обнаруживаются в крови. По существу, в определенных вариантах осуществления способы настоящего изобретения делают возможным последовательное (серийное) взятие образцов тканей опухоли молочной железы, что дает в результате ценную информацию об изменениях, происходящих в опухолевых клетках в зависимости от времени и лечения, и предоставляет клиницистам средства контролирования быстро развивающегося заболевания.
Суммируя, способы настоящего изобретения преимущественно обеспечивают правильный выбор и мониторинг раковых пациентов (например, TNMBC пациентов), которые вероятнее всего получат пользу от таргентной терапии, посредством осуществления исследования метаболического профиля опухолевых клеток с помощью мультиплексного, основанного на антителах способа одиночного обнаружения или анализа «сближения».
II. Определения
При использовании в описании следующие термины имеют значения, приписанные им, если не указано иное.
Термин "рак" включает любую болезнь из класса болезней, характеризующихся неконтролируемым ростом аберрантных (отклоняющихся от нормы) клеток. Термин включает все известные виды рака и неопластические заболевания, характеризуются ли они как злокачественные, доброкачественные, мягких тканей, или солидные, и рак на всех стадиях, включая пред- и постметастатические стадии рака. Примеры разных типов рака включают, но не ограничиваются этим, рак молочной железы; рак легкого (например, немелкоклеточный рак легкого); рак желудочно-кишечного тракта и пищеварительной системы, такой как колоректальный рак, желудочно-кишечные стромальные опухоли, желудочно-кишечные карциноидные опухоли, рак толстой кишки, рак прямой кишки, рак анального канала, рак желчного протока, рак тонкого кишечника и рак желудка; рак пищевода; рак желчного пузыря; рак печени; рак поджелудочной железы; рак аппендикса; рак яичника; рак почки (например, почечно-клеточная карцинома); рак центральной нервной системы; рак кожи; лимфому; хориокарциному; рак головы и шеи; остеогенную саркому и рак крови. При использовании в описании "опухоль" включает одну или более раковых клеток. В одном предпочтительном варианте осуществления опухоль молочной железы происходит от субъекта с инвазивной формой или формой in situ протоковой карциномы или лобулярной (дольковой) карциномы. В другом предпочтительном варианте осуществления опухоль молочной железы происходит от субъекта с рецидивным или метастатическим раком молочной железы.
Термин "аналит" включает любую представляющую интерес молекулу, как правило, макромолекулу, такую как полипептид, присутствие которой, ее количество (уровень экспрессии), состояние активации и/или идентичность определяется. В некоторых случаях аналит является молекулой сигнальной трансдукции, например, такой как HER1 (EGFR), VEGFR2 или c-KIT.
Термин "молекула сигнальной трансдукции" или "сигнальный трансдуктор" включает белки и другие молекулы, осуществляющие процесс, с помощью которого клетка превращает внеклеточный сигнал или раздражитель (стимул) в ответ, как правило, включающий упорядоченные последовательности биохимических реакций внутри клетки. Примеры молекул сигнальной трансдукции включают, но не ограничиваются этим, рецепторные тирозинкиназы, такие как EGFR (например, EGFR/HERl/ErbB1, HER2/Neu/ErbB2, HER3/ErbB3, HER4/ErbB4), VEGFR1/FLT1, VEGFR2/FLK1/KDR, VEGFR3/FLT4, FLT3/FLK2, PDGFR (например, PDGFRA, PDGFRB), c-KIT/SCFR, INSR (инсулиновый рецептор), IGF-IR, IGF-IIR, IRR (рецептор, подобный инсулиновому рецептору), CSF-1R, FGFR 1-4, HGFR 1-2, CCK4, TRK A-C, c-MET, RON, EPHA 1-8, EPHB 1-6, AXL, MER, TYR03, TIE 1-2, ТЕК, RYK, DDR 1-2, RET, c-ROS, V-кадхерин, LTK (тирозинкиназу лейкоцитов), ALK (киназу анапластической лимфомы), ROR 1-2, MUSK, AATYK 1-3 и RTK 106; («укороченные» формы рецепторных тирозинкиназ, такие как «укороченные» рецепторы HER2 с отсутствующими амино-концевыми внеклеточными доменами (например, p95ErbB2 (p95m), р110, р95 с, p95n, и т.д.); димеры рецепторных тирозинкиназ (например, p95HER2/HER3, p95HER2/HER2, HER2/HER2, HER2/HER3, HER1/HER2, HER2/HER3, HER2/HER4 и т.д.); нерецепторные тирозинкиназы, такие как BCR-ABL, Src, Frk, Btk, Csk, Abl, Zap70, Fes/Fps, Fak, Jak, Ack и LIMK; компоненты сигнального тирозинкиназного каскада, такие как АКТ (например, AKT1, AKT2, AKT3), МЕК (МАР2К1), ERK2 (МАРК1), ERK1 (MAPK3), PI3K (например, PIK3CA (p110), PIK3R1 (р85)), PDK1, PDK2, гомолог фосфатазы и тензина (PTEN), SGK3, 4Е-ВР1, P70S6K (например, р70 S6 сплайс-вариант киназы альфа I), протеинтирозинфосфатазы (например, РТР1 В, PTPN13, BDP1 и т.д.), RAP, PLA2, MEKK, JNKK, JNK, р38, She (р66), Ras (например, K-Ras, N-Ras, H-Ras), Rho, Racl, Cdc42, PLC, PKC, p53j циклин D1, STAT1, STAT3, фосфатидилинозитол 4,5-бифосфат (P→IP2), фосфатидилинозитол 3,4,5-трифосфат (PIP3), mTOR, BAD, p21, p27, ROCK, IP3, TSP-1, NOS, GSK-3β, RSK 1-3, JNK, c-Jun, Rb, CREB, Ki67 и паксиллин; ядерные рецепторы гормонов, такие как рецептор эстрогена (ER), рецептор прогестерона (PR), андрогеновый рецептор, глюкокортикоидный рецептор, минералкортикоидный рецептор, рецептор витамина А, рецептор витамина D, ретиноидный рецептор, рецептор тиреоидного гормона и орфановые («сиротские») рецепторы; коактиваторы и репрессоры ядерных рецепторов, такие как амплифицированный в раке молочной железы рецептор коактиватора-1 (AIB1) и ядерный рецептор-корепрессор 1 (NCOR), соответственно; и их комбинации.
Термин "состояние активации" имеет в виду, что какая-либо отдельная молекула сигнальной трансдукции является активированной. Подобным образом, термин "уровень активации" относится к степени, в какой отдельная молекула сигнальной трансдукции является активированной. Состояние или уровень активации в большинстве случаев соответствует статусу фосфорилирования, убиквитинирования и/или комплексообразования или уровню одной или более (например, множества) молекул сигнальной трансдукции. Неограничивающие примеры состояний активации (перечисленные в скобках) включают: HER 1 /EGFR (EGFRvIII, фосфорилированный (р-) EGFR, EGFR:She, убиквитинированнный (u-) EGFR, p-EGFRvIII); ErbB2 (p-ErbB2, p95HER2 («укороченный» ErbB2), p-p95HER2, ErbB2:Shc, ErbB2:PI3K, ErbB2:EGFR, ErbB2:ErbB3, ErbB2:ErbB4); ErbB3 (p-ErbB3, ErbB3:PI3K, p-ErbB3:PI3K, ErbB3:Shc); ErbB4 (p-ErbB4, ErbB4:Shc); c-MET (p-c-MET, c-Met:HGF комплекс); AKT1 (p-AKTl); AKT2 (p-AKT2); AKT3 (p-AKT3); PTEN (p-PTEN); P70S6K (p-P70S6K); MEK (p-MEK); ERK1 (p-ERKl); ERK2 (p-ERK2); PDK1 (p-PDK1); PDK2 (p-PDK2); SGK3 (p-SGK3); 4E-BP1 (p-4E-BP1); PIK3R1 (p-PIK3R1); c-KIT (p-c-KIT); ER (p-ER); IGF-1R (p-IGF-1R, IGF-1R:IRS, IRS:PI3K, p-IRS, IGF-1R:PI3K); INSR (p-INSR); FLT3 (p-FLT3); HGFR1 (p-HGFR1); HGFR2 (p-HGFR2); RET (p-RET); PDGFRA (p-PDGFRA); PDGFRB (p-PDGFRB); VEGFR1 (p-VEGFRl, VEGFR1:PLCγ, VEGFR1:Src); VEGFR2 (p-VEGFR2, VEGFR2:PLCγ, VEGFR2:Src, VEGFR2:гепарин сульфат, VEGFR2:VE-кадхерин); VEGFR3 (p-VEGFR3); FGFR1 (p-FGFR1); FGFR2 (p-FGFR2); FGFR3 (p-FGFR3); FGFR4 (p-FGFR4); TIE1 (p-TIE1); TIE2 (p-TIE2); EPHA (p-EPHA); EPHB (p-EPHB); GSK-3β (p-GSK-3β); NFKB (p-NFKB), 1KB (p-IKB, p-P65:IKB); BAD (p-BAD, BAD: 14-3-3); mTOR (p-mTOR); Rsk-1 (p-Rsk-1); Jnk (p-Jnk); P38 (p-P38); STAT1 (p-STATl); STAT3 (p-STAT3); FAK (p-FAK); RB (p-RB); Ki67; р53 (р-р53); CREB (p-CREB); c-Jun (p-c-Jun); c-Src (p-c-Src); паксиллин (р-паксиллин); GRB2 (p-GRB2), She (p-Shc), Ras (p-Ras), GAB1 (p-GABl), SHP2 (p-SHP2), GRB2 (p-GRB2), CRKL (p-CRKL), PLCγ (p-PLCγ), PKC (например, p-PKCα, p-PKCβ, p-PKCδ), аддуцин (р-аддуцин), RBI (p-RBl) и PYK2 (p-PYK2).
При использовании в описании термин "серийное разведение" включает последовательность уменьшающихся концентраций отдельного образца (например, клеточного лизата) или реагента (например, антитела). Как правило, серийное разведение получают путем смешивания измеренного количества образца или реагента в исходной концентрации с разбавителем (например, буфером для разбавления) для получения более низкой концентрации образца или реагента, и повторения этого процесса достаточное количество раз, чтобы получить желаемое количество последовательных разведений. Образец или реагент может быть последовательно разбавлен, по меньшей мере, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25, 30, 35, 40, 45, 50, 100, 500 или 1000 раз для получения серийного разведения, содержащего, по меньшей мере, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 25, 30, 35, 40, 45 или 50 уменьшающихся концентраций образца или реагента. Например, 2-кратное серийное разведение захватывающего антитела при исходной концентрации 1 мг/мл можно получить, смешав некоторое количество исходной концентрации захватывающего антитела с равным количеством буфера для разведения, чтобы получить концентрацию захватывающего антитела 0,5 мг/мл, и повторяя этот процесс, чтобы получить концентрации захватывающего антитела 0,25 мг/мл, 0,125 мг/мл, 0,0625 мг/мл, 0,0325 мг/мл и т.д.
Термин "высший динамический диапазон" при использовании в описании относится к способности метода анализа определять отдельный аналит как минимум в одной клетке или вплоть до тысяч клеток. Например, описанные здесь методы иммуноанализа, обладают высшим динамическим диапазоном, так как преимущественно с их помощью можно обнаружить отдельную интересующую молекулу сигнальной трансдукции примерно в количестве клеток от 1 до 10000 (например, около 1,5, 10, 25, 50, 75, 100, 250, 500, 750, 1000, 2500, 5000, 7500 или 10000 клеток) при использовании серийного разведения концентраций захватывающего антитела.
Термин "образец" при использовании в описании включает любой биологический образец, взятый у пациента. Образцы включают, без ограничения, цельную кровь, плазму, сыворотку, красные клетки крови (эритроциты), белые клетки крови (например, мононуклеарные клетки периферической крови), смывную жидкость протоков, аспират из соска, лимфу (например, диссеминированные опухолевые клетки лимфатического узла), пунктат костного мозга, слюну, мочу, стул (т.е. кал), мокроту, смыв из бронхов, слезную жидкость, тонкоигольный аспират (например, собранный с помощью периареолярной тонкоигольной аспирационной биопсии), любую другую жидкость организма, образец ткани (например, опухолевой ткани), такой как биопсийный образец опухоли (например, образец, полученный с помощью пункционной биопсии) или лимфатического узла (например, образец биопсии сигнального лимфатического узла), образец ткани (например, опухолевой ткани), например, полученной при хирургическом удалении опухоли, и клеточные экстракты. В некоторых вариантах осуществления образец представляет собой образец цельной крови или ее фракционного компонента, такого как плазма, сыворотка или клеточный осадок. В некоторых случаях образец получают путем выделения циркулирующих клеток солидной опухоли из цельной крови или ее клеточной фракции с помощью любого метода, известного в данной области техники. В других вариантах осуществления образец представляет собой зафиксированный в формалине и залитый парафином (FFPE) образец опухолевой ткани, например, из солидной опухоли молочной железы.
"Биопсия" относится к процессу извлечения образца ткани с целью диагностической или прогностической оценки и к самому образцу ткани. В отношении способов и композиций настоящего изобретения может применяться любой метод биопсии, известный в данной области техники. Используемый метод биопсии, в числе прочих факторов, будет зависеть от типа ткани, которую нужно оценить, размера и типа опухоли (т.е. солидная или суспензионная (т.е. кровь или асцит)). Типичные методы биопсии включают эксцизионную биопсию, инцизионную биопсию, пункционную биопсию (например, толстоигольную биопсию, тон