Способ предпосевной обработки патологического материала для выделения нокардиоформных актиномицетов
Иллюстрации
Показать всеИзобретение относится к санитарной микробиологии и может быть использовано при лабораторных исследованиях. Способ предпосевной обработки патологического материала для выделения нокардиоформных актиномицетов предусматривает измельчение патологического материала с последующим смешиванием с дезинфекционным средством "Септустин" в концентрации 0,1% в объемном соотношении 1:2 в течение 180 минут при комнатной температуре с последующей двукратной в течение 15 минут отмывкой стерильным физиологическим раствором. 4 табл., 5 пр.
Реферат
Изобретение относится к бактериологическим исследованиям, касается способа обработки патологического материала и может быть использовано для выделения нокардиоформных актиномицетов. Способ основан на предпосевной обработке патологического материала и посеве на питательные среды.
По современной классификации микроорганизмов в группе 22 (нокардиоформные актиномицеты) определены роды Nocardia и Rhodococcus [1].
Роды Nocardia и Rhodococcus (нокардиоформные актиномицеты), также как роды Corynebacteriwn и Mycobacterium, имеют клеточные стенки IV типа, содержащие в составе клеточной стенки миколовые кислоты, общие антигены, обладают кислотоустойчивостью в различной степени и другими общими признаками. Близкий состав и структура химических компонентов обусловливает не менее близкие биологические свойства. Исследованиями по гибридизации ДНК-РНК установлено близкое генетическое родство быстрорастущих микобактерий, нокардий и родококков, а коэффициент SAB M.phlei и R. spp. настолько высок (0,72), что их характеризуют как отдаленно родственные виды.
Результативность бактериологического исследования во многом зависит от предварительной обработки патологического материала.
В практике микробиологических лабораторий в настоящее время для предпосевной обработки патологического материала для выявления микобактерий используют растворы серной (А.Ф. Коржинская, 1926; К.К. Креслинг, 1929; А.Н. Маккавейская, 1956, метод А.П. Аликаевой, 1971), соляной (Ю.А. Юденич, 1928), щавелевой кислот (метод Гона, Левенштейна-Сумиоши), едкого натра (метод флотации О.В. Мартова, 1971), гипохлорита кальция и других растворов [2, 3]. К недостаткам перечисленных способов следует отнести губительное действие кислот и щелочей на нокардиоформные актиномицеты, коринебактерии и слабокислотоустойчивые микобактерии.
Цель изобретения - способ обработки патологического материала для выделения нокардиоформных актиномицетов (нокардий и родококков).
Поставленная цель достигается предпосевной обработкой патологического материала дезинфекционным средством «Септустин».
Дезинфекционное средство «Септустин» (изготовитель ООО «Уралстинол БИО», Россия) рекомендовано для дезинфекции объектов ветеринарного надзора. Данный препарат из группы катионных ПАВ содержит в качестве дезинфицирующего вещества катамин АБ, а также спирт изопропиловый, неионогенное ПАВ, гидрокарбонат натрия и бромфеноловый синий [4], обладает широким спектром действия в отношении возбудителей инфекционных болезней бактериальной (включая туберкулез), вирусной и грибковой этиологии.
Сущность способа заключается в предпосевной обработке патологического материала водным раствором дезинфекционного средства "Септустин" в концентрации 0,1% смешиванием в объемном соотношении 1:2 в течение 180 минут при комнатной температуре с последующей двукратной в течение 15 минут отмывкой стерильным физиологическим раствором.
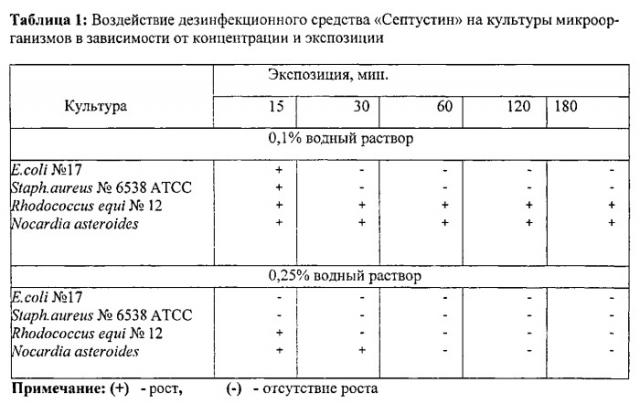
Пример 1. Воздействие дезинфекционного средства «Септустин» в зависимости от концентрации и экспозиции определяли на культурах микроорганизмов, полученных из ГИСК им. Л.А. Тарасевича и выделенных из патологического материала (Rhodococcus equi №12). Результаты представлены в таблице 1.
Как видно из таблицы 1, 0,1% водный раствор дезинфекционного средства «Септустин» при экспозиции 15 минут оказывал бактерицидное действие на все микроорганизмы, при увеличении экспозиции до 30 минут - на E.coli и Staph. aureus, а при увеличении концентрации до 0,25% и при экспозиции 30 минут - на Rhodococcus equi. Бактерицидное действие дезинфекционного средства «Септустин» на все нокардиоформные актиномицеты отмечено при концентрации 0,25% и экспозиции 60 минут.
Пример 2. Биоматериал (печень, селезенка, легкие, почки, сердце) от белых мышей, зараженных культурой R. equi, измельчали в стерильной ступке стерильными ножницами, кусочки заливали раствором дезинфекционного средства «Септустин» 0,1, и 0,25% концентрации в объемном соотношении 1:2 и оставляли на 15, 30, 60, 120 и 180 минут при комнатной температуре. Затем сливали надосадочную жидкость и промывали стерильным физиологическим раствором дважды в течение 15 минут, хорошо перемешивали и сливали, а кусочки растирали песком стерильным пестиком. Полученную суспензию засевали на питательную среду Левенштейна-Иенсена, посевы инкубировали 15 дней при +37°С. Учет результатов проводили ежедневно. Результаты представлены в таблице 2.
Пример 3. Провели культуральное исследование патологического материала (кусочки органов с характерными для туберкулеза изменениями) от коров с положительной реакцией на ППД-туберкулин для млекопитающих из хозяйства, благополучного по туберкулезу. Патологический материал измельчали в стерильной ступке стерильными ножницами, кусочки заливали раствором дезинфекционного средства «Септустин» 0,1% концентрации в объемном соотношении 1:2 и оставляли на 180 минут при комнатной температуре. Затем сливали надосадочную жидкость и промывали стерильным физиологическим раствором дважды в течение 15 минут, хорошо перемешивали и сливали, а кусочки растирали песком стерильным пестиком. Из полученной суспензии производили посевы на питательную среду Левенштейна-Йенсена и помещали в термостат. На вторые сутки выращивания при температуре +37°С отмечали рост в виде крупных слизистых без поверхностного мицелия беловато-желтых колоний. В мазках при окраске по Цилю-Нильсену выявили некислотоустойчивые микроорганизмы, клетки полиморфные - палочки и кокки, которые идентифицировали методом газожидкостной хроматографии (выраженный пик туберкулостеариновой кислоты, низкомолекулярные эфиры жирных кислот с числом углеродных атомов от 12 до 20 и отсутствие высокомолекулярных миколовых кислот) как родококки.
Пример 4. Провели культуральное исследование патологического материала (лимфатические узлы, печени, легкие) от морских свинок, зараженных Nocardia asteroides. Патологический материал измельчали в стерильной ступке стерильными ножницами, кусочки заливали раствором дезинфекционного средства «Септустин» 0,1, 0,25 и 0,5% концентрации в объемном соотношении 1:2 и оставляли на 30, 60, 120 и 180 минут при комнатной температуре. Затем сливали надосадочную жидкость и промывали стерильным физиологическим раствором дважды в течение 15 минут, хорошо перемешивали и сливали, а кусочки растирали песком стерильным пестиком. Полученную суспензию засевали на питательную среду Левенштейна-Йенсена и инкубировали при +37°С. Учет результатов проводили ежедневно. Первичный рост отмечали через 3-4 дня. Результаты представлены в таблице 3.
Пример 5. Провели культуральное исследование биоматериала (брыжеечные, заглоточные, подчелюстные, лимфатические узлы, печени, легкие) от пяти коров с положительной реакцией на ППД-туберкулин для млекопитающих способом в соответствии с изобретением. При просматривании посевов учитывали выделение культур и чистоту посевов. В качестве контроля выбран метод А.П. Аликаевой. Результаты представлены в таблице 4.
Как видно из таблицы 4, оптимальные показатели (выявляемость нокардиоформных актиномицетов, % пророста) отмечались при предпосевной обработке патологического материала водным раствором дезинфекционного средства «Септустин» 0,1% концентрации с экспозицией 180 минут. При увеличении концентрации и экспозиции нокардиоформные актимециты не выявлялись. При предпосевной обработке по А.П. Аликаевой (1971) нокардиоформные актиномицеты не выявлялись.
Проведенные исследования подтвердили, что обработка патологического материала водным раствором дезинфекционного средства «Септустин» 0,1% концентрации с экспозицией 180 минут сдерживает развитие посторонней микрофлоры (споровых палочковидных форм, плесневых грибков), повышает эффективность очистки, снижает вероятность проростов посторонней микрофлоры, не влияет на интенсивность и характер роста нокардиоформных актиномицетов, что свидетельствует об отсутствии подавляющего действия дезинфекционного средства при заявленных параметрах.
Источники информации
1. Хоулт Д. и др. Определитель бактерий Берджи. 2 тома. - М.: Мир, 1967.
2. Должанский В.М. и др. Современные методы лабораторной диагностики туберкулеза: Метод. рекомендации. - М., 1992.
3. Кассич Ю.Я. Туберкулез животных и меры борьбы с ним. - Киев, 1990.
4. Наставление по применению препарата «Септустин» для дезинфекции объектов ветнадзора. Уралстинол. - БИО. - 2002.
Способ предпосевной обработки патологического материала для выделения нокардиоформных актиномицетов, включающий воздействие дезинфекционным средством, отличающийся тем, что в качестве дезинфекционного средства используют дезинфекционное средство «Септустин», причем обработку проводят смешиванием водного раствора дезинфекционного средства «Септустин» концентрацией 0,1% и патологического материала в объемном соотношении 1:2 в течение 180 минут при комнатной температуре с последующей двукратной в течение 15 минут отмывкой стерильным физиологическим раствором.