Введение антисмысловых олигонуклеотидов, комплементарных человеческому аполипопротеину в
Иллюстрации
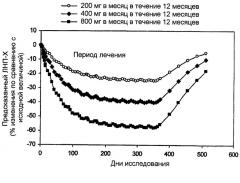
Показать всеИзобретение относится к области биотехнологии, конкретно к использованию антисмыслового олигонуклеотида ISIS 301012 для долгосрочного понижения уровней АроВ, и может быть использовано в медицине. Способ предусматривает введение субъекту ISIS 301012 в составе фармацевтической композиции, путем введения ISIS 301012 в фазе индукции в дозе 210 мг в неделю в течение по меньшей мере 13 недель, с последующей поддерживающей фазой, во время которой вводят ISIS 301012 в дозе 210 мг в неделю в течение такого периода времени, который является необходимым, эффективным и/или переносимым. При этом каждая индукционная доза и каждая поддерживающая доза независимо включают более двух инъекций. Изобретение позволяет ослабить побочные эффекты терапии, а именно уменьшить эритему в месте введения препарата. 13 з.п. ф-лы, 3 ил., 21 табл., 8 пр.
Реферат
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к композициям и способам понижения ЛНП-холестерина и лечения состояний, связанных с повышенными уровнями холестерина. Более конкретно, изобретение относится к композициям и способам ингибирования экспрессии аполипопротеина В в печени.
УРОВЕНЬ ТЕХНИКИ
Коронарная болезнь сердца (CHD) является главной причиной смерти в Соединенных Штатах в течение более ста лет, а осложнения атеросклероза представляют собой наиболее распространенные причины смерти в западном сообществе (Knopp, New Engl. J. Medicine, 1999, 341, 498-511; Davis and Hui, Arterioscler. Thromb. Vasc. Biol., 2001, 21, 887-898; Bonow, Circulation, 2002, 106, 3140-3141). Повышенные уровни холестерина липопротеинов низкой плотности (ЛНП-холестерина) повсеместно признаны в качестве фактора риска CHD. Однако, несмотря на фармакологическое вмешательство, многие субъекты не способны понизить уровни ЛНП-холестерина.
Руководство, касающееся лечения, понижающего уровень липидов, было разработано национальной обучающей программой по холестерину для лечения взрослых людей III (NCEP) в 2001 г. Модификации указанного руководства были рекомендованы координационным комитетом NCEP в 2004 г. и включали в себя более агрессивные цели лечения (Grundy et al., Circulation, 2004, 110, 227-239). Указанное руководство определяет 3 категории риска больших коронарных событий и желательные уровни ЛНП-холестерина. Наибольшему риску подвержены субъекты с CHD или эквивалентом риска CHD, и они должны поддерживать уровень ЛНП-холестерина ниже 100 мг/дл. Последнее руководство NCEP рекомендует субъектам с очень высоким риском CHD применять медикаментозную терапию для достижения уровней ЛНП-холестерина ниже 70 мг/дл. Субъектов с эквивалентом CHD определяют как субъектов с диабетом, заболеванием периферических сосудов, аневризмой брюшного отдела аорты, заболеванием сонных артерий с симптоматикой, а также как субъектов с множественными факторами риска, которые создают 10-летний риск CHD более 20%. Во вторую категорию входят субъекты с умеренным риском CHD, которые имеют множество (2 или более) факторов риска, и для которых 10-летний риск CHD составляет 20%; целью является уровень ЛНП-холестерина ниже 130 мг/дл. Самые последние рекомендации включают в себя терапевтический выбор для понижения уровней ЛНП-холестерина до величин менее 100 мг/дл для категории субъектов с умеренным риском. Третья категория включает в себя субъектов с 0-1 фактором риска, а целью является уровень ЛНП-холестерина ниже 160 мг/дл. Факторы риска включают в себя возраст, курение, гипертензию, низкий уровень ЛВП-холестерина и семейный анамнез CHD. Медикаментозное лечение следует начинать, когда уровень ЛНП-холестерина в сыворотке крови остается на уровне выше 130, 160 и 190 мг/дл в 3 группах риска, соответственно, невзирая на изменения образа жизни в терапевтических целях (Grundy et al., Circulation, 2004, 110, 227-239).
Липопротеины низкой плотности представляют собой один из пяти обширных классов липопротеинов, который включает в себя следующее: хиломикроны, ответственные за транспорт поступающих с пищей жиров из тонкого кишечника в ткани; липопротеины очень низкой плотности (ЛОНП); липопротеины промежуточной плотности (ЛПП); липопротеины низкой плотности (ЛНП); все названные агенты транспортируют триацилглицериды и холестерин из печени в ткани; и липопротеины высокой плотности (ЛВП), которые транспортируют эндогенный холестерин из тканей в печень. Частицы липопротеинов претерпевают непрерывный метаболический процессинг и имеют изменяющиеся свойства и составы. Белковые компоненты липопротеинов известны как аполипопротеины. По меньшей мере девять аполипопротеинов, одним из которых является аполипопротеин В, распределяются в значительных количествах среди различных человеческих липопротеинов.
Аполипопротеин В (известный также как ApoB, аполипопротеин В-100; ApoB-100, аполипопротеин В-48; ApoB-48 и антиген Ag(x)) представляет собой большой гликопротеин, принимающий участие в сборке и секреции жиров и в транспорте и опосредованном рецепторами захвате и доставке различных классов липопротеинов. Аполипопротеин В выполняет ряд функций, включая всасывание и процессинг жиров, поступающих с пищей, а также регуляцию уровней циркулирующих липопротеинов (Davidson and Shelness, Annu. Rev. Nutr., 2000, 20, 169-193). У млекопитающих существуют две формы аполипопротеина В. ApoB-100 представляет белок полной длины, содержащий 4536 аминокислотных остатков, синтезированный, главным образом, в печени человека (Davidson and Shelness, Annu. Rev. Nutr., 2000, 20, 169-193). Усеченная форма, известная как аpoB-48, является коллинеарной концевым 2152 аминокислотным остаткам, и синтезируется в тонком кишечнике всех млекопитающих (Davidson and Shelness, Annu. Rev. Nutr., 2000, 20, 169-193). У людей аpoB-48 циркулирует в ассоциации с хиломикронами и остатками хиломикронов, а указанные частицы устраняются отдельным рецептором, известным как белок, связанный с рецептором ЛНП-холестерина (Davidson and Shelness, Annu. Rev. Nutr., 2000, 20, 169-193). ApoB-48 можно рассматривать как приспособление, посредством которого жир, поступающий с пищей, доставляется из тонкого кишечника в печень, в то время как аpoB-100 участвует в транспорте и доставке холестерина (Davidson and Shelness, Annu. Rev. Nutr., 2000, 20, 169-193). ApoB является главным белковым компонентом ЛНП-холестерина и содержит домен, требующийся для взаимодействия указанного вида липопротеинов с рецептором ЛНП. Помимо этого, ApoB содержит неспаренный остаток цистеина, который опосредует взаимодействие с аполипопротеином (а) и генерирует липопротеин (а) или ЛП(а), другой липопротеин, обладающий атерогенным потенциалом (Davidson and Shelness, Annu. Rev. Nutr., 2000, 20, 169-193). Повышенные уровни липопротеина ЛП(а), содержащего ApoB, связаны с повышенным риском атеросклероза и его проявлений, которые могут включать в себя гиперхолестеринемию (Seed et al., N. Engl. J. Med., 1990, 322, 1494-1499), инфаркт миокарда (Sandkamp et al., Clin. Chem., 1990, 36, 20-23) и тромбоз (Nowak-Gottl et al., Pediatrics, 1997, 99, E11).
Аполипопротеин В участвует в гомеостазе холестерина, а его чрезмерная выработка связана с различными заболеваниями, включая наследственную гиперхолестеринемию, наследственный дефектный АроВ и наследственную комбинированную гиперхолестеринемию (Kane and Havel, The Metabolic and Molecular Bases of Inherited Diseases, 2001, 8-е издание, 2717-2751). Нарушения метаболизма АроВ, которые соответствуют повышенному риску CHD, также наблюдаются при диабете и ожирении (Grundy, Am. J. Cardiol., 1998, 81, 18B-25B; Chan et al., Diabetes, 2002, 51, 2377- 2386; Chan et al., Metabolism, 2002, 51, 1041-1046). Помимо этого, генетические исследования на мышах продемонстрировали корреляцию между повышенными уровнями аполипопротеина В, повышенными уровнями холестерина и атеросклерозом (Kim and Young, J. Lipid Res., 1998, 39, 703-723; Nishina et al., J. Lipid Res., 1990, 31, 859-869).
При изучении субъектов с наследственной гипобеталипопротеинемией (FHBL) было установлено, что у указанных субъектов наблюдается пониженные уровни аполипопротеина В в сыворотке, пониженные уровни ЛНП-холестерина в сыворотке и пониженная частота ишемической болезни сердца (Schonfeld et al., J. Lipid Res., 2003, 44, 878-883). Исследования на мышах показали, что у мышей, имеющих гетерозиготные дефициты аполипопротеина В, наблюдались пониженные уровни ЛНП-холестерина и аполипопротеина В, и, помимо этого, они были защищены от гиперхолестеринемии, вызванной пищей (Farese et al., Proc. Natl. Acad. Sci. USA, 1995, 92, 1774-1778).
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В первом аспекте настоящее изобретение относится к способам, включающим в себя введение субъекту фармацевтической композиции, включающей в себя антисмысловой олигонуклеотид, комплементарный нуклеиновой кислоте, кодирующей человеческий аполипопротеин В-100, в которых введение включает в себя фазу индукции, во время которой вводят дозу антисмыслового олигонуклеотида в пределах 100-300 мг один раз в неделю в течение по меньшей мере 13 недель, с последующей поддерживающей фазой, во время которой вводят дозу антисмыслового олигонуклеотида в пределах 80-200 мг один раз в неделю или один раз в две недели в течение такого периода времени, который является необходимым, эффективным и/или переносимым.
В некоторых вариантах осуществления настоящего изобретения доза, которую вводят во время фазы индукции, составляет 100 мг, а доза, которую вводят во время поддерживающей фазы, составляет 200 мг один раз в неделю. В некоторых вариантах осуществления настоящего изобретения доза, которую вводят во время фазы индукции, составляет 200 мг, а доза, которую вводят во время поддерживающей фазы, составляет 300 мг один раз в неделю. В некоторых вариантах осуществления настоящего изобретения доза, которую вводят во время фазы индукции, составляет 100 мг, а доза, которую вводят во время поддерживающей фазы, составляет 200 мг один раз в неделю, и переносимость или эффективность антисмыслового олигонуклеотида оценивают во время или в конце периода индукции или его части один раз в неделю во время поддерживающей фазы. В некоторых вариантах осуществления настоящего изобретения доза, которую вводят во время фазы индукции, составляет 200 мг, а доза, которую вводят во время поддерживающей фазы, составляет 300 мг один раз в неделю, и переносимость или эффективность антисмыслового олигонуклеотида оценивают во время или в конце периода индукции или его части.
В некоторых вариантах осуществления настоящего изобретения доза, которую вводят во время фазы индукции, составляет 100 мг, а доза, которую вводят во время поддерживающей фазы, составляет 100 мг один раз в две недели, и переносимость или эффективность антисмыслового олигонуклеотида оценивают во время или в конце периода индукции или его части. В некоторых вариантах осуществления настоящего изобретения доза, которую вводят во время фазы индукции, составляет 200 мг, а доза, которую вводят во время поддерживающей фазы, составляет 200 мг один раз в две недели, и переносимость или эффективность антисмыслового олигонуклеотида оценивают во время или в конце периода индукции или его части. В некоторых вариантах осуществления настоящего изобретения доза, которую вводят во время фазы индукции, составляет от 100 мг до 200 мг, а доза, которую вводят во время поддерживающей фазы, составляет от 200 мг до 300 мг один раз в неделю.
В некоторых вариантах осуществления настоящего изобретения указанное введение включает в себя парентеральное введение. В некоторых вариантах осуществления настоящего изобретения указанное парентеральное введение включает в себя подкожное введение. В некоторых вариантах осуществления настоящего изобретения каждая индукционная доза и каждая поддерживающая доза включают в себя однократную инъекцию. В некоторых вариантах осуществления настоящего изобретения каждая индукционная доза и каждая поддерживающая доза включают в себя две или более инъекции. В некоторых вариантах осуществления настоящего изобретения способы дополнительно включают в себя оценку переносимости или эффективности антисмыслового олигонуклеотида во время или в конце периода индукции или его части. В некоторых вариантах осуществления настоящего изобретения оценивают переносимость и эффективность антисмыслового олигонуклеотида.
В некоторых вариантах осуществления настоящего изобретения переносимость антисмыслового олигонуклеотида оценивают путем мониторинга концентрации АроВ в плазме крови указанного субъекта. В некоторых вариантах осуществления настоящего изобретения переносимость антисмыслового олигонуклеотида оценивают путем мониторинга скорости уменьшения концентрации АроВ и концентрации АроВ в плазме крови указанного субъекта. В некоторых вариантах осуществления настоящего изобретения переносимость антисмыслового олигонуклеотида оценивают путем мониторинга концентраций АЛТ в печени субъекта. В некоторых вариантах осуществления настоящего изобретения переносимость антисмыслового олигонуклеотида оценивают путем мониторинга концентраций АНТ в печени субъекта. В некоторых вариантах осуществления настоящего изобретения переносимость антисмыслового олигонуклеотида оценивают путем мониторинга концентраций билирубина в плазме крови субъекта.
В некоторых вариантах осуществления настоящего изобретения скорость уменьшения концентрации АроВ более приблизительно 30 мг/дл в день указывает, что субъект не переносит введение антисмыслового олигонуклеотида. В некоторых вариантах осуществления настоящего изобретения концентрация АроВ менее приблизительно 60 мг/дл указывает, что субъект не переносит введение антисмыслового олигонуклеотида. В некоторых вариантах осуществления настоящего изобретения скорость уменьшения концентрации АроВ более приблизительно 30 мг/дл в день и концентрация АроВ менее приблизительно 60 мг/дл указывает, что субъект не переносит введение антисмыслового олигонуклеотида. В некоторых вариантах осуществления настоящего изобретения дозу антисмыслового олигонуклеотида уменьшают, после того, как было показано, что введение указанного антисмыслового олигонуклеотида не переносится. В некоторых вариантах осуществления настоящего изобретения частоту введения антисмыслового олигонуклеотида уменьшают, после того, как было показано, что введение указанного антисмыслового олигонуклеотида не переносится. В некоторых вариантах осуществления настоящего изобретения дозу антисмыслового олигонуклеотида увеличивают, после того, как было показано, что введение указанного антисмыслового олигонуклеотида переносится. В некоторых вариантах осуществления настоящего изобретения частоту введения антисмыслового олигонуклеотида увеличивают, после того, как было показано, что введение указанного антисмыслового олигонуклеотида переносится.
В некоторых вариантах осуществления настоящего изобретения эффективность антисмыслового олигонуклеотида оценивают путем мониторинга концентрации АроВ, ЛНП-Х, ЛОНП-Х, ЛПП-Х, не-ЛВП-Х, триглицеридов сыворотки, триглицеридов печени, ЛП(а), окси-ЛНП-Х или малых плотных частиц ЛНП в плазме крови указанного субъекта. В некоторых вариантах осуществления настоящего изобретения уменьшение концентрации АроВ, ЛНП-Х, ЛОНП-Х, ЛПП-Х, не-ЛВП-Х, триглицеридов сыворотки, триглицеридов печени, ЛП(а), окси-ЛНП-Х или малых плотных частиц ЛНП указывает, что антисмысловой олигонуклеотид является эффективным. В некоторых вариантах осуществления настоящего изобретения дозу антисмыслового олигонуклеотида уменьшают, после того, как было показано, что введение указанного антисмыслового олигонуклеотида является эффективным. В некоторых вариантах осуществления настоящего изобретения дозу антисмыслового олигонуклеотида увеличивают, после того, как было показано, что введение указанного антисмыслового олигонуклеотида не является эффективным. В некоторых вариантах осуществления настоящего изобретения частоту введения антисмыслового олигонуклеотида уменьшают, после того, как было показано, что введение указанного антисмыслового олигонуклеотида является эффективным. В некоторых вариантах осуществления настоящего изобретения частоту введения антисмыслового олигонуклеотида увеличивают, после того, как было показано, что введение указанного антисмыслового олигонуклеотида не является эффективным.
В некоторых вариантах осуществления настоящего изобретения указанный субъект имеет повышенный АроВ до указанного введения. В некоторых вариантах осуществления настоящего изобретения указанный субъект имеет повышенный холестерин до указанного введения. В некоторых вариантах осуществления настоящего изобретения указанный повышенный холестерин выбран из повышенного общего холестерина, повышенного ЛНП-холестерина, повышенного ЛОНП-холестерина, повышенного ЛПП-холестерина или повышенного не-ЛВП-холестерина до указанного введения. В некоторых вариантах осуществления настоящего изобретения указанный субъект имеет повышенный ЛП(а) до указанного введения. В некоторых вариантах осуществления настоящего изобретения указанный субъект имеет повышенные триглицериды сыворотки до указанного введения. В некоторых вариантах осуществления настоящего изобретения указанный субъект имеет повышенные триглицериды печени до указанного введения. В некоторых вариантах осуществления настоящего изобретения указанный субъект имеет повышенные уровни малых плотных частиц ЛНП до указанного введения.
В некоторых вариантах осуществления настоящего изобретения указанный субъект имеет гиперхолестеринемию. В некоторых вариантах осуществления настоящего изобретения указанный субъект имеет полигенную гиперхолестеринемию. В некоторых вариантах осуществления настоящего изобретения указанный субъект имеет наследственную гиперхолестеринемию. В некоторых вариантах осуществления настоящего изобретения указанный субъект имеет гомозиготную наследственную гиперхолестеринемию. В некоторых вариантах осуществления настоящего изобретения указанный субъект имеет гетерозиготную наследственную гиперхолестеринемию. В некоторых вариантах осуществления настоящего изобретения указанный субъект имеет смешанную дислипидемию. В некоторых вариантах осуществления настоящего изобретения указанный субъект имеет коронарную болезнь в анамнезе.
В некоторых вариантах осуществления настоящего изобретения указанный субъект имеет один или более факторов риска коронарной болезни. В некоторых вариантах осуществления настоящего изобретения указанный один или более факторов риска выбраны из возраста, курения, гипертензии, низкого уровня ЛВП-холестерина и семейного анамнеза ранней CHD. В некоторых вариантах осуществления настоящего изобретения указанный субъект имеет диабет II типа с дислипидемией. В некоторых вариантах осуществления настоящего изобретения указанного субъекта лечили статином. В некоторых вариантах осуществления настоящего изобретения у указанного субъекта лечение статином не достигло своей мишени - ЛНП-холестерина. В некоторых вариантах осуществления настоящего изобретения указанный субъект не выполнял рекомендованное лечение. В некоторых вариантах осуществления настоящего изобретения у указанного субъекта имели место побочные эффекты лечения статином. В некоторых вариантах осуществления настоящего изобретения указанный субъект имеет низкую активность рецепторов ЛНП. В некоторых вариантах осуществления настоящего изобретения у указанного субъекта лечение, понижающее уровень липидов, не достигло своей мишени - ЛНП-холестерина.
В некоторых вариантах осуществления настоящего изобретения указанная поддерживающая фаза включает в себя введение указанной фармацевтической композиции на протяжении всей жизни субъекта. В некоторых вариантах осуществления настоящего изобретения продолжительность указанной поддерживающей фазы составляет один год, 2 года, 3 года, 4 года, 5 лет, 6 лет, 7 лет, 8 лет, 9 лет, 10 лет, 11 лет, 12 лет, 13 лет, 14 лет, 15 лет, 16 лет, 17 лет, 18 лет, 19 лет или 20 лет. В некоторых вариантах осуществления настоящего изобретения продолжительность указанной поддерживающей фазы составляет от одной недели до двадцати лет.
В некоторых вариантах осуществления настоящего изобретения доза, которую вводят во время фазы индукции, составляет 100 мг. В некоторых вариантах осуществления настоящего изобретения доза, которую вводят во время фазы индукции, составляет 200 мг. В некоторых вариантах осуществления настоящего изобретения доза, которую вводят во время фазы индукции, составляет 300 мг. В некоторых вариантах осуществления настоящего изобретения доза, которую вводят во время поддерживающей фазы, составляет 100 мг. В некоторых вариантах осуществления настоящего изобретения доза, которую вводят во время поддерживающей фазы, составляет 200 мг.
В некоторых вариантах осуществления настоящего изобретения указанное введение указанной фармацевтической композиции обеспечивает минимальные уровни антисмыслового олигонуклеотида в плазме крови от 5 до 100 нг/мл. В некоторых вариантах осуществления настоящего изобретения указанное введение указанной фармацевтической композиции обеспечивает минимальные уровни антисмыслового олигонуклеотида в плазме крови от 5 до 50 нг/мл. В некоторых вариантах осуществления настоящего изобретения указанное введение указанной фармацевтической композиции обеспечивает минимальные уровни антисмыслового олигонуклеотида в плазме крови от 10 до 40 нг/мл. В некоторых вариантах осуществления настоящего изобретения указанное введение указанной фармацевтической композиции обеспечивает минимальные уровни антисмыслового олигонуклеотида в плазме крови от 15 до 35 нг/мл. В некоторых вариантах осуществления настоящего изобретения указанное введение указанной фармацевтической композиции обеспечивает минимальные уровни антисмыслового олигонуклеотида в плазме крови от 20 до 30 нг/мл.
В некоторых вариантах осуществления настоящего изобретения указанное введение указанной фармацевтической композиции обеспечивает понижение АроВ по меньшей мере на 10%. В некоторых вариантах осуществления настоящего изобретения указанное понижение АроВ составляет по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95% или по меньшей мере 100%. В некоторых вариантах осуществления настоящего изобретения указанное понижение АроВ составляет от 10% до 80%, от 20% до 70%, от 30% до 60% или от 30% до 70%.
В некоторых вариантах осуществления настоящего изобретения указанное введение указанной фармацевтической композиции обеспечивает понижение ЛНП-холестерина по меньшей мере на 10%. В некоторых вариантах осуществления настоящего изобретения указанное понижение ЛНП-холестерина составляет по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95% или по меньшей мере 100%. В некоторых вариантах осуществления настоящего изобретения указанное введение указанной фармацевтической композиции обеспечивает понижение ЛОНП-холестерина по меньшей мере на 10%. В некоторых вариантах осуществления настоящего изобретения указанное понижение ЛОНП-холестерина составляет по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95% или по меньшей мере 100%.
В некоторых вариантах осуществления настоящего изобретения указанное введение указанной фармацевтической композиции обеспечивает понижение ЛП(а) по меньшей мере на 10%. В некоторых вариантах осуществления настоящего изобретения указанное понижение ЛП(а) составляет по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95% или по меньшей мере 100%. В некоторых вариантах осуществления настоящего изобретения указанное введение указанной фармацевтической композиции обеспечивает понижение малых частиц ЛНП по меньшей мере на 10%. В некоторых вариантах осуществления настоящего изобретения указанное понижение малых частиц ЛНП составляет по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95% или по меньшей мере 100%.
В некоторых вариантах осуществления настоящего изобретения указанное введение указанной фармацевтической композиции обеспечивает понижение не-ЛВП-холестерина по меньшей мере на 10%. В некоторых вариантах осуществления настоящего изобретения указанное понижение не-ЛВП-холестерина составляет по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95% или по меньшей мере 100%.
В некоторых вариантах осуществления настоящего изобретения указанное введение указанной фармацевтической композиции обеспечивает уменьшение риска коронарной болезни у субъекта. В некоторых вариантах осуществления настоящего изобретения указанное введение указанной фармацевтической композиции замедляет или останавливает прогрессирование атеросклероза у субъекта. В некоторых вариантах осуществления настоящего изобретения указанное введение указанной фармацевтической композиции уменьшает риск развития атеросклероза у субъекта. В некоторых вариантах осуществления настоящего изобретения указанное введение указанной фармацевтической композиции обеспечивает улучшение исхода сердечно-сосудистой патологии у субъекта. В некоторых вариантах осуществления настоящего изобретения указанное улучшение исхода сердечно-сосудистой патологии представляет собой уменьшение риска больших сердечно-сосудистых неблагоприятных событий у субъекта. В некоторых вариантах осуществления настоящего изобретения указанное улучшение исхода сердечно-сосудистой патологии представляет собой улучшение толщины интимальной средней оболочки сонных артерий. В некоторых вариантах осуществления настоящего изобретения указанное улучшение исхода сердечно-сосудистой патологии представляет собой улучшение толщины атеромы. В некоторых вариантах осуществления настоящего изобретения указанное улучшение исхода сердечно-сосудистой патологии представляет собой повышение ЛВП-холестерина.
В некоторых вариантах осуществления настоящего изобретения указанное введение обеспечивает понижение уровня липидов. В некоторых вариантах осуществления настоящего изобретения указанное введение обеспечивает понижение ЛНП-холестерина, триглицеридов или малых частиц ЛНП-холестерина или их комбинаций. В некоторых вариантах осуществления настоящего изобретения указанное введение обеспечивает улучшенное соотношение ЛНП/ЛВП. В некоторых вариантах осуществления настоящего изобретения указанное введение обеспечивает повышение уровня ЛВП-холестерина по меньшей мере на 10%. В некоторых вариантах осуществления настоящего изобретения указанное повышение уровня ЛВП-холестерина составляет по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95% или по меньшей мере 100%. В некоторых вариантах осуществления настоящего изобретения указанное введение указанной фармацевтической композиции обеспечивает понижение уровня триглицеридов печени по меньшей мере на 10%.
В некоторых вариантах осуществления настоящего изобретения указанное понижение уровня триглицеридов печени составляет по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95% или по меньшей мере 100%. В некоторых вариантах осуществления настоящего изобретения указанное введение указанной фармацевтической композиции обеспечивает понижение уровня сложного эфира холестерина печени по меньшей мере на 10%. В некоторых вариантах осуществления настоящего изобретения указанное понижение уровня сложного эфира холестерина печени составляет по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95% или по меньшей мере 100%.
В некоторых вариантах осуществления настоящего изобретения способы дополнительно включают в себя совместное введение указанной фармацевтической композиции и по меньшей мере одного дополнительного лекарственного средства. В некоторых вариантах осуществления настоящего изобретения указанное совместное введение является одновременным. В некоторых вариантах осуществления настоящего изобретения указанную фармацевтическую композицию вводят до введения указанного дополнительного лекарственного средства. Способ по п. 100, в котором указанную фармацевтическую композицию вводят после введения указанного дополнительного лекарственного средства. В некоторых вариантах осуществления настоящего изобретения интервал между введением указанной фармацевтической композиции и указанного дополнительного лекарственного средства составляет приблизительно один час, приблизительно 2 часа, приблизительно 3 часа, приблизительно 4 часа, приблизительно 5 часов, приблизительно 6 часов, приблизительно 7 часов, приблизительно 8 часов, приблизительно 9 часов, приблизительно 10 часов, приблизительно 11 часов или приблизительно 12 часов. В некоторых вариантах осуществления настоящего изобретения интервал между введением указанной фармацевтической композиции и указанного дополнительного лекарственного средства составляет приблизительно 1 день, приблизительно 1 неделю, приблизительно 2 недели, приблизительно 3 недели, приблизительно 4 недели, приблизительно 5 недель, приблизительно 6 недель, приблизительно 7 недель, приблизительно 8 недель, приблизительно 9 недель, приблизительно 10 недель, приблизительно 11 недель или приблизительно 12 недель. В некоторых вариантах осуществления настоящего изобретения интервал между введением указанной фармацевтической композиции и указанного дополнительного лекарственного средства составляет приблизительно 1 месяц, приблизительно 2 месяца, приблизительно 3 месяца, приблизительно 4 месяца, приблизительно 5 месяцев или приблизительно 6 месяцев.
В некоторых вариантах осуществления настоящего изобретения способ дополнительно включает в себя введение одного дополнительного лекарственного средства. В некоторых вариантах осуществления настоящего изобретения способ дополнительно включает в себя введение 2 или более дополнительных лекарственных средств. В некоторых вариантах осуществления настоящего изобретения указанное дополнительное лекарственное средство представляет собой лекарственное средство, понижающее уровень липидов. В некоторых вариантах осуществления настоящего изобретения указанное дополнительное средство лечения, понижающее уровень липидов, представляет собой изменение образа жизни в терапевтических целях. В некоторых вариантах осуществления настоящего изобретения указанное дополнительное лекарственное средство, понижающее уровень липидов, представляет собой ингибитор HMG-CoA-редуктазы. В некоторых вариантах осуществления настоящего изобретения ингибитор HMG-CoA-редуктазы выбран из аторвастатина, розувастатина или симвастатина. В некоторых вариантах осуществления настоящего изобретения указанное дополнительное лекарственное средство, понижающее уровень липидов, представляет собой ингибитор всасывания холестерина. В некоторых вариантах осуществления настоящего изобретения ингибитор всасывания холестерина представляет собой эзетимиб. В некоторых вариантах осуществления настоящего изобретения указанные 2 или более дополнительных лекарственных средств включают в себя ингибитор HMG-CoA-редуктазы и ингибитор всасывания холестерина. В некоторых вариантах осуществления настоящего изобретения ингибитор HMG-CoA-редуктазы представляет собой симвастатин, а указанный ингибитор всасывания холестерина представляет собой эзетимиб. В некоторых вариантах осуществления настоящего изобретения указанное дополнительное средство лечения, понижающее уровень липидов, представляет собой аферез ЛНП. В некоторых вариантах осуществления настоящего изобретения указанное введение указанного дополнительного лекарственного средства включает в себя внутривенное лечение. В некоторых вариантах осуществления настоящего изобретения указанное дополнительное лекарственное средство, понижающее уровень липидов, представляет собой ингибитор МТР.
В некоторых вариантах осуществления настоящего изобретения указанная фармацевтическая композиция включает в себя фармацевтически приемлемый наполнитель. В некоторых вариантах осуществления настоящего изобретения указанный фармацевтически приемлемый наполнитель представляет собой физиологический раствор. В некоторых вариантах осуществления настоящего изобретения дозу антисмыслового олигонуклеотида вводят в концентрации приблизительно 50 мг/мл, приблизительно 75 мг/мл, приблизительно 100 мг/мл, приблизительно 125 мг/мл, приблизительно 150 мг/мл, приблизительно 175 мг/мл, приблизительно 200 мг/мл, приблизительно 225 мг/мл или приблизительно 250 мг/мл.
В некоторых вариантах осуществления настоящего изобретения антисмысловой олигонуклеотид включает в себя по меньшей мере одну модифицированную сахарную часть. В некоторых вариантах осуществления настоящего изобретения модифицированная сахарная часть включает в себя 2'-метоксиэтильную сахарную часть. В некоторых вариантах осуществления настоящего изобретения модифицированная сахарная часть включает в себя сахарную часть бициклической нуклеиновой кислоты.
В некоторых вариантах осуществления настоящего изобретения антисмысловой олигонуклеотид включает в себя 2'-дезоксинуклеотидный гэп-сегмент, расположенный между сегментами-ветвями, в котором каждый нуклеотид сегментов-ветвей включает в себя модифицированную сахарную часть. В некоторых вариантах осуществления настоящего изобретения каждый нуклеотид сегмента-ветви включает в себя 2'-О-метоксиэтильную сахарную часть. В некоторых вариантах осуществления настоящего изобретения каждый нуклеотид сегмента-ветви включает в себя сахарную часть бициклической нуклеиновой кислоты. В некоторых вариантах осуществления настоящего изобретения гэп-сегмент включает в себя десять нуклеотидов, а каждый сегмент-ветвь включает в себя пять нуклеотидов.
В некоторых вариантах осуществления настоящего изобретения по меньшей мере одна межнуклеозидная связь представляет собой фосфортиоатную межнуклеозидную связь. В некоторых вариантах осуществления настоящего изобретения каждая межнуклеозидная связь представляет собой фосфортиоатную межнуклеозидную связь.
В некоторых вариантах осуществления настоящего изобретения по меньшей мере один цитозин представляет собой 5-метилцитозин. В некоторых вариантах осуществления настоящего изобретения каждый цитозин представляет собой 5-метилцитозин.
В некоторых вариантах осуществления настоящего изобретения антисмысловой олигонуклеотид является по меньшей мере на 90% комплементарным нуклеиновой кислоте, кодирующей человеческий АроВ. В некоторых вариантах осуществления настоящего изобретения антисмысловой олигонуклеотид является по меньшей мере на 95% комплементарным нуклеиновой кислоте, кодирующей человеческий АроВ. В некоторых вариантах осуществления настоящего изобретения антисмысловой олигонуклеотид является на 100% комплементарным нуклеиновой кислоте, кодирующей человеческий АроВ.
В некоторых вариантах осуществления настоящего изобретения нуклеиновая кислота, кодирующая человеческий АроВ, включает в себя последовательность, идентифицированную инвентарным номером NM_000384.1.
В некоторых вариантах осуществления настоящего изобретения антисмысловой олигонуклеотид включает в себя от 12 до 30 нуклеотидов. В некоторых вариантах осуществления настоящего изобретения антисмысло