Антибактериальные средства на основе четвертичных аммониевых солей
Иллюстрации
Показать всеИзобретение относится к новым производным пиридоксина общей формулы (I), обладающим высокой антибактериальной активностью.
где при R1+R2=-С(СН3)2-, R3+R4=-CH2N+(C8H17)2CH2-, n=1, X=Cl, m=0,
при R1=R2=Η, R3+R4=-CH2N+(C8H17)2CH2-, n=1, Χ=Cl, m=1,
при R1+R2=-С(СН3)2-, R3=R4=CH2N+(CH3)2C8H17, n=2, Χ=Cl, m=0,
при R1=R2=Η, R3+R4=CH2N+(CH3)2C8H17, n=2, X=Cl, m=1,
при R1+R2=-C(CH3)2-, R3=CH2OH, R4=CH2N+(CH3)2C8H17, n=1, X=Br, m=0,
при R1+R2=-C(CH3)2-, R3=CH2OH, R4=CH2N+(CH3)2C18H37, n=1, X=Br, m=0,
при R1=R2=H, R3=CH2OH, R4=CH2N+(CH3)2C8H17, n=1, X=Br, m=1,
при R1=R2=H, R3=CH2OH, R4=CH2N+(CH3)2C18H37, n=1, X=Br, m=1,
при R1+R2=-C(CH3)2-, R3=CH2N+(CH3)2C8H17, R4=Η, n=1, X=Cl, m=0,
при R1+R2=-C(CH3)2-, R3=CH2N+(CH3)2C18H37, R4=Η, n=1, X=Cl, m=0,
при R1=R2=R4=H, R3=CH2N+(CH3)2C8H17, n=1, X=Cl, m=1,
при R1=R2=R4=H, R3=CH2N+(CH3)2C18H37, n=1, X=Cl, m=1.
Изобретение может найти применение в медицине и ветеринарии. 1.з.п. ф-лы, 1 табл., 12 пр.
Реферат
Изобретение относится к химии органических гетероциклических соединений, а именно к новым четвертичным аммониевым солям, содержащим фрагмент пиридоксина общей формулы (I), проявляющим антибактериальные свойства. Соединения могут найти применение в медицине и ветеринарии.
где
при R1+R2=-С(СН3)2-, R3+R4=-CH2N+(C8H17)2CH2-, n=1, Χ=Cl, m=0,
при R1=R2=H, R3+R4=-CH2N+(C8H17)2CH2-, n=1, X=Cl, m=1,
при R1+R2=-C(CH3)2-, R3=R4=CH2N+(CH3)2C8H17, n=2, X=Cl, m=0,
при R1=R2=H, R3+R4=CH2N+(CH3)2C8H17, n=2, X=Cl, m=1,
при R1+R2=-C(CH3)2-, R3=CH2OH, R4=CH2N+(CH3)2C8H17, n=1, X=Br, m=0,
при R1+R2=-C(CH3)2-, R3=CH2OH, R4=CH2N+(CH3)2C18H37, n=1, X=Br, m=0,
при R1=R2=H, R3=CH2OH, R4=CH2N+(CH3)2C8H17, n=1, X=Br, m=1,
при R1=R2=H, R3=CH2OH, R4=CH2N+(СН3)2С18Н37, n=1, Χ=Br, m=1,
при R1+R2=-C(CH3)2-, R3=CH2N+(CH3)2C8H17, R4=Η, n=1, X=Cl, m=0,
при R1+R2=-C(CH3)2-, R3=CH2N+(СН3)2С18Н37, R4=Η, n=1, Χ=Cl, m=0,
при R1=R2=R4=Η, R3=CH2N+(CH3)2C8H17, n=1, X=Cl, m=1,
при R1=R2=R4=Η, R3=CH2N+(CH3)2C18H37, n=1, X=Cl, m=1.
Поиск и направленный синтез высокоэффективных и безопасных противомикробных агентов является одной из первостепенных задач современной фармакологии и медицинской химии. В последние годы наблюдается заметный рост числа и распространенности инфекционных заболеваний, обусловленных появлением новых высокопатогенных штаммов микроорганизмов и повышением их резистентности к существующим антибиотикам и антисептическим средствам.
Четвертичные аммониевые соединения (ЧАС) являются одним из важнейших классов антисептических средств и имеют широкую область применения, в частности, в терапии местных гнойно-воспалительных процессов, в дезинфекции неповрежденной кожи перед операциями, консервировании глазных капель, инъекционных растворов, зубных паст, косметических средств, дезинфекции и очистке поверхностей. Современные ЧАС характеризуются широким спектром антимикробной активности по отношению к грамположительным и грамотрицательным микроорганизмам, а также грибам. Механизм антибактериального действия ЧАС заключается в их адсорбции и проникновении через клеточную стенку бактерий с последующим взаимодействием с фосфолипидами цитоплазматической мембраны, что приводит к полной структурной дезорганизации и последующей гибели бактериальной клетки.
Недостатками используемых ЧАС являются неэффективность в отношении спор и простых вирусов, а также недостаточная активность по отношению к грамотрицательным бактериям и микобактериям.
Среди лекарственных препаратов, содержащих фрагменты четвертичных аммониевых солей, следует выделить:
Мирамистин ((бензилдиметил[3-(миристоиламино)пропил]-аммонийхлорид моногидрат) - разработанный в СССР антисептик, обладающий широким спектром бактерицидного действия в отношении грамположительных (Staphylococcus spp., Streptococcus spp., Streptococcus pneumoniae и др.), грамотрицательных (Pseudomonas aeruginosa, Escherichia coli, Klebsiella spp. и др.), аэробных и анаэробных бактерий, патогенных грибов и вирусов, включая клинические штаммы с полирезистентностью к антибиотикам. Применяется в профилактике нагноений и лечении гнойных ран, лечении и профилактике кандидозов кожи и слизистых оболочек, комплексном лечении острых и хронических отитов, лечении и профилактике инфекционно-воспалительных заболеваний полости рта (стоматитов, гингивитов, пародонтитов, периодонтитов), индивидуальной профилактике заболеваний, передаваемых половым путем (сифилиса, гонореи, хламидиоза, генитального герпеса и др.).
Флуомизин (хлорид деквалиния) - антисептик широкого спектра действия, активен в отношении большинства грамположительных бактерий Streptococcus spp., Staphylococcus aureus, Listeria spp.; анаэробов Peptostreptococcus (группы D), грибов рода Candida (Candida tropicalis, Candida albicans, Candida glabrata), грамотрицательных бактерий Gardnerella vaginalis, Escherichia coli, Serratia spp., Klebsiella spp., Pseudomonas spp., Proteus spp., и простейших (Trichomonas vaginalis). Используется при бактериальном вагинозе, кандидозе кожи, ногтевых валиков, слизистой оболочки полости рта, воспалительных процессах в полости рта и глотки (тонзиллит, стоматит, в т.ч. афтозный, глоссит, фарингит).
Бензалкония хлорид (алкилдиметил(фенилметил) аммония хлорид) - антисептическое средство активное в отношении грамположительных (Staphylococcus spp., Streptococcus spp., Streptococcus pneumoniae и др.), грамотрицательных (Pseudomonas aeruginosa, Escherichia coli, Klebsiella spp. и др.) и анаэробных бактерий, грибов и плесеней. Применяется при первичной и первично-отсроченной обработке ран, профилактике вторичного инфицирования ран госпитальными штаммами микроорганизмов, бактериальном вагинозе, дренировании костных полостей после операции при остеомиелите.
Следует отметить, что описанные выше лекарственные препараты, по мнению заявителя, не могут рассматриваться в качестве аналогов к заявленному техническому решению вследствие того, что они не совпадают с заявляемыми соединениями по химической структуре, хотя и обладают антибактериальной активностью (совпадают по назначению), сопоставимой с заявленным техническим решением в большей или меньшей степени.
Задачей изобретения являются новые соединения, обладающие высокой антибактериальной активностью, расширяющие арсенал известных средств указанного назначения.
Техническим результатом заявленного изобретения является получение новых соединений общей формулы (I), содержащих в своем составе как фрагмент природного соединения (пиридоксина, входящего в группу витамина В6), так и четвертичный аммониевый фрагмент.
Задача решается, и указанный технический результат достигается получением заявляемых новых производных пиридоксина общей формулы (I):
согласно нижеприведенным схемам 1-3, где заявляемые соединения обозначены номерами I-1 - I-12.
Характеристики новых соединений приведены далее в примерах конкретного выполнения. Структуры полученных соединений подтверждены методами 1Н и 13С ЯМР-спектроскопии и масс-спектрометрии. Спектры ЯМР регистрировали на приборе Bruker AVANCE-400. Химический сдвиг определялся относительно сигналов остаточных протонов дейтерированных растворителей (1Н и 13С). Температуры плавления определялись с помощью прибора Stanford Research Systems МРА-100 OptiMelt. Контроль за ходом реакций и чистотой соединений проводили методом ТСХ на пластинах Sorbfil Plates.
HRMS-эксперимент был проведен с использованием масс-спектрометра TripleTOF 5600, АВ Sciex (Германия) из раствора в метаноле методом ионизации - турбоионный спрей (TIS) - при энергии столкновения с молекулами азота 10 еВ.
Примеры конкретного выполнения заявленного технического решения
Пример 1
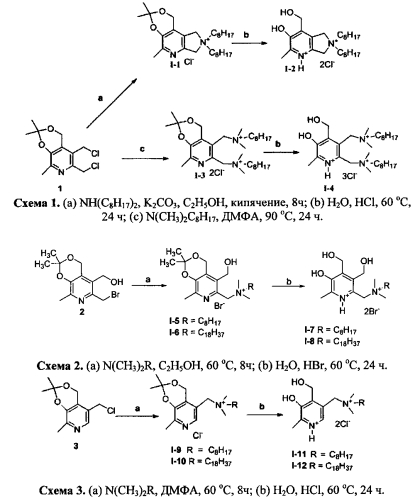
3,3,5-Триметил-8,8-диоктил-1,7,8,9-тетрагидро-[1,3]диоксино[5,4-d]пирроло[3,4-b]пиридин-8-иум хлорид (I-1)
К соединению 1 [M.V. Pugachev, N.V. Shtyrlin, E.V. Nikitina, LP. Sysoeva, T.I. Abdullin, A.G. Iksanova, A.A. Ilaeva, E.A. Berdnikov, R.Z. Musin, Yu.G. Shtyrlin. Synthesis and antibacterial activity of novel phosphonium salts on the basis of pyridoxine. Bioorg. Med. Chem. 2013, 21, 14, 4388-4395] (700 мг, 2.53 ммоль) в этиловом спирте добавляли ди-н-октиламин (0.763 мл, 2.53 ммоль) и К2СО3 (350 мг, 2.53 ммоль). Реакционную смесь перемешивали при кипячении в течение 8 часов. Растворитель отгоняли в вакууме. Далее полученный остаток растворяли в хлороформе, нерастворимый остаток отфильтровывали. Фильтрат отгоняли в вакууме. Маслянистый остаток кипятили в гексане 1 ч, после чего растворитель декантировали. Выход 93% (1126 мг); желтое маслообразное вещество. Спектр 1Н ЯМР (CDCl3) δ, м.д.: 0.83 (т, 6Н, 3JHH=6.8 Гц, 2СН3С7Н14), 1.21-1.35 (м, 20Н, СН2), 1.52 (с, 6Н, 2СН3), 1.60-1.76 (м, 4Н, 2СН2), 2.35 (с, 3Н, СН3), 3.70-3.79 (м, 4Н, 2CH2N+), 4.66 (с, 2Н, СН2), 4.87 (с, 2Н, СН2), 5.44 (с, 2Н, CH2N+). Спектр 13С {1Н} ЯМР (CDCl3) δ, м.д.: 14.10 (с, СН3С7Н14), 18.69 (с, СН3), 22.61 (с, СН2), 23.85 (с, СН2), 24.91 (с, С(СН3)2), 26.44 (с, СН2), 29.07 (с, СН2), 29.16 (с, СН2), 31.66 (с, СН2), 58.78 (с, CH2O), 63.24 (с, CH2N+), 66.05 (с, CH2N+) 66.16 (с, CH2N+), 68.21 (с, CH3N+), 101.06 (с, С(СН3)), 120.97 (с, CPyr), 123.24 (с, CPyr), 141.52 (с, CPyr), 146.87 (с, CPyr), 150.05 (с, CPur). Масс-спектр (HRMS-ESI): Найдено [М-Cl]+ 445.3794. Вычислено для [C28H49N2O2]+ 445.3789.
Пример 2
6,6-Диоктил-3-гидрокси-4-гидроксиметил-2-метил-6,7-дигидро-5Н-пирроло[3,4-b]пиридиний дихлорид (I-2)
К соединению 1-1 (100 мг, 0.21 ммоль) в 30 мл воды и 5 мл метанола добавляли 1 мл конц. HCl. Реакционную смесь перемешивали в течение 24 часов при температуре 60°С. Растворитель отгоняли в вакууме. Выход количественный (99 мг); желтое маслообразное вещество. Спектр 1Н ЯМР (ДМСО-d6) δ, м.д.: 0.85 (т, 6H, 3JHH=6.7 Гц, 2CH3C7H14 1.24-1.25 (м, 20Н, СН2), 1.60 (уш.с, 4Н, 2СН2), 2.46 (с, 3Н, СН3), 3.48-3.53 (м, 4Н, 2CH2N+), 4.68 (с, 2Н, СН2), 4.82 (с, 2Н, СН2), 5.08 (с, 2Н, СН2). Спектр 13С {1H} ЯМР (ДМСО-d6) δ, м.д.: 13.95 (с, CH3C7H14), 18.42 (с, СН3), 22.04 (с, СН2), 22.64 (с, СН2), 25.79 (с, СН2), 28.36 (с, СН2), 28.48 (с, СН2), 31.14 (с, СН2), 57.38 (с, CH2O), 62.64 (с, CH2N+), 64.34 (с, CH2N+), 66.14 (с, CH2N+), 125.22 (с, CPyr), 131.63 (с, CPyr), 142.29 (с, CPyr), 146.29 (с, CPyr), 148.44 (с, CPyr). Масс-спектр (HRMS-ESI): Найдено [М-2Cl-Н]+ 405.3581. Вычислено для [C25H45N2O2]+ 405.3476.
Пример 3
N,N-((2,2,8-триметил-4Н-[1,3]диоксино[4,5-с]пиридин-5,6-диил)бис(метилен))бис(N,N-диметилоктан-1-аминий) дихлорид (I-3)
К соединению 1 (300 мг, 1.08 ммоль) в 30 мл ДМФА добавили Ν,Ν-диметилоктиламин (0.446 мл, 2.16 ммоль). Реакционную смесь перемешивали в течение 8 часов при температуре 90°С. Растворитель отгоняли в вакууме. Полученный остаток перекристализовывали из смеси ацетонгдиэтиловый эфир (10:1). Выход 42% (269 мг); белое кристаллическое вещество; т.пл. 134-135°С (разл.). Спектр 1Н ЯМР (CDCl3) δ, м.д.: 0.81 (т, 3Н, 3JHH=7.2 Гц, CH3C7H14), 0.83 (т, 3Н, 3JHH=7.2 Гц, CH3C7H14), 1.18-1.30 (м, 20Н, 10СН2), 1.50 (с, 3Н, СН3), 1.54 (с, 3Н, СН3), 1.68-2.01 (м, 4Н, 2СН2), 2.39 (с, 3Н, СН3), 3.18 (с, 6Н, 2CH3N+), 3.36 (с, 3Н, CH3N+), 3.42-3.45 (м, 2Н, CH2N+), 3.53 (с, 3Н, CH3N+), 3.74-3.84 (м, 2Н, CH2N+), 4.81, 5.64 (АВ-система, 2Н, 2JHH=-13.2 Гц, СН2), 5.04, 5.46 (АВ-система, 2Н, 2JHH=-16.8 Гц, СН2), 5.04, 5.76 (АВ-система, 2Н, 2JHH=-13.6 Гц, СН2). Спектр 130{1Η} ЯМР (ДМСО-d6) δ, м.д.: 14.11 (с, СН3), 19.04 (с, СН3), 22.61 (с, СН2), 22.94 (с, СН2), 23.04 (с, СН2), 23.57 (с, СН3), 26.29 (с, СН2), 26.47 (с, СН3), 26.70 (с, СН2), 29.11 (с, СН2), 29.16 (с, СН2), 29.28 (с, СН2), 29.32 (с, СН2), 31.70 (с, СН2), 48.01 (с, CH3N+), 49.25 (с, CH3N+), 51.12 (с, CH3N+), 51.94 (с, CH3N+), 60.38 (с, СН2), 61.11 (с, СН2), 62.11 (с, СН2), 63.89 (с, CH2N+), 64.74 (с, CH2N+), 101.21 (с, С(СН3)2), 120.77 (с, CPyr), 131.00 (с, CPyr), 141.12 (с, CPyr), 147.44 (с, CPyr), 150.38 (с, CPyr). Масс-спектр (HRMS-ESI): Найдено [М-2Cl]2+ 259.7382. Вычислено для [C32H61N3O2]2+ 259.7377.
Пример 4
2,3-Бис((диметил(октил)аммонио)метил)-5-гидрокси-4-(гидроксиметил)-6-метилпиридин-1-ий трихлорид (I-4)
Синтезируют и разрабатывают аналогично соединению 1-2 из соединения 1-3 (100 мг, 0.17 ммоль). Выход количественный (99 мг); бесцветное маслообразное вещество. Спектр 1Н ЯМР (ДМСО-d6) δ, м.д.: 0.86 (т, 6Н, 3JHH=6.6 Гц, CH3C7H14), 1.27-1.29 (м, 20Н, 10СН2), 1.69-1.95 (м, 4Н, 2СН2), 2.47 (с, 3Н, СН3), 2.85 (с, 3Н, CH3N+), 2.96 (с, 3Н, CH3N+), 2.98 (с, 3Н, CH3N+), 3.23 (с, 3Н, CH3N+), 3.23-3.40 (м, 2Н, CH2N+), 3.61-3.62 (м, 2Н, CH2N+), 4.59, 5.20 (АВ-система, 2Н, 2JHH=-13.4 Гц, СН2), 4.80, 4.85 (АВ-система, 2Н, 2JHH=-14.0 Гц, СН2), 5.02, 5.37 (АВ-система, 2Н, 2JHH=-14.2 Гц, СН2). Спектр 13С{1Н} ЯМР (ДМСО-d6) δ, м.д.: 13.99 (с, СН3), 19.83 (с, СН3), 21.86 (с, СН2), 22.08 (с, СН2), 25.77 (с, СН2), 25.91 (с, СН2), 28.55 (с, СН2), 28.63 (с, СН2), 31.19 (с, СН2), 47.13 (с, CH3N+), 48.14 (с, CH3N+), 49.82 (с, CH3N+), 50.45 (с, CH3N+), 56.47 (с, СН2), 59.33 (с, СН2), 61.58 (с, СН2), 63.26 (с, CH2N+), 63.78 (с, CH2N+, 122.84 (с, CPyr), 137.96 (с, CPyr), 140.84 (с, CPyr), 148.52 (с, CPyr), 148.88 (с, CPyr), 151.10 (с, CPyr). Масс-спектр (HRMS-ESI): Найдено [М-3Cl-Н]2+ 239.7226. Вычислено для [C29H57N3O2]2+ 239.7220.
Пример 5
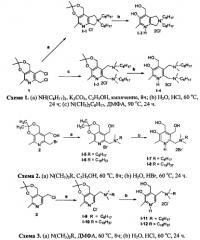
N-((5-(Гидроксиметил)-2,2,8-триметил-4Н-[1,3]диоксино[4,5-с]пиридин-6-ил)метил)-N,N-диметилоктан-1-аминий бромид (1-5)
В раствор соединения 2 [M.V. Pugachev, Ν.V. Shtyrlin, S.V. Sapognikov, L.P. Sysoeva, A.G. Iteanova, E.V. Nikitina, R.Z. Musin, O.A. Lodochnikova, E.A. Berdnikov, Yu.G. Shtyrlin. Bis-phosphonium salts of pyridoxine: the relationship between structure and antibacterial activity. Bioorg. Med. Chem., 2013, 21, 23, 7329-7341] (644 мг, 2.13 ммоль) в 30 мл этилового спирта добавляли Ν,Ν-диметилоктиламин Реакционную смесь перемешивали в течение 8 часов при температуре 60°С. Растворитель отгоняли в вакууме. Продукт перекристаллизовывали из ацетона. Выход 40% (391 мг); белое кристаллическое вещество; т.пл. 139-140°С. Спектр 1Н ЯМР (CDCl3) δ, м.д.: 0.87 (т, 3Н, 3JHH=6.7 Гц, СН3), 1.27-1.38 (м, 10Н, 5СН2) 1.55 (с, 6Н, 2СН3), 1.82-1.88 (м, 2Н, СН2), 2.35 (с, 3Н, СН3), 3.33 (с, 6Н, 2CH3N+) 3.62-3.67 (м, 2Н, СН2), 4.71 (д, 2Н, 3JHH=5 Гц, CH2OH), 4.83 (с, 2Н, CH2N+), 4.99 (с, 2Н, CH2O), 5.14 (т, 1Н, 3JHH=5 Гц, ОН). Спектр 13С {1H} NMR (CDCl3) δ, м.д.: 14.19 (с, СН3), 18.80 (с, СН3), 22.70 (с, СН2), 23.06 (с, СН2), 24.91 (с, C(CH3)2), 26.33 (с, СН2), 29.19 (с, СН2), 29.30 (с, СН2), 31.77 (с, СН2), 51.78 (с, 2CH3N+), 55.35 (с, CH2O), 59.22 (с, CH2O), 63.21 (с, CH2N+), 65.71 (с, CH2N+), 100.23 (с, С(СН3)2), 127.10 (с, CPyr), 132.51 (с, CPyr), 137.44 (с, CPyr), 146.92 (с, CPyr), 147.24 (с, CPyr). Масс-спектр (HRMS-ESI): Найдено [М-Br]+ 379.2961. Вычислено для [C22H39N2O3]+ 379.2955.
Пример 6
N-((5-(гидроксиметил)-2,2,8-триметил-4Н-[13]диоксино[4,5-с]пиридин-6-ил)метил)-N,N-диметилоктадекан-1-аминий бромид (I-6)
Синтезировали и разрабатывали аналогично соединению 1-5 из соединения 2 (400 мг, 1.32 ммоль) и Ν,Ν-диметилоктадецилиламина (0.315 мл, 1.32 ммоль). Выход 60% (475 мг); белое кристаллическое вещество; т.пл. 121-122°С. Спектр 1Н ЯМР (CDCl3) δ, м.д.: 0.89 (т, 3Н, 3JHH=6.3 Гц, CH3C17H34), 1.25-1.41 (м, 30Н, СН2), 1.55 (с, 6Н, 2СН3), 1.88 (уш.с, 2Н, СН2), 2.35 (с, 3Н, СН3), 3.33 (с, 6Н, 2CH3N+), 3.62-3.66 (м, 2Н, CH2N+), 4.72 (д, 2Н, 3JHH=5 Гц, CH2OH), 4.84 (с, 2Н, CH2N+), 4.99 (с, 2Н, CH2O), 5.14 (т, 1H, 3JHH=5 Гц, ОН). Спектр 13С {1H} ЯМР (CDCl3) δ, м.д.: 14.25 (с, CH3C17H34), 18.80 (с, СН3), 22.81 (с, СН2), 23.07 (с, СН2), 24.91 (с, С(СН3)2), 26.34 (с, СН2), 29.36 (с, СН2), 29.48 (с, СН2), 29.55 (с, СН2), 29.61 (с, СН2), 29.72 (с, СН2), 29.78 (с, СН2), 29.82 (с, СН2), 32.04 (с, СН2), 51.79 (с, 2CH3N+), 55.34 (с, CH2O), 59.22 (с, CH2O), 63.18 (с, CH2N+), 65.72 (с, CH2N+), 100.22 (с, С(СН3)2), 127.10 (с, CPyr), 132.53 (с, CPyr), 137.42 (с, CPyr), 146.91 (с, CPyr), 147.23 (с, CPyr). Масс-спектр (HRMS-ESI): Найдено [М-Br]+ 519.4526. Вычислено для [C32H59N2O3]+ 519.4520.
Пример 7
2-((Диметил(октил)аммонио)метил)-5-гидрокси-3,4-бис(гидроксиметил)-6-метилпиридин-1-ий дибромид (I-7)
К соединению 1-5 (100 мг, 0.22 ммоль) в 30 мл воды добавляли 0.3 мл конц. HBr. Реакционную смесь перемешивали в течение 24 часов при температуре 60°С. Растворитель отгоняли в вакууме. Выход количественный (109 мг); желтое маслообразное вещество. Спектр 1Н ЯМР (ДМСО-d6) δ, м.д.: 0.86 (т, 3Н, 3JHH=6.7 Гц, CH3C7H14), 1.26-1.28 (м, 10Н, 5СН2), 1.80 (уш.с, 2Н, СН2), 2.42 (с, 3Н, СН3), 3.04 (с, 6Н, 2 CH3N+), 3.35-3.39 (м, 2Н, CH2N+), 4.63 (с, 2Н, СН2), 4.66 (с, 2Н, СН2), 4.85 (с, 2Н, СН2). Спектр 13С {1Н} ЯМР (ДМСО-d6) δ, м.д.: 14.04 (с, СН3), 18.91 (с, СН3), 21.99 (с, СН2), 22.12 (с, СН2), 25.83 (с, СН2), 28.56 (с, СН2), 31.23 (с, СН2), 50.13 (с, CH3N+), 55.97 (с, СН2), 56.52 (с, СН2), 62.10 (с, СН2), 64.01 (с, СН2), 134.79 (с, CPyr), 135.99 (с, CPyr), 136.18 (с, CPyr), 146.24 (с, CPyr), 151.33 (с, CPyr). Масс-спектр (HRMS-ESI): Найдено [М-2Br-Н]+ 339.2648. Вычислено для [C19H35N2O3]+ 339.2642.
Пример 8
2-((Диметил(октадецил)аммонио)метил)-5-гидрокси-3,4-бис(гидроксиметил)-6-метилпиридин-1-ий дибромид (I-8)
К соединению 1-6 (100 мг, 0.17 ммоль) в 30 мл воды и 10 метанола добавляли 0.3 мл конц. HBr. Реакционную смесь перемешивали в течение 24 часов при температуре 60°С. Растворитель отгоняли в вакууме. Выход количественный (107 мг); желтое маслообразное вещество. Спектр 1Н ЯМР (ДМСО-d6) δ, м.д.: 0.84 (т, 3Н, 3JHH=6.7 Гц, CH3C17H34), 1.22 (уш.с, 30Н, 15СН2), 1.79 (уш.с, 2Н, СН2), 2.45 (с, 3Н, СН3), 3.05 (с, 6Н, 2 CH3N+), 3.37-3.41 (м, 2Н, CH2N+), 4.67 (с, 4Н, 2СН2), 4.87 (с, 2Н, СН2). Спектр 13C{1H} ЯМР (ДМСО-d6) δ, м.д.: 14.00 (с, СН3), 18.48 (с, СН3), 22.01 (с, СН2), 22.14 (с, СН2), 25.83 (с, СН2), 28.59 (с, СН2), 28.75 (с, СН2), 28.90 (с, СН2), 29.01 (с, СН2), 29.09 (с, СН2), 31.34 (с, СН2), 50.08 (с, CH3N+), 55.92 (с, СН2), 56.64 (с, СН2), 61.76 (с, СН2), 64.17 (с, СН2), 135.48 (с, CPyr), 136.29 (с, CPyr), 146.16 (с, CPyr), 151.66 (с, CPyr). Масс-спектр (HRMS-ESI): Найдено [М-2Br-Н]+ 479.4213. Вычислено для [C29H55N2O3]+ 479.4207.
Пример 9
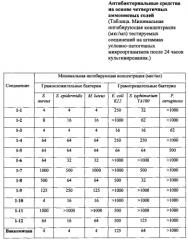
N,N-диметил-N-((2,2,8-триметил-4Н-[1,3]диоксино[4,5-с]пиридин-5-ил)метил)октан-1-аминий хлорид (I-9)
К соединению 3 [Tomita I., Brooks H.G., Metzler D.E. Synthesis of vitamin B6 derivatives. II. 3-Hydroxy-4-hydroxymethyl-2-methyl-5-pyridine acetic acid and related substances. J. Heterocycl. Chem. 1966, 3, 2, 178-183] (387 мг, 1.70 ммоль) в 30 мл ДМФА добавляли Ν,Ν-диметилоктиламин (0.446 мл, 2.16 ммоль). Реакционную смесь перемешивали в течение 8 часов при температуре 60°С. Растворитель отгоняли в вакууме. Полученный остаток перекристализовывали из ацетона. Выход 43% (282 мг); белое кристаллическое вещество; т.пл. 169-173°С (разл.). Спектр 1Н ЯМР (ДМСО-d6) δ, м.д.: 0.86 (т, 3Н, 3JHH=6.4 Гц, CΗ3C17Η34), 1.26-1.29 (м, 10Н, 5СН2), 1.53 (с, 6Н, 2СН3), 2.34 (с, 3Н, СН3), 3.01 (с, 6Н, 2 CH3N+), 3.36-3.42 (м, 2Н, CH3N+), 4.54 (с, 2Н, СН2), 4.99 (с, 2Н, CH3N+), 8.15 (с, 1H, CHPyr). Спектр 13С {1H} ЯМР (ДМСО-d6) δ, м.д.: 13.96 (с, СН3), 18.62 (с, СН3), 21.82 (с, СН2), 22.05 (с, СН2), 24.61 (с, СН2), 25.85 (с, СН2), 28.46 (с, СН2), 28.48 (с, СН2), 31.16 (с, СН2), 48.79 (с, CH3N+), 58.62 (с, CH2O), 60.96 (с, С CH2N+), 63.77 (с, CH2N+), 100.01 (с, С(СН3)2), 118.27 (с, CPyr), 128.53 (с, CPyr), 144.42 (с, CPyr), 145.68 (с, CPyr), 148.59 (с, CPyr). Масс-спектр (HRMS-ESI): Найдено [М-Cl]+ 349.2855. Вычислено для [C21H37N2O2]+ 349.2850.
Пример 10
N,N-Диметил-N-((2,2,8-триметил-4Н-[1,3]диоксино[4,5-с]пиридин-5-ил)метил)октадекан-1-амминий хлорид (I-10)
Синтезировали и разрабатывали аналогично соединению 1-9 из соединения 3 (387 мг, 1.70 ммоль) и Ν,Ν-диметилоктадецилиламина (0.633 мл, 1.70 ммоль). Выход 55% (491 мг); коричневое кристаллическое вещество; т.пл. 137-139°С (разл.). Спектр 1Н ЯМР (CDCl3) δ, м.д.: 0.85 (т, 3Н, 3JHH=6.6 Гц, CH3C17H34), 1.23-1.30 (м, 30Н, 15СН2), 1.54 (с, 6Н, 2СН3), 1.77 (уш.с, 2Н, СН2), 2.53 (с, 3Н, СН3), 3.37 (с, 6Н, 2CH3N+), 3.67 (уш.с, 2Н, CH2N+), 5.29 (с, 4Н, 2СН2), 8.46 (с, 1H, CHPyr). Спектр 13С {1Н} ЯМР (ДМСО-d6) δ, м.д.: 14.22 (с, СН3), 16.87 (с, СН3), 22.78 (с, СН2), 23.09 (с, СН2), 25.06 (с, С(СН3)2), 26.49 (с, СН2), 29.43 (с, СН2), 29.46 (с, СН2), 29.54 (с, СН2), 29.60 (с, СН2), 29.72 (с, СН2), 29.76 (с, СН2), 29.81 (с, СН2), 32.02 (с, СН2), 42.87 (с, СН2), 49.59 (с, CH3N+), 60.04 (с, СН2), 61.69 (с, СН2), 64.38 (с, CH2N+), 101.71 (с, С(СН3)2), 119.87 (с, CPyr), 133.31 (с, CPyr), 140.30 (с, CPyr), 148.25 (с, CPyr), 148.42 (с, CPyr). Масс-спектр (HRMS-ESI): Найдено [М-Cl]+ 489.4420. Вычислено для [C31H57N2O2]+ 489.4415.
Пример 11
5-((Диметил(октил)аммонио)метил)-3-гидрокси-4-(гидроксиметил)-2-метилпиридин-1-ий дихлорид (I-11)
К соединению 1-9 (100 мг, 0.26 ммоль) в 30 мл воды добавляли 1 мл конц. HCl. Реакционную смесь перемешивали в течение 24 часов при температуре 60°С. Растворитель отгоняли в вакууме. Выход количественный (99 мг); белое кристаллическое вещество; т.пл.175-176°С (разл.). Спектр 1Н ЯМР (ДМСО-d6) δ, м.д.: 0.87 (т, 3Н, 3JHH=6.7 Гц, CH3C7H14) 1.26-1.30 (м, 10Н, 5СН2), 1.77 (уш.с, 2Н, СН2), 2.68 (с, 3Н, СН3), 3.02 (с, 6Н, 2CH3N+), 3.43-3.47 (м, 2Н, CH2N+), 4.89 (с, 2Н, СН2), 4.93 (с, 2Н, СН2), 8.49 (с, 1Н, CHPyr). Спектр 13С{1Н} ЯМР (ДМСО-d6) δ, м.д.:13.99 (с, СН3), 15.32 (с, СН3), 21.91 (с, СН2), 22.08 (с, СН2), 25.85 (с, СН2), 28.47 (с, СН2), 28.52 (с, СН2) 31.18 (с, СН2), 48.82 (с, 2CH3N+), 55.72 (с, СН2), 59.69 (с, СН2), 64.75 (с, СН2), 124.45 (с, CPyr), 136.23 (с, CPyr), 144.12 (с, CPyr, 145.24 (с, CPyr), 153.00 (с, CPyr). Масс-спектр (HRMS-ESI): Найдено [М-Cl]+ 309.2542. Вычислено для [C18H33N2O2]+ 309.2537.
Пример 12
5-((Диметил(октадецил)аммонио)метил)-3-гидрокси-4-гидроксиметил)-2-метилпиридин-1-ий дихлорид (I-12)
Синтезировали и разрабатывали аналогично соединению 1-11 из соединения 1-10 (100 мг, 0.19 ммоль). Выход количественный (99 мг); белое кристаллическое вещество; т.пл. 157-160°С (разл.). Спектр 1H ЯМР (ДМСО-d6) δ, м.д.: 0.85 (т, 3Н, 3JHH=6.6 Гц, CH3C17H34), 1.23 (уш.с, 30Н, 15СН2), 1.62-1.76 (м, 2Н, СН2), 2.65 (с, 3Н, СН3), 3.00 (с, 6Н, 2CH3N+), 3.41-3.45 (м, 2Н, CH2N+), 4.88 (с, 4Н, 2СН2), 8.46 (с, 1H, СН3). Спектр 13C {1H} ЯМР (ДМСО-d6) δ, м.д.: 14.01 (с, СН3), 15.73 (с, СН3), 21.93 (с, СН2), 22.15 (с, СН2), 23.59 (с, СН2), 25.87 (с, СН2), 25.98 (с, СН2), 28.62 (с, СН2), 28.76 (с, СН2), 28.88 (с, СН2), 29.10 (с, СН2), 31.34 (с, СН2), 41.86 (с, СН2), 48.83 (с, 2CH3N+), 55.81 (с, СН2), 56.38 (с, СН2), 59.82 (с, СН2), 64.75 (с, СН2), 124.13 (с, CPyr), 136.99 (с, CPyr), 144.47 (с, CPyr), 152.78 (с, CPyr). Масс-спектр (HRMS-ESI): Найдено [М-Cl]+ 449.4107. Вычислено для [C28H53N2O2]+ 449.4102.
Исследование антибактериальной активности четвертичных аммониевых солей на основе производных пиридоксина
Антибактериальная активность новых соединений оценивали на штаммах Staphylococcus aureus, Staphylococcus epidermidis, Micrococus luteus, Escherichia coli K12, Salmonella typhimurium TA100 и Pseudomonas aeruginosa. МИК (Минимальная ингибирующая концентрация) определялась на 96-луночных культуральных планшетах с помощью метода серийных разведений в питательной среде LB-бульоне (среда Лоурия-Бертони). Для инокуляции использовали стандартную микробную взвесь, эквивалентную 0.5 по стандарту МакФарланда, полученную путем разведения в 100 раз 18-часовой культуры питательным бульоном LB, после чего концентрация микроорганизма в ней составляла 1-9×106 КОЕ/мл. Полученную суспензию порциями по 0.1 мл инокулировали в 0.1 мл раствора тестируемого вещества. Начальный раствор с концентрацией соединения 2 мг/мл получали путем растворения/внесения в 100 мкл LB-бульона 2 (двух) мкл раствора соединения с концентрацией 100 мг/мл в ДМСО. Растворы тестируемых соединений с более низкими концентрациями готовили последовательным разбавлением питательной средой (LB-бульоном) начального раствора соединений в LB-бульоне с концентрацией 2 мг/мл. Конечная концентрация тестируемых веществ после инокуляции варьировалась от 1000 до 0.5 мкг/мл. Инкубирование приводили при 37°С в течение 24 ч, в качестве контроля использовали питательную среду. Измерение оптической плотности проводили фотометрически на спектрофотометре СФ-2000 при 600 нм. Минимальную ингибирующую концентрацию определяли как наименьшую концентрацию тестируемого вещества, при которой отсутствовал видимый рост микроорганизма. В качестве препарата сравнения использовали ванкомицин в тех же концентрациях.
Как видно из представленных в Таблице данных, большинство из заявленных соединений обладают выраженной антибактериальной активностью по отношению к исследуемым штаммам микроорганизмов. При этом наиболее активными оказались соединения I-1 и I-3, антибактериальное действие которого по отношению к грамположительным микроорганизмам оказалось сопоставимым с ванкомицином.
Таким образом, использование четвертичных аммониевых солей на основе производных пиридоксина представляет интерес при разработке новых противомикробных препаратов.
1. Антибактериальные средства на основе четвертичных аммониевых солей общей формулы (I): где при R1+R2=-С(СН3)2-, R3+R4=-CH2N+(C8H17)2CH2-, n=1, X=Cl, m=0,при R1=R2=H, R3+R4=-CH2N+(C8H17)2CH2-, n=1, X=Cl, m=1,при R1+R2=-C(CH3)2-, R3=R4=CH2N+(CH3)2C8H17, n=2, X=Cl, m=0,при R1=R2=H, R3+R4=CH2N+(CH3)2С8Н17, n=2, X=Cl, m=1,при R1+R2=-C(CH3)2-, R3=CH2OH, R4=CH2N+(CH3)2C8H17, n=1, X=Br, m=0,при R1+R2=-C(CH3)2-, R3=CH2OH, R4=CH2N+(CH3)2C18H37, n=1, X=Br, m=0,при R1=R2=H, R3=CH2OH, R4=CH2N+(СН3)2С8Н17, n=1, X=Br, m=1,при R1=R2=H, R3=CH2OH, R4=CH2N+(СН3)2C18H37, n=1, X=Br, m=1,при R1+R2=-C(CH3)2-, R3=CH2N+(СН3)2С8Н17, R4=H, n=1, X=Cl, m=0,при R1+R2=-C(CH3)2-, R3=CH2N+(CH3)2C18H37, R4=H, n=1, X=Cl, m=0,при R1=R2=R4=H, R3=CH2N+(СН3)2С8Н17, n=1, X=Cl, m=1,при R1=R2=R4=H, R3=CH2N+(CH3)2C18H37, n=1, X=Cl, m=1.
2. Антибактериальные средства на основе четвертичных аммониевых солей по п. 1, обладающие антибактериальной активностью.