Способ получения 2,7-диалкил-2,3а,5а,7,8а,10а-гексаазапергидропиренов
Иллюстрации
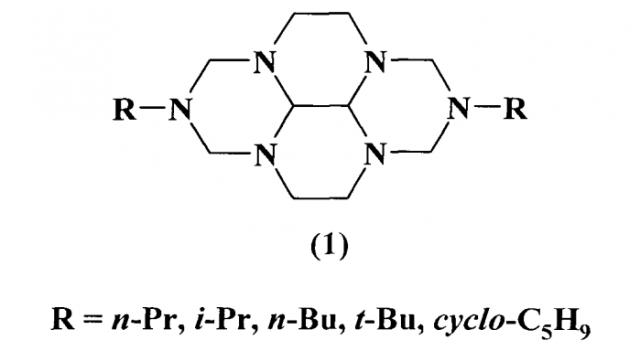
Показать всеИзобретение относится к способу получения 2,7-диалкил-2,3а,5а,7,8а,10а-гексаазапергидропиренов общей формулы (1):
отличающемуся тем, что N,N-бис(метоксиметил)-N-алкиламины общей формулы RN(CH2OCH3)2, где R - указанные выше, подвергают взаимодействию с 1,4,5,8-тетраазадекалином в среде метанол-вода (10:1, объемн.) в присутствии катализатора SmCl3·6H2O при мольном соотношении N,N-бис(метоксиметил)-N-алкиламин: 1,4,5,8-тетраазадекалин: SmCl3·6H2O=2:1:(0.03-0.07) при комнатной (~20°C) температуре и атмосферном давлении в течение 2.5-3.5 ч. Технический результат: получение 2,7-диалкил-2,3а,5а,7,8а,10а-гексаазапергидропиренов общей формулы (1) с высоким выходом. 1 табл., 1 пр.
Реферат
Предлагаемое изобретение относится к органической химии, конкретно, к способу получения 2,7-диалкил-2,3а,5а,7,8а,10а-гексаазапергидропиренов общей формулы (1):
Полиядерные соединения, в том числе производные пирена и их аналоги, известны как органические люминофоры (Katz Н.Е., Johnson J., Lovinger A.J., Li W. J. Am. Chem. Soc, 2000, 122, 7787) и эффективные лекарственные препараты (Roknic S., Glavas-Obrovac L., Karner I., Piantanida I., Zinic M., Pavelic K. Chemotherapy, 2000, 46, 143; Andricopolo A.D., Muller L.A., Filho V.C., Cani G.-N.R.J., Yunes R.A. Farmaco, 2000, 55, 319). В последнее время возрос интерес к подобным структурам, в первую очередь как люминесцентным интеркаляторам [Brun A.M., Harriman A. J. Am. Chem. Soc, 1992, 114, 3656], а также в связи с развитием нанотехнологий, как к потенциальным «строительным блокам» для конструирования различных наноструктур [Боровлев И.В., Демидов О.П. ХГС, 2008, 1613).
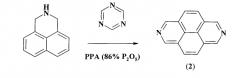
Известен способ [А.V. Aksenov, I.V. Borovlev, I.V. Aksenova, S.V. Pisarenko, and D.A. Kovalev. Tetrahedron Lett., 2008, 49, 707] получения 2,7-диазапирена (2) взаимодействием дигидроазафеналена с сим-триазином
Известный способ не позволяет получать 2,7-диалкил-2,3а,5а,7,8а,10а-гексаазапергидропирены общей формулы (1).
Известен способ получения [И.В. Боровлев, А.В. Аксенов, И.В. Аксенова, С.В. Писаренко. Изв. АН, Сер. хим., 2007, 2275] 1,3,7-триазапирена (3) взаимодействием ароматического диамина с триазином в присутствии полифосфорной кислоты (РРА) при температуре свыше 100°С
Известным способом не могут быть получены 2,7-диалкил-2,3а,5а,7,8а,10а-гексаазапергидропирены общей формулы (1).
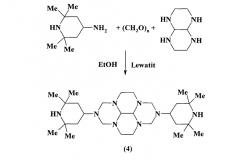
Известен способ получения [P.Neumann, A. Aumueller, Н. Trauth. US Patent 4,904,779 (1990)] бис(пиперидинил)гексаазапергидропирена (4) трехкомпонентной конденсацией аминопиперидина, параформальдегида и 1,4,5,8-тетраазадекалина в среде этанола в присутствии в качестве катализатора сильнокислого катионита Lewatit
Известный способ не позволяет получать 2,7-диалкил-2,3а,5а,7,8а,10а-гексаазапергидропирены общей формулы (1).
Таким образом, в литературе отсутствуют сведения о получении 2,7-диалкил-2,3а,5а,7,8а,10а-гексаазапергидропиренов общей формулы (1).
Предлагается новый способ получения 2,7-диалкил-2,3а,5а,7,8а,10а-гексаазапергидропиренов общей формулы (1).
Сущность способа заключается во взаимодействии N,N-бис(метоксиметил)-N-алкиламина общей формулы RN(CH2OCH3)2, где R=n-Pr, i-Pr, n-Bu, t-Bu, cyclo-С5Н9, с 1,4,5,8-тетраазадекалином в присутствии катализатора SmCl3·6H2O, взятых в мольном соотношении N,N-бис(метоксиметил)-N-алкиламин: 1,4,5,8-тетраазадекалин: SmCl3·6H2O=2:1:(0.03-0.07), предпочтительно 2:1:0.05. Смесь перемешивают 2.5-3.5 ч при температуре 20°C и атмосферном давлении в среде растворителей метанол-вода (10:1, объемн.). Выход 2,7-диалкил-2,3а,5а,7,8а,10а-гексаазапергидропиренов (1) составляет 75-98%. Реакция протекает по схеме
2,7-Диалкил-2,3а,5а,7,8а,10а-гексаазапергидропирены общей формулы (1) образуются только лишь с участием N,N-бис(метоксиметил)-N-алкиламинов и 1,4,5,8-тетраазадекалина, взятых в мольном соотношении 2: 1 (стехиометрические количества). При другом соотношении исходных реагентов снижается выход целевого продукта (1). Без катализатора реакция идет с выходом не более 25%.
Проведение указанной реакции в присутствии катализатора SmCl3·6H2O больше 7 мол. % не приводит к существенному увеличению выхода целевого продукта (1). Использование катализатора SmCl·6H2O менее 3 мол. % снижает выход (1), что связано, возможно, со снижением каталитически активных центров в реакционной массе. Реакции проводили при температуре 20°C. При температуре выше 20°C (например, 60°C) увеличиваются энергозатраты, а при температуре ниже 20°C (например, при 0°C) снижается скорость реакции. Опыты проводили в среде растворителей метанол-вода (10:1, объемн.), т.к. в них хорошо растворяются исходные соединения.
Существенные отличия предлагаемого способа
В известном способе реакция идет с участием в качестве исходных реагентов аминопиперидина, параформальдегида и 1,4,5,8-тетраазадекалина в среде этанола в присутствии сильнокислого катионита Lewatit.
В предлагаемом способе реакция идет с участием в качестве исходных реагентов N,N-бис(метоксиметил)-N-алкиламинов и 1,4,5,8-тетраазадекалина в среде метанол-вода под действием катализатора SmCl3·6H2O. В отличие от известных предлагаемый способ позволяет получать индивидуальные 2,7-диалкил-2,3а,5а,7,8а,10а-гексаазапергидропирены общей формулы (1), синтез которых в литературе не описан.
Способ поясняется примерами:
Пример 1. В сосуд Шленка, установленный на магнитной мешалке, при температуре ~20°C помещают 0.29 г (2 ммоль) N,N-бис(метоксиметил)-N-пропиламина в 10 мл метанола и 0.018 г (0.05 ммоль) SmCl3·6H2O, затем добавляют 0.14 г (1 ммоль) 1,4,5,8-тетраазадекалина в 1 мл воды. Реакционную смесь перемешивают при температуре ~20°C в течение 3 ч и очищают колоночной хроматографией на SiO2, выделяют 2,7-дипропил-2,3а,5а,7,8а,10а-гексаазапергидропирен с выходом 90%.
Другие примеры, подтверждающие способ, приведены в табл.1.
Спектральные характеристики 2,7-дипропил-2,3а,5а,7,8а,10а-гексаазапергидропирена1 [1 Контроль реакции осуществляли методом ТСХ на пластинах Silufol W-254, проявляли парами I2. Для колоночной хроматографии использовали силикагель КСК (100-200 мкм). Масс спектры получены на приборе MALDI TOF/TOF AUTOFLEX III фирмы Bruker. Спектры ЯМР 1D (1Н, 13С) и 2D (COSY, NOESY, HSQC, НМВС) сняты на спектрометре Bruker Avance 400 (100.62 МГц для, 13С и 400.13 МГц для 1Н) по стандартным методикам фирмы Bruker, внутренний стандарт Me4Si, растворитель - CDCl3.]:
MALDI TOF/TOF, m/z: 307.470 [М-H]+. C16H32N6. М308.466.
Спектр ЯМР 1H, δ, м.д. (J, Гц): 0.91 т (6Н, СН3, 2J=7.4, Н-3′, 3″), 1.42-1.54 м (4Н, СН2, Н-2′, 2″), 2.27 уш. с (2Н, СН, Н-10b, 10с), 2.31 д (4Н, СН2, 2J=7.2, На-4, 5, 9, 10), 2.55 д (4Н, СН2, 2J=7.6, Hb-4, 5, 9, 10), 2.76 т (4Н, СН2, 2J=7.6, Н-1′, 1″), 3.06 д (4Н, СН2, 2J=10, На-1, 3, 6, 8), 3.64 д (4Н, СН2, 2J=10, Hb-1, 3, 6, 8). Спектр ЯМР 13С, δ, м.д.: 11.8 (С-3′, С-3″), 21.4 (С-2′, С-2″), 48.0 (С-4, С-5, С-9, С-10), 54.6 (С-1′, С-1″), 74.2 (С-1, С-3, С-6, С-8), 82.7 (С-10b, С-10с).
Спектральные характеристики 2,7-диизопропил-2,3а,5а,7,8а,10а-гексаазапергид ропирена:
MALDI TOF/TOF, m/z: 307.468 [М-Н]+. C16H32N6. М308.466.
Спектр ЯМР 1Н, δ, м.д. (J, Гц): 1.11 д (12Н, СН3, 2J=6.4, Н-2′, 2″, 3′, 3″), 2.26 уш. с (2Н, СН, Н-10b, 10с), 2.32 д (4Н, СН2, 2J=7.2, На-4, 5, 9, 10), 2.57 д (4Н, СН2, 2J=7.2, Нb-4, 5, 9, 10), 2.98 д (4Н, СН2, 2J=10, На-1, 3, 6, 8), 3.17-3.24 м (2Н, СН, Н-1′, 1″), 3.83 д (4Н, СН2, 2J=10, Нb-1, 3, 6, 8).
Спектр ЯМР 13С, δ, м.д.: 20.7 (С-2′, С-2″, С-3′, С-3″), 48.3 (С-4, С-5, С-9, С-10), 49.0 (С-1′, С-1″), 71.7 (С-1, С-3, С-6, С-8), 82.7 (С-10b, С-10с).
Спектральные характеристики 2,7-дибутил-2,3а,5а,7,8а,10а-гексаазапергидропирена:
MALDI TOF/TOF, m/z: 335.521 [М-Н]+. C18H36N6. М336.519.
Спектр ЯМР 1Н, δ, м.д. (J, Гц): 0.92 т (6Н, СН3, 2J=7.2, Н-4′, 4″), 1.30-1.39 м (4Н, СН2, Н-3′, 3″), 1.42-1.49 м (4Н, СН2, Н-2′, 2″), 2.27 уш. с (2Н, СН, Н-10b, 10с), 2.31 д (4Н, СН2, 2J=7.2, На-4, 5, 9, 10), 2.55 д (4Н, СН2, 2J=7.6, Hb-4, 5, 9, 10), 2.79 т (4Н, СН2, 2J=7,4, Н-1′, 1″), 3.06 д (4Н, СН2, 2J=10, На-1, 3, 6, 8), 3.65 д (4Н, CH2, 2J=10.4, Hb-1, 3, 6, 8).
Спектр ЯМР 13С, δ, м.д.: 14.0 (С-4′, С-4″), 20.5 (С-3′, С-3″), 30.5 (С-2′, С-2″), 48.1 (С-4, С-5, С-9, С-10), 52.4 (С-1′, С-1″), 74.2 (С-1, С-3, С-6, С-8), 82.7 (С-10b, С-10с).
Спектральные характеристики 2,7-дитретбутил-2,3а,5а,7,8а,10а-гексаазапергидропирена:
MALDI TOF/TOF, m/z: 335.521 [М-Н]+. C18H36N6. М336.519.
Спектр ЯМР 1Н, δ, м.д. (J, Гц): 1.11 уш. с (18Н, СН3, Н-2′, 2″, 3′, 3″, 4′, 4″), 1.93 уш. с (2Н, СН, Н-10b, 10с), 1.99 д (4Н, СН2, 2J=7.2, На-4, 5, 9, 10), 2.53 д (4Н, СН2, 2J=7.2, Нb-4, 5, 9, 10), 2.79 д (4Н, СН2, 2J=10.4, На-1, 3, 6, 8), 3.85 д (4Н, СН2, 2J=10.4, Hb-1, 3, 6, 8).
Спектр ЯМР 13С, δ, м.д.: 29.0 (С-2′, С-2″, С-3′, С-3″, С-4′, С-4″), 48.4 (С-4, С-5, С-9, С-10), 53.5 (С-1′, С-1″), 69.5 (С-1, С-3, С-6, С-8), 83.4 (С-10b, С-10с).
Спектральные характеристики 2,7-дициклопентил-2,3а,5а,7,8а,10а-гексаазапергидропирена:
MALDI TOF/TOF, m/z: 359.450 [М-Н]+. C20H36N6. М360.540.
Спектр ЯМР 1Н, δ, м.д. (J, Гц): 1.40 уш. с (4Н, СН2, На-2′, 2″, 5′, 5″), 1.58-1.61 м (4Н, СН2, На-3′, 3″, 4′, 4″), 1.71-1.74 м (4Н, СН2, Нb-3′, 3″, 4′, 4″), 1.91 уш. с (4Н, СН2, Нb-2′, 2″, 5′, 5″), 2.32 уш. с (2Н, СН, Н-10b, 10с), 2.35 д (4Н, СН2, 2J=7.2, На-4, 5, 9, 10), 2.59 д (4Н, СН2, 2J=7.6, Hb-4, 5, 9, 10), 3.03 д (4Н, СН2, 2J=9.2, На-1, 3, 6, 8), 3.38 уш. с (2Н, СН, Н-1′, 1″), 3.81 д (4Н, СН2, 2J=10, Hb-1, 3, 6, 8).
Спектр ЯМР 13С, δ, м.д.: 23.9 (С-3′, С-3″, С-4′, С-4″), 31.0 (С-2′, С-2″, С-5′, С-5″), 48.1 (С-4, С-5, С-9, С-10), 60.1 (С-1′, С-1″), 73.1 (С-1, С-3, С-6, С-8), 82.1 (С-10b, С-10с).
Способ получения 2,7-диалкил-2,3а,5а,7,8а,10а-гексаазапергидропиренов общей формулы (1): отличающийся тем, что N,N-бис(метоксиметил)-N-алкиламины общей формулы RN(CH2OCH3)2, где R - указанные выше, подвергают взаимодействию с 1,4,5,8-тетраазадекалином в среде метанол-вода (10:1, объемн.) в присутствии катализатора SmCl3·6H2O при мольном соотношении N,N-бис(метоксиметил)-N-алкиламин: 1,4,5,8-тетраазадекалин: SmCl3·6H2O=2:1:(0.03-0.07) при комнатной (~20°C) температуре и атмосферном давлении в течение 2.5-3.5 ч.