Стабильные составы антител против рецептора программируемой смерти pd-1 человека и относящиеся к ним способы лечения
Иллюстрации
Показать всеИзобретение относится к области иммунологии, в частности к стабильным составам антител против рецептора программируемой смерти PD-1 человека. Указанные составы могут быть жидкими или лиофилизированными, при этом содержат 25-100 мг/мл антитела против PD-1 человека, приблизительно 70 мг/мл сахарозы, приблизительно 0,2 мг/мл полисорбата 80 и приблизительно 10 мМ гистидинового буфера при pH 5,0-6,0, где антителом против PD-1 человека является h409A11. Изобретение позволяет получать стабильные фармацевтические составы для лечения пациентов со злокачественным новообразованием или хронической вирусной инфекцией. 2 н. и 5 з.п. ф-лы, 18 ил., 6 табл., 3 пр.
Реферат
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
По данной заявке испрашивается приоритет по предварительной патентной заявке США № 61/470121, зарегистрированной 31 марта 2011 года, включенной в настоящее описание в качестве ссылки в полном объеме.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к стабильным составам антител против рецептора программируемой смерти PD-1 человека или их антигенсвязывающих фрагментов. Настоящее изобретение дополнительно относится к способам лечения различных злокачественных новообразований и хронических инфекций с использованием стабильных составов антител против PD-1 человека или их антигенсвязывающих фрагментов.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Белок программируемой смерти 1 (PD-1), член костимуляторного семейства генов CD28, умеренно экспрессируется на наивных T-, B- и NKT-клетках и повышающе регулируется передачей сигнала через T/B-клеточные рецепторы на лимфоцитах, моноцитах и миелоидных клетках (1). PD-1 имеет два известных лиганда с различными профилями экспрессии, PD-L1 (B7-H1) и PD-L2 (B7-DC). Экспрессия PD-L2 относительно ограничена, и ее обнаруживают на активированных дендритных клетках, макрофагах и моноцитах и на эндотелиальных клетках сосудов (1-3). Наоборот, PD-L1 экспрессируется более широко, включая экспрессию на наивных лимфоцитах, и его экспрессия индуцируется на активированных B- и T-клетках, моноцитах и дендритных клетках. Кроме того, посредством мРНК он экспрессируется в нелимфоидных тканях, включая эндотелиальные клетки сосудов, эпителиальные клетки и мышечные клетки.
PD-1 рассматривают как важный элемент в иммунной регуляции и поддержании периферической толерантности. Показано, что у мыши для этого необходима экспрессия PD-L1 в периферических тканях и лигандирование PD-1 на потенциально аутореактивных T-клетках для негативной модуляции активации T-клеток, включающей последовательность ITIM в цитоплазматическом домене PD-1 (1, 4).
В зависимости от конкретного генетического фона у мыши pdcdl-/- спонтанно развивается волчаночноподобные явления или дилатационная кардиомиопатия (5, 6). Кроме того, показано, что индуцированная антителами блокада пути PD-1/PD-L1 ускоряет начало аутоиммунного инсулита и диабета у мышей NOD (7).
Обнаруживали, что в злокачественных новообразованиях человека, возникающих в различных тканях, гиперэкспрессируются PD-L1 или PD-L2. На больших наборах образцов, например, рака яичника, почек, колоректального рака, рака поджелудочной железы, печени и меланомы, показано, что экспрессия PD-L1 коррелирует с неблагоприятным прогнозом и сниженной общей выживаемостью независимо от последующего лечения (15-26). Аналогично, обнаруживали, что экспрессия PD-1 на инфильтрирующих опухоль лимфоцитах является признаком дисфункциональных T-клеток при раке молочной железы и меланоме (27-28) и коррелирует с неблагоприятным прогнозом при раке почки (29). С использованием первичных образцов пациентов показано, что блокада PD-1 или PD-L1 in vitro приводит к повышению опухолеспецифичной активация T-клеток человека и продукции цитокинов (30). Таким образом, в нескольких моделях опухолей сингенных мышей, блокада PD-1 или PD-L1 значительно ингибировала рост опухоли или индуцировала полную регрессию.
Блокирующие PD-1 mAb (h409A11) обнаруживали и разрабатывали для использования в лечении людей-пациентов со злокачественными опухолями и пациентов с хронической вирусной инфекцией (описано в совместно рассматриваемой заявке WO2008/156712).
Примером дисфункции антиген-специфичных T-клеток или толерантности является суммарная утрата потенциала продукции интерлейкина 2 (ИЛ-2), фактора некроза опухоли (ФНО), перфорина, интерферона (ИФН) γ (8) и неспособность развивать пролиферативный ответ на запуск T-клеточного рецептора (1). Путь PD-1 контролирует толерантность антиген-специфичных T-клеток, и обнаруживали, что он используется при вирусной инфекции и развитии опухоли для контроля и уклонения от эффективного T-клеточного иммунитета.
При хронической инфекции LCMV (мыши), ВИЧ, HBV или HCV (человека) обнаруживали, что антиген-специфичные T-клетки экспрессировали аномально высокие уровни PD-1, коррелирующие с состоянием анергии или дисфункции (9). Показано, что блокирование взаимодействия PD-1-PD-L1 in vivo (LCMV) или in vitro (ВИЧ, HCV, HBV) восстанавливает противовирусную активность T-клеток (10-12). Блокада PD-1 у макак, недавно инфицированных вирусом иммунодефицита обезьян, приводит к значительному снижению вирусной нагрузки и повышению выживания (13). Аналогично, снижение вирусной нагрузки подтверждали во втором исследовании с использованием длительно инфицированных SIV макак-резусов (14).
В общем, путь PD-1/PD-L1 является хорошо проверенной мишенью для разработки терапевтических средств на основе антител для лечения злокачественных опухолей. Антитела против PD-1 также применимы для лечения хронической вирусной инфекции. CD8+T-клетки памяти, возникающие после острой вирусной инфекции, являются высоко функциональными и представляют собой важный компонент защитного иммунитета. Наоборот, хронические инфекции часто отличаются различными степенями функционального нарушения (истощение) вирус-специфичных T-клеточных ответов, и этот дефект является основной причиной неспособности хозяина элиминировать персистирующий патоген. Хотя функциональные эффекторные T-клетки исходно возникают на ранних стадиях инфекции, они постепенно теряют функцию в течение хронической инфекции. Barber et al. (Barber et al., Nature 439:682-687 (2006)) показали, что у мышей, инфицированных лабораторным штаммом LCMV, развивалась хроническая инфекция, приводящая к высоким уровням вируса в крови и других тканях. У этих мышей исходно развивается устойчивый T-клеточный ответ, но, в конечном итоге, они погибают от инфекции после истощения T-клеток. Авторы обнаруживали, что снижения количества и функции эффекторных T-клеток у хронически инфицированных мышей можно реверсировать инъецированием антитела, блокирующего взаимодействие между PD-1 и PD-L1.
Также показано, что PD-1 значительно экспрессируется на T-клетках ВИЧ-инфицированных индивидуумов, и что экспрессия рецептора коррелирует с нарушением функции T-клеток и прогрессированием заболевания (Day et al., Nature 443:350-4 (2006); Trautmann L. et al, Nat. Med. 12:1198-202 (2006)). In В обоих исследованиях блокада пути PD-1 с использованием антител против лиганда PD-L1 значительно повышает экспансию ВИЧ-специфичных продуцирующих ИФН гамма клеток in vitro.
В других исследованиях также учитывали важность пути PD-1 в контроле вирусной инфекции. Нокаутные по PD-1 мыши проявляют лучший контроль аденовирусной инфекции, чем мыши дикого типа (Iwai et al., Exp. Med. 198:39-50 (2003)). Кроме того, адоптивный перенос HBV-специфичных T-клеток в HBV-трансгенных животных инициировал гепатит (Isogawa M. et al., Immunity 23:53-63 (2005)). Течение заболевания у этих животных меняется вследствие распознавания антигена в печени и положительной регуляции PD-1 клетками печени.
Для блокирования активности цитокинов можно использовать терапевтические антитела. Существенным ограничением использования антител в качестве терапевтического средства in vivo является иммуногенность антител. Т.к. большинство моноклональных антител получают из не являющихся человеком видов, повторное использование у людей приводит к возникновению иммунного ответа против терапевтического антитела. Такой иммунный ответ приводит, как минимум, к утрате терапевтической эффективности и потенциально к фатальному анафилактическому ответу. Таким образом, антитела со сниженной иммуногенностью у людей, такие как гуманизированные или полностью человеческие антитела, предпочтительны для лечения людей. Примеры терапевтических антител, специфичных для PD-1 человека, описывают в принадлежащих одному и тому же правообладателю публикации патентной заявки США № US2010/0266617 и международной патентной публикации № WO2008/156712, описания которых, таким образом, включены в качестве ссылки в полном объеме.
Антитела для применения у людей необходимо хранить до использования и транспортировать к месту, в котором осуществляют введение. Для воспроизводимого достижения желаемого уровня терапевтических антител у индивидуума необходимо хранить лекарственное средство в составе, сохраняющем биологическую активность лекарственного средства. Существует потребность в стабильных составах антител против PD-1 человека для фармацевтического применения, например, для лечения различных злокачественных новообразований и инфекционных заболеваний. Предпочтительно, такие составы будут иметь длительный срок хранения, являться стабильными при хранении и транспортировке и пригодными для введения в высоких концентрациях, например, для применения при подкожном введении, а также низких концентрациях, например, для внутривенного введения.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к стабильным составам антител против рецептора программируемой смерти PD-1 человека или их антигенсвязывающих фрагментов. Настоящее изобретение дополнительно относится к способам лечения различных злокачественных новообразований и хронических инфекций с использованием стабильных составов антител против рецептора программируемой смерти PD-1 человека или их антигенсвязывающих фрагментов.
В определенных вариантах осуществления изобретение относится к лиофилизированному составу антител против PD-1 человека или его антигенсвязывающего фрагмента, содержащему: a) указанное антитело против PD-1 человека или его антигенсвязывающий фрагмент; b) гистидиновый буфер; c) полисорбат 80; и d) сахарозу.
В определенных вариантах осуществления после восстановления состав имеет pH от 5,0 до 6,0.
В определенных вариантах осуществления лиофилизированный состав позволяет восстанавливать антитело или его антигенсвязывающий фрагмент в концентрации приблизительно от 25 мг/мл до 100 мг/мл.
В определенных вариантах осуществления полисорбат 80 присутствует в массовом отношении приблизительно 0,02% (мас./об.).
В определенных вариантах осуществления сахароза присутствует в массовом отношении приблизительно 7% (масс./об.).
В дополнительных вариантах осуществления изобретение относится к лиофилизированному фармацевтическому составу антитела против PD-1 человека или его антигенсвязывающего фрагмента, полученному лиофилизацией водного раствора, содержащего: a) 25-100 мг/мл антитела против PD-1 или его антигенсвязывающего фрагмента; b) приблизительно 70 мг/мл сахарозы; c) приблизительно 0,2 мг/мл полисорбата 80; и d) приблизительно 10 мМ гистидинового буфера при pH 5,0-6,0.
В определенных вариантах осуществления антитело против PD-1 человека или его антигенсвязывающий фрагмент присутствуют в водном растворе в концентрации приблизительно 25 мг/мл. В определенных вариантах осуществления водный раствор имеет pH приблизительно 5,5.
В дополнительных вариантах осуществления изобретение относится к лиофилизированному фармацевтическому составу антитела против PD-1 человека или его антигенсвязывающего фрагмента, после восстановления содержащему: a) 25-100 мг/мл антитела против PD-1 человека или его антигенсвязывающего фрагмента; b) приблизительно 70 мг/мл сахарозы; c) приблизительно 0,2 мг/мл полисорбата 80; и d) приблизительно 10 мМ гистидинового буфера при pH приблизительно 5,0-6,0.
В определенных вариантах осуществления антитело против PD-1 человека или его антигенсвязывающий фрагмент присутствует в восстановленном растворе в концентрации приблизительно 25 мг/мл. В определенных вариантах осуществления восстановленный раствор имеет pH приблизительно 5,5.
В дополнительных вариантах осуществления изобретение относится к жидкому фармацевтическому составу антитела против PD-1 человека или его антигенсвязывающему фрагменту, содержащему: a) 25-100 мг/мл антитела против PD-1 или его антигенсвязывающего фрагмента; b) приблизительно 70 мг/мл сахарозы; c) приблизительно 0,2 мг/мл полисорбата 80; и d) приблизительно 10 мМ гистидинового буфера при pH 5,0-6,0.
В дополнительных вариантах осуществления изобретение относится к фармацевтическому составу антитела против PD-1 человека или его антигенсвязывающего фрагмента, содержащему: a) указанное антитело против PD-1 человека или его антигенсвязывающий фрагмент; b) гистидиновый буфер; c) полисорбат 80, и d) сахарозу. В определенных вариантах осуществления после восстановления состав имеет pH от 5,0 до 6,0. В определенных вариантах осуществления полисорбат 80 присутствует в массовом отношении приблизительно 0,02% (масс./об.). В определенных вариантах осуществления сахароза присутствует в массовом отношении приблизительно 7% (масс./об.).
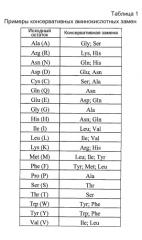
В дополнительных вариантах осуществления изобретение относится к любому из составов, описываемых в настоящем описании, где антитело или его антигенсвязывающий фрагмент содержат легкую цепь, содержащую три последовательности CDR, выбранные из группы, состоящей из SEQ ID NO: 9, 10, 11, 15, 16 и 17.
В дополнительных вариантах осуществления изобретение относится к любому из составов, представленных в настоящем описании, где антитело или его антигенсвязывающий фрагмент содержат тяжелую цепь, содержащую три последовательности CDR, выбранных из группы, состоящей из SEQ ID NO: 12, 13, 14, 18, 19 и 20.
В дополнительных вариантах осуществления изобретение относится к любому из составов, представленных в настоящем описании, где антитело или его антигенсвязывающий фрагмент содержат: i) легкую цепь, содержащую три последовательности CDR SEQ ID NO: 15, 16 и 17; и ii) тяжелую цепь, содержащую три последовательности CDR SEQ ID NO: 8, 19 и 20.
В дополнительных вариантах осуществления изобретение относится к любому из составов, представленных в настоящем описании, где антитело или его антигенсвязывающий фрагмент содержат вариабельный домен легкой цепи, содержащий аминокислотные остатки с 20 по 130 из SEQ ID NO: 32.
В дополнительных вариантах осуществления изобретение относится к любому из составов, представленных в настоящем описании, где антитело или его антигенсвязывающий фрагмент содержат вариабельный домен тяжелой цепи, содержащий SEQ ID NO: 31.
В дополнительных вариантах осуществления изобретение относится к любому из составов, представленных в настоящем описании, где антитело или его антигенсвязывающ фрагмент содержат: i) легкую цепь, содержащую аминокислотные остатки с 20 по 237 из SEQ ID NO: 36, и ii) тяжелую цепь, содержащую аминокислотные остатки с 20 по 466 из SEQ ID NO: 31.
В дополнительных вариантах осуществления изобретение относится к любому из составов, представленных в настоящем описании, где антитело выбрано из группы, состоящей из h409A11, h409A16 и h409A17.
В дополнительных вариантах осуществления изобретение относится к способу лечения хронической инфекции у нуждающегося в этом млекопитающего, включающему введение эффективного количество любого из составов, представленных в настоящем описании.
В дополнительных вариантах осуществления изобретение относится к способу лечения злокачественного новообразования у нуждающегося в этом млекопитающего, включающему введение эффективного количества любого из составов, представленных в настоящем описании. В определенных вариантах осуществления эффективное количество содержит дозу антитела против PD-1 человека, выбранную из группы, состоящей из 1,0, 3,0 и 10 мг/кг.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фигурах 1A-B представлены данные о стабильности для лиофилизированных составов h409A11 при pH 5,5, хранящихся при 5°C (24 месяца).
На фигурах 2A-B представлены данные о стабильности для лиофилизированных составов h409A11 при pH 5,5, хранящихся в условиях 25H (25°C, 60% RH, 12 месяцев).
На фигурах 3A-B представлены данные о стабильности для лиофилизированных составов h409A11 при pH 5,5, хранящихся в условиях RH4 (40°C, 75% RH, 6 месяцев).
На фигурах 4A-B представлены данные о стабильности для лиофилизированных составов h409A11, хранящихся при 5°C (24 месяца).
На фигурах 5A-B представлены данные о стабильности для лиофилизированных составов h409A11 при pH 5,5, хранящихся в условиях 25H (25°C, 60% RH, 6 месяцев).
На фигурах 6A-B представлены данные о стабильности для лиофилизированных составов h409A11 при pH 5,5, хранящихся в условиях RH4 (40°C, 75% RH, 6 месяцев).
На фигурах 7A-B представлены данные о стабильности для лиофилизированных составов h409A11, хранящихся при 5°C (24 месяца).
На фигурах 8A-B представлены данные о стабильности для лиофилизированных составов h409A11 в условиях 25H (25°C, 60% RH, 6 месяцев).
На фигурах 9A-B представлены данные о стабильности для лиофилизированных составов h409A11 в условиях RH4 (40°C, 75% RH, 6 месяцев).
ПОДРОБНОЕ ОПИСАНИЕ
Настоящее изобретение относится к составам антител против PD-1 и их применению для лечения различных злокачественных новообразований и инфекционных заболеваний.
Антитело против PD-1 h409A11 является примером антитела в стабильных составах, представленных в настоящем описании. Три гуманизированных моноклональных антитела против PD-1 (т.е. h409A11, h409A16 и h509A17), подходящих для настоящих составов, описывают в находящейся на одновременном рассмотрении патентной публикации WO2008/156712. Кроме того, составы, представленные в настоящем описании, применимы для лечения конкретных злокачественных новообразований, а также хронических инфекций. В таблице 2 представлен список соответствующих последовательностей CDR для h409A11. В таблице 6 представлен список последовательностей примеров антител против PD-1.
В соответствии с настоящим изобретением можно использовать общепринятые способы молекулярной биологии, микробиологии, экспрессия и очистки белков, антител и способы рекомбинантной ДНК, известные в этой области техники. Такие способы полностью описаны в литературе. См., например,
I. Определения
Как применяют в настоящем описании, термин "антитело" относится к любой форме антитела, проявляющей желаемую биологическую активность. Таким образом, его используют в самом широком смысле, и он конкретно включает моноклональные антитела (включая полноразмерные моноклональные антитела), поликлональные антитела, полиспецифические антитела (например, биспецифические антитела), химерные антитела, гуманизированные антитела, полностью человеческие антитела и т.д. при условии, что они проявляют желательную биологическую активность.
Адъювант
Как применяют в настоящем описании, термин "адъювант" относится к соединению или смеси, повышающим иммунный ответ на антиген. Адъювант может служить в качестве тканевого депо, медленно высвобождающего антиген, а также активатора лимфоидной системы, неспецифически повышающего иммунный ответ (Hood et al., Immunology, Second Ed., 1984, Benjamin/Cummings: Menlo Park, California, p. 384). Зачастую, первичное введение антигена в отдельности в отсутствие адъюванта не будет вызывать гуморальный или клеточный иммунный ответ. Адъюванты включают, в качестве неограничивающих примеров, полный адъювант Фрейнда, неполный адъювант Фрейнда, сапонин, минеральные гели, такие как гидроксид алюминия, поверхностно-активные вещества, такие как лизолецитин, полиолы-плюроники, полианионы, пептиды, масла или углеводородные эмульсии, гемоцианины морского блюдца и потенциально применимые адъюванты человека, такие как N-ацетил-мурамил-L-треонил-D-изоглутамин (thr-MDP), N-ацетил-нор-мурамил-L-аланил-D-изоглутамин, N-ацетилмурамил-L-аланил-D-изоглутаминил-L-аланин-2-(1'-2'-дипальмитоил-sn-глицеро-3-гидроксифосфорилокси)-этиламин, BCG (бацила Кальмета-Герена) и Corynebacterium parvum. Предпочтительно, адъювант является фармацевтически приемлемым.
Цитокин
Термин "цитокин" представляет собой общий термин для белков, высвобождаемых одной популяции клеток, действующих на другую клетку в качестве межклеточных медиаторов. Примерами таких цитокинов являются лимфокины, монокины, хемокины и общепринятые полипептидные гормоны. Примеры цитокинов включают: ИЛ-2, ИФНγ, ИЛ-6, ФНО, ИЛ-17 и ИЛ-5 человека.
Цитотоксическое средство
Как применяют в настоящем описании, термин "цитотоксическое средство" относится к веществу, ингибирующему или предотвращающему функционирование клеток и/или вызывающему разрушение клеток. Термин предназначен для включения радиоактивных изотопов (например, I131, I125, Y90 и Re186), химиотерапевтических средств и токсинов, таких как ферментативно активные токсины бактериального, грибкового, растительного или животного происхождения или их фрагменты.
Терапевтическое использование и способы
Блокирующие PD-1 средства включают средства, специфически связывающиеся с PD-1 человека, их можно использовать для повышения, усиления, стимуляции или повышенной регуляции иммунного ответа. Желаемые индивидуумы включают пациентов-людей, нуждающихся в усилении иммунного ответа, включая пациентов со злокачественным новообразованием и/или хронической вирусной инфекцией.
Злокачественное новообразование
Термины "злокачественное новообразование" или "злокачественный" относятся к, или с помощью них описывают физиологическое состояние у млекопитающих, как правило, отличающееся неконтролируемым ростом клеток. Примеры злокачественного новообразования включают, в качестве неограничивающих примеров, карциному, лимфому, лейкоз, бластому и саркому. Более конкретные примеры таких злокачественных новообразований включают плоскоклеточную карциному, миелому, мелкоклеточный рак легких, немелкоклеточный рак легких, глиому, лимфому Ходжкина, неходжкинскую лимфому, злокачественное новообразование желудочно-кишечного тракта, рак почки, рак яичников, рак печени, лимфобластный лейкоз, лимфоцитарный лейкоз, колоректальный рак, рак эндометрия, рак почки, рак предстательной железы, рак щитовидной железы, меланому, хондросаркому, нейробластому, рак поджелудочной железы, мультиформную глиобластому, рак шейки матки, злокачественное новообразование головного мозга, рак желудка, рак мочевого пузыря, гепатому, рак молочной железы, рак толстого кишечника и рак головы и шеи.
Блокирующие PD-1 средства включают средства, используемые для лечения злокачественного новообразования (т.е. для ингибирования роста или выживания опухолевых клеток). Предпочтительные злокачественные новообразования, рост которых можно ингибировать с использованием антител против PD-1, таких как гуманизированное антитело против PD-1 h409A11, включают злокачественные новообразования, как правило, восприимчивые к иммунотерапии, но также и злокачественные новообразования которые до сих пор не связывали с иммунотерапией. Неограничивающие примеры предпочтительных злокачественных новообразований для лечения включают меланому (например, метастазирующую злокачественную меланому), рак почки (например, светлоклеточный рак), рак предстательной железы (например, гормонорезистентный рак предстательной железы), аденокарциному поджелудочной железы, рак молочной железы, рак толстого кишечника, рак легких (например, немелкоклеточный рак легких), рак пищевода, плоскоклеточную карциному области головы и шеи, рак печени, рак яичников, рак шейки матки, рак щитовидной железы, глиобластому, глиому, лейкоз, лимфому и другие злокачественные новообразования. Злокачественные новообразования, проявляющие улучшенную безрецидивную и общую выживаемость в отношении наличия инфильтрирующих опухоль лимфоцитов в биопсийном или хирургическом материале, например, меланома, колоректальный рак, рак печени, почки, желудка/пищевода, молочной железы, поджелудочной железы и рак яичников, включают в способы и средства лечения, представленные в настоящем описании. Известно, что такие подтипы злокачественных новообразований восприимчивы к иммунному контролю T-лимфоцитами. Дополнительно включают рефрактерные или рецидивирующие злокачественные новообразования, рост которых можно ингибировать с использованием антител, представленных в настоящем описании. Особенно предпочтительные злокачественные новообразования включают отличающиеся повышенной экспрессией PD-1 и/или его лигандов PD-L1 и/или PD-L2 в тестируемых образцах ткани, включая: рак яичника, почки, колоректальный рак, рак поджелудочной железы, молочной железы, печени, желудка, пищевода и меланому. Дополнительные злокачественные новообразования, при которых полезным может являться лечение с использованием антител против PD-1, таких как гуманизированное антитело против PD-1 h409A11, включают ассоциированные с персистирующей инфекцией вирусами, такими как вирусы иммунодефицита человека, вирусы гепатита A, B и C, вирус Эпштейна-Барр, вирусы папилломы человека, о которых известно, что они причинно связаны, например, с саркомой Капоши, раком печени, назофарингеальной карциномой, лимфомой, раком шейки матки, злокачественными новообразованиями наружных женских половых органов, раком анального канала, раком полового члена и полости рта.
Химиотерапевтическое средство
"Химиотерапевтическое средство" является химическим соединением, применимым в лечении злокачественного новообразования. Антитела против PD-1 можно использовать с любым одним или несколькими подходящими химиотерапевтическими средствами. Примеры таких химиотерапевтических средств включают алкилирующие средства, такие как тиотепа и циклофосфамид; алкилсульфонаты, такие как бусульфан, импросульфан и пипосульфан; азиридины, такие как бензодопа, карбоквон, метуредопа и уредопа; этиленимины и methylamelamines, включая алтретамин, триэтиленмеламин, триэтиленфосфамид, триэтилентиофосфамид и триметилоломеламин; ацетогенины (особенно буллатацин и буллатацинон); камптотецин (включая синтетический аналог топотекан); бриостатин; каллистатин; CC-1065 (включая его синтетические аналоги адозелезин, карзелезин и бизелезин); криптофицины (в частности, криптофицин 1 и криптофицин 8); доластатин; дуокармицин (включая синтетические аналоги, KW-2189 и CBI-TMI); элеутеробин; панкратистатин; саркодиктин; спонгистатин; азотистые иприты, такие как хлорамбуцил, хлорнафазин, холофосфамид, эстрамустин, ифосфамид, мехлоретамин, гидрохлорид оксида мехлоретамина, мелфалан, новэмбихин, фенестерин, преднимустин, трофосфамид, урацила иприт; нитрозомочевины, такие как кармустин, хлорзотоцин, фотемустин, ломустин, нимустин, ранимустин; антибиотики, такие как энедииновые антибиотики (например, калихеамицин, особенно калихеамицин гамма-1I и калихеамицин фи-1I, см., например, Agnew, Chem. Intl. Ed. Engl., 33:183-186 (1994); динемицин, включая динемицин A; бисфосфонаты, такие как клодронат; эсперамицин; а также хромофор неокарциностатин и родственные ему хромофоры хромопротеиновых энедииновых антибиотиков), аклациномизины, актиномицин, аутрамицин, азасерин, блеомицины, кактиномицин, карабицин, карминомицин, карцинофилин, хромомицины, дактиномицин, даунорубицин, деторубицин, 6-диазо-5-оксо-L-норлейцин, доксорубицин (включая морфолино-доксорубицин, цианоморфолино-доксорубицин, 2-пирролино-доксорубицин и дезоксидоксорубицин), эпирубицин, эзорубицин, идарубицин, марцелломицин, митомицины, такие как митомицин C, микофеноловая кислота, ногаламицин, оливомицины, пепломицин, потфиромицин, пуромицин, квеламицин, родорубицин, стрептонигрин, стрептозоцин, туберцидин, убенимекс, зиностатин, зорубицин; антиметаболиты, такие как метотрексат и 5-фторурацил (5-FU); аналоги фолиевой кислоты, такие как деноптерин, метотрексат, птероптерин, триметрексат; аналоги пурина, такие как флударабин, 6-меркаптопурин, тиамиприн, тиогуанин; аналоги пиримидина, такие как анцитабин, азацитидин, 6-азауридин, кармофур, цитарабин, дидезоксиуридин, доксифлуридин, эноцитабин, флоксуридин; андрогены, такие как калустерон, дромостанолон пропионат, эпитиостанол, мепитиостан, тестолактон; антиадреналовые вещества, такие как аминоглутетимид, митотан, трилостан; наполнитель на основе фолиевой кислоты, такой как фролиновая кислота; ацеглатон; альдофосфамида гликозид; аминолевулиновая кислота; энилурацил; амсакрин; бестрабуцил; бисантрен; эдатраксат; дефофамин; демекольцин; диазиквон; эльфорнитин; эллиптиния ацетат; эпотилон; этоглуцид; нитрат галлия; гидроксимочевину; лентинан; лонидаинин; майтанзиноиды, такие как майтанзин и ансамитоцины; митогуазон; митоксантрон; мопидамол; нитракрин; пентостатин; фенамет; пирарубицин; лозоксантрон; подофиллиновая кислота; 2-этилгидразид; прокарбазин; разоксан; ризоксин; сизофиран; спирогерманий; тенуазоновая кислота; триазиквон; 2,2',2"-трихлортриэтиламин; трихотецены (особенно токсин T-2, верракурин A, роридин A и ангвидин); уретан; виндезин; дакарбазин; манномустин; митобронитол; митолактол; пипоброман; гацитозин; арабинозид ("Ara-C"); циклофосфамид; тиотепа; таксоиды, например, паклитаксел и доксетаксел; хлорамбуцил; гемцитабин; 6-тиогуанин; меркаптопурин; метотрексат; аналоги платины, такие как цисплатин и карбоплатин; винбластин; платина; этопозид (VP-16); ифосфамид; митоксантрон; винкристин; винорелбин; новантрон; тенипозид; эдатрексат; дауномицин; аминоптерин; кселода; ибандронат; CPT-11; ингибитор топоизомеразы RFS 2000; дифторметилорнитин (DMFO); ретиноиды, такие как ретиноевая кислота; капецитабин и фармацевтически приемлемые соли, кислоты или производные любого из указанного выше. Кроме того, включают противогормональные средства, действующие, регулируя или ингибируя действие гормонов на опухоли, такие как антиэстрогены и селективные модуляторы эстрогеновых рецепторов (SERM), включая, например, тамоксифен, ралоксифен, дролоксифен, 4-гидрокситамоксифен, триоксифен, кеоксифен, LY117018, онапристон и торемифен (Фарестон); ингибиторы ароматазы, ингибирующие фермент ароматазу, регулирующие продукцию эстрогена в надпочечниках, такие как, например, 4(5)-имидазолы, аминоглутетимид, мегестрола ацетат, экземестан, форместан, фадрозол, ворозол, летрозол и анастрозол; и антиандрогены, такие как флутамид, нилутамид, бикалутамид, леупролид и гозерелин; и фармацевтически приемлемые соли, кислоты или производные любого из указанного выше.
Ингибирующее рост средство
Как применяют в настоящем описании, "ингибирующее рост средство" относится к соединению или композиции, ингибирующей рост клеток, особенно злокачественных клеток, гиперэкспрессирующих любой из генов, определенных в настоящем описании, in vitro или in vivo. Таким образом, ингибирующее рост средство является средством, значительно снижающим процентную долю клеток, гиперэкспрессирующих такие гены в S-фазе. Примеры ингибирующих рост средств включают средства, блокирующие прохождение клеточного цикла (в любой момент, кроме S-фазы), такие как средства, индуцирующие арест клеточного цикла в G1-фазу и M-фазу. Классические блокаторы M-фазы включают таксаны барвинка (винкристин и винбластин) и ингибиторы топоизомеразы II, такие как доксорубицин, эпирубицин, даунорубицин и этопозид. Те средства, которые вызывают арест в G1-фазе, также вызывают арест в S-фазе, например, ДНК-алкилирующие средства, такие как дакарбазин, мехлоретамин и цисплатин. Дополнительную информацию можно найти в The Molecular Basis of Cancer, Mendelsohn and Israel, eds., Chapter 1, под названием "Cell cycle regulation, oncogens, and antineoplastic drugs" by Murakami et al. (WB Saunders: Philadelphia, 1995).
Антитело или фрагменты антител в комбинации с дополнительными средствами
Антитело против PD-1 или фрагменты антител можно использовать в отдельности или в комбинации с: другими противоопухолевыми средствами или иммуногенными средствами (например, аттенуированными злокачественными клетками, опухолевыми антигенами (включая рекомбинантные белки, пептиды и молекулы углеводов), антигенпредставляющие клетки, такие как дендритные клетки, активированные антигеном или нуклеиновыми кислотами, полученными из опухоли, иммуностимулирующими цитокинами (например, ИЛ-2, ИФНα2, ГМ-КСФ) и клетками, трансфицированными с использованием генов, кодирующих иммуностимулирующие цитокины, такие как, в качестве неограничивающих примеров, ГМ-КСФ); стандартными способами лечения злокачественных опухолей (например, химиотерапией, лучевой терапией или хирургическим вмешательством); или другими антителами (включая, в качестве неограничивающих примеров, антитела против VEGF, EGFR, Her2/neu, рецепторов VEGF, рецепторов других факторов роста, CD20, CD40, CD-40L, CTLA-4, OX-40, 4-1BB и ICOS).
Инфекционные заболевания
Антагонистические антитела против PD-1 или фрагменты антител также можно использовать для профилактики или лечения инфекций и инфекционного заболевания. Эти средства можно использовать в отдельности или в комбинации с вакцинами для стимуляции иммунного ответа на патогены, токсины и аутоантигены. Антитела или их антигенсвязывающие фрагменты можно использовать для стимуляции иммунного ответа на вирусы, патогенные для людей, включая, в качестве неограничивающих примеров: вирусы иммунодефицита человека, вирусы гепатита A, B и C, вирус Эпштейна-Барр, цитомегаловирус человека, вирусы папилломы человека и вирусы герпеса. Антагонистические антитела против PD-1 или фрагменты антител можно использовать для стимуляции иммунного ответа на инфекцию бактериальными или грибковыми паразитами и другими патогенами. Инфекции вирусами гепатита B и C и ВИЧ, среди прочего, считают хроническими вирусными инфекциями.
Как применяют в настоящем описании, термины "PD-1-связывающий фрагмент", "его антигенсвязывающий фрагмент", "его связывающий фрагмент" или "его фрагмент" включают фрагмент или производное антитела, по существу сохраняющее его биологическую активность связывания с антигеном (PD-1 человека) и его ингибирующую активность (например, блокирование связывания PD-1 с PDL1 и PDL2). Таким образом, термин "фрагмент антитела" или "PD-1-связывающий фрагмент" относится к части полноразмерного антитела, как правило, его антигенсвязывающей части или вариабельной области. Примеры фрагментов антител включают Fab-, Fab'-, F(ab')2- и Fv-фрагменты; диатела, линейные антитела, одноцепочечные молекулы антител, например, sc-Fv, и полиспецифические антитела, полученные из фрагментов антител. Как правило, связывающий фрагмент или производное сохраняет, по меньшей мере, 10% его ингибирующей PD-1 активности. Предпочтительно, связывающей фрагмент или производное сохраняет, по меньшей мере, 25%, 50%, 60%, 70%, 80%, 90%, 95%, 99% или 100% (или более) его ингибирующей PD-1 активности, хотя применимым будет являться любой связывающий фрагмент с аффинностью, достаточной для проявления желаемого биологического эффекта. Также предполагают, что PD-1-связывающий фрагмент может включать варианты, имеющие консервативные аминокислотные замены, по существу не изменяющие его биологическую активность.
"Доменное антитело" является иммунологически функциональным фрагментом иммуноглобулина, содержащим только вариабельную область тяжелой цепи или вариабельную область легкой цепи. В некоторых случаях две или более областей VH ковалентно соединяют с пептидным линкером для получения бивалентного доменного антитела. Две области VH бивалентного доменного антитела могут являться направленными против одного или разных антигенов.
"Бивалентное антитело" содержит два антигенсвязывающих участка. В некоторых случаях два участка связывания имеют одинаковую специфичность против антигена. Однако бивалентные антитела могут являться биспецифическими. Как применяют в настоящем описании, термин "биспецифическое антитело" относится к антителу, как правило, моноклональному антителу, имеющему специфичность связывания, по меньшей мере, для двух различных эпитопов антигена. В одном из вариантов осуществления эпитопы происходят из одного антигена. В другом варианте осуществления эпитопы принадлежат двум различным антигенам. В этой области известны способы получения биспецифических антител. Например, биспецифические антитела можно получать рекомбинантно с использованием коэкспрессии двух пар тяжелых цепей/легких цепей иммуноглобулина. См., например, Milstein et al. (1983) Nature 305:537-39. Альтернативно, биспецифические антитела можно получать с использованием химического соединения. См., например, Brennan et al. (1985) Science 229:81. Биспецифические антитела включают фрагменты биспецифических антител. См., например, Holliger et al. (1993) Proc. Natl. Acad. Sci. U.S.A. 90:6444-48, Gruber et al. (1994) J. Immunol. 152:5368.
Как применяют в настоящем описании, термин "одноцепочечное Fv" или антитело "scFv" относится к фрагментам антител, содержащим домены VH и VL антитела, где эти домены присутствуют в единой полипептидной цепи. Как правило, полипептид Fv дополнительно содержит полипептид линкер между доменами VH и VL, позволяющий sFv образовывать желаемую структуру для связывания антигена. Обзор sFv см. в Pluckthun (1994) THE PHARMACOLOGY OF MONOCLONAL ANTIBODIES, vol. 113, Rosenburg and Moore eds. Springer-Verlag, New York, pp. 269-315.
Моноклональные антитела в настоящем описании также включают камелизированн