Улучшенная среда для культивирования клеток
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, в частности к культивированию клеток и их применению для получения полипептидов. Способ получения рекомбинантного посттрансляционно модифицированного полипептида предусматривает стадию продукции. Рекомбинантные клетки CHO культивируют в среде для культивирования клеток, причем среда для культивирования клеток представляет собой среду, не содержащую сыворотку и не содержащую белки, но содержащую от 220 до 2500 мг/л хлорида холина или эквивалентное количество другой соли холина. Среды для культивирования клеток с высоким содержанием хлорида холина особенно пригодны для периодического культивирования клеток с подпиткой, при котором жизнеспособность клеток остается на более высоком уровне в течение более длительного периода времени и с высокими титрами полипептида, хотя и используют ограниченные количества аминокислот. 2 н. и 7 з.п. ф-лы, 24 ил.
Реферат
Область техники
Настоящее изобретение относится к общей биотехнологии, в частности к культивированию клеток и их применению для получения полипептидов в промышленном масштабе.
Настоящее изобретение относится к средам для культивирования клеток с высоким содержанием хлорида холина, которые обеспечивают культивирование клеток с высокой жизнеспособностью в течение более длительного периода времени. Среды для культивирования клеток по настоящему изобретению, кроме того, позволяют обеспечить высокую продуктивность полипептида и/или улучшенное качество продукта при его использовании для получения полипептида путем рекомбинантной экспрессии полипептидов с использованием систем для культивирования клеток CHO, в частности, в промышленном масштабе.
Уровень техники, к которому относится изобретение
Получение полипептидов с использованием рекомбинантной технологии стало стандартной методикой за последние два десятилетия. Доступ к рекомбинантным полипептидам путем клонирования генов, кодирующих соответствующий полипептид, с последующей трансформацией подходящих хозяев для экспрессии экспрессируемого геном и конечным продуцированием и очисткой полученного рекомбинантного полипептидого продукта позволил получить целый новый класс биологически смоделированных и продуцированных лекарственных средств.
Фармацевтически активные соединения получают в повышающихся количествах в фармацевтической промышленности с использованием технологии рекомбинантных ДНК, а затем способами обработки, разработанными в области биоинженерии.
Такие биологические продукты включают моноклональные антитела, на основе которых были созданы важные варианты лечения в различных областях медицины, включая аутоиммунные заболевания, воспалительные нарушения, заболевание с подавлением иммунного ответа, онкологию или тому подобное.
Для создания таких лекарственных средств биологического происхождения требуется получение в промышленном масштабе, тем самым, обеспечения доступа к большим количествам рекомбинантного полипептида. Предпочтительными экспрессирующими системами являются культуры клеток млекопитающих, которые превосходят большинство других эукариотических систем, основанных на клетках насекомых, дрожжах или тому подобное, или даже традиционные прокариотические экспрессирующие системы.
Однако с клеточной культурой млекопитающих связаны значительные проблемы, особенно при получении в промышленном масштабе. Средства производства для культуры клеток млекопитающих требуют тщательной оптимизации многих условий процесса.
Одним из наиболее важных параметров процесса для контроля общего процесса получения является среда, в которой растут клетки. Подходящие среды для культивирования клеток должны снабжать клеточные культуры всеми необходимыми питательными веществами, что особенно трудно, если в среду не добавляют компонентов животного происхождения, таких как сыворотка или белки, например факторы роста.
Кроме того, для культуры клеток млекопитающих требуются конкретные дополнительные компоненты на различных стадиях процесса получения полипептидов. Таким образом, среда для культивирования клеток должна представлять необходимые субстраты в ходе a) первоначального роста и пролиферации клеток-хозяев при более низкой плотности; b) последующего культивирования клеток до высокой плотности; c) фактического процесса формирования полипептида в культивируемых клетках.
Общий способ продуцирования рекомбинантного полипептида предпочтительно включает фазу увеличения количества и фазу продуцирования. В фазе увеличения количества клетки-хозяева культивируют до высокой плотности с использованием среды для роста для максимизации последующей продукции полипептида. На стадии продукции достигают фактического образования желаемого полипептида в больших количествах с использованием среды для продуцирования. Для удовлетворения конкретных метаболических потребностей клеток на каждой фазе всего процесса получения полипептида были разработаны различные композиции сред для стадии увеличения количества и получения соответственно. Например, среды для продуцирования часто содержат более высокие количества аминокислот, чем среды для роста.
Таким образом, в прошлом были предприняты значительные усилия для разработки сред для культивирования клеток, конкретно, с акцентом на их применение для крупномасштабного получения полипептидов. Тем не менее, постоянное улучшение среды для культивирования клеток остается важной задачей дальнейшей максимизации получения полипептида с точки зрения качества продукта и количественного выхода.
Ранее были исследованы многие компоненты клеточных культуральных сред с точки зрения их роли в получении полипептида. Возможными мишенями являются неорганические соли, аминокислоты, источники углерода, такие как глюкоза, или витамины.
Например, было показано, что добавление соединениями, такими как витамины, хлорид холина или аминокислоты, может увеличить жизнеспособность и продуктивность клеток, культивируемых в условиях отсутствия белка (Kim do Y et al., Cytotechnology 2005, 47, 37-49).
Хлорид холина является стандартным компонентом среды для культивирования клеток, который служит в качестве предшественника фосфолипидов для клеток. После захвата и процессирования клетками его конечным продуктом является, помимо фосфатидилэтаноламина и фосфатидилинозитола, один из основных фосфолипидов в клеточных мембранах, называемый фосфатидилхолином.
Широко используемые среды для культивирования клеток, такие как D-MEM (модифицированная способом Дульбекко среда Игла) и D-MEM/F-12, широко используют для выращивания широкого диапазона клеточных линий млекопитающих. Эти среды включают количества хлорида холина, составляющие 4 мг/л и 8,98 мг/л соответственно.
Другие коммерчески доступные среды, такие как среда Хэма F-12 (коммерчески доступная от BioConcept) и MEM (коммерчески доступная от HyClone), также содержат низкие количества хлорида холина, составляющие 13,96 мг/л и 56 мг/л соответственно.
В US 6180401 описан улучшенный способ получения полипептида в культуре клеток животных. Одной из задач является увеличение концентрации конечного продукта. Для максимизации выхода продукта на стадии продукции модифицируют несколько параметров, включая концентрацию глюкозы, осмолярность и концентрацию глутамина. В US 6180401 описана среда для культивирования клеток, которая имеет содержание хлорида холина 50,86 мг/л.
В US 5122469 описана культуральная среда для размножения различных клеточных линий млекопитающих, в частности клеток яичника китайского хомячка (CHO), и она обеспечивает культивирование клеток при высокой плотности в качестве монослоев или в суспензии, подходящих для мелкомасштабного и крупномасштабного размножения клеток млекопитающих. Еще одним преимуществом является повышение выхода продукта. Среда представляет собой культуральную среду с определенным химическим составом, содержащую повышенные уровни определенных аминокислот. Содержание хлорида холина составляет 50,86 мг/л.
Из уровня техники известно очень мало сред с высоким содержанием хлорида холина. Waymouth описал среду для культивирования клеток, которую можно использовать для культивирования клеточной линии фибробластов соединительной ткани L929 (C. Waymouth, J. Natl. Cancer. Inst., 1959, 22, 1003-1017). Эта среда представляет собой бессывороточную среду с определенным химическим составом, и содержание хлорида холина в ней составляет 250 мг/л. Эта среда коммерчески доступна под названием Waymouth's Medium MB 752/1 (BioConcept and Sigma-Aldrich). Известная возможность использования ограничена культурой целого органа, установлением клеточных линий карциномы из плевральных выпотов и выращиванием потенциально образующих опухоли клеток перед их оценкой in vivo.
В WO 02/101019 описаны две композиции среды с относительно высоким содержанием хлорида холина 101,72 мг/л и 209,40 мг/л соответственно. Эти среды использовали для исследования влияния глутамина и глутамата на получение рекомбинантных белков. Однако обе среды, тем не менее, содержали высокие количества глутамина.
Из уровня техники известна лишь ограниченная информация в отношении роли содержания хлорида холина в средах для культивирования клеток в продуцировании полипептида. В US 6048728 кратко обсуждается роль содержания хлорида холина в средах для культивирования клеток в продуцировании биологических продуктов с использованием клеток гибридом. В случае клеток, экспрессирующих антитело, секрецию максимальных количеств антитела наблюдали в средах с добавлением холина более 4 мг/л и предпочтительно приблизительно от 4 до 75 мг/л в сочетании с другими реагентами Primary Supplement. Описано, что в этих концентрациях холин не является ограничивающим и не проявляет заметной токсичности.
Получение сред для культивирования клеток, особенно сред, предназначенных для использования для продукции рекомбинантных полипептидов в промышленном масштабе, требует увеличенных количеств компонентов, например аминокислот.
Однако было показано, что высококонцентрированные среды для культивирования клеток имеют ограниченную растворимость отдельных компонентов сред. Ограниченная растворимость является техническим недостатком, поскольку высоко концентрированные среды для крупномасштабного получения несут в себе риск выпадения в осадок отдельных компонентов, например в фазе получения и особенно в ходе хранения. Это может привести к изменению состава сред и ухудшению условий культивирования клеток в критический момент образования белка.
В дальнейшем, осаждение приводит к удалению ценных компонентов сред из фактического процесса получения. Дополнительные процессы рециклирования, предназначенные для устранения таких недостатков, являются технически трудными для осуществления и требуют дополнительных усилий с точки зрения ресурсов и времени. Менее концентрированные среды для культивирования клеток, когда они в равной степени эффективны в отношении получения полипептида, обеспечивают достижения значительного снижения затрат в процессах промышленного продуцирования.
Учитывая указанные выше проблемы и существующие недостатки, продолжает существовать потребность в области промышленной биотехнологии в улучшенных средах для культивирования, которые обеспечивают получение рекомбинантных полипептидов в промышленном масштабе с еще более высокими выходами, т.е. повышенной удельной и общей продуктивностью, и повышенным качеством продукта. Улучшенные среды для культивирования клеток особенно необходимы для повышения продуктивности на стадии продукции.
Конкретной технической задачей процессов получения полипептидов является поддержание более высокой жизнеспособности клеток в конце процесса получения для максимального увеличения конечного выхода полипептида, в частности, вследствие продления времени продуцирования. Более того, также важной технической задачей является уменьшение агрегации образовавшегося рекомбинантного полипептида и улучшение качества продукта, в частности, с точки зрения посттрансляционных модификаций, таких как паттерн гликозилирования.
Наконец, желательным является улучшение среды для крупномасштабной продукции полипептидов, которая содержит уменьшенные количества компонентов, одновременно оставаясь равно эффективной или даже лучшей с точки зрения роста клеток, продуктивности в отношении полипептида, качества рекомбинантного полипептида и функциональности полипептида.
Сущность изобретения
Настоящее изобретение относится к средам для культивирования клеток с высоким содержанием хлорида холина, что приводит к неожиданному увеличению удельной продуктивности клеток и жизнеспособности клеток, особенно на более поздних стадиях процессов биотехнологического получения, и которые предназначены для решения технических проблем, указанных выше. Кроме того, качество рекомбинантного продукта при использовании сред для культивирования клеток также неожиданно улучшается. Среды для культивирования клеток по настоящему изобретению особенно эффективны для использования на фазе стадии продукции. Таким образом, настоящее изобретение обеспечивает получение рекомбинантного полипептида из клеток CHO.
Среды для культивирования клеток можно использовать, в частности, в качестве среды для продуцирования для обеспечения высокого роста клеток, высокой плотности жизнеспособных клеток и высокого титра полипептидов на стадии продукции. Также было обнаружено, что качество продуктов, состоящее в меньшей агрегации и/или лучшей посттрансляционной модификации, такой как характер гликозилирования рекомбинантного продукта, может быть улучшено при использовании сред для культивирования клеток по настоящему изобретению.
В настоящем изобретении, предпочтительно, используют хлорид холина. Однако другие источники холина, например гидроксид холина, тартрат/битартрат холина, сульфат холина, фосфат холина или любое другое соединение холина, основанное на использовании отличающегося противоиона, также подходят для использования в средах для культивирования клеток по настоящему изобретению. При использовании таких других соединений холина их количество предпочтительно выбирают так, чтобы достигнуть той же молярной концентрации холина, которую достигают с использованием хлорида холина в диапазонах и величинах концентраций, приведенных выше, т.е. другая соль холина предпочтительно присутствует в концентрации, эквивалентной описанной концентрации хлорида холина. Это также справедливо для конкретных аспектов и вариантов осуществления, описанных ниже.
Согласно первому аспекту настоящего изобретения, предусмотрена среда для культивирования клеток с содержанием хлорида холина в диапазоне от 60 мг/л до 2500 мг/л. Содержание хлорида холина в среде для культивирования клеток может составлять 80 мг/л или выше, альтернативно 160 мг/л или выше, 200 мг/л или выше или 220 мг/л или выше. Содержание хлорида холина в среде для культивирования клеток ограничено до 2500 мг/л, альтернативно 1000 мг/л, 840 мг/л, 500 мг/л или 300 мг/л. Хлорид холина может находиться в концентрации приблизительно 240 мг/л.
Среда для культивирования клеток согласно первому аспекту изобретения, кроме того, имеет только ограниченное содержание аминокислот, выражаемое общей концентрацией аминокислот от 20 до 57 ммоль/л. Альтернативно, общая концентрация аминокислот составляет выше 25 ммоль/л, выше 30 ммоль/л, выше 35 ммоль/л или даже выше 40 ммоль/л. Кроме того, общая концентрация аминокислот может составлять ниже 54 ммоль/л. Общая концентрация аминокислот, например, может составлять приблизительно 51 ммоль/л.
Кроме того, среда для культивирования клеток необязательно содержит сниженное количество глутамина. В частности, глутамин присутствует в концентрации от 500 до 1400 мг/л, альтернативно от 800 до 1400 мг/л или даже от 900 до 1200 мг/л.
Содержащиеся аминокислоты в среде для культивирования клеток согласно первому аспекту изобретения необязательно могут включать следующие аминокислоты в следующих концентрациях, выраженных в ммоль/л:
| Аргинин | 4,0-6,0, предпочтительно, 4,5-5,5 |
| Аспарагин | 3,0-6,0, предпочтительно, 4,0-5,5 |
| Аспарагиновая кислота | 2,5-4,0, предпочтительно, 3,0-3,6 |
| Глицин | 0,3-0,8, предпочтительно, 0,5-0,7 |
| Гистидин | 0,6-1,0, предпочтительно, 0,7-0,9 |
| Изолейцин | 2,0-5,0, предпочтительно, 3,0-4,0 |
| Лейцин | 3,0-7,0, предпочтительно, 3,5-6,0 |
| Лизин | 2,0-4,0, предпочтительно, 2,5-3,5 |
| Метионин | 1,0-1,5, предпочтительно, 1,2-1,4 |
| Фенилаланин | 1,0-2,0, предпочтительно, 1,3-1,8 |
| Пролин | 2,5-6,0, предпочтительно, 3,0-5,5 |
| Серин | 3,0-8,0, предпочтительно, 4,0-7,0 |
| Треонин | 2,0-3,5, предпочтительно, 2,5-3,1 |
| Триптофан | 0,4-1,0, предпочтительно, 0,5-0,8 |
| Валин | 2,5-5,0, предпочтительно, 3,0-4,5 |
| Тирозин | 1,0-2,0, предпочтительно, 1,2-1,8 |
| Цистин | 0,5-1,0, предпочтительно, 0,6-0,8 |
Среды для культивирования клеток предпочтительно являются средами, не содержащими сыворотку и не содержащими белок. Предпочтительно, они также не содержат гидролизаты белка.
Согласно второму аспекту, настоящее изобретение относится к способу получения рекомбинантного полипептида, включающему фазу продуцирования, где рекомбинантные клетки CHO культивируют в средах для культивирования клеток, согласно первому аспекту изобретения.
Получаемый рекомбинантный полипептид представляет собой, в частности, рекомбинантное антитело. В способе по изобретению клетки предпочтительно культивируют в периодическом процессе с подпиткой.
Краткое описание чертежей
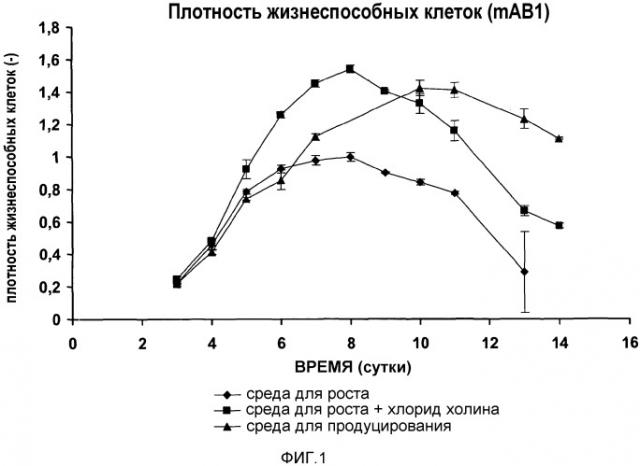
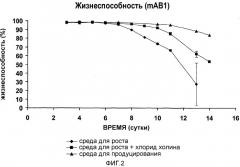
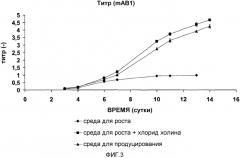
На фиг.1-8 три среды представляют собой среду для роста с низким содержанием холина (♦ (ромб); контроль 1), среду для продуцирования (▲ (треугольник); контроль 2) и среду с высоким содержанием холина, т.е. среду для роста с низким содержанием холина, дополненную дополнительным количеством хлорида холина 200 мг/л (■ (квадрат)).
На фиг.1 представлены нормализованные плотности жизнеспособных клеток для клеток, экспрессирующих mAb1, культивируемых во вращающихся флаконах, в качестве функции времени в трех различных средах для культивирования клеток (эксперимент 1).
На фиг.2 представлена жизнеспособность клеток, экспрессирующих mAb1, культивируемых во вращающихся флаконах, в качестве функции времени в трех различных средах для культивирования клеток (эксперимент 1).
На фиг.3 представлен нормализованный титр полипептида, полученный после культивирования клеток, экспрессирующих mAb1, во вращающихся флаконах в качестве функции времени для трех различных сред (эксперимент 1).
На фиг.4 представлены нормализованные плотности жизнеспособных клеток, экспрессирующих mAb2, культивируемых во вращающихся флаконах в качестве функции времени в трех различных средах для культивирования клеток (эксперимент 2).
На фиг.5 представлена жизнеспособность клеток, экспрессирующих mAb2, культивируемых во вращающихся флаконах, в качестве функции времени в трех различных средах для культивирования клеток (эксперимент 2).
На фиг.6 представлен нормализованный титр полипептида, полученный после культивирования клеток, экспрессирующих mAb2, во вращающихся флаконах, в качестве функции времени для трех различных сред (эксперимент 2).
На фиг.7 представлены нормализованные плотности жизнеспособных клеток, экспрессирующих mAb3, культивируемых во вращающихся флаконах, в качестве функции времени в трех различных средах для культивирования клеток (эксперимент 3).
На фиг.8 представлена жизнеспособность клеток, экспрессирующих mAb3, культивируемых во вращающихся флаконах, в качестве функции времени в трех различных средах для культивирования клеток (эксперимент 3).
На фиг.9 представлен нормализованный титр полипептида, полученный после культивирования клеток, экспрессирующих mAb3, во вращающихся флаконах в качестве функции времени для трех различных сред (эксперимент 3).
На фиг.10 представлен уровень агрегации mAb3, продуцированного после семи суток культивирования во вращающихся колбах. Уровень агрегации измеряют эксклюзионной хроматографией (SEC). Планки погрешностей представляют собой стандартные отклонения для трех повторений биологических экспериментов.
На фиг.11 представлена нормализованная плотность жизнеспособных клеток для клеток, экспрессирующих mAb3, культивируемых при периодическом культивировании с подпиткой в биореакторе в качестве функции времени в трех различных средах для культивирования клеток (эксперимент 4).
На фиг.12 представлена жизнеспособность клеток, экспрессирующих mAb3, культивируемых путем периодического культивирования с подпиткой в биореакторе в качестве функции времени в трех различных средах для культивирования клеток (эксперимент 4).
На фиг.13 представлен нормализованный титр полипептида, полученный с использованием клеток, экспрессирующих mAb3, при периодическом культивировании с подпиткой в качестве функции времени с использованием трех различных сред (эксперимент 4).
На фиг.14 представлен нормализованный титр антитела mAb3, полученный после культивирования клеток в течение 13 суток с использованием среды для роста с низким содержанием холина, дополненной различными концентрациями хлорида холина.
На фиг.15 представлена жизнеспособность клеток, экспрессирующих mAb-3, на 13 сутки культивирования клеток с использованием среды для роста с низким содержанием холина, дополненной различными концентрациями хлорида холина.
На фиг.16 представлена нормализованная плотность жизнеспособных клеток для клеток, экспрессирующих mAb3, начиная с 3 суток (100%) по 13 сутки, с использованием среды для роста с низким содержанием холина, дополненной различными концентрациями хлорида холина.
На фиг.17 представлена жизнеспособность клеток, экспрессирующих mAb3, начиная с 3 суток по 13 сутки, с использованием среды для роста с низким содержанием холина, дополненной различными концентрациями хлорида холина.
На фиг.18 представлено нормализованное развитие титра антитела mAb3, начиная с 3 суток по 13 сутки, при культивировании с использованием среды с низким содержанием холина, дополненной различными концентрациями хлорида холина.
На фиг.19 представлена нормализованная плотность жизнеспособных клеток для клеток, экспрессирующих mAb4, начиная с 0 суток по 17 сутки, с использованием среды с низким содержанием холина, дополненной различными концентрациями хлорида холина.
На фиг.20 представлена жизнеспособность клеток, экспрессирующих mAb4, начиная с 0 суток по 17 сутки, с использованием среды для роста с низким содержанием холина, дополненной различными концентрациями хлорида холина.
На фиг.21 представлена жизнеспособность клеток, экспрессирующих mAb4, на 17 сутки при использовании среды для роста с низким содержанием холина, дополненной различными концентрациями хлорида холина.
На фиг.22 представлен нормализованный титр антитела mAb4, начиная с 7 суток по 17 сутки с использованием среды для роста с низким содержанием холина, дополненной различными концентрациями хлорида холина.
На фиг.23 представлена нормализованная концентрация антитела mAb4 на 17 сутки при использовании среды для роста с низким содержанием холина, дополненной различными концентрациями хлорида холина.
На фиг.24 представлена нормализованная средняя удельная продуктивность клеток (qP) для клеток, экспрессирующих mAb4, полученная при культивировании клеток в течение 17 суток с использованием среды для роста с низким содержанием хлорида холина, дополненной различными концентрациями хлорида холина.
Подробное описание изобретения
Общепринятые среды для культивирования клеток, которые используют для культивирования клеток и последующего получения полипептидов из этих клеточных культур, содержат только небольшие количества хлорида холина. Только очень немногие среды для культивирования клеток, описанные в уровне техники, содержат умеренные или даже высокие количества хлорида холина. Однако эти среды не были системно исследованы с точки зрения того, какую роль высокие количества хлорида холина играют в удельной продуктивности клетки, росте клетки и качестве продукта, особенно при использовании на стадии продукции.
По настоящему изобретению наблюдается неожиданное улучшение удельной продуктивности клеток (или экспрессии полипептида) при культивировании клеток CHO с использованием в качестве сред для получения сред для культивирования клеток, содержащих высокие количества хлорида холина по сравнению с более низкими количествами хлорида холина. В настоящем документе показано, что даже среду для роста, когда в нее добавлены высокие количества хлорида холина, можно неожиданно использовать в качестве эффективной среды для получения в целях культивирования клеток CHO на стадии продукции, тем самым получая большие количества полипептида, предпочтительно полипептида, получаемого рекомбинантной экспрессией полипептида в клеточных культурах.
Хотя по настоящему изобретению предпочтительно используют хлорид холина, другие источники холина, например гидроксид холина, тартрат/битартрат холина, сульфат холина, фосфат холина или любое другое соединение холина, основанное на использовании отличающегося противоиона, также в равной степени подходят для применения в средах для культивирования клеток по настоящему изобретению.
Использование среды для культивирования клеток по настоящему изобретению для получения полипептидов обычно вовлекает культивирование клеток CHO для рекомбинантной экспрессии полипептидов. Предпочтительно среду для культивирования клеток используют для крупномасштабного получения полипептидов. Крупномасштабное получение полипептидов относится к количествам, обычно требуемым для промышленного получения рекомбинантных полипептидов, используемых для получения терапевтически активных биофармацевтических средств. Для использования для крупномасштабного получения, как правило, обычно применяют культуры клеток объемом по меньшей мере 500 л, по меньшей мере 1000 л, по меньшей мере 5000 л или даже больших объемов.
Количество хлорида холина в среде для культивирования клеток по настоящему изобретению, используемой для получения полипептида, значительно превышает содержание хлорида холина, известное для ранее использованных сред для культивирования клеток, используемых для крупномасштабного получения полипептида.
Таким образом, настоящее изобретение может использоваться для получения рекомбинантного полипептида с использованием клеток CHO, имеющих высокое содержание хлорида холина, такое как 60 мг/л или выше, 80 мг/л или выше, 160 мг/л или выше, 200 мг/л или выше или даже 220 мг/л или выше. Содержание хлорида холина в среде для культивирования клеток ограничено до 2500 мг/л, 1000 мг/л, 840 мг/л, 500 мг/л или даже 300 мг/л. Хлорид холина может присутствовать в концентрации приблизительно 240 мг/л.
Чем больше концентрация хлорида холина, тем больше стоимость среды. Таким образом, чрезмерно высокие концентрации хлорида холина невыгодны с экономической точки зрения. Более того, содержание хлорида холина влияет на осмолярность среды. Чрезмерно высокие концентрации хлорида холина могут быть неблагоприятны, поскольку они могут привести, совместно с другими компонентами среды, к общей осмолярности, превышающей желаемую. В частности, в периодических процессах культивирования с подпиткой нежелательно использовать чрезмерно высокую начальную осмолярность, поскольку она может налагать ограничения на стратегию подпиток.
По указанным выше причинам авторы изобретения полагают, что оптимальные концентрации хлорида холина находятся в пределах, указанных в настоящем описании.
Если используют соединения холина, отличные от хлорида холина, их используют в эквивалентных концентрациях. Эквивалентные концентрации означают, что достигают молярных концентраций холина, которые находятся в тех же диапазонах, которые достигаются, если хлорид холина используется в концентрациях в указанных выше диапазонах.
Согласно первому аспекту настоящего изобретения, среда для культивирования клеток имеет только ограниченное содержание аминокислот, выражаемое в качестве общей концентрации аминокислот. Более конкретно, среда для культивирования клеток согласно первому аспекту изобретения характеризуется общей концентрацией аминокислот от 20 до 57 ммоль/л. Общая концентрация аминокислот может составлять более 25 ммоль/л, более 30 ммоль/л, более 35 ммоль/л или даже более 40 ммоль/л. Более того, общая концентрация аминокислот может составлять ниже 54 ммоль/л. Общая концентрация аминокислот может составлять, например, приблизительно 51 ммоль/л.
В то же время, концентрация хлорида холина соответствует той, которая указана выше, т.е. находится в диапазоне от 60 мг/л до 2500 мг/л, причем предпочтительные диапазоны и величины также соответствуют тем, которые указаны выше.
Среду для культивирования клеток согласно первому аспекту настоящего изобретения можно использовать, в частности, в качестве среды для получения для достижения высокого роста клеток, высокой плотности жизнеспособных клеток и высокого титра полипептида на стадии продукции. Кроме того, достигают более высокого качества рекомбинантного продукта, в частности, с точки зрения меньшей агрегации и/или лучших посттрансляционных модификаций, таких как улучшенный паттерн гликозилирования.
Роль аминокислоты глутамина для роста клеточных культур и конечной продуктивности в отношении полипептида в последние годы подвергалась тщательным исследованиям. Было обнаружено, что глутамин является не только важным структурным блоком для синтеза полипептида, но также он является основным источником энергии для клеток млекопитающих. Таким образом, в среды для культивирования клеток, используемые для получения полипептида, обычно вносят высокие концентрации глутамина. Высокие количества глутамина в средах для культивирования клеток являются важными для роста клеток и экспрессии полипептида, в частности в промышленном масштабе.
Тем не менее, метаболизм глутамина приводит к распаду глутамина и накоплению ионов аммония, которые известны в качестве побочного продукта, являющегося токсичным для роста клеток и получения полипептида. Таким образом, желательно ограничить количество глутамина в клеточных культурах. В уровне техники было предложено несколько агентов для замены глутамина, например глутаминовая кислота. Однако было описано, что замена глутамина глутаминовой кислотой в периодических процессах культивирования с подпиткой приводит не только к меньшему образованию побочных продуктов, но также к более низкой продуктивности (Doverskog et al., J. Biotechnol., 1997, 59, 103-115). Таким образом, для культивирования клеток желательны среды, содержащие пониженное количество глутамина, но при этом обеспечивающие высокий рост клеток и продуктивность полипептида.
Было обнаружено, что добавление высоких количеств хлорида холина позволяет использовать среды, содержащие пониженные количества глутамина по сравнению с некоторыми известными средами, особенно на стадии продукции, в то время как продуктивность клеток сохраняется по большей части неизмененной.
Таким образом, в соответствии с первым аспектом настоящее изобретение относится к среде для культивирования клеток, необязательно дополнительно содержащей количество глутамина, которое значительно снижено по сравнению со средами, известными из уровня техники. Среды для культивирования клеток также могут не содержать заменяющих глутамин агентов, таких как глутаминовая кислота или тому подобное. Среда для культивирования клеток, необязательно, содержит глутамин в концентрации от 500 до 1400 мг/л, от 800 до 1400 мг/л или от 900 до 1200 мг/л.
В то же время, концентрация хлорида холина соответствует той, которая указана выше, т.е. находится в диапазоне от 60 мг/л до 2500 мг/л, причем предпочтительные диапазоны и величины также соответствуют тем, которые указаны выше. Кроме того, в то же время общая концентрация аминокислот в среде для культивирования клеток составляет от 20 до 57 ммоль/л, причем предпочтительные диапазоны и величины также соответствуют тем, которые указаны выше.
Согласно другой необязательной модификации первого аспекта настоящего изобретения, соответствующие количества отдельных аминокислот соответствуют тем, которые указаны ниже.
Такие умеренные количества аминокислот, тем не менее, превышают количества аминокислот, содержащихся в общепринятых средах для культивирования клеток, таких как DMEM или RPMI, но в то же время являются значительно более низкими, чем количества аминокислот, содержащихся в типичных средах для продукции, используемых при крупномасштабном получении.
Повышенные количества аминокислот в средах для продукции считаются важными для высокой продуктивности и высокого качества продукта, особенно, если получение полипептида осуществляют в крупном масштабе или даже в промышленном масштабе. В рамках настоящего изобретения было обнаружено, что наличие высоких количеств хлорида холина позволяет ограничить количества отдельных аминокислот, особенно в средах для культивирования клеток, используемых на стадии продукции.
Содержание отдельных аминокислот в среде для культивирования клеток согласно этой необязательной модификации в соответствии с первым аспектом настоящего изобретения включает следующие аминокислоты в следующих количествах, выраженных в ммоль/л:
| Аргинин | 4,0-6,0, предпочтительно 4,5-5,5 |
| Аспарагин | 3,0-6,0, предпочтительно 4,0-5,5 |
| Аспарагиновая кислота | 2,5-4,0, предпочтительно 3,0-3,6 |
| Глицин | 0,3-0,8, предпочтительно 0,5-0,7 |
| Гистидин | 0,6-1,0, предпочтительно 0,7-0,9 |
| Изолейцин | 2,0-5,0, предпочтительно 3,0-4,0 |
| Лейцин | 3,0-7,0, предпочтительно 3,5-6,0 |
| Лизин | 2,0-4,0, предпочтительно 2,5-3,5 |
| Метионин | 1,0-1,5, предпочтительно 1,2-1,4 |
| Фенилаланин | 1,0-2,0, предпочтительно 1,3-1,8 |
| Пролин | 2,5-6,0, предпочтительно 3,0-5,5 |
| Серин | 3,0-8,0, предпочтительно 4,0-7,0 |
| Треонин | 2,0-3,5, предпочтительно 2,5-3,1 |
| Триптофан | 0,4-1,0, предпочтительно 0,5-0,8 |
| Валин | 2,5-5,0, предпочтительно 3,0-4,5 |
| Глутамин | 6,0-10,0, предпочтительно 7,5-9,0 |
| Тирозин | 1,0-2,0, предпочтительно 1,2-1,8 |
| Цистин | 0,5-1,0, предпочтительно 0,6-0,8 |
В то же время, концентрация хлорида холина соответствует той, которая указана выше, т.е. находится в диапазоне от 60 мг/л до 2500 мг/л, причем предпочтительные диапазоны и величины также соответствуют тем, которые указаны выше. Кроме того, в то же время общая концентрация аминокислот в среде для культивирования клеток составляет от 20 до 57 ммоль/л, причем предпочтительные диапазоны и величины также соответствуют тем, которые указаны выше.
Благодаря высокому содержанию хлорида холина, соответствующие количества аминокислот могут быть значительно более низкими, чем количества, используемые в других средах для культивирования клеток, используемых для крупномасштабного получения полипептидов. Иными словами, добавление высоких количеств хлорида холина позволяет значительно снизить количество большинства из аминокислот без снижения роста клеток, жизнеспособности клеток и титра полипептидов. Это имеет техническое преимущество, состоящее в том, что можно использовать среды для культивирования клеток с более низкой концентрацией большинства из включенных аминокислот, тем самым избегая проблем, связанных с выпадением в осадок менее растворимых компонентов сред для культивирования клеток. Кроме того, достигается значительное снижение затрат на среды для культивирования клеток без изменения или даже с улучшением общего качества и выхода полипептидного продукта. Как описано ниже, с использованием сред для культивирования клеток по настоящему изобретению может быть снижена агрегация рекомбинантного полипептидного продукта. Кроме того, также могут проходить лучшие посттрансляционные модификации, например, быть улучшен характер гликозилирования или улучшены другие признаки качества белка, такие как более низкая агрегация рекомбинантного полипептида. В некоторых случаях модификация сред для культивирования клеток, описанных в рамках настоящего изобретения, даже содействует увеличению жизнеспособности клеток и росту клеток, а также улучшает конечный титр полипептида.
Термин "среда для культивирования клеток" относится к водному раствору питательных веществ, которые можно использовать для выращивания клеток в течение продолжительного периода времени. Как правило, среды для культивирования клеток включают следующие компоненты: источник энергии, который обычно представляет собой углеводное соединение, предпочтительно глюкозу, аминокислоты, предпочтительно основной набор аминокислот, включая все незаменимые и заменимые аминокислоты, витамины и/или другие органические соединения, которые требуются при