Стент, выделяющий рапамицин
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к имплантируемым внутрипросветным сосудистым медицинским устройствам для локальной доставки терапевтических средств или их комбинаций, и может быть использовано для профилактики и лечения стеноза или рестеноза, развивающихся, например, вследствие атеросклероза, либо чрезкожной транслюминальной коронарной ангиопластики. Предложенное устройство - стент - содержит спиралевидную среднюю секцию, образованную синусоидально расположенными несущими элементами конструкции в перемежающемся порядке. Синусоидально расположенные несущие элементы этой секции образуют устойчивый спиралевидный модуль, соединенный посредством гибких шарниров. При этом указанная секция содержит повторяющиеся нити несущего элемента, которые геометрически симметричны по отношению к себе. Указанная секция содержит также первую и вторую кольцевидные концевые секции, образованные синусоидально расположенными несущими элементами конструкции в перемежающемся порядке, соединенными посредством гибких шарниров. Спиралевидная средняя секция содержит также первую и вторую переходные секции, образованные синусоидально расположенными несущими элементами конструкции в перемежающемся порядке, образующими вариабельный спиралевидный модуль, соединенный посредством гибких шарниров. Первая и вторая спиралевидные переходные секции имеют элементы конструкции, расположенные в перемежающемся порядке и соединяющие гибкие шарниры, которые не обладают симметрией по отношению к себе. Первая и вторая кольцевидные концевые секции присоединены к спиралевидной средней секции при помощи первой и второй спиралевидных переходных секций, соответственно. При этом, по меньшей мере, один из несущих элементов конструкции содержит, по меньшей мере, один резервуар. По меньшей мере, в одном резервуаре находится композиция, содержащая ингибитор mTOR и поддающийся биологическому разложению полимер, выделяющая ингибитор mTOR в аблюминальном направлении. Изобретение позволяет замедлить развитие стеноза и рестеноза, поскольку несимметричные и перемежающиеся секции устройства обеспечивают неравномерное развитие соединительной ткани, а также обеспечивает доставку препарата или комбинации препаратов, выделяющихся преимущественно в пристеночном или аблюминальном направлении, локально. 5 з.п. ф-лы, 39 ил., 7 табл.
Реферат
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
1. Область изобретения
Настоящее изобретение относится к местному применению терапевтических средств и/или комбинации терапевтических средств для профилактики и лечения сосудистых заболеваний, а более конкретно к внутрипросветным медицинским устройствам для локальной доставки терапевтических средств и/или комбинаций терапевтических средств.
2. Обзор материалов, использованных при экспертизе заявки
Множество людей страдает болезнями органов кровообращения, причиной которых является прогрессирующая окклюзия кровеносных сосудов, перфузирующих сердце и другие важные органы. Более интенсивная окклюзия кровеносных сосудов у таких людей зачастую приводит к артериальной гипертензии, ишемическому повреждению, инсульту или инфаркту миокарда. Атеросклеротические поражения сосудов, ограничивающие или блокирующие коронарный кровоток, являются основной причиной ишемической болезни сердца. Медицинская процедура, целью которой является увеличение кровотока в артерии, называется чрескожной транслюминальной коронарной ангиопластикой. Чрескожная транслюминальная коронарная ангиопластика является предпочтительным методом лечения стеноза коронарных артерий. Все возрастающее применение этого метода обусловлено довольно высокой частотой успеха и минимальной инвазивностью по сравнению с операцией коронарного шунтирования. Недостатком чрескожной транслюминальной коронарной ангиопластики является риск внезапного закрытия сосуда, которое может произойти непосредственно после процедуры, и рестеноза, который развивается в поздние сроки после процедуры. Кроме того, рестеноз является частым осложнением у пациентов, которые перенесли аутовенозное шунтирование с использованием подкожной вены бедра. Механизм острой окклюзии включает несколько факторов и может быть следствием уменьшения просвета сосуда с результирующим закрытием артерии и/или отложения тромбоцитов и фибрина вдоль поврежденного участка только что расширенного кровеносного сосуда.
Рестеноз после чрескожной транслюминальной коронарной ангиопластики - более постепенный процесс, вызванный повреждением сосуда. Каждый их множества процессов, включающих тромбоз, воспаление, выделение фактора роста и цитокина, пролиферацию клеток, клеточную миграцию и синтез внеклеточного матрикса, способствует развитию рестеноза.
Хотя точный механизм рестеноза недостаточно изучен, основные этапы этого процесса установлены. В нормальной артериальной стенке скорость пролиферации гладкомышечных клеток низкая, приблизительно менее 0,1% в день. Гладкомышечные клетки в стенках сосудов имеют, в основном, сократительный фенотип, характеризующийся тем, что от 80 до 90% объема цитоплазмы занимает сократительный аппарат. Доля эндоплазматического ретикулума, комплекса Гольджи и свободных рибосом невелика, и локализованы они в околоядерной области. Внеклеточный матрикс окружает гладкомышечные клетки; он богат гепариноподобными гликозаминогликанами, которые, как предполагается, отвечают за сохранение сократительного фенотипа гладкомышечных клеток (Campbell and Campbell, 1985).
В процессе ангиопластики при расширении коронарного баллонного катетера под давлением происходит повреждение гладкомышечных клеток и эндотелиальных клеток внутри стенок сосудов; в ответ на повреждение инициируется тромботическая и воспалительная реакция. Клеточные факторы роста, такие как тромбоцитарный фактор роста, основной фактор роста фибробластов, эпидермальный фактор роста, тромбин и т.д., высвобождающиеся тромбоцитами, мигрирующими макрофагами и/или лейкоцитами или непосредственно гладкомышечными клетками, вызывают ответную пролиферацию и миграцию гладкомышечных клеток медии. Эти клетки претерпевают изменение фенотипа: сократительный фенотип меняется на синтетический фенотип, для которого характерно наличие незначительного количества пучков сократительных волокон, хорошо развитого гранулярного эндоплазматического ретикулума, аппарата Гольджи и свободных рибосом. Пролиферация/миграция, как правило, начинается в течение одного-двух дней после травмы и достигает максимума через несколько дней после начала (Campbell and Campbell, 1987; Clowes and Schwartz, 1985).
Дочерние клетки мигрируют в интимальный слой гладкой мускулатуры артерии и продолжают пролиферировать и секретировать значительное количество белков внеклеточного матрикса. Пролиферация, миграция и синтез внеклеточного матрикса продолжаются до того момента, пока не восстановится поврежденный эндотелиальный слой, после чего пролиферация внутри интимы замедляется, что происходит, как правило, в течение семи-четырнадцати дней после травмы. Новообразованная ткань называется неоинтима. Дальнейшее сужение сосуда, которое происходит в течение последующих трех-шести месяцев, главным образом, является следствием негативного или констриктивного ремоделирования.
Одновременно с локальной пролиферацией и миграцией клетки воспалительного инфильтрата адгезируются к месту повреждения сосуда. В течение трех-семи дней посттравматического периода клетки воспалительного инфильтрата мигрируют в более глубокие слои стенки сосуда. В экспериментальных моделях на животных, где применялось как введение баллонного катетера, так и имплантация стента, клетки воспалительного инфильтрата присутствовали в месте повреждения сосуда по меньшей мере в течение тридцати дней (Tanaka et al., 1993; Edelman et al., 1998). Таким образом, присутствующие клетки воспалительного инфильтрата могут способствовать развитию как острой, так и хронической фазы рестеноза.
Многочисленные препараты были протестированы на наличие предполагаемого антипролиферативного действия при рестенозе и продемонстрировали некоторый эффект в экспериментальных моделях на животных. Препараты, которые продемонстрировали способность успешно уменьшать степень интимальной гиперплазии в экспериментах на животных, включают следующие: гепарин и фрагменты гепарина (Clowes, A.W. and Karnovsky M., Nature 265: 25-26, 1977; Guyton, J.R. et al., Circ. Res., 46: 625-634, 1980; Clowes, A.W. and Clowes, M.M., Lab. Invest. 52: 611-616, 1985; Clowes, A.W. and Clowes, M.M., Circ. Res. 58: 839-845, 1986; Majesky et al., Circ. Res. 61: 296-300, 1987; Snow et al., Am. J. Pathol. 137: 313-330, 1990; Okada, T. et al., Neurosurgery 25: 92-98, 1989), колхицин (Currier, J.W. et al., Circ. 80: 11-66, 1989), таксол (Sollot, S.J. et al., J. Clin. Invest. 95: 1869-1876, 1995), ингибиторы ангиотензинпревращающего фермента (АПФ) (Powell, J.S. et al., Science, 245: 186-188, 1989), ангиопептин (Lundergan, C.F. et al. Am. J. Cardiol. 17(Suppl. B):132B-136B, 1991), циклоспорин A (Jonasson, L. et al., Proc. Natl., Acad. Sci., 85: 2303, 1988), антитело козы к фактору роста тромбоцитов кролика (Ferns, G.A.A., et al., Science 253: 1129-1132, 1991), тербинафин (Nemecek, G.M. et al., J. Pharmacol. Exp. Thera. 248: 1167-1174, 1989), трапидил (Liu, M.W. et al., Circ. 81: 1089-1093, 1990), траниласт (Fukuyama, J. et al., Eur. J. Pharmacol. 318: 327-332, 1996), интерферон-гамма (Hansson, G.K. and Holm, J., Circ. 84: 1266-1272, 1991), рапамицин (Marx, S.O. et al., Circ. Res. 76: 412-417, 1995), стероиды (Colburn, M.D. et al., J. Vasc. Surg. 15: 510-518, 1992), см. также (Berk, B.C. et al., J. Am. Coll. Cardiol. 17: 111B-117B, 1991), ионизирующее излучение (Weinberger, J. et al., Int. J. Rad. Onc. Biol. Phys. 36: 767-775, 1996), гибридные токсины (Farb, A. et al., Circ. Res. 80: 542-550, 1997), антисмысловые олигонуклеотиды (Simons, M. et al., Nature 359: 67-70, 1992) и генные векторы (Chang, M.W. et al., J. Clin. Invest. 96: 2260-2268, 1995). Антипролиферативное действие в отношении гладкомышечных клеток in vitro продемонстрировали многие из вышеперечисленных препаратов, включая гепарин и конъюгаты гепарина, таксол, траниласт, колхицин, ингибиторы ангиотензинпревращающего фермента (АПФ), гибридные токсины, антисмысловые олигонуклеотиды, рапамицин и ионизирующее излучение. Таким образом, препараты с различными механизмами ингибирования гладкомышечных клеток могут иметь терапевтический эффект в отношении уменьшения интимальной гиперплазии.
Однако в отличие от экспериментов на животных, попытки предотвратить рестеноз у людей, перенесших ангиопластику, с помощью системных фармакологических препаратов до сих пор не увенчались успехом. Ни комбинация аспирин-дипиридамол, ни тиклопидин, ни антикоагулянтная терапия (гепарин для неотложного лечения, варфарин для длительного применения, гирудин или гирулог), ни блокада рецепторов тромбоксана, ни стероиды не обладают эффективностью при предотвращении рестеноза, хотя ингибиторы тромбоцитов оказались эффективны для предотвращения острой реокклюзии после ангиопластики (Mak and Topol, 1997; Lang et al., 1991; Popma et al., 1991). Антагонист ГП IIb/IIIa рецепторов тромбоцита РеоПро(Reopro®) до сих пор находится на стадии изучения, однако на сегодняшний день окончательного эффекта от применения РеоПро (Reopro®) в плане снижения рестенозов после ангиопластики и стентирования не наблюдается. Другие препараты, также оказавшиеся недейственными в предотвращении рестеноза, включают блокаторы кальциевых каналов, миметики простациклина, ингибиторы ангиотензинпревращающего фермента, блокаторы серотониновых рецепторов и антипролиферативные препараты. Данные препараты должны применяться системно, однако достижение терапевтически эффективной дозы может быть невозможным. Концентрации, необходимые для антипролиферативного (или антирестенозного) эффекта, могут превышать известные токсические концентрации этих препаратов, так что уровень препарата в крови, достаточный для ингибирования гладких мышц, не может быть достигнут (Mak and Topol, 1997; Lang et al., 1991; Popma et al., 1991).
Дополнительные клинические испытания, в которых изучали эффективность использования пищевых добавок, содержащих диетический рыбий жир или холестеринопонижающие средства, в отношении профилактики рестенозов, дали противоречивые или отрицательные результаты. Таким образом, в настоящее время нет клинически доступного фармакологического препарата для предотвращения постангиопластического рестеноза. (Mak and Topol, 1997; Franklin and Faxon, 1993: Serruys, P.W. et al., 1993). Современные исследования позволяют предположить, что гиполипидемический/антиоксидантный препарат пробукол может применяться для предотвращения рестеноза, однако данное исследование требует подтверждения (Tardif et al., 1997; Yokoi, et al., 1997). В настоящее время пробукол (Probucol) не утвержден для применения в Соединенных Штатах Америки, а тридцатидневный период предварительного лечения исключает возможность его применения в случае неотложной ангиопластики. Кроме того, применение ионизирующего излучения показало многообещающие результаты в отношении уменьшения или предотвращения рестенозов после ангиопластики у пациентов с имплантированными стентами (Teirstein et al., 1997). Тем не менее, на сегодняшний день наиболее эффективными способами лечения рестеноза являются повторная ангиопластика, атерэктомия или аортокоронарное шунтирование, так как на данный момент ни одно терапевтическое средство не разрешено для использования с целью предотвращения постангиопластического рестеноза Управлением по контролю за качеством пищевых продуктов и медикаментов.
В отличие от системной терапии лекарственными средствами, стенты доказали свою эффективность в плане значительного уменьшения рестенозов. Как правило, стенты представляют собой металлические трубочки ячеистой структуры, (обычно, но не обязательно, изготовленные из нержавеющей стали), расширяемые при помощи баллона, которые после расширения внутри просвета коронарной артерии, подвергаемой ангиопластике, обеспечивают структурную опору благодаря жесткой поддержке стенки артерии. Эта поддержка способствует поддержанию проходимости просвета сосуда. В двух рандомизированных клинических испытаниях стенты способствовали ангиографическому успеху после чрескожной транслюминальной коронарной ангиопластики, путем увеличения минимального диаметра просвета и уменьшения частоты возникновения, но не предотвращения рестеноза через шесть месяцев (Serruys et al., 1994; Fischman et al., 1994).
Кроме того, оказалось, что покрытие стентов гепарином дало дополнительный положительный эффект, выраженный в уменьшении подострых тромбозов после имплантации стента (Serruys et al., 1996). Таким образом, постоянное механическое расширение стенозированной коронарной артерии при помощи стента, как оказалось, в некоторой степени способствует предотвращению рестеноза, а покрытие поверхности стентов гепарином демонстрирует как целесообразность, так и клиническую эффективность локальной доставки лекарственных средств непосредственно к месту повреждения ткани.
Как указано выше, использование стентов, покрытых гепарином, показало целесообразность и клиническую эффективность локальной доставки лекарственных средств. Однако способ фиксации конкретного средства или комбинации средств на устройстве доставки также играет немаловажную роль в эффективности данного вида лечения. Например, способы и материалы, используемые для фиксации средства/комбинации средств на устройстве для локальной доставки, не должны препятствовать действию препарата/комбинации препаратов. Кроме того, используемые процессы и материалы должны обладать биосовместимостью, а также должны удерживать препарат/комбинацию препаратов на устройстве для локальной доставки в процессе доставки и в течение заданного периода времени. Например, удаление препарата/комбинации препаратов в процессе доставки с поверхности устройства для локальной доставки потенциально может стать причиной нарушения работы устройства.
Таким образом, существует потребность в препарате/комбинации препаратов и соответствующих устройствах для локальной доставки с целью предотвращения и лечения повреждений сосудов, вызывающих утолщение интимы, которые имеют либо биологическую причину, например атеросклероз, либо нанесены механическим путем, например в результате чрескожной транслюминальной коронарной ангиопластики.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Стент, выделяющий рапамицин и являющийся предметом настоящего изобретения, преодолевает описанные выше ограничения, свойственные ранним прототипам.
В соответствии с одним из примеров осуществления, настоящее изобретение относится к разряду имплантируемых медицинских устройств, оснащенных резервуарами, заполняемыми лекарственными средствами и выделяющими их. Это имплантируемое медицинское устройство, оснащенное резервуарами, заполняемыми лекарственными средствами и выделяющими их, представляющее собой стент, содержащий спиралевидную среднюю секцию, образованную по существу синусоидально расположенными перемежающимися несущими элементами конструкции, образующими устойчивый спиралевидный модуль, соединенный посредством гибких шарниров; первую и вторую кольцевидные концевые секции, образованные по существу синусоидально расположенными перемежающимися несущими элементами конструкции, соединенными посредством гибких шарниров; и первую и вторую переходные секции, образованные по существу синусоидально расположенными перемежающимися несущими элементами конструкции, образующими вариабельный спиралевидный модуль, соединенный посредством гибких шарниров; при этом первая и вторая кольцевидные концевые секции присоединены к спиралевидной средней секции при помощи первой и второй переходных секций, соответственно, и где по меньшей мере один из несущих элементов конструкции содержит по меньшей мере один резервуар, и где композиция содержит ингибитор mTOR и поддающийся биологическому разложению полимер, и при этом композиция находится по меньшей мере в одном резервуаре и скомпонована таким образом, что выделяет ингибитор mTOR в аблюминальном направлении (т.е. в направлении просвета сосуда).
Стент, являющийся предметом настоящего изобретения, обладает уникальной конструкцией, вкратце описанной выше, и может производиться из кобальт-хромового сплава. Стент сконструирован таким образом, чтобы поддерживать проходимость просвета сосуда и осуществлять доставку сиролимуса к окружающим артерию тканям в целях профилактики и лечения сосудистой патологии, включая повторное стенозирование. Сиролимус входит в состав полимерного матрикса, предпочтительно в сочетании со стабилизирующим агентом, таким как бутилированный гидрокситолуол. Каждый резервуар в составе стента заполняется раствором, содержащим сиролимус, полимер, стабилизирующий агент и растворитель. Процесс заполнения осуществляется в несколько этапов, каждый из которых сопровождается стадией высушивания в целях удаления растворителя. Конструкция каждого резервуара минимизирует выделение сиролимуса в кровоток, при этом максимально способствуя его высвобождению в окружающие стент ткани артериальной стенки.
Стент, являющийся предметом настоящего изобретения, обеспечивает контролируемую, продолжительную и местную доставку сиролимуса непосредственно к окружающим его тканям, с минимальной потерей препарата в кровоток. Настоящий стент предпочтительнее изготавливать из кобальт-хромового сплава, который является менее хрупким и обладает большей эластичностью и прочностью, а также повышенной долговечностью в сравнении со стентами, изготовленными из других материалов.
КРАТКОЕ ОПИСАНИЕ ФИГУР
Вышеизложенные и прочие характеристики и преимущества изобретения станут очевидными после следующего более подробного описания предпочтительных вариантов осуществления изобретения, проиллюстрированных с помощью прилагаемых фигур.
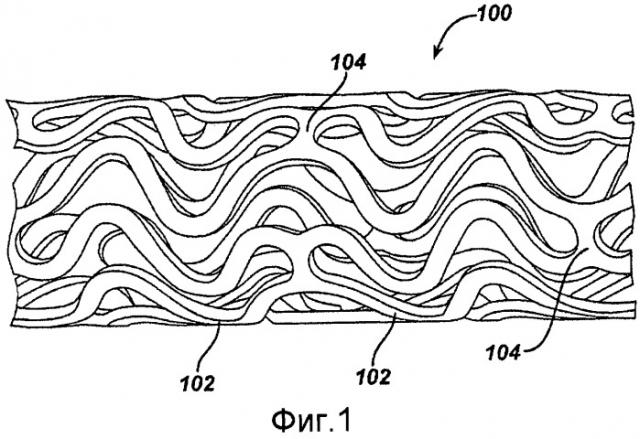
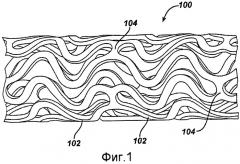
На фигуре 1 представлен продольный вид стента (концы не показаны) до расширения; видны наружная поверхность стента и характерная ячеистая структура стента.
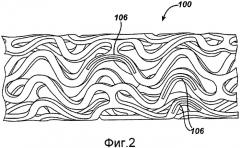
На фигуре 2 представлен общий продольный вид стента, показанного на фигуре 1, который подвергся модификации с целью создания резервуаров.
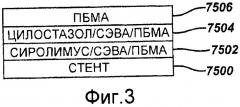
На фигуре 3 в виде диаграммы представлен первый пример осуществления настоящего изобретения, где стент покрыт комбинацией сиролимуса и цилостазола.
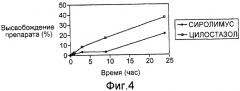
На фигуре 4 графически представлена кинетика высвобождения сиролимуса и цилостазола in vitro, характерная для стента, рассматриваемого в первом примере осуществления настоящего изобретения.
На фигуре 5 в виде диаграммы представлен второй пример осуществления настоящего изобретения, где стент покрыт комбинацией сиролимуса и цилостазола.
На фигуре 6 графически представлена кинетика высвобождения сиролимуса и цилостазола in vitro, характерная для стента, рассматриваемого во втором примере осуществления настоящего изобретения.
На фигуре 7 в виде диаграммы представлен третий пример осуществления настоящего изобретения, где стент покрыт комбинацией сиролимуса и цилостазола.
На фигуре 8 представлены антитромботические свойства покрытий, содержащих комбинацию сиролимуса и цилостазола в экспериментальной модели кровообращения in vitro с использованием бычьей крови.
На фигуре 9 графически представлена кинетика высвобождения сиролимуса и цилостазола in vivo из стента, показанного на фигуре 11.
На фигуре 10 графически представлена кинетика высвобождения сиролимуса и цилостазола in vitro из стента, показанного на фигуре 11.
На фигуре 11 в виде диаграммы представлен четвертый пример осуществления настоящего изобретения, где стент покрыт комбинацией сиролимуса и цилостазола.
На фигуре 12 графически представлена кинетика высвобождения сиролимуса и цилостазола in vivo из стента, показанного на фигуре 3.
На фигуре 13 графически представлена кинетика высвобождения сиролимуса и цилостазола in vitro из стента, показанного на фигуре 3.
На фигуре 14 представлено изометрическое изображение расширяемого медицинского устройства с лечебным препаратом, размещенным на концах устройства.
На фигуре 15 представлено изометрическое изображение расширяемого медицинского устройства с лечебным препаратом, размещенным в центральной части устройства, и без лечебного препарата на концах устройства.
На фигуре 16 представлено изометрическое изображение расширяемого медицинского устройства с различными лечебными препаратами, размещенными в различных отверстиях.
На фигуре 17 представлено изометрическое изображение расширяемого медицинского устройства с различными лечебными препаратами, размещенными в перемежающихся отверстиях.
На фигуре 18 представлено увеличенное боковое изображение расширяемого медицинского устройства с ячейками для лечебных препаратов, расположенными в соединительных элементах.
На фигуре 19 представлено увеличенное боковое изображение участка расширяемого медицинского устройства с бифуркационной ячейкой.
На фигуре 20 представлено изображение поперечного разреза расширяемого медицинского устройства, содержащего комбинацию первого лекарственного средства, например, противовоспалительного агента, размещенного в первой группе ячеек, со вторым лекарственным средством, таким как антипролиферативный препарат, размещенным во второй группе ячеек.
На фигуре 21 в качестве примера графически показана кинетика высвобождения противовоспалительного и антипролиферативного препаратов, доставляемых расширяемым медицинским устройством, представленным на фигуре 20.
На фигурах 22A, 22B, 22C представлены частично выполненные в форме диаграммы иллюстрации альтернативного варианта осуществления расширяемого медицинского устройства.
На фигурах 23A, 23B, 23C представлены примеры лактидов (димеров), используемых в синтезе стереоспецифичных полилактидов.
На фигуре 24 представлен L-лактид.
На фигуре 25 представлен поли-D-лактид.
На фигурах 26A, 26B и 26C представлены схемы покрытия или депонирования с применением чередующихся слоев полимеров, имеющих идентичные терапевтическим средствам химические составы, но различные оптические свойства.
На фигурах 27A, 27B представлены схемы покрытия или депонирования с применением растворов, содержащих как поли-D-молочную кислоту, так и поли-L-молочную кислоту в молярном отношении "один к одному".
На фигуре 28 представлено графическое боковое изображение части стента, выделяющего два лекарственных средства.
На фигуре 29 представлено графическое изображение общего высвобождения лекарственного средства в процентном соотношении in vivo.
На фигуре 30 графически представлено общее количество (по весу) высвободившихся сиролимуса и цилостазола in vivo.
На фигуре 31 представлено схематическое изображение альтернативного варианта стента, осуществляемого в соответствии с условиями настоящего изобретения.
На фигуре 32 представлено детальное схематическое изображение стента, представленного на фигуре 31.
ПОДРОБНОЕ ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНЫХ ОСУЩЕСТВЛЕНИЙ
Препарат/комбинация препаратов и устройства доставки, охватываемые рамками настоящего изобретения, могут использоваться для эффективного предотвращения и лечения заболеваний сосудов, в частности заболеваний сосудов, вызванных повреждениями сосудов. Различные медицинские устройства, используемые при лечении заболеваний сосудов, могут в итоге вызывать дальнейшие осложнения. Например, процедура баллонной ангиопластики используется для улучшения кровотока через артерию и является предпочтительным видом лечения стеноза коронарных сосудов. Однако, как описано выше, обычно эта процедура приводит к определенному повреждению стенки сосуда, тем самым потенциально усугубляя проблему в будущем. Хотя другие процедуры и заболевания также могут приводить к подобным повреждениям, примеры осуществления настоящего изобретения будут описаны применительно к лечению рестеноза и связанных с ним осложнений, возникающих в результате чрескожной транслюминальной коронарной ангиопластики и иных подобных манипуляций на артериальных/венозных сосудах, включая процедуру соединения артерий, вен и других сосудов, переносящих жидкость. Помимо этого, будут описаны различные методы и устройства для эффективной доставки медицинских устройств с покрытием.
Тогда как примеры осуществления настоящего изобретения будут описаны применительно к лечению рестеноза и сопутствующих осложнений, возникающих в результате чрескожной транслюминальной коронарной ангиопластики, важно отметить, что локальная доставка препарата/комбинации препаратов может применяться для лечения широкого спектра патологических состояний с использованием любого количества медицинских устройств или для улучшения работы и/или увеличения срока службы устройства. Например, искусственные хрусталики, имплантируемые для восстановления зрения после удаления катаракты, часто провоцируют развитие вторичной катаракты. Последняя, как правило, является результатом чрезмерного разрастания клеток на поверхности хрусталика, что потенциально можно свести к минимуму, если использовать устройство в сочетании с препаратом или препаратами. Для других медицинских устройств, которые часто выходят из строя вследствие врастания ткани или отложения белкового материала внутри, на поверхности или вокруг устройства, такого как шунты при гидроцефалии, катетеры для диализа, устройства для прикрепления калоприемников, ушные дренажные трубки, электроды кардиостимуляторов и имплантируемых дефибрилляторов, подход "комбинация устройство доставки-препарат" также может быть полезным. Применение устройств, которые служат для улучшения структуры и функции ткани или органа, в сочетании с подходящим препаратом или препаратами, также имеет больше преимуществ. Например, улучшенная остеоинтеграция протезов для повышения стабилизации имплантатов потенциально может быть достигнута путем их комбинирования с такими препаратами, как костный морфогенетический белок. Аналогичным образом другие хирургические средства и устройства, шовный материал, скобы, устройства для анастомоза, позвоночные диски, костные стержни, фиксаторы шовного материала, гемостатические барьеры, скобки, винты, металлические пластинки для соединения костных отломков, обоймы сшивающих аппаратов, сосудистые протезы, тканевой клей и герметики, тканевые каркасы, различные виды перевязочного материала, заменители кости, внутрипросветные устройства и опоры для сосудов, также могут обеспечивать значительный лечебный эффект для пациентов, если применить подход "комбинация устройство доставки-препарат". В частности, эффективными могут быть периваскулярные обертывания сами по себе или в сочетании с другими медицинскими устройствами. Периваскулярные обертывания могут обеспечивать дополнительную доставку лекарственного средства к месту лечения. В сущности, любое медицинское устройство может быть тем или иным способом покрыто лекарственным средством или комбинацией лекарственных средств, что улучшает результаты лечения по сравнению с применением устройства или фармацевтического препарата по отдельности.
В дополнение к разнообразным медицинским устройствам, их покрытия могут использоваться для доставки терапевтических и фармакологических агентов, включая: антипролиферативные/антимитотические агенты, включающие природные продукты, такие как алкалоиды барвинка (т.е. винбластин, винкрестин и винорелбин), паклитаксел, эпидиоподофиллотоксины (т.е. этопозид, тенипозид), антибиотики (дактиномицин (актиномицин Д), даунорубицин, доксорубицин и идарубицин), антрациклины, митоксантрон, блеомицины, пликамицин (митрамицин) и митомицин, ферментные препараты (L-аспарагиназа, которая системно метаболизирует L-аспарагин и лишает клетки возможности синтезировать собственный внутриклеточный аспарагин); агенты, оказывающие противотромбоцитарное действие, как, например, ингибиторы G(GP) IIb/IIIa и антагонисты рецептора витронектина; антипролиферативные/антимитотические алкилирующие агенты, такие как азотистые иприты (мехлорэтамин, циклофосфамид и аналоги, мелфалан, хлорамбуцил), этиленимины и метилмеламины (гексаметилмеламин и тиотепа), алкилсульфонаты - бусульфан, производные нитрозомочевины (кармустин (BCNU) и аналоги, стрептозоцин), тразены - дакарбазинин (DTIC); антипролиферативные/антимитотические антиметаболиты, такие как аналоги фолиевой кислоты (метотрексат), аналоги пиримидина (флуороурацил, флоксуридин и цитарабин), аналоги пурина и родственные ингибиторы (меркаптопурин, тиогуанин, пентостатин и 2-хлордезоксиаденозин {кладрибин}); комплексные соединения платины (цисплатин, карбоплатин), прокарбазин, гидроксимочевину, митотан, аминоглютетимид; гормоны (например, эстроген); антикоагулянты (гепарин, соли синтетического гепарина и другие ингибиторы тромбина); фибринолитические агенты (такие как тканевой активатор плазминогена, стрептокиназа и урокиназа), аспирин, дипиридамол, тиклопидин, клопидогрел, абциксимаб; средства, влияющие на клеточную миграцию; противосекреторные (бревельдин); противовоспалительные: такие как, например, адренокортикостероиды (кортизол, кортизон, флудрокортизон, преднизон, преднизолон, 6α-метилпреднизолон, триамцинолон, бетаметазон и дексаметазон), нестероидные противовоспалительные средства (производные салициловой кислоты, т.e. аспирин; производные парааминофенола, т.e. ацетаминофен; производные индолуксусной и инденуксусной кислот (индометацин, сулиндак и этодалак), гетероариловых уксусных кислот (толметин, диклофенак и кеторолак), арилпропионовых кислот (ибупрофен и его производные), ортоаминобензойной кислоты (мефенамовая кислота и меклофенамовая кислота), эноловых кислот (пироксикам, теноксикам, фенилбутазон и оксифентатразон), набуметон, соединения золота (ауранофин, ауротиоклюкоза, ауротиомалат натрия); иммуносупрессанты: (циклоспорин, такролимус (FK-506), сиролимус (рапамицин), азатиоприн, мофетила микофенолат); ангиогенные средства: фактор роста эндотелия сосудов (VEGF), фактор роста фибробластов (FGF); блокаторы рецептора ангиотензина; доноры оксида азота; антисенсорные олигонуклеотиды и их комбинации; ингибиторы клеточного цикла, ингибиторы mTOR и ингибиторы киназ, ответственных за передачу внутриклеточных сигналов, инициированных рецепторами к факторам роста; ретиноиды; ингибиторы циклинов и циклин-зависимых киназ (CDK); ингибиторы ГМГ (гидрокси-метил-глютарил) ко-фермента А редуктазы (статины); и ингибиторы протеаз.
Как отмечается в настоящем документе, имплантация коронарного стента в сочетании с баллонной ангиопластикой является высокоэффективным методом лечения острого закрытия сосудов и может сократить риск развития рестеноза. Интраваскулярные ультразвуковые исследования (Mintz et al., 1996) позволяют предположить, что коронарное стентирование эффективно предотвращает сужение сосудов, и что, в большинстве случаев, поздняя утрата люминального просвета после имплантации стента происходит вследствие разрастания бляшек, что в свою очередь может быть вызвано неоинтимальной гиперплазией. Частота поздней утраты люминального просвета после коронарного стентирования практически в два раза выше, чем после традиционной баллонной ангиопластики. Таким образом, поскольку стенты препятствуют развитию по меньшей мере части процесса образования рестеноза, то использование комбинаций лекарственных средств, веществ или соединений, которые препятствуют пролиферации гладкомышечных клеток, уменьшают воспаление, замедляют процесс коагуляции, или препятствуют пролиферации гладкомышечных клеток путем нескольких механизмов, уменьшают воспаление и замедляют процесс коагуляции, в сочетании со стентом может обеспечить более эффективную профилактику постангиопластического рестеноза. Систематическое применение препаратов, веществ и соединений в сочетании с локальной доставкой этих или других препаратов/комбинаций препаратов также может обеспечить более эффективный метод лечения.
Локальная доставка препаратов/комбинаций препаратов из стента имеет следующие преимущества: предотвращение сужения просвета и ремоделирования сосудов благодаря каркасной функции стента, угнетение многих звеньев неоинтимальной гиперплазии или рестеноза, а также уменьшение воспаления и вероятности возникновения тромбоза. Локальное введение лекарственного средства, веществ или соединений в стентированные коронарные артерии также может принести дополнительную терапевтическую пользу. Например, более высокие концентрации лекарственного средства, агентов или соединений в ткани можно достичь скорее посредством локальной доставки, чем путем системного введения. Кроме того, локальная доставка, в отличие от системного введения, позволяет снизить общую токсичность, поддерживая при этом более высокие концентрации препарата в ткани. Кроме того, в случае использования локальной доставки с поверхности стента, в отличие от системного введения, для обеспечения хорошего комплайенса пациента может быть достаточно одной процедуры. Дополнительным преимуществом лечения с использованием комбинации лекарственного средства, агента и/или соединения может быть уменьшение дозы каждого из лекарственных средств, агентов или соединений, благодаря чему снижается их токсичность, при этом все равно достигается уменьшение рестеноза, воспаления и тромбоза. Локальная терапия, основанная на применении стента, таким образом, является средством увеличения терапевтического индекса (эффективность/токсичность) антирестенозных, противовоспалительных, антитромботических препаратов, агентов или соединений.
Существует множество различных стентов, которые могут использоваться после чрескожной транслюминальной коронарной ангиопластики. Хотя в соответствии с настоящим изобретением может применяться любое количество стентов, для простоты в примерах осуществления настоящего изобретения будет описано ограниченное количество стентов. Специалистам в данной области будет понятно, что применительно к настоящему изобретению возможно использование любого количества стентов. Кроме того, как описано выше, возможно использование других медицинских устройств.
Стент обычно представляет собой трубчатую конструкцию, оставляемую в просвете канала для устранения окклюзии. Обычно стент вставляют в просвет в нерасширенной форме, а затем расширяют автономно или при помощи другого устройства in situ. Типичным методом расширения является расширение при помощи баллона для ангиопластики, установленного на катетере; баллон раздувается внутри стенозированного сосуда или канала тела для того, чтобы рассечь и разрушить препятствия, связанные с элементами стенки сосуда, и расширить его просвет.
На фигуре 1 представлен пример стента 100, который может использоваться в соответствии с примером осуществления настоящего изобретения. Расширяемый цилиндрический стент 100 включает в себя структуру с многочисленными отверстиями, предназначенную для помещения в кровеносный сосуд, канал или просвет для удержания сосуда, канала или просвета в открытом состоянии, а более конкретно для защиты сегмента артерии от рестеноза после ангиопластики. Стент 100 может расширяться по окружности и поддерживаться в расширенной конфигурации, то есть он остается жестким по окружности или по радиусу. Стент 100 является гибким в осевом направлении, и при сгибании по полосе стент 100 не будет содержать какие-либо выступающие наружу элементы.
Стент 100 обычно состоит из первого и второго концов с промежуточным участком между ними. Стент 100 имеет продольную ось и содержит множество продольно расположенных полос 102, где каждая полоса 102 определяет границы непрерывной волны вдоль сегмента, параллельного продольной оси. Множество связующих звеньев 104, расположенных по окружности, поддерживает прочную трубчатую структуру полос 102. В сущности, каждая продольная полоса 102 соединяется во множестве периодических участков при помощи коротких связующих звеньев 104, расположенных по окружности, со смежной полосой 102. Волна, связанная с каждой полосой 102, имеет приблизительно такую же основную пространственную частоту на промежуточном участке, а полосы 102 расположены таким образом, что волна, связанная с ними, обычно расположена на одной линии, чтобы совпадать по фазе друг с другом. Как показано на фигуре, каждая продольно расположенная полоса 102 проходит приблизительно через два цикла до связующего звена, соединяющего ее со смежной полосой 102.
Стент 100 может быть изготовлен любым из множества способов. Например, стент 100 может быть изготовлен из полой или формованной трубки из нержавеющей стали, которая может быть механически обработана при помощи лазера, электроразрядной фрезеровки, путем химического травления или