Модифицированный капсулярный сахарид, способ его получения и применение
Иллюстрации
Показать всеГруппа изобретений относится к области биотехнологии. Предложены модифицированный капсулярный сахарид для вызова гуморального иммунного ответа, способ его получения и применение для профилактики или лечения бактериального менингита, конъюгат сахарид-белок и способы его получения, фармацевтическая композиция на основе модифицированного капсулярного сахарида и способ индуцирования гуморального иммунного ответа у млекопитающих. Модифицированный капсулярный сахарид содержит блокирующую группу в положении гидроксильной группы на по меньшей мере 80% моносахаридных единиц соответствующего нативного капсулярного сахарида. При этом блокирующая группа имеет формулу (Ia): , где X представляет собой C(O); Y представляет собой C1-6 алкил, замещенный 1, 2 или 3 группами, независимо выбранными из гидроксильной, сульфгидрильной и аминогруппы. Предложенный модифицированный капсулярный сахарид более устойчив к гидролизу, чем нативный сахарид. Кроме того, наличие указанной блокирующей группы обеспечивает более эффективное конъюгирование модифицированного капсулярного сахарида с молекулой носителя. 10 н. и 28 з.п. ф-лы, 9 ил., 4 табл., 2 пр.
Реферат
Все документы, процитированные в настоящем документе, включены в настоящий документ посредством ссылки в их полном объеме.
Область техники
Настоящее изобретение лежит в области химии полисахаридов и относится к модифицированным сахаридам, способам их производства и конъюгированным производным. В частности, изобретение относится к модифицированным сахаридам, имеющим улучшенную устойчивость в воде.
Уровень техники
Полисахариды представляют собой важные биологические молекулы и широко применяются в фармацевтической промышленности для предотвращения и лечения заболеваний. Например, капсулярные полисахариды в течение уже многих лет применяются в вакцинах против капсулированных бактерий, таких как менингококк (Neisseria meningitidis), пневмококк (Streptococcus pneumoniae) и Hib (Haemophilus influenzae типа В).
Чтобы усилить иммуногенность этих полисахаридов, в частности, у детей были разработаны вакцины на основе конъюгатов. Они содержат капсулярный полисахарид, конъюгированный с белком-носителем [например, ссылки 1, 2, 3]. Конъюгирование может превратить Т-независимые антигены в Т-зависимые антигены.
Проблемой многих типов полисахаридов является плохая устойчивость в воде. Устойчивость полисахаридов в воде может зависеть от природы О-гликозидных связей, соединяющих сахаридные единицы. Плохая устойчивость в воде является результатом того, что О-гликозидные связи легко гидролизуются в присутствии кислот или гликозидаз. Капсулярный полисахарид менингококка серогруппы А является примером полисахарида, имеющего плохую устойчивость в воде.
Устойчивость полисахаридов является конкретной проблемой при производстве вакцин на основе конъюгатов. Для того чтобы приготовить конъюгат полисахарид-белок, необходимо управлять химически функциональными группами на полисахариде так, чтобы полисахарид мог быть связан с белком. Воздействие на полисахарид химическими реагентами в способах его создания, и особенно кислотами, может привести к нежелательному расщеплению гликозидных связей и последующей фрагментации полисахарида. Такая фрагментация весьма нежелательна и вызывает потери в выходе синтеза конъюгатов полисахарид-белок.
Полисахариды, которые являются нестабильными, таким образом, как правило, требуют тщательного выбора реагентов и условий для того, чтобы избежать проблем, описанных выше. Однако это ограничивает реагенты, доступные для воздействия на полисахарид, таким образом, ограничивая ряд связей, которые могут быть созданы между полисахаридом и белком-носителем. Кроме того, неустойчивость этих полисахаридов означает, что трудно разработать надежные методики, которые можно применять для получения вакцин в промышленном масштабе.
Ссылка 4 раскрывает модифицированный капсулярный сахарид, содержащий блокирующую группу в положении гидроксильной группы на, по меньшей мере, одной из моносахаридных единиц соответствующего нативного капсулярного сахарида. Модифицированный капсулярный сахарид, как указывают, имеет улучшенную устойчивость к гидролизу. Целью изобретения является обеспечение альтернативных или улучшенных модифицированных капсулярных сахаридов, которые имеют улучшенную устойчивость к гидролизу.
Описание изобретения
Изобретение основано на открытии, что модификация гидроксильных групп на моносахаридных единицах капсулярных сахаридов специфическими блокирующими группами позволяет улучшить устойчивость. Модифицированные сахариды, получаемые способом по изобретению, более устойчивы к гидролизу, чем их нативные сахаридные аналоги.
Настоящее изобретение, таким образом, обеспечивает модифицированный капсулярный сахарид, содержащий блокирующую группу в положении гидроксильной группы на, по меньшей мере, одной из моносахаридных единиц соответствующего нативного капсулярного сахарида. Блокирующая группа определена ниже. Модифицированный капсулярный сахарид по настоящему изобретению более устойчив к гидролизу, чем его нативные сахаридные аналоги. Предпочтительно, модифицированный капсулярный сахарид по настоящему изобретению сохраняет иммунологическую перекрестную реактивность, такую же, как у его нативного сахаридного аналога.
Настоящее изобретение так же предоставляет способы модификации капсулярного сахарида блокирующей группой; конъюгаты сахарид-белок, содержащие модифицированный капсулярный сахарид; способы создания конъюгатов сахарид-белок, фармацевтические композиции, содержащие модифицированные капсулярные сахариды и/или конъюгаты сахарид-белок и способы и применения вышеуказанного.
Модифицированные сахариды по изобретению
Изобретение обеспечивает модифицированный капсулярный сахарид, содержащий блокирующую группу в положении гидроксильной группы на, по меньшей мере, одной из моносахаридных единиц соответствующего нативного капсулярного сахарида. Блокирующая группа имеет формулу (Ia) или (Ib):
где
Х представляет собой С(O), S(O) или SO2;
Y представляет собой NR1R2 или R3;
R1 представляет собой C1-6алкил, замещенный 1, 2 или 3 группами, независимо выбранными из гидроксила, сульфгидрила и амина;
R2 представляет собой Н или C1-6алкил; и
R3 представляет собой C1-6алкил.
Предпочтительно, блокирующая группа имеет формулу (Ia). В этом варианте выполнения изобретения, предпочтительно, чтобы Х представлял собой С(O). Такие карбаматные и сложноэфирные блокирующие группы оказывают стабилизирующее действие на гликозидную связь и могут быть получены при мягких условиях. Примеры способов воздействия на сахариды для получения карбаматных или сложноэфирных блокирующих групп описаны ниже. Однако изобретение не ограничивается модифицированными сахаридами, полученными способами, приведенными здесь в качестве примеров, и другие способы получения модифицированных сахаридов по изобретению будут очевидны специалистам в данной области техники.
Предпочтительно, R2 представляет собой Н.
C1-6алкил в R1 замещен 1, 2 или 3 группами, независимо выбранными из гидроксила, сульфгидрила и амина. Если C1-6алкил замещен 2 или 3 группами, заместители могут представлять собой одинаковые или разные группы, хотя, как правило, они будут представлять собой одинаковые группы. Предпочтительно, С1-6алкил в R1 замещен 1, 2 или 3 гидроксильными группами.
R1 может быть замещен в любом положении C1-6алкильной цепи. Предпочтительно, по меньшей мере, один заместитель присутствует на дистальном конце C1-6алкильной цепи. Где C1-6алкильная цепь представляет собой алкильную группу с неразветвленной цепью, это означает, что C1-6алкил замещен при Cx, где x представляет собой общее число атомов углерода в C1-6алкильной цепи. Подобным образом, когда C1-6алкильная цепь представляет собой алкильную группу с разветвленной цепью, это означает, что C1-6алкил замещен на дистальном конце одной из ветвей, как правило, самой длинной ветви.
В предпочтительных вариантах выполнения изобретения R1 замещен одной группой, причем заместитель находится на дистальном конце C1-6алкильной цепи, как указано выше. Такие группы особенно эффективны при обеспечении улучшенной устойчивости к гидролизу. Предпочтительно единичная группа представляет собой гидроксильную группу. Предпочтительные группы поэтому включают гидроксиметил, 2-гидроксиэтил, 3-гидроксипропил, 4-гидроксибутил, 5-гидроксипентил и 6-гидроксигексил. Особенно предпочтительной группой является 2-гидроксиэтил.
В других предпочтительных вариантах выполнения изобретения R1 замещен двумя вицинальными группами, то есть двумя группами в соседних положениях вдоль C1-6алкильной цепи. Такие группы особенно эффективны при обеспечении улучшенной устойчивости к гидролизу. Предпочтительно, две вицинальные группы находятся на дистальном конце C1-6алкильной цепи. Где С1-6 алкильная цепь представляет собой алкильную группу с неразветвленной цепью, это означает, что две вицинальные группы находятся при Cx и Cx-1, где x представляет собой общее число атомов углерода в C1-6алкильной цепи. Подобным образом, где C1-6алкильная цепь представляет собой алкильную группу с разветвленной цепью, это означает, что две вицинальные группы находятся на дистальном конце одной из ветвей, обычно самой длинной ветви. Предпочтительно две вицинальные группы представляют собой гидроксильные группы. Такие группы обеспечивают основу для конъюгирования с молекулой носителя, как описано ниже. Предпочтительные группы включают 1,2-дигидроксиэтил; 1,2-дигидроксипропил и 2,3-дигидроксипропил; 1,2-дигидроксибутил, 2,3-дигидроксибутил и 3,4-дигидроксибутил; 1,2-дигидроксипентил, 2,3-дигидроксипентил, 3,4-дигидроксипентил и 4,5-дигидроксипентил; и 1,2-дигидроксигексил, 2,3-дигидроксигексил, 3,4-дигидроксигексил, 4,5-дигидроксигексил и 5,6-дигидрокгексил. Как отмечено выше, предпочтительно, чтобы две вицинальные группы находились на дистальном конце C1-6алкильной цепи. Поэтому особенно предпочтительные группы включают 1,2-дигидроксиэтил, 2,3-дигидроксипропил; 3,4-дигидроксибутил, 4,5-дигидроксипентил и 5,6-дигидроксигексил. Особенно предпочтительная группа представляет собой 4,5-дигидроксипентил.
В некоторых вариантах выполнения изобретения модифицированный капсулярный сахарид содержит, по меньшей мере, два вида блокирующей группы (как описано выше). Например, предпочтительно, сахарид содержит а) по меньшей мере, одну блокирующую группу, где R1 замещен одной группой, причем это замещение происходит на дистальном конце С1-6алкильной цепи (как описано выше); и b) по меньшей мере, одну блокирующую группу, где R1 замещен двумя вицинальными группами (как описано выше). Такие смешанные блокирующие группы особенно эффективны при обеспечении улучшенной устойчивости к гидролизу. Более того, путем включения, по меньшей мере, одной блокирующей группы, в которой R1 замещен двумя вицинальными гидроксильными группами, обеспечивается основа для конъюгирования с молекулой носителя, как описано ниже.
Предпочтительно, R3 представляет собой C1-С3алкил. Более предпочтительно R3 представляет собой C1алкил (СН3), хотя C2алкил и С3алкил так же являются предпочтительными.
Блокирующие группы формулы -O-X-Y или -O-R1 могут быть получены из гидроксильных групп (например, как обнаружено в нативной молекуле) путем стандартных методик получения производных, таких как реакция гидроксильной группы с ацилгалидом, алкилгалидом, сульфонилгалидом и т.д. Следовательно, атом кислорода в -O-X-Y предпочтительно представляет собой атом кислорода гидроксильной группы, тогда как группа -X-Y в -O-X-Y предпочтительно замещает атом водорода гидроксильной группы. Альтернативно блокирующие группы могут быть доступны через реакцию замещения, такую как реакция Мицунобу. Эти и другие способы получения блокирующих групп из гидроксильных групп хорошо известны.
Как правило, модифицированные сахариды по настоящему изобретению представляют собой олигосахариды. Олигосахариды могут быть получены из полисахаридов посредством любых способов деполимеризации и распределения по размерам, описанных здесь.
Модифицированные капсулярные сахариды по изобретению могут быть получены из нативных капсулярных сахаридов. Однако настоящее изобретение не ограничивается модифицированными сахаридами, получаемыми из нативных капсулярных сахаридов. Модифицированные капсулярные сахариды могут быть получены другими способами, такими как общий или частичный синтез (смотрите, например, ссылку 5).
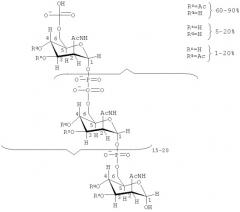
В модифицированных капсулярных сахаридах по изобретению число моносахаридных единиц, имеющих блокирующие группы, может варьироваться. Предпочтительно все или по существу все моносахаридные единицы модифицированного капсулярного сахарида могут иметь блокирующие группы. Альтернативно, по меньшей мере, 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80% или 90% моносахаридных единиц модифицированного капсулярного сахарида могут иметь блокирующие группы. По меньшей мере, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39 или 40 моносахаридных единиц модифицированного капсулярного сахарида могут иметь блокирующие группы.
Где модифицированные капсулярные сахариды содержат, по меньшей мере, два вида блокирующей группы, число моносахаридных единиц, имеющих каждый вид блокирующей группы, может также варьироваться. Например, соотношение общего числа блокирующих групп одного типа к другому типу(ам) блокирующих групп может варьироваться. В частности, когда присутствует два вида блокирующих групп, соотношение одного типа блокирующей группы и другого типа блокирующей группы может выбираться из 1:20, 1:19, 1:18, 1:17, 1:16, 1:15, 1:14, 1:13, 1:12, 1:11, 1:10, 1:9, 1:8, 1:7, 1:6, 1:5, 1:4, 1:3, 1:2 и 1:1. В частности, в варианте выполнения изобретения, описанном выше, где сахарид содержит а) по меньшей мере, одну блокирующую группу, в которой R1 замещен одной группой, причем это замещение происходит на дистальном конце C1-6алкильной цепи; и b) по меньшей мере, одну блокирующую группу, в которой R1 замещен двумя вицинальными группами, предпочтительно, что соотношение первого типа блокирующей группы и второго типа блокирующей группы выбирается из 99:1, 98:2, 97:3, 96:4, 95:5, 94:6, 93:7, 92:8, 91:9, 90:10, 89:11, 88:12, 87:13, 86:14, 85:15, 84:16, 83:17, 82:18, 81:19 и 80:20. Такие соотношения, как 95:5, 94:6, 93:7, 92:8, 91:9, 90:10, 89:11, 88:12, 87:13, 86:14 и 85:15, являются особенно предпочтительными. Среди указанных соотношений 90:10 является предпочтительным.
Подобным образом, число блокирующих групп на моносахаридной единице может варьироваться. Например, число блокирующих групп на моносахаридной единице может составлять 1, 2, 3, 4, 5 или 6, предпочтительно 1-4, более предпочтительно 1 или 2, наиболее предпочтительно 1.
В одном варианте выполнения изобретения, по меньшей мере, одна моносахаридная единица, имеющая блокирующую группу, включает нетерминальную моносахаридную единицу. Термин "нетерминальная моносахаридная единица" означает моносахаридную единицу, которая не представляет собой одну из терминальных моносахаридных единиц в цепи олигосахарида/полисахарида.
Настоящее изобретение охватывает модифицированные капсулярные сахариды, в которых все положения гидроксильных групп терминальных и нетерминальных моносахаридных единиц имеют блокирующую группу. Однако в некоторых предпочтительных вариантах выполнения изобретения присутствует, по меньшей мере, одна свободная гидроксильная группа или аминогруппа в модифицированном капсулярном сахариде по настоящему изобретению. Свободная гидроксильная группа или аминогруппа является преимущественной, так как обеспечивает основу для дальнейших реакций модифицированного капсулярного сахарида, например, для конъюгирования с молекулой носителя, как описано ниже. Когда модифицированный сахарид содержит свободную гидроксильную группу, она может представлять собой аномерную гидроксильную группу, в частности терминальную аномерную гидроксильную группу. Когда модифицированный сахарид содержит аминогруппу, она может быть получена из аномерной гидроксильной группы. Аминогруппы могут быть легко получены из аномерных гидроксильных групп путем восстановительного аминирования (применяя, например NaBH3CN/NH4Cl). Подобным образом, в других предпочтительных вариантах выполнения изобретения существует, по меньшей мере, одна моносахаридная единица модифицированного капсулярного сахарида, где две вицинальные гидроксильные группы соответствующего нативного капсулярного сахарида не содержат блокирующие группы. Таким образом, предпочтительно, 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 11%, 12%, 13%, 14%, 15%, 16%, 17%, 18%, 19% или 20% моносахаридных единиц имеют две вицинальные гидроксильные группы. Например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39 или 40 моносахаридных единиц имеют две вицинальные гидроксильные группы. Таким образом, предпочтительно 5-15%, наиболее предпочтительно 10% моносахаридных единиц имеют две вицинальные гидроксильные группы. Две вицинальные гидроксильные группы в моносахаридной единице(ах) являются преимущественными, потому что они обеспечивают основу для конъюгирования с молекулой носителя, как обсуждается ниже.
Альтернативно, в некоторых предпочтительных вариантах выполнения изобретения, по меньшей мере, 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 11%, 12%, 13%, 14%, 15%, 16%, 17%, 18%, 19% или 20% моносахаридных единиц модифицированного капсулярного сахарида имеют блокирующие группы, в которых R1 замещен двумя вицинальными гидроксильными группами, как описано выше. Например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39 или 40 моносахаридных единиц модифицированного капсулярного сахарида могут иметь такие блокирующие группы. Предпочтительно 5-15%, наиболее предпочтительно 10%, моносахаридных единиц модифицированного капсулярного сахарида имеют блокирующие группы, где R1 замещен двумя вицинальными гидроксильными группами. Еще раз, две вицинальные гидроксильные группы в моносахаридной единице(ах) являются преимущественными, потому что обеспечивают основу для конъюгирования с молекулой носителя, как описано ниже.
В ссылке 4 предположили, что эффективными блокирующими группами являются электроноакцепторные группы. Не желая ограничиваться теорией, полагают, что гликозидные связи являются неустойчивыми к гидролизу из-за внутримолекулярной нуклеофильной атаки сахаридной гидроксильной группы на гликозидную связь (то есть путем образования циклического интермедиата). Чем больше нуклеофильность гидроксильной группы, тем больше тенденция к внутримолекулярной нуклеофильной атаке. Электроноакцепторная блокирующая группа оказывает эффект делокализации неподеленной пары кислорода, таким образом, уменьшая нуклеофильность кислорода и уменьшая тенденцию к внутримолекулярной нуклеофильной атаке. Удивительно было обнаружено, что группы, содержащие C1-6алкил, замещенный 1, 2 или 3 группами, независимо выбранными из гидроксильной, сульфгидрильной и аминогруппы могут быть эффективными блокирующими группами, несмотря на присутствие нуклеофильного гидроксила, сульфгидрила и аминогруппы, могут быть эффективными блокирующими группами, несмотря на присутствие нуклеофильной гидроксильной, сульфгидрильной или аминогруппы в блокирующей группе. Более того, эти гидроксил-, сульфгидрил- или аминозамещенные группы являются преимущественными, так как они обеспечивают более эффективное конъюгирование модифицированного капсулярного сахарида с молекулой носителя. Не желая ограничиваться теорией, полагают, что этот эффект возникает из-за относительной гидрофильности групп, содержащих C1-6алкил, замещенный 1, 2 или 3 группами, независимо выбранными из гидроксила, сульфгидрила и амина. Кроме того, когда блокирующие группы содержат C1-6алкил, замещенный двумя вицинальными гидроксильными группами, блокирующая группа сама по себе обеспечивает основу для конъюгирования с молекулой носителя.
Во всех вариантах выполнения изобретения, описанных выше, модифицированный капсулярный сахарид предпочтительно представляет собой модифицированный капсулярный сахарид, имеющий фосфодиэфирные связи. Особенно предпочтительно, модифицированный капсулярный сахарид представляет собой модифицированный сахарид серогруппы A Neisseria meningitidis. Сахариды серогруппы A Neisseria meningitidis являются особенно неустойчивыми к гидролизу.
Когда модифицированный капсулярный сахарид представляет собой модифицированный сахарид серогруппы A Neisseria meningitidis, блокирующая группа предпочтительно находится в положениях 3 и/или 4, более предпочтительно в положениях 4 соответствующего сахарида серогруппы A Neisseria meningitidis. Блокирующие группы в положениях 4 и/или 3 сахарида серогруппы A Neisseria meningitidis, как было показано, особенно эффективны для улучшения устойчивости в отношении гидролиза.
В вариантах выполнения изобретения со сложноэфирными блокирующими группами (например, когда блокирующая группа имеет формулу (Ia), X представляет собой С(O), и Y представляет собой R3), изобретатели обнаружили, что устойчивость модифицированного сахарида серогруппы А Neisseria meningitidis зависит от доли 4- и/или 3-положений, которые имеют блокирующие группы. Например, доля 4-положений, которые имеют блокирующие группы, может составлять около 0%, по меньшей мере, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95% или около 100%, причем, по меньшей мере, 30% и около 100% является предпочтительным. Подобным образом, доля 3-положений, которые имеют блокирующие группы, может составлять около 0%, по меньшей мере, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95% или около 100%, причем, по меньшей мере, 95% и около 100% является предпочтительным. Обычно, доля 4- и 3-положений, имеющих блокирующие группы, является приблизительно одинаковой. Другими словами, соотношение положений 4, имеющих блокирующие группы, и положений 3, имеющих блокирующие группы, составляет около 1:1. Однако в некоторых вариантах выполнения изобретения, доля 4-положений, которые имеют блокирующие группы, может варьироваться относительно 3-положений, которые имеют блокирующие группы. Например, однако, соотношение положений 4, которые имеют блокирующие группы, и положений 3, которые имеют блокирующие группы, может составлять 1:20, 1:19, 1:18, 1:17, 1:16, 1:15, 1:14, 1:13, 1:12, 1:11, 1:10, 1:9, 1:8, 1:7, 1:6, 1:5, 1:4, 1:3 или 1:2. Подобным образом, соотношение 3-положений, которые имеют блокирующие группы, и 4-положений, которые имеют блокирующие группы, может составлять 1:20, 1:19, 1:18, 1:17, 1:16, 1:15, 1:14, 1:13, 1:12, 1:11, 1:10, 1:9, 1:8, 1:7, 1:6, 1:5, 1:4, 1:3 или 1:2.
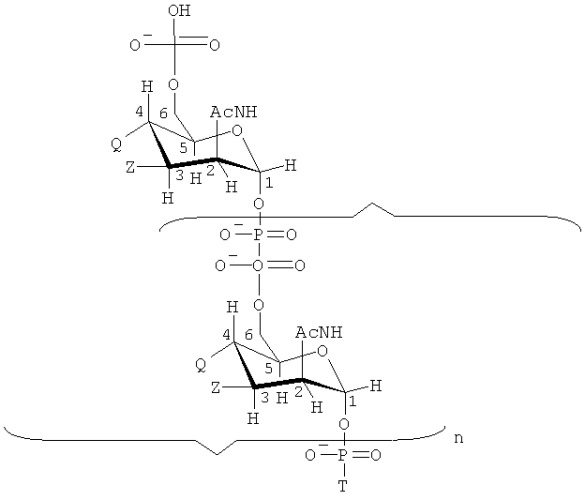
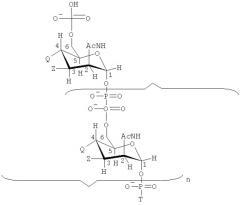
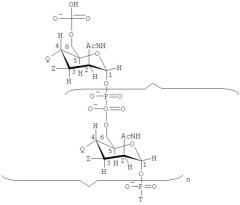
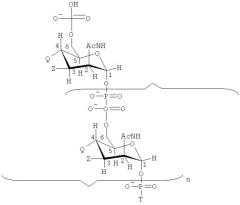
Изобретение также обеспечивает сахарид формулы:
где
Т имеет формулу (А) или (В):
n представляет собой целое число от 1 до 100;
каждая группа Z независимо выбирается из -ОН, ОАс или блокирующей группы, как определено выше; и
каждая группа Q независимо выбирается из -ОН, ОАс или блокирующей группы, как определено выше;
V выбирается из -NH2, -NНЕ, -NE1E2, W2, или -O-D, где Е, Е1 и Е2 представляют собой группы, защищающие атом азота, которые могут быть одинаковыми или разными, и D представляет собой защитную группу для кислорода;
W выбирается из -ОН или блокирующей группы, как указано выше;
W1 выбирается из -ОН или блокирующей группы, как указано выше;
W2 выбирается из -ОН или блокирующей группы, как указано выше;
и где, по меньшей мере, одна (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39 или 40) из групп Z и/или, по меньшей мере, одна (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39 или 40) из групп Q представляет собой блокирующие группы, как определено выше.
Предпочтительно n представляет собой целое число от 15 до 25.
Каждые из n+2 Z групп могут быть одинаковыми или отличными друг от друга. Подобным образом, каждые из n+2 Q групп могут быть одинаковыми или отличными друг от друга.
V представляет собой предпочтительно -NH2 или -NНЕ.
Подходящие защитные группы для атома азота представляют собой силильные группы (такие как TMS, TES, TBS, TIPS), ацильные производные (такие как, трифторацетамиды, метоксикарбонил, этоксикарбонил, т-бутоксикарбонил (Вос), бензилоксикарбонил (Z или Cbz), 9-фторенилметоксикарбонил (Fmoc), 2-(триметилсилил)этоксикарбонил, аллилоксикарбонил (Alloc), 2,2,2-трихлорэтоксикарбонил (Troc)), сульфонильные производные (такие как β-триметилсилилэтансульфонил (SES)), сульфенильные производные, C1-12алкил, бензил, бензгидрил, тритил, аллил, 9-фенилфторенил и т.д. Предпочтительной защитной группой для азота является Fmoc.
Двухвалентные защитные группы атома азота, которые могут применяться в виде Е1Е2, включают циклические имидные производные (такие как N-фталимиды, N-дитиасукцинимиды, N-2,3-дифенилмалеимиды), производные имина (такие как N-1,1-диметилтиометиленамины, N-бензилиденамины, N-п-метоксибензилиденамины, N-дифенилметиленамины), производные енамина (такие как N-(5,5-диметил-3-оксо-1-циклогексенил)амины) и т.д. Предпочтительная двухвалентная защитная группа атома азота представляет собой N-фталимидил.
Подходящие защитные группы для атома азота включают сложные эфиры, простые эфиры (например, простые силильные эфиры или алкильные эфиры) и ацетали. Конкретные примеры включают аллил, ацетил, Aloс, бензил, бензилоксиметил (ВОМ), т-бутил, тритил, трет-бутилдиметилсилил (TBS), трет-бутилдифенилсилил (TBDPS), триэтилсилил (TES), триметилсилил (TMS), триизопропилсилил (TIPS), параметоксибензил (РМВ), MEM, метоксиметил (MOM), МТМ и тетрагидропиранил (ТНР).
Все группы Z могут представлять собой ОН (при условии, что, по меньшей мере, одна из групп Z и/или, по меньшей мере, одна из групп Q представляют собой блокирующие группы). В качестве альтернативы того, что все группы Z представляют собой ОН, по меньшей мере, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80% или 90% групп Z могут представлять собой ОАс. Предпочтительно, около 60-90% групп Z представляют собой ОАс, причем оставшиеся группы Z представляет собой ОН или блокирующие группы, как описано выше. Предпочтительно, по меньшей мере, 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 25%, 30%, 35% или 40% групп Z представляют собой блокирующие группы, 60-90% представляют собой ОАс, и остаток представляет собой ОН. Предпочтительно, около 10-40% групп Z представляют собой блокирующие группы, 60-90% представляют собой ОАс и остаток представляет собой ОН. Альтернативно, около 0%, по меньшей мере, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95% или около 100% групп Z представляют собой блокирующие группы, причем, по меньшей мере, 95% и около 100% является предпочтительным.
Все группы Q могут представлять собой ОН (при условии, что, по меньшей мере, одна из групп Z и/или групп Q представляют собой блокирующие группы). Альтернативно, по меньшей мере, 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15% или 20% групп Q могут представлять собой ОАс. Предпочтительно, около 1-20% групп Q представляют собой ОАс, причем остаток групп Q представляет собой ОН или блокирующие группы, как описано выше. Предпочтительно, по меньшей мере, 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% групп Q представляют собой блокирующие группы, 1-20% представляют собой ОАс и оставшиеся группы представляют собой ОН. Предпочтительно, около 80-99% групп Q представляют собой блокирующие группы, 1-20% представляют собой ОАс и оставшиеся группы представляют собой ОН. Альтернативно, около 0%, по меньшей мере, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95% или около 100% групп Q представляют собой блокирующие группы, причем, по меньшей мере, 30% и около 100% являются предпочтительными.
Настоящее изобретение также предоставляет молекулу, содержащую сахаридную составляющую формулы:
где
Т имеет формулу (А) или (В):
n, Z, Q и W определены выше; по меньшей мере одна (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39 или 40) из групп Z и/или по меньшей мере одна (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39 или 40) из групп Q представляет собой блокирующие группы; и L представляет собой О, NH, NE, S или Se.
Свободная ковалентная связь L может быть соединена с любой подходящей составляющей, например с -Н, -Е, линкером, белком-носителем и т.д. L предпочтительно представляет собой N или О. Так же возможно, что L представляет собой N, соединенный с двухвалентным линкером, с двухвалентной защитной группой или с двухвалентным белком-носителем.
Предпочтительные значения n и групп Z, Q и W описываются выше.
Настоящее изобретение также предоставляет молекулу, содержащую сахарид формулы:
в которой
Т имеет формулу (А) или (В):
n, Z, Q, W, W1 и V определены выше; по меньшей мере одна (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39 или 40) из групп Z и/или по меньшей мере одна (например,1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39 или 40) из групп Q представляет собой группу формулы (IIa) или (IIb):
где
Х определена выше;
Y' представляет собой NR2R4;
R2 определена выше; и
R4 представляет собой -C1-4алкилен-СН(О) или -C1-5алкилен-NH-, где группа -NH- представляет собой часть белка-носителя.
Предпочтительно, по меньшей мере одна группа(ы) Z и/или Q имеет формулу (IIa). В этом варианте выполнения изобретения, предпочтительно, чтобы Х представлял собой С(O).
Предпочтительные группы R2 описаны выше в отношении формулы (Ia).
Предпочтительные группы R4 включают -C1алкилен-СН(О), -С2алкилен-СН(O), -С3алкилен-СН(О) и -С4алкилен-СН(О). Особенно предпочтительная группа R4 представляет собой-С3алкилен-СН(О).
Другие предпочтительные группы R4 группы включают -C1алкилен-NH-, -C2алкилен-NH-; -С3алкилен-NH-, -C4алкилен-NH- и -С5алкилен-NH-. Особенно предпочтительная R4 группа представляет собой -C4алкилен-NH-.
Предпочтительные значения n и групп Z, Q, W, W1 и V описываются выше.
Способ производства модифицированного сахарида.
Изобретение обеспечивает способ модификации капсулярного сахарида, содержащий стадии:
(a) обеспечение капсулярного сахарида, имеющего, по меньшей мере, одну гидроксильную группу на моносахаридной единице; и
(b) превращение указанной, по меньшей мере, одной гидроксильной группы в блокирующую группу.
Блокирующая группа представляет собой любую из блокирующих групп, определенных выше.
Капсулярный сахарид может представлять собой нативный капсулярный сахарид (олигосахарид или полисахарид). В качестве альтернативы, капсулярный сахарид может представлять собой, например, де-O-ацетилированный капсулярный сахарид, имеющий терминальную аминогруппу (например, полученный путем восстановительного аминирования).
Предпочтительный способ модификации сахарида, в котором блокирующая группа представляет собой -OC(O)NR1R2,представляет собой способ, в котором стадия (b) содержит стадии:
(b1) реакция капсулярного сахарида с бифункциональным реагентом в органическом растворителе; и
(b2) реакция продукта стадии (b1) с аминосоединением формулы (III):
,
где R1 и R2 определены выше.
Термин "бифункциональный реагент" означает любой реагент, который способен осуществлять двойные функции (i) обеспечения на стадии (b1) первого электрофильного атома углерода для связывания с гидроксильной группой(ами) на сахариде; и (ii) обеспечение второго электрофильного атома углерода для связывания с аминогруппой, применяемой на стадии (b2). В общем, второй электрофильный атом углерода регенерируется из первого электрофильного атома углерода во время стадии (b). Бифункциональный реагент обеспечивает связь -С(O)- между полисахаридом и аминосоединением.
Бифункциональные реагенты для применения в настоящем изобретении включают, но без ограничения к этому, 1,1'-карбонилдиимидазол (CDI), карбонил ди-1,2,4-триазол (CDT), карбонил ди-1,2,3-бензотриазол (CDB), дифенилкарбонат, цианоген бромид, фосген или трифосген. Специалист в данной области техники осведомлен о других бифункциональных реагентах, которые могут осуществлять те же функции, как эти.
Предпочтительным бифункциональным реагентом является CDI. CDI имеет то преимущество, что является более мягким реагентом, чем, например, фосген или цианоген бромид. В частности, реакции связывания, применяющие CDI, не приводят к образованию газов галогенводородных кислот, таких как HCl или HBr. Образование газа HCl или HBr является нежелательным, потому что эти газы приводят к необходимости очищения проходов реакционной камеры, чтобы избежать их выхода в атмосферу. Более того, образование HCl или HBr газа может воздействовать на чувствительные функциональные группы на сахариде, приводя к потере в выходе из-за разрушения или фрагментации сахарида.
Органический растворитель, применяемый на стадии (b1), предпочтительно представляет собой апротонный растворитель. Апротонные растворители хорошо известны специалистам в данной области техники и не содержат какие-либо ионизируемые атомы водорода. Эти растворители являются предпочтительными, потому что они способствуют реакции гидроксильной группы(групп) на сахариде с бифункциональным реагентом, путем усиления нуклеофильности гидроксильной группы(групп). Подходящие апротонные растворители включают, но без ограничения к этому, диметилсульфоксид (DMSO), диметилформамид (DMF), формамид, гексаметилфосфортриамид (НМРТ), 1,3-диметил-3,4,5,6-тетрагидро-2(1Н)-пиримидинон (DMPU), диметилацетамид (DMAC) или гексаметилфосфорамид (НМРА). DMSO является предпочтительным.
На стадии (b2) способа по изобретению продукт стадии (b1) реагирует с аминосоединением с образованием модифицированного полисахарида. Аминосоединение, применяемое в способе по настоящему изобретению, имеет формулу (III), как описано выше.
Подходящие аминосоединения, которые могут применяться в изобретении, зависят от R1 и R2. Как описано выше, в предпочтительных вариантах выполнения изобретения, R1 замещен одной гидроксильной группой, причем это замещение происходит на дистальном конце C1-6алкильной цепи, и R2 представляет собой Н. Предпочтительные аминосоединения, которые могут применяться в изобретении, таким образом, включают аминометанол, 2-аминоэтанол, 3-аминопропан-1-ол, 4-аминобутан-1-ол, 5-аминопентан-1-ол и 6-аминогексил-1-ол. Особенно предпочтительным аминосоединением является 2-аминоэтанол. В других предпочтительных вариантах выполнения изобретения, R1 замещен двумя вицинальными гидроксильными группами, и R2 представляет собой Н. Предпочтительные аминосоединения, которые могут применяться в изобретении, таким образом, включают 1-аминоэтан-1,2-диол; 1-аминопропан-1,2-диол и 3-аминопропан-1,2-диол; 1-аминобутан-1,2-диол, 1-аминобутан-2,3-диол и 4-аминобутан-1,2-диол; 1-аминопентан-1,2-диол, 1-аминопентан-2,3-диол, 5-аминопентан-2,3-диол и 5-аминопентан-1,2-диол; и 1-аминогексан-1,2-диол, 1-аминогексан-2,3-диол, 5-аминогексан-3,4-диол, 6-аминогексан-2,3-диол и 6-аминогексан-1,2-диол. В особенно предпочтительных вариантах выполнения изобретения R1 замещен двумя вицинальными гидроксильными группами на дистальном конце C1-6алкильной цепи. Предпочтительные аминосоединения, которые могут применяться в изобретении, таким образом, включают, 3-аминопропан-1,2-диол, 4-аминобутан-1,2-диол, 5-аминопентан-1,2-диол и 6-аминогексан-1,2-диол. Особенно предпочтительным аминосоединением является 5-аминопентан-1,2-диол. Эти соединения могут применяться в виде соли (например, гидрохлоридной соли).
Предпочтительный способ по изобретению показан на схеме 1 ниже:
В этой схеме, сахарид (например, MenA полисахарид или олигосахарид) сначала активируют через, по меньшей мере, одну из его гидроксильных групп на моносахаридной единице, применяя CDI в растворителе DMSO. Полученный интермедиат, карбамат имидазола захватывается амином R1R2NH (например, 2-аминоэтанол) с получением модифицированного сахарида.
Модифицированные сахариды альтернативно могут быть получены с помощью одностадийного способа путем реакции одной или более гидроксильных групп на капсулярном сахариде с реагентом формулы XC(O)CONR1R2, где Х представляет собой уходящую группу, и R1 и R2 описаны выше. Походящие уходящие группы включают, но без ограничения к этому, -Cl, -Br, -CF3, -OC6F5 или -CCl3.
Предпочтительный способ модификации сахарида представляет собой способ, в