Производные 5,7-диметил-1,3-диазаадамантан-6-она, содержащие монотерпеновый остаток, новые анальгезирующие средства
Иллюстрации
Показать всеИзобретение относится к производным 5,7-диметил-1,3-диазаадамантан-6-она, содержащим монотерпеновый остаток, общей формулы 1, которые обладают анальгезирующим действием. В формуле 1 R выбран из:. 3 табл., 6 пр.
Реферат
Изобретение относится к области органической химии, а именно к новым органическим соединениям, конкретно к производным 5,7-диметил-1,3-диазаадамантан-6-она, содержащим монотерпеновый остаток, общей формулы 1 (включая пространственные изомеры, в том числе оптически активные формы, в том числе в виде солей по атомам азота),
где R может быть:
обладающим анальгезирующим действием.
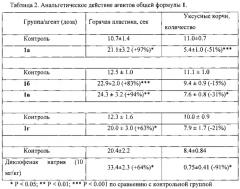
Среди анальгезирующих средств, относящихся по фармакологическому действию к ненаркотическим анальгетикам, известны такие, как ацетилсалициловая кислота, анальгин и другие [1]. Данные по активности на модели «уксусные корчи» (ED50) и острой токсичности (LD50) известных лекарственных средств приведены в [2] и отражены в таблице 1.
Основными недостатками применения ацетилсалициловой кислоты являются низкое селективное обезболивающее действие и гастротоксичность; анальгина - возможное угнетение кроветворения, вплоть до полного агранулоцитоза.
Наиболее близким к заявляемому средству по фармакологическому действию - прототипом, является диклофенак натрия [3].
Недостатками применения диклофенака натрия являются желудочно-кишечные расстройства и гастротоксичность.
Задача, на решение которой направлено изобретение, заключается в создании нового соединения, обладающего анальгезирующей активностью.
Поставленная задача решается производными 5,7-диметил-1,3-диазаадамантан-6-она, содержащими монотерпеновый остаток, общей формулы 1 (включая пространственные изомеры, в том числе оптически активные формы, в том числе в виде солей по атомам азота),
где R может быть:
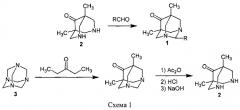
Соединения общей формулы 1 не были ранее описаны в литературе, они могут быть синтезированы в соответствии со схемой 1 взаимодействием биспидинона 2 с монотерпеновыми альдегидами (миртеналем для получения соединения 1а, цитралем - 1б, цитронеллалем - 1в, и камфоленовым альдегидом - 1г).
Соединение 2 может быть, в свою очередь, синтезировано из гексаметилентетрамина (уротропина) 3 в соответствии с известными методиками [4].
Анальгетическая активность соединений общей формулы 1 изучалась на моделях висцеральной боли «уксусные корчи» и термического раздражения «горячая пластина» при однократном внутрижелудочном введении белым беспородным мышам в дозе 20 мг/кг за час до тестирования.
«Уксусные корчи» воспроизводили путем внутрибрюшинного введения 0.75% уксусной кислоты по 0.1 мл на одно животное. Оценка активности осуществлялась спустя 5 минут после введения кислоты путем подсчета количества корчей в течение 3 мин.
«Горячая пластина» - тест, характеризующий термическое раздражение. Животных помещали на медную пластину, Τ=54°C. Эффект оценивали по продолжительности нахождения животного на горячей пластине до первой вокализации в секундах.
Обнаружено, что соединения 1а-г в дозе 20 мг/кг проявили выраженную анальгетическую активностью в тесте «горячая пластина», при этом соединения 1а-в превосходят по эффективности диклофенак натрия (таблица 2). Кроме того, соединения 1а и 1в проявили достоверную анальгетическую активность в тесте «уксусные корчи».
Одним из наиболее серьезных побочных эффектов, связанных с использованием ненаркотических анальгетиков, в частности нестероидных противовоспалительных средств, является гастротоксичность. Для соединения 1а, проявившего наибольшую активность в обоих тестах, мы исследовали ульцерогенную активность в сравнении с индометацином.
В ходе эксперимента самкам крыс линии Вистар массой 160-180 г (группы по 8 животных) ежедневно в течение 3 дней вводили внутрижелудочно агент 1а (в дозе 30 мг/кг) и индометацин (в дозе 20 мг/кг). На 4 день животных подвергли эвтаназии, извлекли желудки, рассекли их по малой кривизне, визуально оценивали слизистую оболочку желудка.
В группе животных, получавших индометацин, до окончания эксперимента погибли 4 животных, у оставшихся 4 были обнаружены эрозии и язвы (от 4 до 11 язв на животное). В группе животных, получавших соединение 1а, до конца эксперимента дожили все животные, наличия язв не было выявлено.
Острую токсичность соединения 1а определяли на белых беспородных мышах массой 20-22 г при однократном внутрижелудочном введении по методу Кербера. Показано, что соединение 1а является умереннотоксичным веществом: LD50 превышает 1000 мг/кг. Таким образом, соединение 1а существенно менее токсично, чем диклофенак натрия (LD50 370 мг/кг).
Исходя из вышесказанного, можно заключить, что соединения общей формулы 1 проявляют высокую анальгетическую активность в сочетании с низкой острой токсичностью и отсутствием ульцерогенного действия, и могут, после проведения соответствующих испытаний, использоваться, как в чистом виде, так и в качестве основы новых низкотоксичных высокоэффективных анальгезирующих лекарственных форм.
Изобретение иллюстрируется следующими примерами.
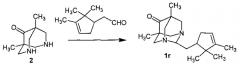
Пример 1. Синтез 2-(6,6-диметилбицикло[3.1.1]гепт-2-ен-2-ил)-5,7-диметил-1,3-диазаадамантан-6-она 1а.
К 0.057 г (0.38 ммоль) (-)-миртеналя добавили 0.062 г (0.37 ммоль) 1,5-диметилбиспидин-9-она в 2 мл метанола. Смесь перемешивали в течение 7.5 часов при комнатной температуре. Растворитель отогнали, продукт очистили колоночной хроматографией на SiO2. Получили 0.064 г (58%) соединения 1а. [ α ] D 27 = − 21.63 . ЯМР 1H CDCl3, δH, м.д: 0.79 с и 0.89 с (по 3Н, C11H3, C12H3), 0.88 с (3Н, C21H), 1.14 д (1Н, J19анти,19син=8.0 Гц, H19анти), 1.28 с (3Н, C20H3), 2.09-2.14 м (1Н, H16), 2.30 д.д.д.д (1Н, 2J=18.0 Гц, J15,14=J15,16=J15,2=3.0 Гц, H15), 2.37 д.д.д.д (1Н, 2J=18.0 Гц, J15′,14=J15′,16=J15′,2=3.0 Гц, Н15), 2.42-2.47 м (2Н, Н18, Н19син), 2.68-2.75 м (2Н), 3.08-3.16 м (2Н), 3.26-3.33 м (3Н), 3.45 д.д (1Н, 2J=13.2 Гц, 4J=3.3 Гц) - 4NCH2, 4.35 м (1H, все J≤3.5 Гц, Η2), 5.72 м (1Η, все J≤3.5 Гц, Η14). ЯМР 13C CDCl3, δC, м.д: 79.33 д (С2), 67.60 т и 67.40 т (С8, С10 или С4, С9), 45.61 с и 45.89 с (С5, С7), 212.31 с (С6), 59.95 т и 60.51 т (С4, С9 или С8, С10), 15.82 к и 16.31 к (С11, С12), 144.28 с (С13), 120.97 д (С14), 31.38 т (С15), 40.86 д (С16), 37.60 с (С17), 41.58 д (С18), 31.83 т (С19), 26.14 к (С20), 21.02 к (С21). Найдено [М+]: 300.2196. C19H28N2O. Вычислено [M+]: 300.2196.
Пример 2. Синтез 2-(2,6-диметилгепта-1,5-диен-1-ил)-5,7-диметил-1,3-диазаадамантан-6-она 1б.
К 0.056 г (0.37 ммоль) цитраля добавили 0.062 г (0.37 ммоль) 1,5-диметилбиспидин-9-она в 2 мл метанола и перемешивали 30 минут при комнатной температуре. Растворитель отогнали, продукт очистили колоночной хроматографией на SiO2. Получили 0.058 г (55%) 1б (в виде цис- и транс-изомеров в соотношении ~1 к 1). цис-Изомер. ЯМР 1Н CDCl3, δH, м.д: 0.84 с, 0.87 с (по 3Н, C11Н3, C12Н3), 1.58 ш.с (3Н, С21Н3), 1.65 м (3Н, все J≤2.5 Гц, С19Н3), 1.77 м (3Н, все J≤2.5 Гц, С20Н3), 2.02-2.08 м (2Н, 2Н16), 2.11-2.16 м (2Н, 2Н15), 2.72-2.76 м (2Н), 3.05-3.09 м (2Н), 3.28-3.33 м (2Н), 3.45-3.51 м (2Н) - 4NCH2, 4.61 ш.д (1Н, J2,13=5.5 Гц, Н2), 5.11 т.к.к (1H, J17,16=7.2 Гц, J17,19=J17,21=1.5 Гц, Н17), 5.48 д.м (1Н, J13,2=5.5 Гц, Н13). ЯМР 13С CDCl3, δC, м.д: 75.34 д (С2), 59.74 т, 59.77 т, 67.13 т, 67.19 т (С4, С8, С9, С10), 45.17 с, 45.97 с (С5, С7), 212.07 с (С6), 15.89 к, 16.28 к. (С11, С12), 121.35 д (С13), 141.95 с (С14), 32.50 т (С15), 26.11 т (С16), 124.07 д (С17), 131.62 с (С18), 25.56 к (С19), 23.39 к (С20), 17.40 к (С21). транс-Изомер. ЯМР 1Н CDCl3, δH, м.д: 0.84 с, 0.88 с (по 3Н, С11Н3, С12Н3), 1.59 ш.с (3Н, С21Н3), 1.66 м (3Н, все J≤2.5 Гц, С19Н3), 1.72 ш.с (С20Н3), 2.04-2.09 м (2Н, Н15), 2.10-2.14 м (2Н, Н16), 2.73-2.77 м (2Н), 3.07-3.11 м (2Н), 3.31-3.36 м (2Н), 3.45-3.51 м (2Н) - 4NCH2, 4.61 ш.д (1Н, J2,13=5,5 Гц, Н2), 5.08 т.к.к (1Н, J17,16=7.0 Гц, J17,19=J17,21=1.4 Гц, Н17), 5.48 д.м (1H, J13,2=5.5 Гц, Н13). ЯМР 13С CDCl3, δC, м.д: 75.55 д (С2), 59.74 т, 59.77 т, 67.13 т, 67.19 т (С4, С8, С9, С10), 45.21 с, 45.93 с (С5, С7), 212.03 с (С6), 15.89 к, 16.31 к (С11, С12), 120.68 д (С13), 141.60 с (С14), 39.68 т (С15), 26.27 т (С16), 124.88 д (С17), 131.55 с (С18), 25.60 к (С19), 16.81 к (С20), 17.59 к (С21). Найдено [M+]: 302.2351. C19H30N2O. Вычислено [M+]: 302.2353.
Пример 3. Синтез 2-(2,6-диметилгепт-5-ен-1-ил)-5,7-диметил-1,3-диазаадамантан-6-она 1в.
К 0.057 мг цитронеллаля (0.37 ммоль) добавили 0.061 г (0.36 ммоль) 1,5-диметилбиспидин-9-она в 2 мл метанола, перемешивали 10 минут. Растворитель отогнали, продукт очистили колоночной хроматографией на SiO2. Получили 0.059 г (54%)соединения 1в. ЯМР 1Н CDCl3, δH, м.д: (J, Гц): 0.84 с (3Н), 0.87 с (3Н, C11Н3, C12Н3), 0.94 д (3Н, J20,14=6.6 Гц, С20Н3), 1.21 д.д.д.д (1H, 2J=13.5 Гц, J15,16=9.8 Гц, J15,14=7.6 Гц, J15,16=6.0 Гц, Н15), 1.38 д.д.д.д (1Н, 2J=13.5 Гц, J15′,16′=9.8 Гц, J15′,14=J15′,16=5.8 Гц, Н15′), 1.49 д.д.д (1H, 2J=13.7 Гц, J13,14=8.6 Гц, J13,2=5.9 Гц, Н13), 1.59 ш.с (3Н, С21Н3), 1.53-1.63 м (1Н, Н14), 1.66 м (3Н, все J≤2.5 Гц, С19Н3), 1.92 д.д.д (1Н, 2J=13.7 Гц, J=13′,2=8.1 Гц, J13′,14=5.2 Гц, Н13′), 1.90-2.08 м (2Н, 2Н16), 2.73 д.д (1Н, 2J=13.7 Гц, 4J=3.0 Гц), 2.74 д.д (1Н, 2J=13.7 Гц, 4J=3.0 Гц), 3.07-3.12 м (2Н), 3.27 д.д (1H, 2J=13.0 Гц, 4J=3.3 Гц), 3.29 д.д (1H, 2J=13.0 Гц, 4J=3.3 Гц), 3.39 д.д (1H, 2J=13.7 Гц, 4J=3.3 Гц), 3.44 д.д (1Н, 2J=13.7 Гц, 4J=3.3 Гц) - 4NCH2, 3.93 д.д (1H, J2,l3′=8.1 Гц, J2,13=5.9 Гц, Н2), 5.09 т.к.к (1H, J17,16=7.0 Гц, J17,19=J17,21=1.5 Гц, Н17). ЯМР 13С CDCl3, δC, м.д: 76.14 д (С1), 58.74 т, 59.00 т, 67.93 т, 67.96 т (С4, С8, С9, С10), 45.63 с, 45.86 с (С5, С7), 211.87 с, (С6), 15.78 к, 16.36 к (С11, С12), 37.28 т (С13), 29.71 д (С14), 37.13 т (С15), 25.33 т (С16), 124.63 д (С17), 131.09 с (С18), 25.59 к (С19), 19.41 к (С20), 17.57 к (С21). Найдено [M+]: 304.2511. C19H32N2O. Вычислено [M+]: 304.2509.
Пример 4. Синтез 5,7-диметил-2-[(2,2,3-триметилциклопент-3-ен-1-ил)метил]-1,3-диазаадамантан-6-она 1 г.
К 0.054 мг (0.36 ммоль) (-)-камфоленового альдегида добавили 0.061 г (0.36 ммоль) 1,5-диметилбиспидин-9-она в 2 мл метанола, перемешивали 10 минут. Растворитель отогнали, продукт очистили колоночной хроматографией на SiO2. Получили 0.068 г (63%) соединения 1г. [ α ] D 26 = 7.28 . ЯМР 1H CDCl3, δH, м.д: 0.77 с (3Н, С20Н3), 0.84 с, 0.86 с (по 3Н, С11Н3, С12Н3), 0.97 с (3Н, С19Н3), 1.57 м (3Н, все J≤3.0 Гц, С21Н3), 1.56-1.62 м (1H, Н13), 1.83-1.92 м (2Н, Н14, Н18), 2.11 д.д.д (1H, 2J=13.8 Гц, J13′,2=9.3 Гц, J13′,14=2.9 Гц, Н13′), 2.25-2.33 м (1H, Н18′), 2.72 д.д (1H, 2J=13.6 Гц, 4J=3.0 Гц), 2.75 д.д (1Н, 2J=13.6 Гц, 4J=3.0 Гц), 3.07 д.д (1H, 2J=13.2 Гц, 4J=3.0 Гц), 3.08 д.д (1Н, 2J=13.2 Гц, 4J=3.0 Гц,), 3.24 д.д (1Н, 2J=13.2 Гц, 4J=3.3 Гц), 3.28 д.д (1Н, 2J=13.2 Гц, 4J=3.3 Гц), 3.37 д.д (1Н, 2J=13.6 Гц, 4J=3.3 Гц), 3.48 д.д (1Н, 2J=13.6 Гц, 4J=3.3 Гц) - 4NCH2, 3.88 д.д (1Н, J2,13′=9.3 Гц, J2,13=4.8 Гц, Н2), 5.19 м (1Н, все J≤4.0 Гц, Н17). ЯМР 13С, CDCl3, δC, м.д: 77.04 д (С2), 58.47 т, 58.94 т, 67.80 т, 67.88 т (С4, С8, С9, С10), 45.63 с, 45.84 с (С5, С7), 211.71 с (С6), 15.71 к, 16.32 к (С11, С12), 30.35 (С13), 46.71 д (С14), 46.49 с (С15), 148.23 с (С16), 121.49 д (С17), 35.15 т (С18), 25.46 к (С19), 19.60 к (С20), 12.43 к (С21). Найдено [M+]: 302.2348. C19H30N2O. Вычислено [M+]: 302.2353.
Пример 5. Исследование анальгетической активности соединений общей формулы 1 в тестах «горячая пластина» и «уксусные корчи».
Опыты проводили на белых беспородных мышах-самцах массой 22-25 г. Экспериментальные группы были сформированы по 8 животных в каждой.
Исследуемые агенты общей формулы 1 в дозе 20 мг/кг вводились однократно внутрижелудочно за час до воспроизведения моделей. Контрольным животным вводили соответствующий растворитель.
В тесте «горячая пластина» животных помещали на медную пластину Τ=54°C. Эффект оценивали по продолжительности нахождения животного на горячей пластине до первой вокализации, в секундах. Результаты представлены в таблице 2.
«Уксусные корчи» воспроизводили путем внутрибрюшинного введения 0.75% уксусной кислоты по 0.1 мл на одно животное. Контролем являлись животные с введением только уксусной кислоты. Оценку активности проводили через 5 мин. после введения кислоты, путем подсчета количества корчей в течение 3 мин. Результаты приведены в таблице 2.
Обнаружено, что соединения 1а-г обладают выраженной анальгетической активностью в тесте «горячая пластина», при этом соединения 1а-в превосходят по эффективности диклофенак натрия. Соединения 1а и 1г проявили достоверную анальгетическую активность в тесте «уксусные корчи».
Пример 6. Исследование ульцерогенной активности агента 1а.
Самкам крыс линии Вистар массой 160-180 г (группы по 8 животных) ежедневно в течение 3 дней вводили внутрижелудочно агент 1а (в дозе 30 мг/кг) и индометацин (в дозе 20 мг/кг). На 4 день животных подвергли эвтаназии, извлекли желудки, рассекли их по малой кривизне, визуально оценивали слизистую оболочку желудка. Полученные результаты представлены в табл. 3.
В группе животных, получавших индометацин, в течение эксперимента погибли 4 животных, у оставшихся 4 были обнаружены множественные эрозии и язвы слизистой оболочки желудка (от 4 до 11 язв на животное). В группе с соединением 1а до конца эксперимента дожили все животные, наличия язв не было выявлено.
Источники информации
1. Машковский М.Д. Лекарственные средства. Т. 1. М.: Медицина. 2007.
2. Сюбаев Р.Д., Машковский М.Д., Шварц Г.Я., Покрышкин В.И. Сравнительная фармакологическая активность современных нестероидных противовоспалительных препаратов. Хим.-фарм. журн. 1986. Т. 20. №1. С. 33-39.
3. Справочник Видаль. Лекарственные препараты в России: Справочник. М.: АстраФармСервис. 2002. З-90.
4. Ссылка на синтез биспидинона
Производные 5,7-диметил-1,3-диазаадамантан-6-она, содержащие монотерпеновый остаток, общей формулы 1 (включая пространственные изомеры, в том числе оптически активные формы, в том числе в виде солей по атомам азота), где R может быть: обладающие анальгезирующим действием.