Макроциклические соединения, применимые в качестве ингибиторов гистондеацетилаз
Иллюстрации
Показать всеИзобретение относится к новому макроциклическому соединению общей формулы (I), обладающему ингибиторной активностью в отношении гистондеацетилаз (HDAC), фармацевтической композиции, содержащей соединение, и способу, применимому для лечения заболеваний с использованием соединения. 4 н. и 7 з.п. ф-лы, 3 табл., 9 ил., 11 пр.
Реферат
РОДСТВЕННЫЕ ЗАЯВКИ
По этой заявке испрашивается приоритет по предварительной заявке США № 61/348978, зарегистрированной 27 мая 2010 года, включенной в настоящий документ в качестве ссылки в полном объеме.
ЗАЯВЛЕНИЕ ПРАВ НА ИЗОБРЕТЕНИЯ, СОЗДАННЫЕ В ХОДЕ СПОНСИРУЕМОГО ГОСУДАРСТВОМ ИССЛЕДОВАНИЯ
Это изобретение создали при поддержке грантов правительства R01 CA 107098 и R01 CA110246, присужденных Национальным Институтом Здоровья. Государство обладает некоторыми правами на изобретение.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
В настоящем описании, главным образом, представлена серия новых макроциклических депсипептидных соединений с ингибиторными свойствами в отношении гистондеацетилаз (HDAC). В частности, в настоящем описании описаны соединения, пригодные для использования для селективной остановки роста клеток, стимуляции терминальной дифференцировки и/или инициации апоптоза опухолевых клеток, таким образом, ингибирования их пролиферации. В описании представлены способы получения этих новых макроциклических соединений, фармацевтических композиций и способов лечения, включающих селективное ингибирование изоформ HDAC, приводящее к направленной терапии злокачественного новообразования. Соединения по изобретению также можно применять в лечении заболеваний, запускаемых дисрегуляцией HDAC, таких как воспалительные заболевания, аутоиммунные заболевания, аллергические заболевания и различные заболевания центральной нервной системы.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Показано, что ларгазол, циклический депсипептид, исходно выделенный из морской цианобактерии Symploca sp., является противоопухолевым средством (Taori et al., 2008). Ларгазол специфически воздействует на гистондеацетилазы, дисфункция которых часто ассоциирована с множеством опухолей человека. Показано, что ларгазол (i) демонстрирует значения GI50 по отношению к множеству клеточных линий в нМ (например, клетки карциномы молочной железы MDA-MB-231, GI50=7,7 нМ; фибробластные клетки остеосаркомы U2OS, GI50=55 нМ; клетки толстого кишечника HT29, GI50=12 нМ; клетки нейробластомы IMR-32 (Taori et al., 2008), GI50=16 нМ) (Taori et al., 2008), (ii) демонстрирует дифференциальную активность по отношению к трансформированным и нетрансформированные клеткам (Nasveschuk et al., 2008; Taori et al., 2008; Ungermannova 2010) и (iii) является структурно более простым и, вероятно, более легко получаемым синтетически, чем другие депсипептиды.
Хотя доказано, что молекула ларгазола является противоопухолевым средством, всегда существует потребность в улучшенных структурных аналогах, приводящих к улучшению ингибиторных свойств в отношении HDAC, токсичности и физико-химических профилей, что приводит к улучшению способов терапии злокачественных новообразований.
В течение многих лет было известно, что DMSO и бутират, два известных относительно неспецифичных ингибитора HDAC, могут индуцировать дифференцировку определенных лейкозных клеток и подавлять неопластический рост (Sato et al., 1971; Leder et al., 1975).
В последние годы HDAC и гистонацетилазы (HAT) общепринято считают ключевыми факторами в регуляции транскрипции (Minucci и Pelicci 2006). Ацетилирование лизинов в хвостах гистонов H3 и гистонов H4 четко коррелирует с состоянием хроматина, готового к транскрипции или являющегося частью активно транскрибируемых областей генома (Allfrey et al., 1964). Ацетилирование гистонов также коррелирует с другими важными функциями клетки, включая сборку хроматина, репарацию ДНК и рекомбинацию.
В геноме человека существуют гены 18 ферментов HDAC, которые можно разделять на четыре класса (Lane и Chabner 2009). Классы I, II и IV содержат молекулу цинка (Zn2+) в своем активном центре (таблица 1 из (Lane и Chabner 2009)).
По причине своей важной роли в регуляции транскрипции и нарушений их регуляции в опухолевых клетках предполагают, что ингибирование HDAC может являться эффективным способом терапии злокачественных новообразований. Таким образом, достигнут значительный прогресс в отношении ингибиторов ферментов HDAC (HDACi) в качестве потенциальных противоопухолевых лекарственных средств (Marks). Такое внимания к HDACi оправдано, и его клиническая значимость недавно была подтверждена внедрением в конце 2006 года вориностата (Zolinza™ Merck, также широко известного как SAHA = субероиланилид гидроксамовой кислоты) для лечения кожной T-клеточной лимфомы и, недавно, ромидепсина (FK228) (Marks).
Каталитическая активность HDAC включает свойства и сериновой протеазы, и металлопротеазы. На основе структуры кристалла HDAC8 и бактериального гистондеацетилаза-подобного белка (HDLP) были предложены механизмы реакции деацетилирования (Finnin et al., 1999; Somoza et al., 2004; Vannini et al., 2004). Существует глубокий трубчатый узкий карман, расширяющийся книзу, и внутренняя полость, граничащая с карманом (фигура 1.1). Внутренняя часть трубы состоит из гидрофобных и ароматических остатков. Ион цинка расположен в нижней части кармана, и Zn2+ и His142, действуя как общее основание, активируют молекулу воды для нуклеофильной атаки на карбонильную группу субстрата. Это будет приводить к образованию тетраэдрического углерода, стабилизируемого образованием водородной связи с Tyr306, а общая кислота His143 протонирует уходящую группу лизина, приводя к образованию продуктов - ацетата и лизина. И His142, и His143 входят в систему переноса заряда Asp 166-His 131, которая, как предполагают, модулирует основность остатков His (фигура 1.4) (Finnin et al., 1999).
Механизмом действия большинства ингибиторов HDAC является имитация взаимодействия субстрата с деацетилазой, таким образом предотвращающая вход ацетилированного остатка лизина, локализованного на хвосте гистонового белка. Все низкомолекулярные ингибиторы гистондеацетилаз обладают тремя структурными элементами, участвующими в ингибировании HDAC: (1) распознающий поверхность домен, заякоренный на краю трубчатого кармана HDAC, (2) участок связывания цинка, (3) линкерная область, связывающая распознающий поверхность домен с участком связывания цинка (Finnin et al., 1999). На фигуре 1.5 (из (Newkirk et al., 2009)) представлена общая фармакофорная модель нескольких известных ингибиторов HDAC.
Хотя SAHA проявляет свою противоопухолевую активность, по меньшей мере, частично модуляцией HDAC напрямую посредством координации иона Zn2+ в активном центре фермента через концевую гидроксамовую кислоту, он демонстрирует плохую селективность среди 3 классов HDAC частично по причине простоты своей структуры (Minucci и Pelicci 2006; Lane и Chabner 2009). Общепринято считают, что HDAC класса I более важны для терапии злокачественных новообразований, и плохая селективность ингибиторов HDAC ответственна за хроническую токсичность (Minucci и Pelicci 2006; Lane и Chabner 2009). Поиск более специфичных ингибиторов HDAC класса I привел к открытию ряда природных депсипептидов, включая FR901375 (Koho 1991), FK228 (Ueda et al., 1994a), спирухостатин A (Masuoka et al., 2001) и недавно выделенный ларгазол (Taori et al., 2008) (фигура 2). Эти природные продукты, известные как депсипептиды, обладают общим свойством - все они содержат боковую цепь (3S,4E)-3-гидрокси-7-меркапто-4-гептеновой кислоты (Newkirk et al., 2009). Свободный сульфгидрил (тиол) должен подвергаться воздействию этого класса соединений для осуществления ингибиторной активности в отношении HDAC, так как тиол координирует ион Zn2+ в активном центре для предотвращения катализа.
Zn2+-связывающая часть ларгазола неактивна до удаления тиоэфира гидролизом. Показано, что ларгазол-тиол является активным веществом, потенциально ингибирующим HDAC (Bowers et al., 2008; Ying et al., 2008b). Таким образом, наиболее вероятно, ларгазол является пролекарством, активируемым эстеразой/липазами после захвата клетками или конъюгированным с носителем/транспортным белком и восстанавливаемым до тиола внутриклеточно. Произошел значительный прогресс в дизайне пролекарств для улучшения физико-химических и фармакокинетических свойств биологически активных веществ-прототипов (Rautio et al., 2008). Однако эти стратегии не применяли к ларгазолу систематически.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к области терапии злокачественных новообразований. В частности, изобретение относится к новым макроциклическим соединениям и содержащим их фармацевтическим композициям. Кроме того, изобретение относится к новому способу получения и применения этих соединений. Эти макроциклические соединения являются ингибиторами HDAC и применимы в качестве антипролиферативных средств для терапии рака. Способы, представленные в настоящем описании, позволяли устанавливать соединения, обладающие селективностью при воздействии на HDAC при противораковой терапии. Эти соединения воздействуют на HDAC, дисфункция которых часто ассоциирована с различными опухолями человека (Marks и Breslow 2007).
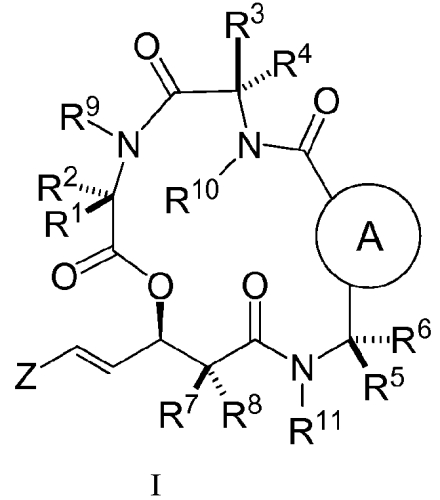
В одном из аспектов настоящее изобретение относится к соединениям формулы (I)
,
где
"A" представляет собой арил или гетероарил, необязательно, замещенный одной или несколькими группами, выбранными из C1-C10-алкила, C3-C10-циклоалкила, C3-C10-гетероциклоалкила, арила, гетероарила, галогена, гидроксила, -CN, -COOH, -CF3, -OCH2F, -OR20, -NR20R22, -NCOR20R22, -CONR20R22;
Z представляет собой -(CH2)nSR12;
R1 и R2 независимо представляют собой H, галоген, C1-C10-алкил, C3-C10-циклоалкил, C3-C10-гетероциклоалкил,
или R1 и R2 вместе,
или один из R1, R2 вместе с R9 образуют C3-C10-циклоалкил, C3-C10-гетероциклоалкил, где C1-C10-алкил, C3-C10-циклоалкил и C3-C10-гетероциклоалкил, необязательно, замещен одной или несколькими группами, выбранными из C1-C10-алкила, C3-C10-циклоалкила, C3-C10-гетероциклоалкила, арила, гетероарила, галогена, гидроксила, -CN, -COOH, -CF3, -OCH2F, -OR20, -NR20R22, -NCOR20R22, -CONR20R22;
R3 и R4 независимо представляют собой H, галоген, C1-C10-алкил, C3-C10-циклоалкил, C3-C10-гетероциклоалкил,
или R3 и R4 вместе,
или один из R3, R4 вместе с R10 образуют C3-C10-циклоалкил, C3-C10-гетероциклоалкил,
где C1-C10-алкил, C3-C10-циклоалкил и C3-C10-гетероциклоалкил, необязательно, замещают одной или несколькими группами, выбранными из C1-C10-алкила, C3-C10-циклоалкила, C3-C10-гетероциклоалкила, арила, гетероарила, галогена, гидроксила, -CN, -COOH, -CF3, -OCH2F, -OR20, -NR20R22, -NCOR20R22, -CONR20R22, -S(O)mR20;
R5 и R6 независимо представляют собой H, галоген, C1-C10-алкил, C3-C10-циклоалкил, C3-C10-гетероциклоалкил,
или R5 и R6 вместе,
или один из R5, R6 вместе с R11 образуют C3-C10-циклоалкил, C3-C10-гетероциклоалкил,
где C1-C10-алкил, C3-C10-циклоалкил, C3-C10-гетероциклоалкил, необязательно, замещен одной или несколькими группами, выбранными из C1-C10-алкила, C3-C10-циклоалкила, C3-C10-гетероциклоалкила, арила, гетероарила, галогена, гидроксила, -CN, -COOH, -CF3, -OCH2F, -OR20, -NR20R22, -NCOR20R22, -CONR20R22;
R7 и R8 независимо представляют собой H, галогеновую группу, C1-C10-алкил, C3-C10-циклоалкил, C3-C10-гетероциклоалкил,
или R5 и R6 совместно образуют C3-C10-циклоалкил, C3-C10-гетероциклоалкил, где C1-C10-алкил, C3-C10-циклоалкил, C3-C10-гетероциклоалкил, необязательно, замещен одной или несколькими группами, выбранными из C1-C10-алкила, C3-C10-циклоалкила, C3-C10-гетероциклоалкила, арила, гетероарила, галогена, гидроксила, -CN, -COOH, -CF3, -OCH2F, -OR20, -NR20R22, -NCOR20R22, -CONR20R22;
R9 независимо представляет собой H, C1-C10-алкил, C3-C10-циклоалкил, C3-C10-гетероциклоалкил,
или вместе с одним из R1, R2 образует C3-C10-циклоалкил, C3-C10-гетероциклоалкил,
где C1-C10-алкил, C3-C10-циклоалкил, C3-C10-гетероциклоалкил, необязательно, замещен одной или несколькими группами, выбранными из C1-C10-алкила, C3-C10-циклоалкила, C3-C10-гетероциклоалкила, арила, гетероарила, галогена, гидроксила, -CN, -COOH, -CF3, -OCH2F, -OR20, -NR20R22, -NCOR20R22, -CONR20R22;
R10 независимо представляет собой H, C1-C10-алкил, C3-C10-циклоалкил, C3-C10-гетероциклоалкил,
или вместе с одним из R3, R4 образует C3-C10-циклоалкил, C3-C10-гетероциклоалкил,
где C1-C10-алкил, C3-C10-циклоалкил, C3-C10-гетероциклоалкил, необязательно, замещен одной или несколькими группами, выбранными из C1-C10-алкила, C3-C10-циклоалкила, C3-C10-гетероциклоалкила, арила, гетероарила, галогена, гидроксила, -CN, -COOH, -CF3, -OCH2F, -OR20, -NR20R22, -NCOR20R22, -CONR20R22;
R11 независимо представляет собой H, C1-C10-алкил, C3-C10-циклоалкил, C3-C10-гетероциклоалкил,
или вместе с одним из R5, R6 образует C3-C8-циклоалкил, C3-C8-гетероциклоалкил,
где C1-C10-алкил, C3-C10-циклоалкил, C3-C10-гетероциклоалкил, необязательно, замещен одной или несколькими группами, выбранными из C1-C8-алкила, C3-C8-циклоалкила, C3-C8-гетероциклоалкила, арила, гетероарила, галогена, гидроксила, -CN, -COOH, -CF3, -OCH2F, -OR20, -NR20R22, -NCOR20R22, -CONR20R22;
R12 независимо представляет собой H, C1-C10-алкил, -COR20, -CONR20R22, -OR20, -COOR20, -COCR20R22NR20R22, -SR20, -P(O)(OR24)2;
R20 и R22 независимо представляют собой H, C1-C10-алкил, C3-C10-циклоалкил, C3-C10-гетероциклоалкил, арил или гетероарил;
R24 независимо представляет собой H, C1-C10-алкил, C3-C10-циклоалкил, C3-C10-гетероциклоалкил, Na, K или Ca;
n=1-6
m=1 или 2;
или их фармацевтически приемлемой соли, сольвату, пролекарству или стереоизомеру.
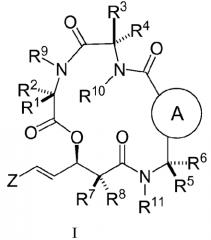
В другом аспекте настоящее изобретение относится к соединениям формулы (II)
,
где
L и Q независимо представляют собой S, O, N или CR26;
R26 независимо представляет собой H, галоген, C1-C10-алкил, C3-C10-циклоалкил, C3-C10-гетероциклоалкил, арил, гетероарил, где C1-C10-алкил, C3-C10-циклоалкил, C3-C10-гетероциклоалкил, арил и гетероарил, необязательно, замещен одной или несколькими группами, выбранными из C1-C10-алкила, C3-C10-циклоалкила, C3-C10-гетероциклоалкила, арила, гетероарила, галогена, гидроксила, -CN, -COOH, -CF3, -OCH2F, -OR20, -NR20R22, - NCOR20R22, -CONR20R22;
R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R11 и Z являются такими, как описано выше;
или их фармацевтически приемлемой соли, сольвату, пролекарству или стереоизомеру.
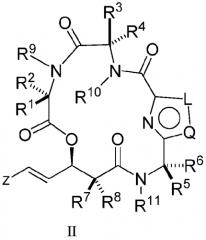
В еще одном аспекте настоящее изобретение относится к соединениям формулы (III)
,
где
L, Q и Y независимо представляют собой S, O, N, или CR26;
R26 независимо представляет собой H, галоген, C1-C10-алкил, C3-C10-циклоалкил, C3-C10-гетероциклоалкил, арил, гетероарил, где C1-C10-алкил, C3-C10-циклоалкил, C3-C10-гетероциклоалкил, арил и гетероарил, необязательно, замещен одной или несколькими группами, выбранными из C1-C10-алкила, C3-C10-циклоалкила, C3-C10-гетероциклоалкила, арила, гетероарила, галогена, гидроксила, -CN, -COOH, -CF3, -OCH2F, -OR20, -NR20R22, - NCOR20R22, -CONR20R22;
R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R11 и Z являются такими, как описано выше;
или их фармацевтически приемлемой соли, сольвату, пролекарству или стереоизомеру.
В еще одном аспекте настоящее изобретение относится к соединению формулы (IV)
или его фармацевтически приемлемой соли, сольвату, пролекарству или стереоизомеру.
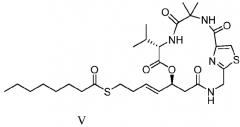
В еще одном аспекте настоящее изобретение относится к соединению формулы (V)
или его фармацевтически приемлемой соли, сольвату, пролекарству или стереоизомеру.
В еще одном аспекте настоящее изобретение относится к соединению формулы (VI)
или его фармацевтически приемлемой соли, сольвату, пролекарству или стереоизомеру.
В еще одном аспекте настоящее изобретение относится к соединению формулы (VII)
или его фармацевтически приемлемой соли, сольвату, пролекарству или стереоизомеру.
В еще одном аспекте настоящее изобретение относится к соединению формулы (VIII)
или его фармацевтически приемлемой соли, сольвату, пролекарству или стереоизомеру.
В еще одном аспекте настоящее изобретение относится к соединению формулы (IX)
или его фармацевтически приемлемой соли, сольвату, пролекарству или стереоизомеру.
В еще одном аспекте настоящее изобретение относится к соединению формулы (X)
,
где A, R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R11 и n являются такими, как описано выше;
или его фармацевтически приемлемой соли, сольвату, пролекарству или стереоизомеру.
В еще одном аспекте настоящее изобретение относится к фармацевтическим композициям соединений или фармацевтически приемлемых солей одного или нескольких соединений, представленных в настоящем описании, и фармацевтически приемлемого носителя.
В еще одном аспекте настоящее изобретение относится к способам лечения заболеваний, опосредуемых ферментами HDAC, включающим введение нуждающемуся в этом субъекту терапевтически эффективного количества одного или нескольких соединений, представленных в настоящем описании. Другие способы включают способы комбинированной терапии посредством введения одного или нескольких соединений по настоящему изобретению с другими противораковыми средствами.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фигуре 1 изображена потенциальная роль HAT и HDAC в регуляции транскрипции.
A) Модификация гистонов HAT и HDAC.
B) Регуляция экспрессии генов переключается комплексом коактиватора или корепрессора. Фигура и описание взяты из (Kim et al., 2003).
На фигуре 2 представлено несколько вариантов комплексов HDLP-TSA.
A) Представление заполнения пространства TSA в кармане активного центра. Группа гидроксамовой кислоты, большая часть алифатической цепи и часть диметиламинофенильной группы TSA находятся в глубине (60% площади поверхности TSA).
B) Схематичное представление взаимодействий HDLP-TSA. оба изображения и часть описания взяты из (Finnin et al., 1999).
На фигуре 3 представлен предполагаемый механизм действия цинк-зависимых HDAC.
На фигуре 4 представлен один из вариантов осуществления фармакофора HDACi. Область кэпа сверху; линкер внизу с цинк-связывающей частью. Фигура и описание взяты из (Newkirk et al., 2009).
Фигура 5. Природные депсипептидные ингибиторы HDAC. Представлен ключевой тиолсодержащий домен.
На фигуре 6 изображена возможная активация ларгазола и FK228 для осуществления ингибирования HDAC. Ларгазол является пролекарством, превращающимся после гидролиза в соответствующий тиол, инактивирующий HDAC посредством выведения цинка из активного центра фермента путем образования хелатного комплекса. Аналогично, восстановление дисульфидной связи в FK228 высвобождает тиол, потенциально ингибирующий HDAC.
На фигуре 7 представлены структуры ларгазола и нескольких структурных аналогов ларгазола. Пример 1 также обозначают как CGN 552.
На фигуре 8 представлены примерные данные, показывающие, что ларгазол, его селективные аналоги и SAHA стимулируют гиперацетилирование H3 в линии злокачественных клеток HCT 116.
a) Ларгазол (L) и SAHA ингибируют деацетилирование H3 в зависимости от времени. Клетки HCT 116 обрабатывали 10 нМ ларгазолом или 200 нМ SAHA в течение времени, указанного на фигуре. Экстракты клеток разделяли электрофорезом в ПААГ в присутствие SDS и определяли получаемые полосы с использованием антител против ацетил-H3. Обработанные DMSO клетки служили отрицательным контролем, в то время как экспрессию GAPDH использовали в качестве контроля для демонстрации стабильной экспрессии.
b) Клетки HCT 116 отвечали на ларгазол, его селективные аналоги и SAHA доза-зависимым образом. Клетки обрабатывали указанным соединением в течение 8 часов с концентрациями в диапазоне от 1/мкМ до 100 нМ и подвергали иммуноблоттингу с использованием антител против ацетилгистона H3. CGN-722, CGN-552 и CGN-596 являются немного более активными ингибиторами деацетилаз, чем ларгазол (L) и SAHA. Превращение сложного тиоэфира в кетон (CGN-363) делает соединение неактивным в отношении ингибирования HDAC.
На фигуре 9 представлены данные анализа с использованием ДНК-микрочипа, показывающие, что SAHA, ларгазол и его выбранный аналог по примеру 1 вызывают четкие изменения в профилях экспрессии генов в линии раковых клеток HCT116, a) иерархическая кластеризация и тепловые карты изменений профилей экспрессии генов в клетках HCT116 с указанной обработкой, b) диаграммы Венна, на которых показаны наборы уникальных и общих генов, уровни экспрессии которых изменялись более чем в 2 раза после подвергания указанной обработке через 6 часов и 24 часа.
В таблице 1 представлена классификация изоформ HDAC. Класс I состоит из HDAC 1, 2, 3 и 8. Класс II состоит из HDAC 4, 5, 6, 7, 9, 10.
В таблице 2 представлены примерные данные, показывающие эффект ларгазола, аналогов ларгазола вместе с примерами соединений по настоящему изобретению на ингибирование роста раковых клеток.
Сравнительный анализ цитотоксического эффекта ларгазола на линии раковых клеток человека HCT116, SW480 и MDA-MB231. HME использовали в качестве контроля. 8000 клеток помещали в 96-луночные планшеты, где ряды 1 и 10 обрабатывали DMSO, ряд 2 не содержал клеток для определения фоновых уровней, ряды 3-9 содержали повышенные концентрации соединения. Клетки инкубировали с ларгазолом в течение 48 часов с последующим окрашиванием красителем кристалл-виолет. Поглощение при 588 нМ измеряли с использованием спектрофотометра Tecan Safire II для чтения планшетов. Эксперименты осуществляли в шести повторениях и получали кривые концентрация-ответ с помощью анализа данных нелинейной регрессией методом наименьших квадратов с использованием GraphPad Prism (San Diego, CA). Ингибирование роста (GI50) для каждого соединения определяли как концентрацию лекарственного средства, приводящую к 50% снижению A588 по сравнению с контролями.
В таблице 3 представленная сумма количеств генов, уровни экспрессии которых изменялись в 2 раза после обработки указанными химическими веществами по сравнению с DMSO. Файлы с величинами экспрессии для каждого образца получали с использованием алгоритма Robust Multichip Average (RMA). Дифференциальную экспрессию определяли с использованием пакета программ R limma для получения линейных моделей и эмпирической байесовой статистики. Гены считали дифференциально экспрессирующимися, если значение P, скорректированное для многократного тестирования с использованием метода Бенджамини-Хохберга, составляло <5%, и log 2-кратного изменения составлял ≤1 или ≥-1.
ПОДРОБНОЕ ОПИСАНИЕ
Следующее ниже описание является исключительно иллюстративным и не предназначено для ограничения настоящего описания, заявки или применения.
ОПРЕДЕЛЕНИЯ
Как применяют в настоящем описании, термин "замена для" относится к смене введения субъекту первого соединения или лекарственного средства на введение субъекту второго соединения или лекарственного средства. Например, экстракт кратома может являться заменой соединению, вызывающему привыкание, таким образом, что субъекту будут вводить экстракт кратома вместо соединения, вызывающего зависимость.
Как применяют в настоящем описании, термин "с риском" относится к медицинскому состоянию или набору медицинских состояний, развившихся у пациента, которые могут предрасполагать пациента к конкретному заболеванию или нарушению. Например, эти состояния могут возникать по причине факторов, включающих, в качестве неограничивающих примеров, поведенческие, эмоциональные, химические, биохимические или воздействия окружающей среды.
Как применяют в настоящем описании, термин "эффективное количество" относится к конкретному количеству фармацевтической композиции, содержащей терапевтическое средство, помогающее достигать клинически благоприятного эффекта (т.е., например, снижения симптомов). Токсичность и терапевтическую эффективность таких композиций можно определять стандартными фармацевтическими способами на культурах клеток или экспериментальных животных, например, для определения LD50 (дозы, летальной для 50% популяции) и ED50 (дозы, терапевтически эффективной для 50% популяции). Отношение доз между токсическими и терапевтическими эффектами представляет собой терапевтический индекс, и его можно выражать как отношение LD50/ED50. Предпочтительны соединения, проявляющие большие терапевтические индексы. Данные, полученные при анализах этих культур клеток и дополнительных исследованиях на животных, можно использовать при составлении диапазона дозировок для применения у человека. Дозы таких соединений предпочтительно лежат в диапазоне концентраций в кровотоке, включающем ED50 с небольшой токсичностью или без нее. Дозы варьируются в этом диапазоне в зависимости от используемой лекарственной формы, чувствительности пациента и пути введения.
Как применяют в настоящем описании, термин "симптом" относится к любому субъективному или объективному доказательству заболевания или физического нарушения, наблюдаемого пациентом. Например, субъективное доказательство, как правило, зависит от самообследования пациента и может включать, в качестве неограничивающих примеров, боль, головную боль, зрительные нарушения, тошноту и/или рвоту. Альтернативно, объективное доказательство, как правило, является результатом медицинского тестирования, включая, в качестве неограничивающих примеров, температуру тела, клинический анализ крови, липидный спектр, исследование гормональной активности щитовидной железы, артериальное давление, частоту сердечных сокращений, электрокардиограмму, визуализацию тканей тела и результаты других медицинских тестов.
Как применяют в настоящем описании, термин "заболевание" относится к любому нарушению нормального состояния живого животного, в целом или одной из его частей, нарушающему или модифицирующему осуществление жизнедеятельности. Обычно проявляющееся отличительными признаками и симптомами, оно, как правило, является ответом на i) факторы внешней среды (например, неправильное питание, промышленное загрязнение или климат); ii) конкретные инфекционные агенты (например, червей, бактерий или вирусы); iii) наследственные дефекты организма (например, генетические аномалии); и/или iv) комбинации этих факторов.
Термины "уменьшать", "ингибировать", "ослаблять", "подавлять", "снижать", "предотвращать" и грамматические эквиваленты (включая "ниже", "меньше" и т.д.) по отношению к проявлению любого симптома у не подвергнутого лечению субъекта относительно подвергнутого лечению субъекта означает, что количество и/или сила симптомов у подвергнутого лечению субъекта ниже, чем у не подвергнутого лечению субъекта на любое количество, признанное клинически значимым любым медицинским персоналом. В одном из вариантов осуществления количество и/или сила симптомов у подвергнутого лечению субъекта составляет по меньшей мере на 10% ниже, по меньшей мере на 25% ниже, по меньшей мере на 50% ниже, по меньшей мере на 75% ниже и/или по меньшей мере на 90% ниже, чем количество и/или сила симптомов у не подвергнутого лечению субъекта.
Как применяют в настоящем описании, термин "ингибирующее соединение" относится к любому соединению, способному взаимодействовать (т.е., например, прикрепляться, связываться и т.д.) с партнером по связыванию в таких условиях, что партнер по связыванию перестает отвечать на свои природные лиганды. Ингибирующие соединения могут включать в качестве неограничивающих примеров небольшие органические молекулы, антитела и белки/пептиды.
Как применяют в настоящем описании, термин "прикрепленный" относится к любому взаимодействию между средой (или носителем) и лекарственным средством. Прикрепление может являться обратимым или необратимым. Такое прикрепление включает, в качестве неограничивающих примеров, ковалентную связь, ионную связь, ван-дер-ваальсовы силы или силы трения и т.п. Лекарственное средство прикрепляют к среде (или носителю), если оно вкраплено, включено, покрыто, находится в суспензии, в растворе, смешано и т.д.
Как применяют в настоящем описании, термин "лекарственное средство" или "соединение" относится к любому фармакологически активному веществу, которое можно вводить и достигать желаемого эффекта. Лекарственные средства или соединения могут являться синтетическими или природными, непептидными, белками или пептидами, олигонуклеотидами или нуклеотидами, полисахаридами или сахарами.
Как применяют в настоящем описании, термин "вводимый" или "введение" относится к любому способу предоставления композиции пациенту таким образом, что композиция оказывает свой предполагаемый эффект на пациента. Примером способа введения является прямой механизм, такой как, местное введение в ткань (т.е., например, внесосудистое введение), пероральное введение, трансдермальный пластырь, местное введение, ингаляция, использование суппозиториев и т.д.
Как применяют в настоящем описании, термин "пациент" означает человека или животное, не нуждающихся в госпитализации. Например, амбулаторные пациенты, субъекты в домах престарелых или инвалиды с медицинским обслуживанием являются "пациентами". Пациент может представлять собой человека или не являющееся человеком животное любого возраста и, таким образом, включает и взрослые, и молодые особи (т.е. детей). Не следует понимать, что термин "пациент" имеет дополнительно значение, относящееся к потребности в медицинской помощи, таким образом, пациент может вольно или невольно являться частью экспериментальных работ, клинических или в поддержку исследований в области фундаментальных наук.
Как применяют в настоящем описании, термин "субъект" относится к позвоночному, предпочтительно - млекопитающему, более предпочтительно - примату, еще более предпочтительно - человеку. Млекопитающие включают, в качестве неограничивающих примеров, людей, приматов, диких животных, одичавших животных, сельскохозяйственных животных, спортивных животных и домашних животных.
Как применяют в настоящем описании, термин "сродство", относится к любой силе притяжения между веществами или частицами, заставляющей их вступать в химическую комбинацию и оставаться в ней. Например, соединение-ингибитор, обладающее высоким сродством к рецептору, будет обеспечивать большую эффективность в предотвращении взаимодействия рецептора с его природными лигандами, чем ингибитор с низким сродством.
Как применяют в настоящем описании, термин "полученный из" относится к источнику соединения или последовательности. С одной стороны, соединение или последовательность можно получать из организма или конкретных видов. С другой стороны, соединение или последовательность можно получать из большего комплекса или последовательности.
Как применяют в настоящем описании, термин "тестируемое соединение" относится к любому соединению или молекуле, признанным кандидатом для ингибирующего соединения.
Как применяют в настоящем описании, термин "белок" относится к любому из многочисленных природных крайне сложных веществ (например, ферменту или антителу), состоящему из аминокислотных остатков, соединенных пептидными связями, содержащими элементы углерод, водород, азот, кислород, как правило, серу. В основном, белок содержит аминокислоты в количестве порядка сотен.
Как применяют в настоящем описании, термин "пептид" относится к любому из многочисленных амидов, получаемых из двух или более аминокислот комбинацией аминогруппы одной кислоты с карбоксильной группой другой и, как правило, получаемых частичным гидролизом белков. В основном, пептид содержит аминокислоты в количестве порядка десятков.
Как применяют в настоящем описании, термин "фармацевтически" или "фармакологически приемлемый" относится к молекулам и композициям, не вызывающим побочные, аллергические или другие неблагоприятные реакции при введении животному или человеку.
Как применяют в настоящем описании, термин "фармацевтически приемлемый носитель" включает любой растворитель и все растворители или дисперсионную среду, включая, в качестве неограничивающих примеров, воду, этанол, полиол (например, глицерин, пропиленгликоль, жидкий полиэтиленгликоль и т.п.), их подходящие смеси, и растительные масла, покрытия, изотоничные и замедляющие всасывание средства, липосомы, коммерчески доступные очищающие средства и т.п. В такие носители также можно включать дополнительные биоактивные ингредиенты.
Как применяют в настоящем описании, термин "очищенный" или "выделенный" может относится к композиции пептидов, подвергнутой обработке (т.е., например, фракционированию) для удаления различных других компонентов и, по существу, сохраняющей свою выраженную биологическую активность.
Как применяют в настоящем описании, термин "образец" используют в его широчайшем смысле, и он включает природные и биологические образцы. Природные образцы включают материал из окружающей среды, такой как грунт и вода. Биологические образцы могут являться животным, включая человека, жидкостью (например, кровью, плазмой и сывороткой), твердым веществом (например, фекалиями), тканью, жидкой пищей (например, молоком) и твердой пищей (например, овощами). Например, с помощью бронхоальвеолярного лаважа (BAL) можно получать образец из легкого, содержащий жидкость и клетки, происходящие из ткани легкого. Биологический образец может содержать клетки, экстракт ткани, биологическую жидкость, хромосомы или внехромосомные элементы, выделенные из клетки, геномную ДНК (в растворе или связанную с твердой подложкой, такой как подложка для анализа Саузерн-блоттингом), РНК (в растворе или связанную с твердой подложкой, такой как подложка для анализа нозерн-блоттингом), кДНК (в растворе или связанную с твердой подложкой) и т.п.
Термин "биологически активный" относится к любой молекуле, имеющей структурные, регуляторные или биохимические функции. Например, биологическую активность можно определять, например, восстановлением роста, характерного для дикого типа, в клетках с недостаточной активностью белка. Клетки с недостаточной активностью белка можно получать многими способами (т.е., например, точковой мутацией и мутацией со сдвигом рамки считывания). Комплементации достигают трансфекцией клеток с недостаточной активностью белка с использованием экспрессирующего вектора, с которого экспрессируется белок, его производное или его часть.
В настоящем описании термин "метка" или "детектируемая метка" используют в отношении любой композиции, детектируемой спектроскопическими, фотохимическими, биохимическими, иммунохимическими, электрическими, оптическими или химическими способами. Такие метки включают биотин для окрашивания меченым конъюгатом стрептавидина, магнитные бусы (например, Dynabeads®), флуоресцентные красители (на