Способ получения 3-(2-алкинил)-1,3-оксазолидинов
Иллюстрации
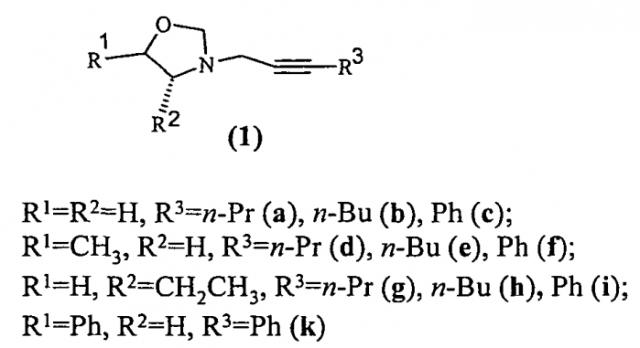
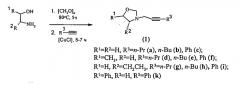
Показать всеНастоящее изобретение относится к области органической химии, в частности к способу получения 3-(2-алкинил)-1,3-оксазолидинов формулы (1), которые могут быть использованы в качестве универсальных прекурсоров для тонкого органического синтеза и биологически активных соединений. Способ осуществляют путем взаимодействи моноэтаноламина общей формулы HO(R1)CHCH(R2)NH2 (где R1=R2=H; R1=СН3, R2=H; R1=H, R2=CH2CH3; R1=Ph, R2=H) с параформом при кипячении в бензоле в течение 5 ч с последующим вакуумированием бензола и добавлением алкил(фенил)ацетилена-1 общей формулы R3-C≡CH (где R3=C3H5, С4Н9, Ph) в толуоле и катализатора CuCl. Затем реакционную массу перемешивают в атмосфере аргона при 80°С и атмосферном давлении в течение 5-7 ч. Реакцию проводят при мольном соотношении HO(R1)CHCH(R2)NH2: (CH2O)n: R3-C≡CH: CuCl=2:3:1:(0.03÷0.07). Технический результат - селективное получение 3-(2-алкинил)1,3-оксазолидинов. 1 табл., 14 пр.
Реферат
Предлагаемое изобретение относится к органической химии, в частности к способу получения 3-(2-алкинил)-1,3-оксазолидинов общей формулы (1).
Соединения общей формулы (1) могут быть использованы в качестве универсальных прекурсоров для тонкого органического синтеза [М. Balasubramanian, J.G. Keay. Comprehensive Heterocyclic Chemistry. II, A.R. Katritzky, С.W. Rees, E.F. V. Scriven. (Ed.), Pergamon Press, Oxford-N. - Y., 1996, 5, 245; N. Uhlig. C.-J. Li. Org. Lett. 2012, 14, 3000] и биологически активных соединений [В.М. Куриленко, Г.H. Хлиенко, Л.М. Моисеева, Д.В. Соколов, К.Д. Пралиев, Н.А. Беликова, Хим.-фарм. журн. 1976, 10, 60; С.L. Zirkle, С. Kaiser, in Psychopharmacological Agents., М. Gordon (Ed), Academic Press, New York, 1964, 1, 445-554].
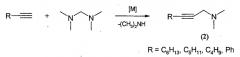
Известен способ (М.Г. Шайбакова, И.Г. Титова, А.Г. Ибрагимов, У.М. Джемилев. N,N,N′,N′-Тетраметилметандиамин - новый реагент для аминометилирования ацетиленов. Журн. орган. хим. 2008, 44, 1141) получения N,N-диметил-3-(алкил,фенил)-2-пропин-1-аминов (2) реакцией аминометилирования терминальных ацетиленов с помощью N,N,N′,N′-тетраметилметандиамина под действием комплексов и солей d-переходных металлов и лантаноидов по схеме:
Известным способом не могут быть получены 3-(2-алкинил)-1,3-оксазолидины общей формулы (1).
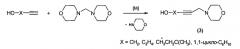
Известен способ [М.Г. Шайбакова, И.Г. Титова, А.Г. Ибрагимов, У.М. Джемилев. Аминометилирование ацетиленовых спиртов и их эфиров гем-диаминами, катализируемое комплексами d-переходных и редкоземельных металлов. Журн. орган. хим. 2011, 47, 173] получения 4-морфолиноалк-2-инолов (3) реакцией ацетиленовых спиртов (пропаргиловый спирт, бут-3-ин-1-ол, 3-метилпент-1-ин-3-ол, 1-этинилциклогексанол) с 4,4′-метилендиморфолином под действием катализатора Sm(NO3)3·6Н2О или CuCl при температуре 80°С с выходами 48-60% по схеме:
Известным способом не могут быть получены 3-(2-алкинил)-1,3-оксазолидины общей формулы (1).
Таким образом, в литературе отсутствуют сведения о селективном получении 3-(2-алкинил)-1,3-оксазолидинов общей формулы (1).
Предлагается новый способ получения 3-(2-алкинил)-1,3-оксазолидинов общей формулы (1).
Сущность способа заключается в предварительном взаимодействии 1,2-этаноламина общей формулы НО(R1)CHCH(R2)NH2, где R1=R2=H; R1=CH3, R2=H; R1=H, R2=СН2СН3; R1=Ph, R2=H, с параформом в кипящем бензоле в колбе с обратным холодильником и насадкой Дина-Старка для удаления воды в течение 5 ч с последующим вакуумированием растворителя бензола и добавлением алкил(фенил)ацетилена-1 общей формулы R3-C≡CH, где R3=C3H5, C4H9, Ph, и катализатора CuCl, взятых в мольном соотношении 1,2-этаноламин : (CH2O)n : алкил(фенил)-ацетилен-1 : CuCl=2:3:1:(0.03-0.07) предпочтительно 2:3:1:0.05. Смесь перемешивают в атмосфере аргона 5-7 ч при температуре 80°С и атмосферном давлении в толуоле в качестве растворителя. Выход 3-(2-алкинил)-1,3-оксазолидинов (1) составляет 24-83%. Реакция протекает по схеме:
3-(2-Алкинил)-1,3-оксазолидины формулы (1) образуются только лишь с участием 1,2-этаноламинов, параформа и алкил(фенил)-ацетилен-1-ов, взятых в мольном соотношении 2:3:1 (стехиометрические количества). При другом соотношении исходных реагентов снижается выход целевого продукта (1). Проведение указанной реакции в присутствии катализатора CuCl больше 7 мол.% не приводит к существенному увеличению выхода целевого продукта (1). Использование катализатора CuCl менее 3% снижает выход (1), что связано, возможно, со снижением каталитически активных центров в реакционной массе. Реакции проводили при температуре 80°С. При температуре выше 80°С (например, 100°С) увеличиваются энергозатраты, а при температуре ниже 80°С (например, 60°С) снижается скорость реакции. Опыты проводили в толуоле, т.к. в нем хорошо растворяются целевые продукты.
Существенные отличия предлагаемого способа
В известных способах в качестве исходных реагентов применяются N,N,N′,N′-тетраметилметандиамин или 4,4′-метилендиморфолин. Известный способ не позволяет получать 3-(2-алкинил)-1,3-оксазолидины общей формулой (1). В предлагаемом способе в качестве исходных реагентов применяются коммерчески доступные 1,2-этаноламины и параформ. Предлагаемый способ позволяет получать 3-(2-алкинил)-1,3-оксазолидины общей формулой (1).
Способ поясняется следующими примерами
Пример 1
Смесь 0.12 мл (2 ммоль) моноэтаноламина, 0.06 г (2 ммоль) параформа и 50 мл бензола кипятят с обратным холодильником и ловушкой Дина-Старка в течение 0.5 ч. Затем к реакционной смеси добавляют 0.03 г (1 ммоль) параформа и кипятят 4.5 ч до прекращения выделения воды. Реакционную смесь отфильтровывают, растворитель упаривают на роторном испарителе. Получают бесцветную вязкую жидкость, которую помещают в стеклянный реактор, установленный на магнитной мешалке, затем добавляют 3 мл толуола и пентин-1 (0.10 мл, 1 ммоль) в атмосфере аргона, добавляют CuCl (0.005 г, 5 мол.%), перемешивают при температуре 80°С в течение 6 ч, образовавшийся раствор отфильтровывают через слой SiO2, промывают хлороформом 3×5 мл, упаривают, продукт реакции очищают методом колоночной хроматографии. Выход 3-(2-гексинил)-1,3-оксазолидина (1а) составляет 0.09 г (58%).
Другие примеры, подтверждающие способ, приведены в табл. 1.
| Таблица 1 | ||||||
| № | Исходный этаноламин HO(R1)CHCH(R2)NH2 | Ацетилен R3-C≡CH | Соотношение этаноламин:(CH2O)n:ацетилен:CuCl, ммоль | Время реакции, ч | Продукт | |
| № | (%) | |||||
| 1 | R1=R2=H | R3=С3Н5 | 2:3:1:0.05 | 6 | 1a | 58 |
| 2 | R1=R2=H | R3=С3Н5 | 2:3:1:0.03 | 6 | 1a | 45 |
| 3 | R1=R2=H | R3=С3Н5 | 2:3:1:0.07 | 6 | 1a | 60 |
| 4 | R1=R2=H | R3=С3Н5 | 2:3:1:0.05 | 5 | 1a | 43 |
| 5 | R1=R2=H | R3=C3H5 | 2:3:1:0.05 | 7 | 1a | 61 |
| 6 | R1=R2=H | R3=C4H9 | 2:3:1:0.05 | 6 | 1b | 71 |
| 7 | R1=R2=H | R3=Ph | 2:3:1:0.05 | 6 | 1с | 81 |
| 8 | R1=СН3, R2=H; | R3=С3Н5 | 2:3:1:0.05 | 6 | 1d | 45 |
| 9 | R1=СН3, R2=H; | R3=C4H9 | 2:3:1:0.05 | 6 | 1e | 70 |
| 10 | R1=СН3, R2=H; | R3=Ph | 2:3:1:0.05 | 6 | 1f | 28 |
| 11 | R1=H, R2=CH2CH3; | R3=С3Н5 | 2:3:1:0.05 | 6 | 1g | 72 |
| 12 | R1=H, R2=СН2СН3; | R3=C4H9 | 2:3:1:0.05 | 6 | 1h | 83 |
| 13 | R1=H, R2=СН2СН3; | R3=Ph | 2:3:1:0.05 | 6 | 1i | 24 |
| 14 | R1=Ph, R2=H | R3=Ph | 2:3:1:0.05 | 6 | 1k | 60 |
| Физико-химические характеристики соединений 1а-1к:* (* Спектры ЯМР 1Н и 13С регистрировали на спектрометре Bruker Avance-400 с рабочими частотами 300.13 и 100.62 МГц, растворитель - CDCl3 (δC 77.10 м.д.). ИК-спектры снимали на спектрометре Bruker Vertex 70 v в суспензии в вазелиновом масле. Анализ методом ГХ-МС проводили на хроматографе Shimadzu GC 2010 с масс-спектрометрическим детектором GCMS-QP2010 Ultra (Shimadzu, Япония). Использовали капиллярную колонку Supelco 5ms (60 м × 0.25 мм × 0.25 мкм). В качестве газа-носителя использовали гелий. Температура инжектора - 260°C, интерфейса - 260°C, ионного источника - 200°C. Элементный состав С, Н и N определяли на приборе Karlo Erba-1106.) |
3-(2-Гексинил)-1,3-оксазолидин (1a)
Прозрачное масло, выход: 0.09 г (58%). Rf=0.22 (CCl4-этилацетат, 2:1). ИК спектр, ν, см-1: 1056 (С-О-С), 1450 (CH2), 2253 (C≡С), 2932 (СН2). Спектр ЯМР 1Н (400 МГц, CDCl3), δ, м.д. (J, Гц): 0.98 (3Н, т, J=7.2, СН 3); 1.53 (2Н, сек, J=7.2, СН 2СН3); 2.17 (2Н, т, J=7.2, СН 2СН2СН3); 3.06 (2Н, т, J=6.8, Н-4); 3.36 (2Н, с, 3-NCH 2CC); 3.80 (2Н, т, J=6.8, H-5); 4.37 (2Н, с, Н-2). Спектр ЯМР 13С (100 МГц, CDCl3), δ, м.д.: 13.5 (СН3); 20.7 (СН2СН2СН3); 22.2 (СН2СН3); 42.9 (3-NCH2CC); 51.3 (С-4); 63.6 (С-5); 76.1 (3-NCH2 CC); 84.3 (3-NCH2CC); 85.9 (С-2). Масс-спектр (ЭУ, 70 эВ), m/z (Ioтн, %): 152 [M-H]+ (100), 123 [М-Н-С2Н5]+ (28), 110 [M-C3H7]+ (31), 72 [C2H4NCH2O]+ (62). Найдено, %: С 70.47; Н 9.95; N 9.21. C9H15NO. Вычислено, %: С 70.55; Н 9.87; N 9.14.
Пример 6
3-(2-Гептинил)-1,3-оксазолидин (1b)
Прозрачное масло, выход: 0.12 г (71%). Rf=0.22 (CCl4-этилацетат, 2:1). ИК спектр, ν, см-1: 1058 (C-O-C), 1458 (CH2), 2250 (С≡С), 2930 (CH2). Спектр ЯМР 1Н (400 МГц, CDCl3), δ, м.д. (J, Гц): 0.93 (3Н, т, J=7.2, СН 3); 1.39-1.45 (2Н, м, СН 2СН3); 1.45-1.52 (2Н, м, СН 2СН2СН3); 2.18-2.22 (2Н, м, СССН 2СН2); 3.07 (2Н, т, J=6.8, Н-4); 3.37 (2Н, с, 3-NCH 2CC); 3.80 (2Н, т, J=6.8, H-5); 4.38 (2Н, с, Н-2). Спектр ЯМР 13С (100 МГц, CDCl3), δ, м.д.: 13.6 (СН3); 18.4 (СССН2СН2); 21.9 (CH2CH3); 30.8 (СН2СН2СН3); 42.8 (3-NCH2CC); 51.3 (С-4); 63.6 (С-5); 75.9 (3-NCH2 CC); 84.5 (3-NCH2CC); 85.9 (С-2). Масс-спектр (ЭУ, 70 эВ), m/z (Ioтн, %): 166 [M-H]+ (100), 137 [М-Н-С2Н5]+ (22), 110 [М-С4Н9]+ (31), 72 [C2H4NCH2O]+ (33). Найдено, %: С 71.89; Н 10.17; N 8.35. C10H17NO. Вычислено, %: С 71.81; Н 10.25; N 8.37.
Пример 7
3-(3-Фенил-2-пропинил)-1,3-оксазолидин(1с)
Прозрачное масло, выход: 0.15 г (81%), nd=1.3657 (при 28°С). Rf=0.23 (гексан-CH2Cl2-этилацетат, 2:2:1). Спектр ЯМР 1Н (400 МГц, CDCl3), δ, м.д. (J, Гц): 3.05 (2Н, т, J=6.8, Н-4); 3.54-3.57 (2Н, м, 3-NCH 2CC); 3.76 (2Н, т, J=6.8, H-5); 4.36-4.40 (2Н, м, Н-2); 7.22-7.25 (3Н, м, H-Ph); 7.37-7.41 (2Н, м, H-Ph). Спектр ЯМР 13С (100 МГц, CDCl3), δ, м.д.: 43.2 (3-NCH2CC); 51.4 (С-4); 63.7 (С-5); 84.0 (3-NCH2 CC); 85.6 (3-NCH2CC); 86.0 (С-2); 122.9 (C-Ph); 128.2 (C-Ph); 128.3 (C-Ph); 131.7 (C-Ph). Масс-спектр (ЭУ, 70 эВ), m/z (Ioтн, %): 186 [М-Н]+ (42), 156 [М-CH2O]+ (81), 115 [PhC≡CCH2]+ (100); 102 [PhC≡СН]+ (17), 89 [CPh]+ (64). Найдено, %: С 76.91; Н 7.06; N 7.55. C12H13NO. Вычислено, %: С 76.98; Н 7.00; N 7.48.
Пример 8
5-Метил-3-(2-гексинил)-1,3-оксазолидин (1d)
Светло-желтое прозрачное масло, выход: 0.09 г (45%). ИК спектр, ν, см-1: 1076 (С-O-С), 1457 (СН2), 2250 (С≡С), 2932 (СН2). Rf=0.40 (гексан-этилацетат, 2:1). Спектр ЯМР 1Н (400 МГц, CDCl3), δ, м.д. (J, Гц): 0.91-0.94 (3Н, м, 3-СН 3); 1.15-1.21 (3Н, м, 5-СН 3); 1.43-1.49 (2Н, м, СН2СН 2СН3); 2.44-2.48 (1Н, м, На-4); 2.11-2.12 (2Н, м, СН 2СН2СН3); 3.11-3.16 (1Н, м, Hb-4); 3.33 (2Н, д, J=2.0, 3-NCH 2CC); 4.08-4.12 (1Н, м, Н-5); 4.33 (2Н, д, J=2.4, Н-2). Спектр ЯМР 13С (100 МГц, CDCl3), δ, м.д.: 13.4 (3-СН3); 19.9 (5-СН3); 20.6 (СССН2СН2); 22.1 (СН2СН3); 42.8 (3-NCH2CC); 58.2 (С-4); 71.8 (С-5); 75.9 (3-NCH2 CC); 84.5 (3-NCH2CC); 85.2 (С-2). Масс-спектр (ЭУ, 70 эВ), m/z (Ioтн, %): 166 [М-Н]+ (37), 123 [M-H-C3H7]+ (100), 95 [NCH2C≡CC3H7]+ (63). Найдено, %: С 71.77; Н 10.32; N 8.42. C10H17NO. Вычислено, %: С 71.81; Н 10.25; N 8.37.
Пример 9
5-Метил-3-(2-гептинил)-1,3-оксазолидин (1e)
Светло-желтое масло, выход: 0.14 г (70%). Rf=0.38 (гексан-этилацетат, 2:1). Спектр ЯМР 1Н (400 МГц, CDCl3), δ, м.д. (J, Гц): 0.83 (3Н, т, J=7.2, 3-СН2СН 3); 1.17-1.19 (3Н, м, 5-СН 3); 1.30-1.35 (2Н, м, СН 2СН2СН3); 1.37-1.40 (2Н, м, СН2СН 2СН3); 2.12 (2Н, м, 3-СССН 2СН2); 2.42-2.47 (1Н, м, Н-4); 3.09-3.16 (1Н, м, Н-4); 3.30-3.31 (2Н, м, 3-NCH2CC); 4.01-4.10 (1Н, м, Н-5); 4.31-4.32 (2Н, м, Н-2). Спектр ЯМР 13С (100 МГц, CDCl3), δ, м.д.: 13.5 (3-СН3); 18.3 (5-СН3); 19.9 (3-СССН2СН2); 21.8 (СН2СН3); 30.7 (СН2СН2СН3); 42.8 (3-NCH2CC); 58.2 (С-4); 71.8 (С-5); 76.7 (3-NCH2 CC); 84.4 (3-NCH2CC); 85.2 (С-2). Масс-спектр (ЭУ, 70 эВ), m/z (Ioтн, %): 180 [M-H]+ (45), 137 [М-Н-С3Н7]+ (53), 95 [СН2С≡СС4Н9]+ (100). Найдено, %: С 72.79; Н 10.61; N 7.78. C11H19NO. Вычислено, %: С 72.88; Н 10.56; N 7.73.
Пример 10
5-Метил-3-(3-фенил-2-пропинил)-1,3-оксазолидин (1f)
Светло-желтое масло, выход: 0.06 г (28%). Rf=0.45 (гексан-этилацетат, 2:1). Спектр ЯМР 1Н (400 МГц, CDCl3), δ, м.д. (J, Гц): 1.29 (3Н, д, J=6, 5-СН 3); 2.59, 2.62 (1Н, д.д., J1=12, J2=7.2, Н-4); 3.25, 3.28 (1Н, д.д., J1=12, J2=7.2, Н-4); 3.65 (2Н, с, 3-NCH 2CC); 4.21 (1Н, м, Н-5); 4.48 (2Н, с, Н-2); 7.30-7.31 (3Н, м, H-Ph); 7.52-7.55 (2Н, м, H-Ph). Спектр ЯМР 13С (100 МГц, CDCl3), δ, м.д.: 20.1 (5-СН3), 43.4 (3-NCH2CC), 58.4 (С-4), 72.0 (С-5), 84.2 (3-NCH2 CC), 85.3 (3-NCH2CC), 85.4 (С-2), 122.9 (C-Ph), 128.3 (C-Ph), 131.7 (C-Ph), 132.2 (C-Ph). Масс-спектр (ЭУ, 70 эВ), m/z (Ioтн, %): 200 [М-Н]+ (8), 157 [М-СН3СНО]+ (29), 115 [PhC≡ССН2]+ (100). Найдено, %: С 77.52; Н 7.45; N 7.02. C13H15NO. Вычислено, %: С 77.58; Н 7.51; N 6.96.
Пример 11
4(R)-Этил-2-(3-гексинил)-1,3-оксазолидин (1g)
Светло-желтое масло, выход: 0.13 г (72%). Rf=0.56 (гексан-этилацетат, 2:1), [α]D 21 -7.8° (с 0.40, CHCl3). Спектр ЯМР 1Н (517 МГц, CDCl3), δ, м.д. (J, Гц): 0.96 (3Н, т, J=7.5, 4-СН 3); 0.99 (3Н, т, J=7.5, 3-СН 3); 1.41 (1Н, кв, J=7.0, 4-CH aHbCH3); 1.54-1.56 (2Н, м, 3-СН 2СН3); 1.64 (1Н, кв, J=7.0, 4-CH aHbCH3); 2.18 (2Н, т, J=7.0, 3-СН 2СН2СН3); 2.99 (1Н, кв, J=7.0, H-4); 3.40-3.43 (1Н, м, На-5); 3.43 (2Н, с, 3-NCH 2CC); 4.06 (1Н, т, J=7.5, Hb-5); 4.44 (2Н, с, Н-2). Спектр ЯМР 13С (125.78 МГц, CDCl3), δ, м.д.: 11.0 (4-СН3); 13.5 (3-СН3); 20.7 (3-СН2СН2СН3); 22.2 (3-СН2 СН2СН3); 25.9 (4-СН2СН3); 42.5 (3-NCH2CC); 63.8 (С-4); 70.30 (С-5); 76.9 (3-NCH2 CC); 85.0 (3-NCH2CC); 85.3 (С-2). Масс-спектр (ЭУ, 70 эВ), m/z (Ioтн, %): 180 [M-H]+ (38), 152 [М-С2Н5]+ (100), 124 [M-C4H9]+ (45). Найдено, %: С 72.95; Н 10.61; N 7.66. C11H19NO. Вычислено, %: С 72.88; Н 10.56; N 7.73.
Пример 12
4(R)-Этил-2-(3-гептинил)-1,3-оксазолидин (1h)
Темно-желтое масло, выход: 0.17 г (83%). Rf=0.50 (гексан-этилацетат, 2:1), [α]D 20 -7.3° (с 2.39, CHCl3). Спектр ЯМР 1Н (517 МГц, CDCl3), δ, м.д. (J, Гц): 0.90 (3Н, т, J=7.5, 3-СН 3); 0.94 (3Н, т, J=7.5, 4-СН 3); 1.31-1.37 (1Н, м, 4-CH aHbCH3); 1.38-1.44 (2Н, м, 3-СН 2СН3); 1.45-1.51 (2Н, м, 3-СН 2СН2СН3); 1.57-1.64 (1Н, м, 4-CH aHbCH3); 2.18 (2Н, т, J=7.0, 3-СССН 2СН2); 2.94 (1Н, кв, J=7.0, H-4); 3.36-3.39 (1Н, м, На-5); 3.37 (2Н, с, 3-NCH 2CC); 4.02 (1Н, т, J=7.5, Hb-5); 4.40 (2Н, с, Н-2). Спектр ЯМР 13С (125.78 МГц, CDCl3), δ, м.д.: 10.9 (4-СН3); 13.6 (3-СН3); 18.4 (3-СССН2СН2); 21.9 (3-СН2 СН2СН3); 26.1 (4-СН2СН3); 30.8 (3-СН2СН2СН3); 42.5 (3-NCH2CC); 63.7 (С-4); 70.2 (С-5); 75.8 (3-NCH2 CC); 84.4 (3-NCH2CC); 85.4 (С-2). Спектр ЯМР 15N (50.69 МГц, CDCl3), δ, м.д.: 65.1 (N-3). Масс-спектр (ЭУ, 70 эВ), m/z (Ioтн, %): 194 [M-H]+ (6), 166 (100), 138 [М-С2Н5]+ (50). Найдено, %: С 73.87; Н 10.79; N 7.24. C12H21NO. Вычислено, %: С 73.80; Н 10.84; N 7.17.
Пример 13
4(R)-Этил-3-(3-фенил-2-пропинил)-1,3-оксазолидин (1i)
Светло-желтое масло, выход: 0.05 г (24%). Rf=0.53 (гексан-этилацетат, 2:1), [α]D 18 -2.3° (с 1.01, CDCl3). Спектр ЯМР 1Н (517 МГц, CDCl3), δ, м.д. (J, Гц): 1.01 (3Н, т, J=7.5, 4-СН 3); 1.41-1.49 (1Н, м, 4-CH aHbCH3); 1.64-1.73 (1Н, м, 4-CH aHbCH3); 3.09 (1Н, кв, J=7.0, H-4); 3.45 (1Н, т, J=7.5, Ha-5); 3.69 (2Н, с, 3-NCH2CC); 4.12 (1Н, т, J=7.5, Hb-5); 4.50 (1Н, д, J=5.3, Н-2); 4.53 (1Н, д, J=5.3, H-2); 7.32-7.33 (3Н, м, H-Ph); 7.44-7.46 (2Н, м, H-Ph). Спектр ЯМР 13С (125.78 МГц, CDCl3), δ, м.д.: 11.0 (4-СН3), 26.1 (4-СН2СН3), 43.0 (3-NCH2CC), 64.0 (C-4), 70.4 (C-5), 84.0 (3-CCPh), 85.5 (3-CCPh), 85.5 (C-2), 122.9 (C-Ph), 128.2 (C-Ph), 128.3 (C-Ph), 131.7 (C-Ph). Спектр ЯМР 15N (50.69 МГц, CDCl3), δ, м.д.: 65.1 (N-3). Масс-спектр (ЭУ, 70 эВ), m/z (Ioтн, %): 214 [М-Н]+ (55), 186 [М-СНСН3]+ (100), 115 [PhC≡CCH2]+ (100). Найдено, %: С 78.18; Н 7.91; N 6.56. С14Н17НО. Вычислено, %: С 78.10; Н 7.96; N 6.51.
Пример 14
5-Фенил-3-(3-фенил-2-пропинил)-1,3-оксазолидин (1k)
Светло-желтое масло, выход: 0.09 г (60%). Rf=0.50 (гексан-CCl4-этилацетат, 2:1:2). Спектр ЯМР 1Н (400 МГц, CDCl3), δ, м.д. (J, Гц): 2.41 (1Н, с, H-4); 2.96-3.02 (1Н, м, H-4); 3.77 (2Н, с, Н-6); 4.77 (2Н, м, H-2); 5.13 (1Н, т, J=7.2, Н-5); 7.22-7.52 (10Н, м, H-Ph). Спектр ЯМР 13С (100 МГц, CDCl3), δ, м.д.: 43.5 (С-6); 61.4 (C-4); 77.4 (C-5); 83.4 (3-CCPh); 85.3 (3-CCPh); 86.9 (C-2); 122.9 (C-Ph); 125.6 (C-Ph) 127.2 (C-Ph), 127.3 (C-Ph), 128.1 (C-Ph), 131.8 (C-Ph), 141.8 (C-Ph). Масс-спектр (ЭУ, 70 эВ), m/z (Ioтн, %): 263 [М]+ (65), 115 [PhC≡CCH2]+ (100), 104 [PhCHCH2]+ (100). Масс-спектр (MALDI-TOF/TOF), m/z: 264.318 [М+Н]. Найдено, %: С 82.03; Н 6.56; N 5.28. C18H17NO. Вычислено, %: С 82.10; Н 6.51; N 5.32.
Способ получения 3-(2-алкинил)-1,3-оксазолидинов общей формулы (1) ,отличающийся тем, что моноэтаноламин общей формулы HO(R1)CHCH(R2)NH2 (где R1=R2=H; R1=СН3, R2=H; R1=H, R2=CH2CH3; R1=Ph, R2=H) подвергается взаимодействию с параформом при кипячении в бензоле в течение 5 ч с последующим вакуумированием бензола и добавлением алкил(фенил)ацетилена-1 общей формулы R3-C≡CH (где R3=C3H5, С4Н9, Ph) в толуоле и катализатора CuCl, после чего реакционную массу перемешивают в атмосфере аргона при 80°С и атмосферном давлении в течение 5-7 ч, реакцию проводят при мольном соотношении HO(R1)CHCH(R2)NH2: (CH2O)n: R3-C≡CH: CuCl=2:3:1:(0.03÷0.07).