Биоактивное покрытие титанового имплантата, вводимого в костную ткань человека
Иллюстрации
Показать всеИзобретение относится к области медицины. Описано многослойное биоактивное покрытие титанового имплантата, вводимого в костную ткань человека, полученное атомно-слоевым осаждением и состоящее, по крайней мере, из слоев одного оксида переходного металла, выбранных из группы, включающей слои оксида титана, слои из оксида циркония, слои из оксида гафния, слои из оксида тантала, слои из оксида ниобия, из слоев многокомпонентного оксида (TiO2)x(Ta2O5)1-x, где х равен 0,8-0,95 со структурой твердого раствора на основе тетрагональной кристаллической решетки, с контролируемой толщиной покрытия, определяемой числом повторяющихся циклов осаждения соответствующих прекурсоров - химических реагентов в виде жидких органометаллических соединений указанных переходных металлов и воды. Покрытие обладает высокой однородностью с развитым поверхностным рельефом, хорошими биоактивными свойствами, высокой коррозионной стойкостью. 1 з.п. ф-лы, 7 ил., 5 табл., 6 пр.
Реферат
Изобретение относится к области медицины и конкретно касается получения титановых имплантатов с биоактивным покрытием, предназначенным для введения в костную ткань для устранения костных дефектов с восстановлением в них костной ткани, в частности для изготовления различных титановых ортопедических и дентальных имплантатов.
Как известно из уровня техники, некоторые металлы или металлические сплавы, такие как титан, цирконий, гафний, тантал, ниобий или их сплавы, используют для образования относительно прочных связей с костной тканью. В частности, металлические имплантаты из титана и его сплавов, начиная приблизительно с 1950 года, известны благодаря их способности хорошо связываться с костной тканью. Такого рода связь Бранемарк назвал остеоинтеграцией (см. Branemark et al., «Osseointegrated implants in the treatment of the edentulous jaw. Experience from a 10-year period (Остеоинтегрированные имплантаты при лечении лишенной зубов челюсти. 10-летний опыт)», Scand. J. Plast. Reconstr., II, suppi 16 (1977)).
В настоящее время титан, благодаря сочетанию хороших прочностных характеристик, высокой коррозионной стойкости и не токсичности, является одним из основных материалов при изготовлении различных устройств (дентальные, ортопедические имплантаты) для имплантации в костную ткань. При обычных условиях титан легко окисляется и на его поверхности появляется тонкая пленка аморфного диоксида титана (~5 нм), которая и обеспечивает высокую коррозионную стойкость титана, но при этом характеризуется достаточно длительными сроками интеграции с костной тканью.
Таким образом, титан и его сплавы широко используются в восстановительной хирургии в качестве как зубных, так и ортопедических имплантатов вследствие их превосходной биосовместимости с костной тканью (P.J. Branemark, J. Prosthetik Dent 50:399-410, 1983; D.J. Bardos, D. Williams (ed). Concise Encyelopedia of Medical je Dental Materials, Pergamon Press, Ox for 1990, p.p.360-365; R. van Noork, J. Mater. Sci 22: 3801-3811, 1987). Это может быть объяснено уникальными характеристиками поверхности раздела титан-кость. Однако для усиления процессов соединения или сцепления и улучшения прочности связи или сцепления были разработаны и одобрены для клинического применения покрытия с плазменным напылением из апатита, в частности из гидроксиапатита (К. De Groot, J. Ceram. Soc Japan 99: 943-953, 1991).
Хотя прочность связи между металлом и костной тканью является относительно сильной, желательно эту связь усилить. В настоящее время разработано много способов обработки металлических имплантатов с целью получения подходящей поверхности для улучшения их остеоинтеграции. Из RU 2074674 А1, 10.03.1997 известен способ изготовления внутрикостных имплантатов, он заключается в том, что на титановую основу имплантата методом плазменного напыления наносят систему покрытий из четырех слоев - двух слоев титана или гидрида титана различной дисперсности и толщины, третьего слоя из механической смеси титана или гидрида титана или гидроксиапатита соотношением 60-80 мас.% и 20-40 мас.% и наружного слоя - гидроксиапатита. Для повышения механической прочности имплантата напыление ведут послойно при различных режимах, обеспечивающих плавный переход от структуры компактного титана к структуре биоактивного слоя.
Стремление ускорить остеоинтеграцию титановых имплантатов стимулировало в научном сообществе направление по разработке так называемых биоактивных покрытий. Под биоактивностью в имплантологии понимают способность материала к более быстрой остеоинтеграции по сравнению с неким реперным материалом, чаще всего с титаном. Традиционным биоактивным покрытием является гидроксиапатит (НА), который наносится на поверхность имплантата методом плазменного напыления.
Лясников В.Н. с соавторами (Лясников В.Н., Серянов Ю.В., Протасова Н.В., Мазанов К.В. Формирование равномерной пористой структуры титановых и гидроксиапатитовых покрытий на дентальных имплантатах при ультразвуковом плазменном напылении Клин. имплант. и стомат., 2000, № ¾ (13/14), с.114-118) предлагают использовать три промежуточных слоя для получения надежного покрытия, содержащего гидроксиапатит: 1-ый слой - пористый титан, дисперсность 3-10 мкм, 2-ой слой - пористый титан, дисперсность 50-100 мкм, 3-ий слой - пористая композиция, титановые частицы с гидроксиапатитом (60% Ti, 40% гидроксиапатит). Создание дополнительной разветвленной поверхности приводит к наиболее прочному закреплению на ней частичек плазменно напыленного гидроксиапатита. Для повышеия однородности и пористости покрытия предложена технология активации ультразвуковых вибраций подложки в процессе напыления.
Однако такие покрытия обладают низкой кристалличностью и слабой адгезией к титановому имплантату. Низкая кристалличность является причиной быстрого растворения гидроксиапатитного покрытия в тканевой жидкости и приводит к снижению срока службы покрытия, в то время как слабая адгезия может приводить к его отслоению. Поэтому важным становится вопрос о поиске новых биоактивных покрытий.
Из RU 2458707 С1, 20.08.2012, известен имплантат, который содержит на поверхности послойно-напыленную плазменным методом систему биосовместимых покрытий различной дисперсности и толщины, состоящую из пяти слоев: первых двух из титана или гидрида титана, последующих двух слоев из смеси титана или гидрида титана с гидроксиапатитом кальция, отличающихся содержанием компонентов в слоях, и пятого слоя из гидроксиапатита кальция, после чего многослойная система биосовместимых покрытий облучена в разреженной среде углеводородного газа высокоэнергетическими ионами инертного газа с энергией 40-130 кэВ и дозой облучения 2000-5000 мкКл/см2. Данное известное техническое решение обеспечивает повышение биоактивности и механической прочности имплантата.
ИЗ RU 2124329 С1, 10.01.1999, известен покровный материал для биомедицинских применений, в частности на биомедицинских имплантатах из подложки из титана или титанового сплава и который содержит главным образом гелеобразный на основе окиси титана материал, который обработан при температуре 350°С-750°С, при этом упомянутый материал способен вызывать образование фосфата кальция на его поверхности при условиях in vitro, например, в имитаторе жидкости тела и/или при условиях in vivo.
Покровный материал нанесен на подложку путем окунания в золевой раствор вещества с последующим удалением из раствора и сушкой, при этом в качестве вещества использован гелеобразный на основе окиси титана материал, обработанный при температуре 350°С-750°С, или гальваническим методом.
Из US 2009005880 A1, 01.01.2009, известен имплантат из титана, в частности, с высокой степенью остеоинтеграции и способ получения таких имплантатов, покрытых тонкой пленкой диоксида титана в кристаллической форме анатазной. Имплантат получен нанесением на подложку, погружением, окунанием, распылением или нанесением валиком жидкого гелеобразного и стабильного реагента (далее - прекурсор), полученного из неорганических или металлоорганических соединений титана(IV), с последующей термической обработкой для достижения уплотнения, в результате на поверхности подложки образуются тонкие пленки покрытия из TiO2 в кристаллической форме анатаза.
Жидкий прекурсор содержит соединение титана, воду, органический растворитель, органическую или неорганическую кислоту, катионноактивное или неионогенное поверхностно-активное вещество.
В качестве соединения титана используют либо неорганическое соединение титана, например тетрахлорид титана (TiCl4), либо органометаллическое соединение титана.
Известное техническое решение не позволяет получать на поверхности титанового имплантата очень тонкие многослойные пленки покрытия с необходимыми свойствами.
Из патента US 2010159118 A1, 24.06.2010, известен биосовместимый титановый имплантат с нанесенным на подложку, например, из титана или титанового сплава методом золь-гель технологии пленки из оксида титана, например, анатазной модификации, которая обладает превосходной способностью к образованию гидроксиапатита, что позволяет использовать имплантат для устранения костных дефектов и образования костной ткани. Покрытия из оксида титана по золь-гель технологии образуются при нанесении на подложку жидкости, содержащей соединение титана, такого как алкоксид титана, например этоксититан [Ti(ОС2Н5)4], органический растворитель, предпочтительно одноатомный спирт, воду, катализатор гидролиза (кислота или щелочь, например неорганическая кислота). Жидкость нанесена на подложку, например, окунанием. Далее осуществляют термообработку от 250°С до 790°С, предпочтительно 350°С и выше. А затем осуществляют ультрафиолетовое облучение и обработку имплантата в имитаторе жидкости тела для генерации на его поверхности кристаллов гидроксиапатита. Отметим, что описанный методне применим к имплантатам с большой площадью поверхности, содержащим глубокие поры малого диаметра.
Из уровня техники известна технология осаждения на подложках тонких пленок, которая основывается на последовательных химических реакциях между газообразным регентом и твердым телом, так называемый метод атомно-слоевого осаждения (АСО). Большинство АСО-реакций используют два химических соединения, которые обычно называют прекурсорами. Такие прекурсоры поочередно вступают в реакцию с поверхностью. В результате многократного влияния прекурсоров происходит рост тонкой пленки [В.Б. Алесковский, журнал «Прикладная химия», 47, 2145, (1974)].
Этот способ атомно-слоевого осаждения широко используется в микроэлектронике. Так, например, в монографии (Киреев В.Ю., Столяров А.А. Технологии микроэлектроники. Химическое осаждение из газовой фазы. - М.: Техносфера, 2006. - 192 с.) описан способ атомно-слоевого осаждения пленок сложных химических соединений путем послойного, разделенного на циклы процесса осаждения материала, моноатомной за цикл толщиной. По окончании каждого цикла химическая реакция самоостанавливается. Общая толщина пленки задается и контролируется по количеству циклов осаждения. Атомы последующего слоя образуют химические связи с атомами предыдущего таким образом, что создается упорядоченная структура пространственного расположения атомов всего многослойного осадка. Технология реализуется путем дискретной поочередной подачи реагентов к поверхности подложки с промежуточной продувкой зоны реакции инертным газом.
В частности, в патенте US 2006/0251875 A1, 09.11.2006, описан биосовместимый и биоинертный имплантат (в виде чипа), биосовместимый с теплокровными животными, и способ получения его путем нанесения на кремниевую подложку методом атомно-слоевого осаждения биосовместимого и биоинертного покрытия. состоящего из одного или несколькоих слоев одного или более следующих материалов: оксид алюминия или оксид титана, или оксид циркония, или оксид ванадия, или олово, или нитрид кремния, или карбид кремния, или титана. Покрытие осаждают с использованием газообразных прекурсоров, например, из тетрахлорида титана и воды, при температуре осаждения 100-900°С.
Однако получаемое покрытие не является биоактивным и получаемый материал, как устройство типа чипа, не предназначен для использования в качестве имплантата для устранения дефектов костной ткани. Кроме того. в качестве прекурсоров на металл используются галлиды металлов TiCl4, TiI4, ZrCl4, которые могут приводить к внедрению в покрытие галогенов, а также поскольку при использовании этих прекурсоров одним из основных продуктов реакций является коррозионно-активные вещества типа HCl, способные взаимодействовать с материалом реактора (как правило хромоникелевая нержавеющая сталь), покрытие может насыщаться такими элементами, как Ni, Cr, Fe, что ввиду их токсичности крайне нежелательно в биомедицинских применениях. Отметим, что использование в качестве прекурсоров на Ti, Zr, Та, Nb органометаллических соединений Ti(OC2H5)4, Zr[N(CH3)(C2H5)]4, Та(ОС2Н5)5, соответственно, не должно приводить к насыщению покрытия токсичными элементами.
Технической задачей заявленного изобретения и достигаемым при этом техническим результатом являются получение биоактивного многослойного покрытия титанового имплантата, с высокой однородностью покрывающего трехмерный имплантат, в том числе и с очень развитым поверхностным рельефом, обладающим хорошими биоактивными свойствами, пониженной токсичностью, высокой коррозионной стойкостью, расширение арсенала технических средств - имплантатов титановых для устранения различных костных дефектов, восстановления костной ткани.
Поставленная техническая задача и достигаемый при этом технический результат обеспечиваются изобретением, а именно:
биоактивным покрытием титанового имплантата, вводимого в костную ткань человека, представляющее собой нанесенное на поверхность металлической подложки-основы титанового имплантата многослойное биоактивное покрытие, выращенное из продуктов реакции прекурсоров атомно-слоевым осаждением и представляющее собой покрытие из слоев по меньшей мере одного оксида переходного металла, выбранного из группы, включающей покрытие из слоев оксида титана TiO2 с кристаллической анатазной модификацией, покрытие из слоев ZrO2, слоев из HfO2 с поликристаллической структурой с тетрагональной решеткой, покрытие из слоев Ta2O5 с аморфной структурой, из слоев Nb2O5 с аморфной структурой, покрытие из слоев многокомпонентного оксида (TiO2)x·(Ta2O5)1-x, где х равен 0,8-0,95 со структурой твердого раствора на основе тетрагональной кристаллической решетки (типа анатаз) или из слоев многокомпонентного оксида (ZrO2)x·(Ta2O5)1-x, где х равен 0,8-0,95 со структурой твердого раствора на основе тетрагональной кристаллической решетки, с контролируемой толщиной покрытия, определяемой числом повторяющихся циклов осаждения соответствующих прекурсоров - химических реагентов в виде жидких органометаллических соединений указанных переходных металлов и воды.
Получаемое заявленным изобретением покрытие титанового имплантата, вводимого в костную ткань человека, является биоактивным. Биоактивность покрытия контролируется по образованию in vitro слоя гидроксиапатита в растворе, имитирующем тканевую жидкость тела человека.
Известно, что такие кристаллические модификации TiO2, как анатаз и рутил, обладают биоактивными свойствами, проявляющимися в их ускоренной (по сравнению с аморфным естественным окислом титана) остеоинтеграции, при этом предпочтение отдается оксиду титана с кристаллической структурой анатаз.
Действительно, было установлено, что анатаз удовлетворяет прежде всего кристаллографическому критерию при выборе материалов для биоактивных покрытий [Masaki Uchida, Hyun-Min Kim, Tadashi Kokubo, Shunsuke Fujibayashi, Takashi Nakamura. Structural dependence of apatite formation on titania gels in a simulated body fluid// Journal of Biomedical Materials Research Part A Volume 64A, Issue 1, pages 164-170, 1 (2003)].
Так как основой костной ткани человека является гидроксиапатит (Са10(PO4)6(ОН)2) в гексагональной кристаллографической модификации, то материалы в кристаллической модификации с межплоскостными расстояниями, схожими с гидроксиаптитом (прежде всего оксиды переходных металлов), особенно тетрагональной модификации, являются потенциальными кандидатами на быструю остеинтеграцию с костной тканью человека.
Полученное покрытие титанового имплантата, вводимого в костную ткань человека, представляет собой многослойное биоактивное покрытие из, по меньшей мере, слоев одного оксида переходного металла из группы оксид титана, оксид циркония, оксид гафния, оксид тантала, оксид ниобия, слои биоактивного покрытия получены, в частности, путем выращивания тонких пленок из указанных оксидов металлов методом атомно-слоевого осаждения при пониженном давлении, температуре в реакционной зоне используемого устройства для атомно-слоевого осаждения 200-300°С и при продувке реакционной зоны азотом при давлении 0,5-5 мбар с использованием импульсной подачи их к поверхности металлической подложки имплантата химических реагентов - прекурсоров, включающих органометаллические соединения и воду, с периодом длительности импульсов подачи металлсодержащих прекурсоров 0,2-0,6 с и с межимпульсной продувкой реакционной зоны азотом около 6 с. Количество циклов осаждения определяет необходимую толщину биоактивного покрытия, которое варьируется в пределах от 100 до 1000 циклов. В качестве прекурсоров используют химические реагенты, включающие по меньшей мере одно соответствующее органометаллическое соединение и воду, выбранные из группы, включающие химические реагенты-прекурсоры, в которую входят этоксититан (тетраэтоксититан Ti(OC2H5)4) и воду, этилметиламидциркония Zr[N(CH3)·(C2H5)]4 и воду, этилметиламидгафния Hf[N(CH3)·(С2Н5)]4 и воду, пентаэтокситантал Ta(OC2H5)5, пентаэтоксиниобий Nb(OC2H5)5 и воду.
В качестве органометаллических соединений переходных металлов, помимо указанных в первичных материалах заявки, могут использоваться и другие органометаллические соединения указанных переходных металлов, например такие, как Ti(OCH3)4; Ta[N(CH3)2]5; Ti[OCH)(CH3)2]4; Zr[N(CH3)(C2H5)]4; Hf[N(CH3)(C2H5)]4; Ti[N(C2H5)2]4; Ti[N(CH3)(C2H5)]4; Ti[N(CH3)2]4; Hf[N(C2H5)2]4; Hf[N(CH3)(C2H5)]4; Hf[N(CH3)2]4; Zr[N(C2H5)2]4; Zr[N(OCH3]4; и др.
Около 6 с следует понимать как значение, лежащее вблизи значения «6» (немного больше или меньше «6»), например, 5,4 с, 5,7 с, 5,9 с, 6,1 с, 6,3 с.
Изобретения поясняются чертежами и конкретными примерами.
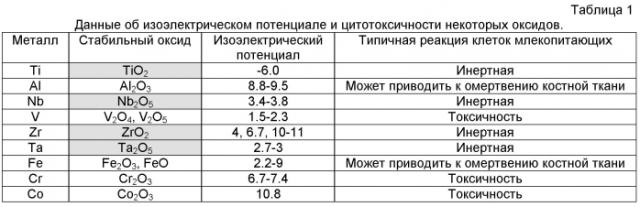
На фиг. 1 изображено взаимное расположение ОН-групп гидроксиапатита по отношению к атомам кислорода в TiO2 со структурой анатаз.
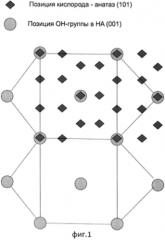
На фиг. 2 изображено взаимное расположение ОН-групп гидроксиапатита по отношению к атомам кислорода в TiO2 со структурой рутила.
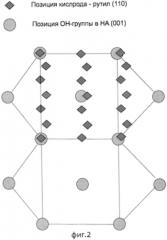
На фиг. 3 представлены рентгеновские дифрактограммы от покрытий TiO2, осажденных на титановую подложку за указанное число реакционных циклов.
На фиг. 4 представлены рентгеновские дифрактограммы от покрытий TiO2, осажденных на титановую подложку за указанное число рекционных циклов после выдержки в растворе, моделирующем тканевую жидкость.
На фиг. 5 изображены спектры рентгеновской дифракции, измеренные от образцов с TiO2, полученных при следующих длительностях импульсов тетраэтоксититана: t=0.06 с, t=0,2 с и t=0,6 с.
На фиг. 6 представлены дифрактограммы образцов с ZrO2, полученных при следующих длительностях импульсов этилметиламид циркония: t=0,06 с. и t=0,5 с.
На фиг. 7 приведены спектры рентгеновской дифракции, измеренные от образцов с многокомпонентными оксидами (TiO2)х(Ta2O5)1-х, с концентрацией TiO2 х=0.7 и х=0.9.
На фиг. 1 и 2 показано взаимное расположение ОН-групп гидроксиапатита по отношению к атомам кислорода в TiO2 со структурой анатаза (фиг. 1), и в TiO2 со структурой рутила (фиг. 2).
Действительно, на фиг. 1 показано положение атомов О анатаза в кристаллографической плоскости (101) по отношению к положениям ОН-групп гидроксиапатита в плоскости (0001), а на фиг. 2 - положение атомов О рутила в плоскости (110) по отношению к положениям ОН-групп гидроксиапатита в плоскости (0001). Из рисунка видно, что в случае анатаза совпадение положения атомов кислорода с положением ОН- групп практически полное, а в случае рутила присутствует расхождение ~ 3%. Данное обстоятельство часто принимается во внимание при объяснении более высокой биоактивности анатаза по сравнению с рутилом.
Биоактивными характеристиками обладают также покрытия из оксида циркония и оксида гафния в тетрагональной кристаллической модификации.
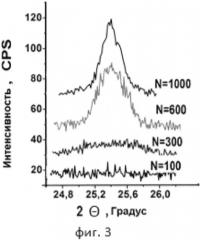
1. При выборе материалов покрытий - кандидатов на высокую биоактивность, кроме описанного выше кристаллографического подхода при выборе материалов, представляется интересным рассмотреть еще следующие обстоятельства. Согласно работе [Kim Н-М, Himeno Т, Kokubo Т, Nakamura Т, Process and kinetics of bonelike apatite formation on sintered hydroxyapatite in a simulated body fluid, Biomaterials 26 (2005) 4366-4373] ключевым фактором для усиления биоактивных свойств является формирование активного притока ионов кальция на поверхность имплантата, поскольку с формирования кальцийсодержащего слоя и начинается процесс остеоинтеграции. Изоэлектрический потенциал является величиной, которая фактически является значением рН жидкости, при помещении в которую не возникает разности потенциалов между поверхностью имплантата и жидкостью. Известно, что рН крови человека изменяется в пределах 7.2-7.4. Тогда материалы с изоэлектрическим потенциалом поверхности <7.2-7.4 будут обеспечивать разность потенциалов с тканевой жидкостью, обеспечивая поток ионов Са+ к их поверхности. В табл. 1 из работы [М. Textor, С. Sittig, V. Frauchiger, S. Tosatti, D.M. Brunette. Properties and Biological Significance of Natural Oxide Films on Titanium and Its Alloys in "Titanium in Medicine: Material Science, Surface Science, Engineering, Biological Responses and Medical Applications", Springer Verlag, Heidelberg and Berlin; 2001; pp.171-230] приведены данные об изоэлектрическом потенциале и цитотоксичности некоторых простых оксидов переходных металлов. Серым цветом выделены оксиды, обладающие как низким изоэлектрическим потенциалом, так и не проявляющие цитотоксичности. Среди этих материалов наиболее низким изоэлектрическим потенциалом обладает Та2О5.
Тем не менее, тонкие пленки из оксида тантала, получаемые различными методами, обладают существенным с точки зрения представленного выше кристаллографического критерия биоактивности недостатком - они аморфны в достаточно широком диапазоне толщин. Поэтому, в этой связи, представляется перспективной разработка многокомпонентного покрытия, включающего в себя компонент, удовлетворяющий кристаллографическому критерию (TiO2 в тетрагональной модификации анатаз или ZrO2 в тетрагональной модификации) и компонент с низким изоэлектрическим потенциалом (Та2О5). При этом с целью максимального соответствия кристаллографическому критерию покрытие по своему фазовому составу должно представлять твердый раствор типа (TiO2)x(Ta2O5)1-x или (ZrO2)x(Ta2O5)1-x с тетрагональной решеткой. Отметим, что использование в качестве прекурсоров Ti, Zr, Hf, Та органометаллических соединений Ti(OC2H5)4, Zr[N(CH3)(C2H5)]4, Hf[N(CH3)(C2H5)]4, Та(ОС2Н5)5, соответственно, не должно приводить к насыщению покрытия токсичными элементами.
Ниже представлены примеры, иллюстрирующие заявленное изобретение, но не ограничивающие его.
Пример 1.
Непосредственно перед АСО титановые пластины марки Grade 4 отмывалась в ультразвуковой ванне при 50°С сначала в ацетоне (ХЧ) (10 мин), затем в этаноле (96%, ХЧ) (10 мин), затем в деионизованной воде (10 мин). АСО TiO2 на титановые пластины проводили в реакторе атомно-слоевого осаждения вертикального типа, работающего при пониженном давлении (~2 мбар) при температуре реактора 300°С в режиме прокачки азота. Из-за низкого давления паров этоксититана (Ti(OC2H5)4) его подавали в реактор из прогреваемого источника при температуре 150°С. Длительность импульсов подачи Ti(OC2H5)4 и Н2О составляла 0.2 и 0.2 с, соответственно. Время продувки азотом после каждого импульса подачи прекурсоров составляло 6 с после каждого импульса подачи реагентов. Количество реакционных циклов «n» варьировали от 100 до 1000, что соответствовало толщине получаемого TiO2 от 4 до 40 нм.
Кристаллическая структура полученных TiO2 покрытий исследовалась методом рентгеновской дифрактометрии. В этом и в других примерах реализации изобретения Биоактивность покрытий оценивалась по способности образовывать на поверхности слой гидроксиапатита после их выдержки в растворе, моделирующем тканевую жидкость (РМТЖ), в течение 9 дней по методике, изложенной в работе [Tas A.C., Bhaduri S.B. If Biomaterials. 2000. V. 21. P. 1429]. Наличие гидроксиапатита контролировалось методом рентгеновской дифрактометрии и/или гравитометрическим методом.
На фиг. 3 и 4 показаны дифрактограммы титановых образцов с покрытием TiO2 100, 300, 600 и 1000 циклов. Измерения были сделаны в области наиболее интенсивного пика анатаза (101) 2θ ~ 24.6°-26.2°. Было замечено, что пока число циклов меньше 300 рентгеновская дифракция не выявляла каких-либо дифракционных пиков. Сканирование в широком диапазоне (2θ ~ 10-70°, не показано на фиг. 3) также не выявило дифракционных пиков за исключением пика от титановой подложки. В то время как при количестве циклов n≥300 появляется пик от анатаза (101) 2θ ~ 25.4° (ICDD: №01-070-6826). Также стоит отметить, что интенсивность пика растет с увеличением количества циклов «n» (фиг. 3).
Пока количество реакционных циклов «n» менее 600, появляется второй пик от анатаза на 48,2° (200).
Таким образом, поликристаллическая структура пленки и соответствующее табличным данным отношение сравнительной интенсивности пиков (101) и (200) показывают на отсутствие сильного текстурирования пленок TiO2, созданных методом атомно-слоевого осаждения.
Итак, на фиг. 3 и 4 представлены рентгеновская дифракция от: фиг. 3 - покрытия TiO2, осажденного на титановую подложку за 100, 300, 600, 1000 реакционных циклов; фиг. 4 - покрытия TiO2, осажденного на титановую подложку за 100, 300, 600, 1000 реакционных циклов после выдержки в растворе, моделирующем тканевую жидкость в зависимости от числа реакционных циклов. Апатит-образующая способность TiO2 покрытия была изучена в зависимости от числа реакционных циклов n. После выдержки в растворе, моделирующем тканевую жидкость, титановые образцы с TiO2 покрытием были проанализированы методами рентгеновской дифракции, растровым электронным микроскопом с приставкой элементного анализа. На фиг. 3 показана дифрактограмма титановых образцов с покрытием из TiO2, полученных при варьировании числа реакционных циклов n в диапазоне 100-1000 циклов после выдержки в растворе, моделирующем тканевую жидкость. При n<300 дифракция выявляет только один дифракционный пик на 31.7°, что соответствует NaCl. При n≥300 появляется пик на 26.1°, 31.8°, 32.3° и 32.8°, что соответствует пикам (002), (211), (112), (300) гидроксиапатита соответственно. Таким образом, фиг. 3 и 4 показывают, что аморфное покрытие TiO2 (n<300) не вызывает рост гидроксиапатита при выдержке в растворе, моделирующем тканевую жидкость. При дальнейшем увеличении толщины покрытия при изменении n в диапазоне 300-1000 (10-40 нм) гидроксиапатит присутствует, при этом не наблюдается существенного изменения его количества.
В результате установлена корреляция между структурными характеристиками АСО TiO2 и его биоактивными свойствами, проявляющаяся в том, что рентгеноаморфные ТiO2 покрытия являются биоинертными (после выдержки образцов в РМТЖ гидроксиапатит отсутствует), в то время как поликристаллические с тетрагональной структурой типа анатаз проявляют биоактивные свойства (после выдержки образцов в РМТЖ на поверхности присутствует гидроксиапатит). Таким образом, показано, что толщина АСО покрытия TiO2 может быть подобрана из условия проявления покрытием поликристаллической структуры.
Пример 2.
АСО покрытия ТiO2 были получены при трех различных длительностях импульсах подачи титанового прекурсора - Ti(ОС2Н5)4, а именно t=0,2 с, t=0,6 с и t=0,06 с. Все остальные условия подготовки подложек и АСО процесса были такими же, как и в примере 1. Ниже приведены спектры рентгеновской дифракции, измеренные от образцов с ТiO2, полученных при t=0,2 с (фиг. 5) и t=0,6 с (фиг. 5).
Рентгендифракционный анализ показал, что проведение АСО короткими импульсами t=0,2 с подачи титанового прекурсора позволяет получить однофазное TiO2 покрытие со структурой анатаз, в то время как АСО процесс при t=0.6 с приводит в дополнении к анатазной фазе появлению в покрытии рутильной фазы 2Θ ~ 27.5° (110). При t=0.06 с рефлексов от кристаллических фаз не выявлено.
В примере 1 показано, что рентгеноаморфные TiO2 покрытия являются биоинертными. Вместе с тем, было известно, что биоактивность рутильной фазы TiO2 существенно уступает биоактивности анатазной. Таким образом, показана необходимость проведения процесса АСО TiO2 при длительностях импульсов титанового прекурсора, указанных в формуле изобретения.
Пример 3.
Непосредственно перед АСО титановые пластины марки Grade 4 отмывалась в ультразвуковой ванне при 50°С сначала в ацетоне (ХЧ) (10 мин), затем в этаноле (96%, ХЧ) (10 мин), затем в деионизованной воде (10 мин). АСО ZrO2 проводили с использованием этиламидациркония Zr[N(CH3)(C2H5)]4 и воды в качестве прекурсоров, а АСО HfO2 - с использованием этиламидагафния Hf[N(СН3)(С2Н5)]4 и воды в качестве прекурсоров, в реакторе атомно-слоевого осаждения вертикального типа при температуре реактора 240°С, работающего при пониженном давлении (~2 мбар) в режиме прокачки азота. Из-за низкого давления паров этилметиламидциркония Zr[N(СН3)(С2Н5)]4 и этиламидагафния Hf[N(СН3)(С2Н5)]4 их подавали в реактор из прогреваемого источника при температуре 100°С. Время продувки азотом после каждого импульса подачи прекурсоров составляло 6 с. АСО покрытия ZrO2 и HfO2 и были получены при трех различных длительностях импульсах подачи металлсодержащих прекурсоров - Zr[N(CH3)(C2H5)]4 в случае роста ZrO2 и Hf[N(СН3)(С2Н5)]4 в случае роста HfO2, а именно t=0,8 с, t=0,5 с и t=0,06 с. Количество реакционных циклов варьировали в диапазоне 100-1000, что соответствовало толщинам получаемых покрытий 8-80 нм.
На фиг. 6 представлены дифрактограммы образцов с длительностями импульсов этилметиламид циркония 0,06 с и 0,5 с. Из фигуры видно, что образец со временем напуска прекурсора Zr[N(СН3)(С2Н5)]4 0,5 с обладает кристаллическими рефлексами [110], [101] тетрагональной структуры, а образец с 0,06 с является аморфным.
После этого был сделан тест на биоактивность в растворе моделирующей тканевую жидкость. Для проверки данных результатов были приведены количественные исследования на основе РД-спектров, в ходе которых оценивалась площадь под пиками. Моделирование производилось в среде WinXRD, для моделирования спектров были использованы функции Pearson и Split Pearson. Данные по количественным рентгено-структурным исследованиям и приросту массы сведены в таблицу 2.
| Таблица 2 | ||
| Интегральные интенсивности и прирост массы для образцов с покрытием ZrO2 с различными длительностями импульсов этилметиламида. | ||
| Образцы ZrO2 с длительностью импульса Zr[N(CH3)(C2H5)]4, с | Интегральные интенсивности пиков гидроксиапатита | Прирост массы, мг |
| 0.06 | 0 | 0 |
| 0.8 | 102±6 | 6.8±0.4 |
| 0.5 | 130±8 | 8.4±0.4 |
Из таблицы видно, что наибольшей биоактивностью обладает образец, полученный при длительности импульса Zr[N(CH3)(C2H5)]4 0.5 с. Аналогичные зависимости по биоактивности покрытий от длительности импульса металлического прекурсора были получены и в случае роста покрытия HfO2 с использованием этилметиламидогафния в качестве металлического прекурсора. Таким образом, показана необходимость проведения процесса АСО ZrO2 и HfO2 при длительностях импульсов металлических прекурсоров, указанных в формуле изобретения.
Пример 4.
Непосредственно перед АСО титановые пластины марки Grade 4 отмывалась в ультразвуковой ванне при 50°С сначала в ацетоне (ХЧ) (10 мин), затем в этаноле (96%, ХЧ) (10 мин), затем в деионизованной воде (10 мин). АСО Та2О5 проводили с использованием в качестве прекурсоров пентаокситантала Та(ОС2Н5)5 и воды в качестве, а АСО Nb2O5 - с использованием пентаоксиниобия Nb(OC2H5)5 и воды, в реакторе атомно-слоевого осаждения вертикального типа при температуре реактора 300°С, работающего при пониженном давлении (~2 мбар) в режиме прокачки азота. Время продувки азотом после каждого импульса подачи прекурсоров составляло 6 с. АСО покрытия и Nb2O5 и были получены при трех различных длительностях импульсах подачи металлсодержащих прекурсоров - Та(ОС2Н5)5 в случае роста Та2О5 и Nb(OC2H5)5 в случае роста Nb2O5, а именно t=0,8 с, t=0,5 с и t=0,06 с. Количество реакционных циклов n варьировали в диапазоне 100-1000, что соответствовало толщинам получаемых покрытий 4-40 нм.
Образцы с покрытиями были протестированы на биоактивность в растворе, моделирующем тканевую жидкость. После рентгено-дифракционной идентификации образования гидроксиапатита на образцах, выдержанных в растворе, моделирующем тканевую жидкость, прирост массы гидроксиапатита был определен гравитометрически и приведен в Таблице 3.
| Таблица 3 | |
| Интегральные интенсивности и прирост массы для образцов с покрытием Ta2O5 с различными длительностями импульса металлического прекурсора. | |
| Образцы с покрытием Ta2O5, полученные при длительностью импульса Та(ОС2Н5)5, с | Прирост массы гидроксиапатита, мг |
| 0.06 | 0 |
| 0.8 | 5.1±0.4 |
| 0.5 | 7.2±0.4 |
Из таблицы видно, что наибольшей биоактивностью (наибольший прирост гидроксиапатита) обладает образец с покрытим Ta2O5, полученный при длительности импульса Та(ОС2Н5)5 - 0.5 с. Аналогичные зависимости по биоактивности покрытий от длительности импульса металлического прекурсора были получены и в случае роста покрытия Nb2O5 с использованием Nb(OC2H5)5 в качестве металлического прекурсора. Таким образом, показана необходимость проведения процесса АСО ТагОз и Nb2O5 при длительностях импульсов металлических прекурсоров, указанных в п. 1 формулы изобретения.
Пример 5.
АСО покрытия (TiO2)x(Ta2O5)1-x на титановых пластинах марки Grade 4 были получены при трех различных значениях концентраций х, а именно х=0.9, х=0.7 и х=0.98. С целью получения многокомпонентных покрытий указанного состава х АСО процесс проводили циклически повторяющимися супециклами, включающими 9 реакционных циклов с использованием Ti(OC2H5)4 (длительность импульса 0.2 сек) и Н2О (длительность импульса 0.1 с) и 1 реакционный цикл с использованием Ta(OC2H5)5 (длительность импульса 0.5 сек) и Н2О (длительность импульса 0.1 с) - для получения покрытия состава х=0.9; 7 реакционных циклов с использованием Ti(ОС2Н5)4 (длительность импульса 0.2 с) и Н2О (длительность импульса 0.1 с) и 1 реакционный цикл с использованием Та(ОС2Н5)5 (длительность импульса 0.5 с) и Н2О (длительность импульса 0.1 с) - для получения покрытия состава х=0.7; 20 реакционных циклов с использованием Ti(OC2H5)4 (длительность импульса 0.2 с) и Н2О (длительность импульса 0.1 с) и 1 реакционный цикл с использованием Та(ОС2Н5)5 (длительность импульса 0.5 с) и Н2О (длительность импульса 0.1 с) - для получения покрытия состава х=0.98. Общее чило суперциклов подбирали такими, чтобы получить толщину многокомпонентного (TiO2)x(Ta2O5)1-x покрытия в диапазоне 30-50 нм. Все остальные условия подготовки подложек и проведения процесса АСО были такими же, как и в примере 1.
Ниже представлены дифрактограммы образцов с многокомпонентными покрытиями (TiO2)x(Ta2O5)1-x с концентрационными значениями х=0.7 и х=0.9.
На приведенной фиг. 7 изображены спектры рентгеновской дифракции, измеренные от образцов с (TiO2)x(Ta2O5)1-x, полученного при концентрационных числах х=0.7 и х=0.9.
Из фиг. 7 видно, что образец со значением концентрации х=0.9 имеет дифракционный максимум, соответствующий рефлексу (101) от кристаллической структуры анатаз, тогда как образец с концентрационным значением х=0.7 не имеет дифракционных максимумов, что означает, что на поверхности находится аморфное покрытие. Также был проведен тест в растворе, моделирующем тканевую жидкость, после чего был сделан анализ на дифрактометре. Результаты продемонстрированы в т