Макроциклические ингибиторы интегразы
Иллюстрации
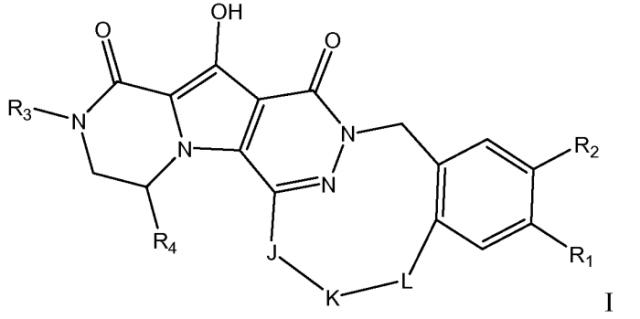
Показать всеИзобретение относится к макроциклическому соединению общей формулы I, к его стереохимически изомерной форме и к его фармацевтически приемлемой соли, где R1 представляет собой F; R2 представляет собой Н, F или Cl; R3 представляет собой C1-4алкил или циклопропил; R4 представляет собой метил; J представляет собой ---N(R5)-SO2-, ---С(=O)-N(R5)-, ---N(R5)-, где пунктирная линия означает точку присоединения к пиридазиноновому кольцу; К представляет собой -(CHR6)P, или *-(СН2)q-CH=CH-CH2-, где * означает точку присоединения к группе J; L представляет собой -O-, -O-СН2-* или -N(R5)-С(=O)-*, где * означает точку присоединения к фенильному кольцу; и R5 представляет собой водород, C1-4алкил или C3-5циклоалкил; каждый R6 независимо представляет собой водород или C1-3алкил; p равно 3, 4, 5 или 6; q равно 2 или 3. Также изобретение относится к фармацевтической композиции на основе соединения формулы I и применению соединения формулы I. Технический результат: получены новые макроциклические соединения, полезные при лечении или профилактики ВИЧ-инфекции. 4 н. и 9 з.п. ф-лы. 6 табл., 169 пр.
Реферат
Настоящее изобретение относится к макроциклическим пиразинопирролопиридазиндионовым производным, обладающим свойствами ингибирования репликации ВИЧ (Вирус Иммунодефицита Человека), их получению и фармацевтическим композициям, включающим эти соединения.
Предпосылки изобретения
Изначально лечение ВИЧ инфекции состояло из монотерапии с использованием нуклеозидных производных, и, несмотря на то, что такая терапия была успешной в подавлении вирусной репликации, эти лекарственные средства быстро теряли свою эффективность из-за появления лекарственно-резистентных штаммов. Очевидно, что высокая скорость мутации в сочетании с быстрой репликацией сделали ВИЧ особенно интересной мишенью для противовирусной терапии. Введение комбинированной терапии, включающей несколько средств против ВИЧ, обеспечивало лучший терапевтический результат. Существующий стандарт лечения представляет собой так называемую HAART (высокоактивная антиретровирусная терапия), которая предлагает сильное и продолжительное подавление вируса. HAART обычно включает комбинацию нуклеозидных или нуклеотидных ингибиторов обратной транскриптазы (NRTI или NtRTI, соответственно) с не-нуклеозидным ингибитором обратной транскриптазы (NNRTI), ингибитором протеазы (PI) и ингибитором интегразы или ингибитором входных ворот инфекции. Существующие руководства для антиретровирусной терапии рекомендуют, по меньшей мере, режим тройной комбинированной терапии даже для начального лечения. Хотя HAART способна подавлять ВИЧ вплоть до неопределяемых уровней, резистентность может возникать из-за проблем совместимости. Также было показано, что резистентный вирус передается новым инфицированным субъектам, оставляя в результате строго ограниченные варианты терапии для этих не имеющих лекарственного привыкания пациентов.
Поэтому существует постоянная потребность в новых и эффективных соединениях, которые можно использовать в качестве анти-ВИЧ лекарственных средств. В частности, существует потребность в дополнительных ингибиторах ВИЧ интегразы, которые являются более эффективными в том, что касается активности против вируса дикого типа, но также против мутированных штаммов, в частности, в отношении мутированных штаммов, выбранных по резистентности к известным ингибиторам интегразы, таким как ралтегравир и элвитегравир. Первичные мутации, наиболее часто развивающиеся в ходе терапевтического лечения ралтегравиром, включают N155H и Q148K/R/H, и не очень часто Y143R/C. Как было обнаружено, приобретение N155 или Q148 мутаций приводит к перекрестной резистентности к структурно несхожим ингибиторам интегразы. Неудачное лечение ралтегравиром связывают с мутациями интегразы в по меньшей мере 3 разных генетических путях, определяемых 2 или более мутациями, включая сигнатурную (главную) мутацию, представляющую собой одну из первичных мутаций в Q148H/K/R, N155H или Y143R/H/C, и одну или несколько дополнительных малых мутаций. Малые мутации, описанные в Q148H/K/R пути, включают L74M плюс E138A, E138K или G140S. Наиболее распространенная картина мутаций в этом пути представляет собой Q148H плюс G140S, которая также сообщает наибольшую потерю восприимчивости к лекарственному средству. (V. A. Johnson et al. (2009) Topics in HIV Medicine 17(5), 138-145).
Существует потребность в ингибиторах интегразы, которые имеют преимущества, связанные с их фармакокинетическим и/или фармакодинамическим профилем. Другие аспекты, которые следует учитывать при разработке дополнительных ингибиторов интегразы, включают благоприятный профиль безопасности, дозирование и/или отсутствие необходимости в ревакцинации.
Другие ингибиторы ВИЧ интегразы известны из уровня техники. Например, WO0255079, WO0230931, WO0230930 и WO0230426 раскрывают аза- и полиазанафталинилкарбоксамиды, полезные в качестве ингибиторов ВИЧ интегразы. WO0236734 раскрывает дополнительно аза- и полиазанафталинилкетоны, полезные в качестве ингибиторов ВИЧ интегразы. Roggo et al, Journal of antibiotics (1996) раскрывает спиродигидробензофуранлактамы в качестве антагонистов эндотелина и в качестве ингибиторов ВИЧ-1 протеазы.
Полициклические карбамоилпиридоны также были раскрыты в качестве ингибиторов ВИЧ интегразы в EP1874117. WO2005118593 раскрывает ряд бициклических гетероциклов в качестве ингибиторов интегразы, и WO2004103278 раскрывает ряд ацилсульфонамидов в качестве ингибиторов ВИЧ интегразы. WO2005028478 раскрывает ряд азахинолинолфосфонатных соединений в качестве ингибиторов интегразы, и WO2004035577 раскрывает ряд имеющих предварительно определенное молекулярное расположение трициклических ингибиторов интегразы. Кроме того, ряд пиридопиразиновых и пиримидопиразиндионовых соединений раскрыт в WO2005087766. Кроме того, тетрагидро-4H-пиридо(1,2-a)пиримидины и родственные соединения были раскрыты в WO2004058757 Instituto di Ricerche di Biologia Moleculare p Angeletti Spa. Japan Tobacco Inc раскрывает 4-оксихинолиновые соединения в качестве ингибиторов ВИЧ интегразы в WO2004046115 и 6-(гетероцикл-замещенный бензил)-4-оксохинолиновое соединение в качестве ингибитора ВИЧ в US20080207618. WO2005110414 и WO2005110415 раскрывают гидрокси-замещенные пиразинопирролопиридазиндионовые соединения в качестве ингибиторов ВИЧ интегразы и ингибиторов ВИЧ репликации.
Настоящее изобретение направлено на обеспечение конкретного нового ряда пиразинопирролопиридазиндионовых производных, обладающих свойствами ингибирования ВИЧ репликации и ВИЧ интегразы.
Описание изобретения
Соединения по настоящему изобретению отличаются от соединений предшествующего уровня техники по своей структуре, противовирусной активности и/или фармакологической активности. Было обнаружено, что соединения по настоящему изобретению являются не только высокоактивными против вируса дикого типа, но также против мутантных штаммов, в частности, против штаммов, которые демонстрируют резистентность к одному или нескольким известным ингибиторам интегразы, такие штаммы называют лекарственно- или полилекарственно-резистентными ВИЧ штаммами. Также было обнаружено, что соединения по настоящему изобретению демонстрируют благоприятные фармакокинетические и/или фармакодинамические свойства.
Таким образом, в одном аспекте настоящее изобретение относится к соединениям формулы I, включая их стереохимически изомерные формы, которые могут быть представлены формулой I:
где
R1 представляет собой F или Cl;
R2 представляет собой H, F или Cl;
R3 представляет собой C1-4алкил, C1-4алкоксиC1-4алкил, циклопропил или тетрагидрофуранил;
R4 представляет собой водород или метил;
J представляет собой ---N(R5)-SO2-, ---C(=O)-N(R5)-, ---N(R5)-, ,
где пунктирная линия означает точку присоединения к пиридазиноновому кольцу;
K представляет собой -(CHR6)р, *-(CH2)q-CH=CH-CH2- или *-(CH2)q-CH≡CH-CH2-, где * означает точку присоединения к группе J;
L представляет собой -O-, -O-CH2-* или -N(R5)-C(=O)-*, где * означает точку присоединения к фенильному кольцу; и
R5 представляет собой водород, C1-4алкил или C3-5циклоалкил;
каждый R6 независимо представляет собой водород или C1-3алкил;
p равно 3, 4, 5 или 6;
q равно 0, 1, 2 или 3;
или их фармацевтически приемлемую соль или сольват.
В следующем аспекте изобретение относится к применению соединений формулы I или подгрупп таких соединений, определенных в настоящей заявке, для ингибирования цикла репликации ВИЧ.
Альтернативно, предусматривается применение указанных соединений для получения лекарственного средства для ингибирования цикла репликации ВИЧ, или соединения формулы I для применения в качестве лекарственного средства для ингибирования репликации ВИЧ.
Как используется в настоящей заявке, "C1-3алкил", в качестве группы или части группы, означает насыщенные линейные или разветвленные углеводородные группы, содержащие от 1 до 3 атомов углерода, такие как, например, метил, этил, 1-пропил или 2-пропил.
Как используется в настоящей заявке, "C1-4алкил", в качестве группы или части группы, означает насыщенные линейные или разветвленные углеводородные группы, содержащие от 1 до 4 атомов углерода, такие как, например, метил, этил, 1-пропил, 2-пропил, 1-бутил, 2-бутил, 2-метил-1-пропил, 2-метил-2-пропил.
Термин "C3-5циклоалкил" является общим для циклопропила, циклобутила и циклопентила.
Термин "C1-4алкокси", в качестве группы или части группы, означает группу формулы -O-C1-4алкил, где C1-4алкил определен выше. Примерами C1-4алкокси являются метокси, этокси, н-пропокси, изопропокси, 1-бутокси, 2-бутокси и трет-бутокси.
В любом случае, когда встречается радикал в определении соединений формулы I или в любой из подгрупп, определенных в настоящей заявке, указанный радикал независимо имеет значение, определенное выше в определении соединений формул I или в более ограниченных определениях далее в настоящей заявке.
Также следует отметить, что положения радикалов в любой молекулярной группе, используемой в определениях, могут представлять собой любое положение в такой группе, при условии, что группа является химически стабильной. Например, бутил включает 1-бутил и 2-бутил.
Некоторые соединения формулы I также могут существовать в их таутомерной форме. Такие формы, хотя они определенным образом не указаны в структурных формулах, раскрытых в настоящей заявке, предусматриваются для включения в объем настоящего изобретения.
Настоящее изобретение также включает любые изотопы атомов, присутствующих в соединениях по настоящему изобретению. Например, изотопы водорода включают тритий и дейтерий, а изотопы углерода включают C-13 и C-14.
В любом случае, когда выше или ниже в настоящей заявке используются термины "соединения формулы I", "представленные соединения", "соединения по настоящему изобретению" или любые эквивалентные термины, предполагается, что они включают соединения общей формулы I, а также их соли, сольваты и стереоизомеры. Подобным образом, термины "подгруппы соединений формулы I", "подгруппы представленных соединений", "подгруппы соединений по настоящему изобретению" или любые эквивалентные термины включают подгруппы соединений общей формулы I, а также их соли, сольваты и стереоизомеры.
Когда какая-либо переменная неоднократно встречается в какой-либо группе, каждое ее определение является независимым. Любые ограниченные определения радикалов, представленные в настоящей заявке, применимы к группе соединений формулы I, а также к любой подгруппе, определенной или указанной в настоящей заявке. Например, когда K представляет собой -(CHR6)n-, и p равно 5, тогда каждая из 5 присутствующих переменных R6 определена независимо, и это значит, что, в качестве примера, следующие группы охватываются определением K: -CH2-CH2-CH(CH3)-CH2-CH2- или -CH(CH3)-CH2-CH2-CH2-CH2- или подобные.
Представляющие интерес подгруппы соединений формулы I представляют собой такие соединения формулы I, к которым применимо одно или несколько из следующих ограничений:
- R1 представляет собой F;
- R2 представляет собой H или F;
- R2 представляет собой H;
- R3 представляет собой C1-4алкил или циклопропил;
- R3 представляет собой этил, изопропил или циклопропил;
- R3 представляет собой этил или изопропил;
- R4 представляет собой метил;
- R4 представляет собой метил, и стереоконфигурация, в которой углерод, к которому присоединена метильная группа, представляет собой (S);
J представляет собой ---N(R5)-SO2-,
J представляет собой ---N(R5)-SO2- или
K представляет собой -(CHR6)p-, где p равно 3, 4, 5 или 6 и каждый R6 независимо представляет собой H или CH3;
K представляет собой -(CHR6)p-, где p равно 3, 4, 5 или 6 и каждый R6 представляет собой H;
K представляет собой -(CHR6)p-, где p равно 4 или 5 и каждый R6 представляет собой H;
- K представляет собой *-(CH2)q-CH=CH-CH2-, где q равно 2 или 3;
- L представляет собой -O- или -O-CH2-,
- R5 представляет собой C1-4алкил или C3-5циклоалкил,
- R5 представляет собой метил, этил или циклопропил,
- R5 представляет собой метил,
- связывающая цепь -JKL-, т.е. атомы, образующие связь между фенильным кольцом и пиридазиноновым кольцом формулы I, представляет собой цепь длиной 8-11 атомов.
Фармацевтически приемлемые солевые формы, которые могут образовывать соединения по настоящему изобретению, легко можно получить с использованием подходящих кислот или оснований.
Соединения формулы I, содержащие основную функциональную группу, могут образовывать фармацевтически приемлемые кислотно-аддитивные соли с подходящими кислотами, такими как неорганические кислоты, например, галогенводородные кислоты (например, хлористоводородная или бромистоводородная кислота), серная, гемисерная, азотная, фосфорная и подобные; или органические кислоты, такие как метансульфоновая, этансульфоновая, бензолсульфоновая, п-толуолсульфоновая и подобные. И наоборот, указанные кислотно-аддитивные солевые формы можно преобразовать в форму свободного основания путем обработки подходящим основанием.
Соединения формулы I, содержащие кислотные протоны, можно преобразовать в их фармацевтически приемлемые формы солей присоединения металла или амина путем обработки подходящими органическими и неорганическими основаниями. Подходящие основные солевые формы включают, например, соли аммония, соли щелочных и щелочноземельных металлов, например, соли лития, натрия, калия, магния, кальция и подобные, соли с органическими основаниями, например, первичными, вторичными и третичными алифатическими и ароматическими аминами, такие как соли метиламина, этиламина, пропиламина, изопропиламина, четырех бутиламиновых изомеров, диметиламина, диэтиламина, диэтаноламина, дипропиламина, диизопропиламина, ди-н-бутиламина, пирролидина, пиперидина, морфолина, триметиламина, триэтиламина, трипропиламина, хинуклидина, пиридина, хинолина и изохинолина, бензатина, N-метил-D-глюкамина, 2-амино-2-(гидроксиметил)-1,3-пропандиола, гидрабамина, и соли с аминокислотами, такими как, например, аргинин, лизин и подобные. И наоборот, солевую форму можно преобразовать путем обработки кислотой в форму свободной кислоты.
Термин "сольват" охватывает любой фармацевтически приемлемый сольват, который могут образовывать соединения формулы I, а также любая фармацевтически приемлемая соль такого соединения. Такие сольваты представляют собой, например, гидраты, алкоголяты, например, этаноляты, пропаноляты и подобные.
Чистые стереоизомерные формы соединений и промежуточных соединений, указанных в настоящей заявке, определены как изомеры, по существу не содержащие другие энантиомерные или диастереомерные формы такой же основной молекулярной структуры указанных соединений или промежуточных соединений. В частности, термин "стереоизомерно чистый" относится к соединениям или промежуточным соединениям, имеющим стереоизомерный избыток по меньшей мере 80% (т.е. минимально 90% одного изомера и максимально 10% других возможных изомеров), вплоть до стереоизомерного избытка 100% (т.е. 100% одного изомера и отсутствие других), более конкретно, к соединениям или промежуточным соединениям, имеющим стереоизомерный избыток от 90% вплоть до 100%, еще более конкретно, имеющим стереоизомерный избыток от 94% вплоть до 100%, и наиболее точно, имеющим стереоизомерный избыток от 97% вплоть до 100%. Термины "энантиомерно чистый" и "диастереомерно чистый" следует рассматривать как аналогичные, обращая при этом внимание на энантиомерный избыток и диастереомерный избыток, соответственно, рассматриваемой смеси.
Чистые стереоизомерные формы или стереоизомеры соединений и промежуточных соединений по настоящему изобретению можно получить путем применения процедур, известных из уровня техники. Например, энантиомеры можно отделить друг от друга путем селективной кристаллизации их диастереомерных солей с использованием оптически активных кислот или оснований. Примеры включают винную кислоту, дибензоилвинную кислоту, дитолуоилвинную кислоту и камфорсульфоновую кислоту.
Альтернативно, энантиомеры можно разделить хроматографическими методами с использованием хиральных стационарных фаз. Указанные чистые стереохимически изомерные формы также можно получить из соответствующих чистых стереоизомерных форм подходящих исходных веществ, при условии, что реакция осуществляется стереоспецифически. Предпочтительно, когда желательно получение конкретного стереоизомера, указанное соединение синтезируют стереоспецифическими способами получения. В этих способах преимущественно используют энантиомерно чистые исходные вещества.
Диастереомерные рацематы соединений формулы I можно получить отдельно традиционными способами. Подходящие способы физического разделения, которые предпочтительны для использования, представляют собой, например, селективную кристаллизацию и хроматографию, например, колоночную хроматографию или сверхкритическую жидкостную хроматографию.
Соединения формулы I или подгруппы таких соединений могут иметь несколько центров хиральности. Особый интерес представляет стереогенный центр пиперазинонового кольца по R4-замещенному атому углерода. Конфигурация в этом положении может быть (R) или (S), в частности, конфигурация в этом положении представляет собой (S) конфигурацию, как проиллюстрировано формулой I(S).
В случае, когда K в линкере -JKL- содержит двойную связь, тогда Z-конфигурация такой двойной связи представляет интерес.
Соединение в соответствии с настоящим изобретением, как правило, можно получить путем последовательного осуществления стадий, каждая из которых известна специалистам в данной области. В частности, соединения, раскрытые в настоящей патентной заявке, можно получить в соответствии с одним или несколькими из следующих способов получения. На следующих схемах, если не указано иное, все используемые переменные такие, как определено для соединений формулы I.
Макроциклы общей формулы I по настоящему изобретению можно получить посредством реакции циклизации, включающей «предшественник с разомкнутым циклом» общей формулы IIa, IIa' или IIa'', в котором гидроксильная функциональная группа пиррольного кольца в I защищена путем метилирования. Указанную макроциклизацию можно осуществить посредством образования амидной связи, эфирной связи или алкеновой связи, и ее, как правило, осуществляют в области линкера J-K-L, как проиллюстрировано на схеме 2a. Удаление метильной защитной группы в соединениях общей формулы III можно осуществить различными способами (схема 1). В первом варианте осуществления предшественник III обрабатывают хлоридом металла, таким как хлорид лития, в полярном апротонном растворителе, таком как диметилформамид (ДМФА). Это преобразование наиболее предпочтительно осуществляют при температуре в пределах от 90°C до 150°C. Во втором варианте осуществления макроцикл общей формулы III можно обработать йодидом натрия и тетрахлорсиланом в смеси растворителей, состоящей из полярного апротонного растворителя, такого как ацетонитрил или подобные, и ароматического неполярного растворителя, такого как толуол или подобные. Указанное преобразование предпочтительно осуществляют при температуре в пределах от 0°C до комнатной температуры. В третьем варианте осуществления предшественник III обрабатывают реагентом на основе бора, таким как трибромид бора (BBr3), в апротонном растворителе, таком как дихлорметан, при низкой температуре, такой как -78°C.
Схема 1
Макроциклы общей формулы IIIa, IIIa' и IIIa'' можно синтезировать по реакции макролактамизации, как показано на схеме 2a. Для этого преобразования требуется присутствие дегидратирующего реагента. Примерами таких традиционно используемых веществ являются HBTU (гексафторфосфат O-бензотриазол-N,N,N',N'-тетраметилурония), EDCI (1-этил-3-(3-диметиламинопропил)карбодиимид)(1-этил-3-(3-диметиламинопропил)карбодиимид), EDAC (гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида) или FDPP (пентафторфенил дифенилфосфинат). В конкретном варианте осуществления указанный дегидратирующий реагент представляет собой HBTU или FDPP. Реакцию обычно осуществляют путем медленного добавления предшественника с разомкнутым циклом общей формулы IIa, IIa' или IIa'' к смеси, содержащей указанный дегидратирующий агент и избыточное количество третичного амина, такого как диизопропилэтиламин. Полезный растворитель представляет собой апротонный растворитель или, более предпочтительно, полярный апротонный растворитель. Примеры апротонных растворителей включают CH2Cl2 (DCM), ДМФА, CH3CN, CHCl3 и т.п. Примеры полярных апротонных растворителей включают ДМФА, диметилацетамид (DMA), N-метилпирролидон (NMP) или диметилсульфоксид (ДМСО). В некоторых обстоятельствах предпочтительно использование гидроксибензотриазола (HOBT) или подобных соединений в качестве добавки в реакции сочетания. В предпочтительном варианте осуществления реакцию циклизации осуществляют при низкой концентрации предшественника с разомкнутым циклом, такой как в пределах 1-10 мМ.
Схема 2a
Макроциклы общей формулы IIIb можно синтезировать по реакции Мицунобу, как показано на схеме 2b. Это преобразование можно осуществить путем обработки дигидрокси-предшественника с разомкнутым циклом общей формулы IIb фосфином, таким как трифенилфосфин или трибутилфосфин, и диалкилазодикарбоксилатным реагентом, таким как диизопропилазодикарбоксилат (DIAD) или диэтилазодикарбоксилат (DEAD). Реакцию предпочтительно осуществляют в полярном апротонном растворителе, таком как тетрагидрофуран (ТГФ), или в неполярном растворителе, таком как толуол, и требуется температура реакции в пределах от -20°C до 50°C.
Схема 2b
Макроциклы общей формулы IIIc можно синтезировать по реакции макро-этерификации, как показано на схеме 2c. Это преобразование можно осуществить путем обработки предшественника с разомкнутым циклом IIc, содержащего гидроксиалкильный заместитель и бензилгалогенид, такой как хлорид, сильным неорганическим основанием, таким как KOtBu, в полярном апротонном растворителе, таком как DMA. Температура реакции находится в пределах от -10°C до 20°C, в частности, составляет около 0°C.
Схема 2c
Макроциклы общей формулы IIId, т.е. где K представляет собой C3-6алкенилен, можно синтезировать по реакции макроциклизации с олефиновым метатезисом (обменом олефинов), как показано на схеме 2d. Указанное преобразование осуществляют с использованием рутениевого катализатора, такого как катализатор Граббса первого поколения (например, 1,3-бис-(2,4,6-триметилфенил)-2-имидазолидинилиден)(дихлорфенилметилен)-(трициклогексилфосфин)рутений) или катализатор Ховейда-Граббса второго поколения (например, (1,3-бис-(2,4,6-триметилфенил)-2-имидазолидинилиден)дихлор(o-изопропоксифенилметилен)рутений). Предпочтительный растворитель представляет собой галогенированный растворитель, такой как дихлорметан, и температура реакции находится в пределах от 30°C до 90°C. Указанное преобразование может дать макроцикл общей формулы IIId в виде E-изомера или Z-изомера, или их смеси, которую можно разделить с использованием хроматографических методов, известных специалистам в данной области, таких как сверхкритическая CO2 хроматография. Исходное соединение IId получают, следуя реакционным путям, описанным для схемы 5b для введения аллилокси-замещенной фенильной группы, и реакционному пути, описанному для схем 7a-b и 8a для взаимодействия фторпиридазинона с подходящей группой A-(CH2)n-CH=CH2.
Схема 2d
Макроциклы, где K представляет собой C3-6алкинилен, можно получить способом, подобным процедуре получения макроциклов общей формулы IIId, но с использованием реакции макроциклизации с алкиновым метатезисом, известной из уровня техники.
Макроциклы можно подвергнуть дальнейшей дериватизации, как проиллюстрировано на схемах 3a и 3b. Например, на схеме 3a макроцикл общей формулы IIIa'' подвергают алкилированию путем обработки алкилгалогенидом R5-X, предпочтительно йодидом и/или первичным алкилом, таким как йодметан или йодэтан, и требуется присутствие сильного неорганического основания, такого как NaH. Преобразование предпочтительно осуществляют в полярном апротонном растворителе, таком как ТГФ, при температуре реакции в пределах от 0°C до 20°C.
Схема 3a
Альтернативно, макроцикл общей формулы IIIe может быть алкилирован с получением макроцикла IIIf путем обработки первичным алкилгалогенидом (схема 3b), предпочтительно йодидом, таким как йодметан, и требуется присутствие сильного литийамидного основания, такого как диизопропиламид лития (LDA) или гексаметилдисилазид лития (LiHMDS). Реакцию осуществляют в полярном апротонном растворителе, таком как ТГФ, при температуре в пределах от -78°C до 20°C.
Схема 3b
Макроциклические предшественники общей формулы IIa можно получить способами, проиллюстрированными на схемах 4a-4e.
Бензилирование трициклического амина IVa для получения структуры общей формулы IVc можно осуществить путем обработки сильным литийамидным основанием, таким как LiHMDS, в апротонном полярном растворителе, таком как ДМФА, при температуре в пределах от 0°C до 20°C, в частности, примерно при 10°C. Бензильная группа представлена формулой IVb, где X представляет собой галоген, такой как бром или хлор.
Схема 4a
Введение сульфонамидосодержащего линкера (J представляет собой -N(R5)-SO2-) можно осуществить, исходя из IVc, как проиллюстрировано на схеме 4b. Сначала аминогруппу преобразуют во фтор по реакции Сандмейера, которую осуществляют путем обработки соединения IVc нуклеофильным фторидным реагентом, таким как фтористый водород, в пиридине в присутствии агента диазотирования, такого как нитрит натрия, при температуре в пределах от 0°C до 20°C, с получением фторсодержащего соединения IVd. Затем фторсодержащий предшественник IVd обрабатывают сульфонамидосодержащим линкером, имеющим формулу LI, в присутствии неорганического основания, такого как карбонат цезия, в полярном органическом растворителе, таком как ДМСО, при температуре в пределах от 50°C до 100°C, с получением защищенного макроциклического предшественника общей формулы IVe. Затем осуществляют удаление защитных групп линкерного предшественника. Группу сложного эфира карбоновой кислоты в IVe гидролизуют. Это можно осуществить с использованием гидроксида металла (M-OH), такого как гидроксид калия, гидроксид натрия или гидроксид лития. Реакцию осуществляют в водной среде, и наиболее предпочтительно ее осуществляют в присутствии по меньшей мере одного смешиваемого с водой органического сорастворителя, такого как метанол, этанол или ТГФ. Удаление Boc-защитной группы амина можно осуществить путем обработки полученной Boc-карбоновой кислоты раствором, содержащим трифторуксусную кислоту, необязательно в присутствии триизопропилсилана, в апротонном растворителе, таком как дихлорметан, с получением макроциклического предшественника общей формулы IIa-1. В предпочтительном варианте осуществления удаление защитной Boc-группы осуществляют при температуре в пределах от 0°C до комнатной температуры. Альтернативно, указанное удаление защиты можно осуществить путем обработки Boc-карбоновой кислоты раствором хлористоводородной кислоты в полярном апротонном растворителе, таком как диоксан, в частности, 4 н. раствором HCl в диоксане.
Схема 4b
Введение аминосодержащего линкера (J представляет собой -N(R5)-) можно осуществить путем восстановительного аминирования исходя из IVc, как проиллюстрировано на схеме 4c. Сначала получают промежуточный имин путем обработки амина IVc альдегидом L2 в протонном органическом растворителе, таком как 2-пропанол, в присутствии кислоты, такой как карбоновая кислота, например, уксусная кислота. Эта реакция требует повышенной температуры, такой как в пределах от примерно 60°C до примерно 90°C. Вторую стадию восстановительного аминирования проводят при более низкой температуре, такой как 0°C, и требуется восстановитель, такой как боргидрид натрия, и протонный органический растворитель, такой как метанол. Защитная группа в L2 может представлять собой кислотно-лабильную бензильную функциональную группу, такую как 2,4-диметоксибензил.
Схема 4c
Амин в IVf-1 может быть алкилирован с получением третичного амина общей формулы IVf-2 (R5 представляет собой C1-4алкил или циклопентил), как показано на схеме 4d. Амин IVf-1 обрабатывают сильным основанием, таким как NaH, в полярном апротонном растворителе, таком как ТГФ, при температуре в пределах от -10°C до 5°C. Алкилйодид формулы R5-I затем используют для взаимодействия с анионом.
Схема 4d
Процедура удаления защиты, подобная той, которая описана для схемы 4b выше, но исходя из соединения общей формулы IVf-3, обеспечивает получение аминокислотного макроциклического предшественника общей формулы IIa-2, и это проиллюстрировано на схеме 4e.
Схема 4е
Макроциклические предшественники общей формулы IIa' можно получить способами, проиллюстрированными на схемах 5a-5d, как показано для получения соединения IIa-1' (соединения формулы IIa', где L представляет собой -O-). Трициклический амин IVa преобразуют в соответствующее фторсодержащее соединение Va (схема 5a) в соответствии с процедурами, подобными описанным выше (схема 4a).
Схема 5a
Пиридазиноновую группу в Va можно бензилировать, следуя 2 альтернативным протоколам (схема 5b). В первом варианте осуществления это бензилирование осуществляют по реакции Мицунобу, подобной той, которая описана в настоящей заявке выше (схема 2b), с использованием защищенного бензилового спирта A1. Во втором варианте осуществления бензилирование осуществляют аналогично тому, как описано в настоящей заявке выше для схемы 4a, используя защищенный бензилгалогенид A2.
Схема 5b
Пиперазинильную группу (для соединений формулы I, где J представляет собой ) вводят путем обработки фторпиридазинона Vb пиперазином в полярном апротонном растворителе, таком как NMP, при температуре в пределах от 110°C до 130°C. В этих реакционных условиях осуществляют деметилирование метоксигруппы в пиррольном кольце с получением соответствующего гидроксила в полученном соединении общей формулы Vc. Пиперазинил защищают Boc-группой путем обработки с помощью Boc2O в протонном растворителе, таком как метанол, при температуре в пределах от 0°C до 20°C, с получением соединения формулы Vd. Гидроксил снова защищают путем обработки йодметаном в присутствии неорганического основания, такого как карбонат калия, в полярном апротонном растворителе, таком как ДМФА, при температуре в пределах от 0°C до 20°C, с получением соединения формулы Ve.
Схема 5c
Удаление защитной пара-метоксибензильной (PMB) группы осуществляют путем обработки сильной кислотой, такой как HCl, в апротонном растворителе, таком как 1,4-диоксан, или трифторуксусной кислотой (ТФУК), необязательно в присутствии галогенированного сорастворителя, такого как DCM, при температуре в пределах от 0°C до 20°C, с получением соединения формулы Vf. Как следствие, происходит одновременное удаление защитной группы Boc, и необходима повторная защита пиперазина с использованием BoC2O аналогично тому, как описано в настоящей заявке выше, для получения соединения формулы Vg. Введение углеродного линкера (-K-) осуществляют путем обработки галогенированным алканоатом L4 в присутствии неорганического основания, такого как карбонат калия, в полярном апротонном растворителе, таком как ДМФА, при температуре в пределах от 0°C до 20°C, с получением соединения формулы Vh. Процедура удаления защиты, аналогичная той, которая описана для схемы 4b, исходя из соединения общей формулы Vh, приводит к получению аминокислотного макроциклического предшественника общей формулы IIa-1', как показано на схеме 5d.
Схема 5d
Макроциклические предшественники общей формулы IIa'' можно получить способами, проиллюстрированными на схеме 6, как показано для получения соединения IIa-1'' (соединение IIa'', где L представляет собой -O-). Первая стадия включает реакцию Мицунобу, как показано на схеме 6, которую осуществляют аналогично реакции, описанной для схемы 2b, с использованием соединения общей формулы VIa и бензилового спирта A3 с фосфином, таким как трифенилфосфин или трибутилфосфин, и диалкилазодикарбоксилатного реагента, такого как диизопропилазодикарбоксилат (DIAD) или диэтилазодикарбоксилат (DEAD). Реакцию предпочтительно проводят в полярном апротонном растворителе, таком как ТГФ, или неполярном растворителе, так как толуол, и требуется температура реакции в пределах от -5°C до 20°C, с получением соединения формулы VIb. Последовательное осуществление процедур удаления защиты, аналогично тому, как описано для схемы 4b, исходя из соединения общей формулы VIb, приводит к получению аминокислотного макроциклического предшественника общей формулы IIa-1''.
Схема 6
Макроциклические предшественники общей формулы IIb можно получить способами, проиллюстрированными на схемах 7a-7b, на примере синтеза соединений IIb-1 (соединение IIb, где J представляет собой -N(R5)-SO2-) и IIb-2 (соединение IIb, где J представляет собой ) соответственно. Как проиллюстрировано на схеме 7a, сульфонамидосодержащий линкер L3 вводят путем реакции нуклеофильного замещения фтортрициклического соединения Vb с L3, в которой спирт защищен в виде алканоата -C(=O)-R. Указанную реакцию проводят в полярном растворителе, таком как ДМСО, и требуется присутствие неорганического основания, такого как карбонат цезия. Реакцию наиболее предпочтительно проводят при температуре в пределах от 50°C до 80°C с получением соединения формулы VIIa. Удаление алканоатной защитной группы можно осуществить путем обработки основанием, таким как NaOH, LiOH, в протонном растворителе, таком как метанол или этанол, при комнатной температуре. Удаление PMB защитной группы можно осуществить путем обработки кислотой, такой как ТФУК, в галогенированном растворителе, таком как DCM, или HCl в полярном растворителе, таком как 1,4-диоксан, с получением макроциклического предшественника IIb-1.
Схема 7a
Синтез макроциклических предшественников общей формулы (IIb-2, схема 7b) начинается с нуклеофильного замещения атома фтора в соединении формулы Vb с использованием 1,1-диоксида 1,2,5-тиадиазолидина, с получением соединения формулы VIIIa, аналогично тому, как описано в н