Антисмысловые нуклеиновые кислоты
Иллюстрации
Показать всеГруппа изобретений относится к области биотехнологии, в частности к антисмысловым олигомерам, используемым в качестве активного ингредиента в фармацевтических композициях для лечения мышечной дистрофии. Антисмысловой олигомер состоит из нуклеотидной последовательности, 100% комплементарной нуклеотидной последовательности-мишени или нуклеотидной последовательности, в которой 1 или 2 нуклеотида, не комплементарные нуклеотидной последовательности-мишени, содержатся в нуклеотидной последовательности, 100% комплементарной нуклеотидной последовательности-мишени. Нуклеотидная последовательность-мишень представляет собой любую из последовательностей, состоящую из нуклеотидов с 32-го по 56-й или с 36-го по 56-й с 5′-конца 53-го экзона в гене дистрофина человека. При этом 53-й экзон в гене дистрофина человека обладает нуклеотидной последовательностью, выбранной из (a) и (b): (a) нуклеотидная последовательность SEQ ID NO: 1 и (b) нуклеотидная последовательность, обладающая по меньшей мере 90% идентичностью с нуклеотидной последовательностью SEQ ID NO: 1. Данный олигомер эффективно обеспечивает вызов пропуска 53-го экзона в гене дистрофина человека. 2 н. и 11 з.п. ф-лы, 19 ил., 7 табл., 6 пр.
Реферат
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к антисмысловому олигомеру, который является причиной пропуска экзона 53 в гене дистрофина человека, и к фармацевтической композиции, включающей этот олигомер.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Мышечная дистрофия Дюшенна (DMD) является самой часто встречающейся формой наследственной прогрессирующей мышечной дистрофии, которая поражает одного на приблизительно 3500 новорожденных мальчиков. Хотя двигательные функции редко отличаются от таковых здоровых людей в раннем детском возрасте и в подростковом периоде, у детей в возрасте приблизительно 4-5 лет отмечается мышечная слабость. Затем мышечная слабость прогрессирует до утраты способности передвигаться к приблизительно 12-летнему возрасту и смерти вследствие сердечной или дыхательной недостаточности в возрасте от двадцати до двадцати девяти лет. DMD является таким серьезным нарушением. В настоящее время нет эффективной терапии для DMD, и разработка нового терапевтического средства была сильно желательной.
Известно, что причиной DMD является мутация в гене дистрофина. Ген дистрофина расположен на хромосоме Х и представляет собой огромный ген, состоящий из 2,2 миллионов пар нуклеотидов ДНК. ДНК транскрибируется в предшественники мРНК, и интроны удаляются в результате сплайсинга с синтезом мРНК, в которой 79 экзонов соединены вместе. Эта мРНК транслируется в 3685 аминокислот с образованием белка дистрофина. Белок дистрофин связывают с сохранением стабильности мембраны мышечных клеток и необходим для усиления мышечных клеток. Ген дистрофина у пациентов с DMD содержит мутацию, и поэтому белок дистрофин, являющийся функциональным в мышечных клетках, редко экспрессируется. Поэтому в теле пациентов с DMD структура мышечных клеток не сохраняется, что приводит к большому поступлению ионов кальция в мышечные клетки. В результате возникает ответная реакция, подобная воспалению, с активацией фиброза, так что мышечные клетки лишь с трудом могут регенерироваться.
Причиной мышечной дистрофии Беккера (BMD) также является мутация в гене дистрофина. Симптомы включают мышечную слабость, которая сопровождается атрофией мышц, но типично представляют собой слабовыраженную и медленную в развитии мышечную слабость по сравнению с DMD. Во многих случаях ее начало имеет место во взрослом состоянии. Различия в клинических симптомах между DMD и BMD, как полагают, основаны на том, нарушает или нет мутация рамку считывания для аминокислот при трансляции мРНК для дистрофина в белок дистрофин (непатентный документ 1). Конкретнее, в случае DMD присутствие мутации сдвигает рамку считывания для аминокислот, так что экспрессия функционального белка дистрофина аннулируется, тогда как в случае BMD белок дистрофин, который функционирует, хотя недостаточно, продуцируется, поскольку рамка считывания для аминокислот сохраняется, хотя часть экзонов делетирована в результате мутации.
Считают, что пропуск экзона будет служить в качестве способа лечения DMD. Этот способ включает модифицирование сплайсинга для восстановления рамки считывания для аминокислот в мРНК дистрофина и индукции экспрессии белка дистрофина, обладающего частично восстановленной функцией (непатентный документ 2). Часть аминокислотной последовательности, которая является мишенью в случае пропуска экзонов, будет утрачена. По этой причине белок дистрофин, экспрессируемый в результате этого лечения, становится короче нормального белка, но поскольку рамка считывания для аминокислот сохраняется, частично сохраняется функция стабилизации мышечных клеток. Поэтому считают, что пропуск экзона будет вести DMD к симптомам, схожим с таковыми BMD, которая является более слабовыраженной. Подход с использованием пропуска экзона прошел испытания на животных, используя мышей и собак, и в настоящее время оценивается в клинических испытаниях на являющихся людьми пациентах с DMD.
Пропуск экзона можно индуцировать посредством связывания антисмысловых нуклеиновых кислот, мишенью которых является или 5', или 3' сайт сплайсинга, или оба сайта, или сайты внутри экзона. Экзон будет включаться в мРНК, только когда оба сайта сплайсинга будут распознаваться комплексом сплайсомой. Таким образом, пропуск экзона можно индуцировать посредством таргетинга сайтов сплайсинга с использованием антисмысловых нуклеиновых кислот. Кроме того, связывание белка SR с экзонным энхансером сплайсинга (ESE), как полагают, необходимо для распознавания экзона механизмом сплайсинга. Соответственно, пропуск экзона можно также индуцировать с помощью таргетинга ESE.
Поскольку мутация гена дистрофина может отличаться в зависимости от пациентов с DMD, необходима разработка антисмысловых нуклеиновых кислот на основе сайта или типа соответствующей генетической мутации. Ранее антисмысловые нуклеиновые кислоты, которые индуцируют пропуск экзона, для всех 79 экзонов были созданы Steve Wilton и др., University of Western Australia (непатентный документ 3), а антисмысловые нуклеиновые кислоты, которые индуцируют пропуск экзона, для 39 экзонов были созданы Annemieke Aartsma-Rus. и др., Нидерланды (непатентный документ 4).
Считается, что лечение приблизительно 8% всех пациентов с DMD может осуществляться с помощью пропуска 53-го экзона (в дальнейшем называемого «экзоном 53»). На протяжении последних лет множество исследовательских организаций сообщили об исследованиях, в которых экзон 53 в гене дистрофина был таргетирован для пропуска экзона (патентные документы 1-4; непатентный документ 5). Однако метод пропуска экзона 53 с высокой эффективностью все еще не создан.
Патентный документ 1: публикация международной заявки WO 2006/000057
Патентный документ 2: публикация международной заявки WO 2004/048570
Патентный документ 3: US 2010/0168212
Патентный документ 4: публикация международной заявки WO 2010/048586
Непатентный документ 1: Monaco A.P. et al., Genomics 1988; 2: p. 90-95
Непатентный документ 2: Matsuo M., Brain Dev. 1996; 18: p. 167-172
Непатентный документ 3: Wilton S.D. et al., Molecular Therapy 2007: 15: p. 1288-1296
Непатентный документ 4: Annemieke Aartsma-Rus et al., (2002) Neuromuscular Disorders 12: S71-S77
Непатентный документ 5: Linda J. Popplewell et al., (2010) Neuromuscular Disorder, vol. 20, no 2, p. 102-110
ОПИСАНИЕ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
При вышеизложенных обстоятельствах были желательны антисмысловые олигонуклеотиды с сильной индукцией пропуска экзона 53 в гене дистрофина и терапевтические средства против мышечной дистрофии, включающие олигомеры.
В результате тщательных исследований структуры гена дистрофина авторы настоящего изобретения установили, что пропуск экзона 53 можно индуцировать с высокой эффективностью посредством таргетинга последовательности, состоящей из нуклеотидов с 32-го по 56-й с 5'-конца экзона 53 в предшественнике мРНК (в дальнейшем называемом «пре-МРНК»), в гене дистрофина, с помощью антисмысловых олигомеров. На основе этого открытия авторы настоящего изобретения осуществили настоящее изобретение.
Т.е. настоящим изобретением является следующее.
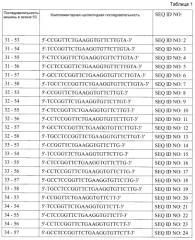
[1] Антисмысловой олигомер, который является причиной пропуска 53-го экзона в гене дистрофина человека, состоящий из нуклеотидной последовательности, комплементарной любой из последовательностей, состоящей из нуклеотидов с 31-го по 53-й; с 31-го по 54-й, с 31-го по 55-й; с 31-го по 56-й; с 31-го по 57-й; с 31-го по 58-й; с 32-го по 53-й; с 32-го по 54-й; с 32-го по 55-й; с 32-го по 56-й; с 32-го по 57-й; с 32-го по 58-й; с 33-го по 53-й; с 33-го по 54-й; с 33-го по 55-й; с 33-го по 56-й; с 33-го по 57-й; с 33-го по 58-й; с 34-го по 53-й; с 34-го по 54-й; с 34-го по 55-й; с 34-го по 56-й; с 34-го по 57-й; с 34-го по 58-й; с 35-го по 53-й; с 35-го по 54-й; с 35-го по 55-й; с 35-го по 56-й; с 35-го по 57-й; с 35-го по 58-й; с 36-го по 53-й; с 36-го по 54-й; с 36-го по 55-й; с 36-го по 56-й; с 36-го по 57-й или с 36-го по 58-й с 5'-конца 53-го экзона в гене дистрофина человека.
[2] Антисмысловой олигомер в соответствии с [1] выше, который представляет собой олигонуклеотид.
[3] Антисмысловой олигомер в соответствии с [2] выше, в случае которого сахарная составляющая и/или область соединения через фосфатную группу по крайней мере одного нуклеотида, составляющего олигонуклеотид, является модифицированной.
[4] Антисмысловой олигомер в соответствии с [3] выше, в случае которого сахарной составляющей по крайней мере одного нуклеотида, составляющего олигонуклеотид, является рибоза, в которой группа 2'-ОН заменена любой группой, выбираемой из группы, состоящей из OR, R, R'OR, SH, SR, NH2, NHR, NR2, N3, CN, F, Cl, Br и I (где R представляет собой алкил или арил, а R' представляет собой алкилен).
[5] Антисмысловой олигомер в соответствии с [3] или [4] выше, в случае которого областью соединения через фосфатную группу по крайней мере одного нуклеотида, составляющего олигонуклеотид, является любая область, выбираемая из группы, состоящей из фосфоротиоатной связи, фосфородитиоатной связи, алкилфосфонатной связи, фосфорамидатной связи и боранофосфатной связи.
[6] Антисмысловой олигомер в соответствии с [1] выше, который представляет собой морфолино олигомер.
[7] Антисмысловой олигомер в соответствии с [6] выше, который представляет собой морфолино-фосфородиамидатный олигомер.
[8] Антисмысловой олигомер в соответствии с любым из [1]-[7] выше, в случае которого 5'-концом является любая из групп с химическими формулами [1]-[3] ниже:
[9] Антисмысловой олигомер в соответствии с любым из [1]-[8] выше, состоящий из нуклеотидной последовательности, комплементарной последовательности, состоящей из нуклеотидов с 32-го по 56-й или с 36-го по 56-й с 5'-конца 53-го экзона в гене дистрофина человека.
[10] Антисмысловой олигомер в соответствии с любым из [1]-[8] выше, состоящий из нуклеотидной последовательности, представленной любой последовательностью, выбираемой из группы, состоящей из SEQ ID NO: 2-37.
[11] Антисмысловой олигомер в соответствии с любым из [1]-[8] выше, состоящий из нуклеотидной последовательности, представленной любой последовательностью, выбираемой из группы, состоящей из SEQ ID NO: 11, 17, 23, 29 и 35.
[12] Антисмысловой олигомер в соответствии с любым из [1]-[8] выше, состоящий из нуклеотидной последовательности, представленной SEQ ID NO: 11 или 35.
[13] Фармацевтическая композиция для лечения мышечной дистрофии, включающая в качестве активного ингредиента антисмысловой олигомер в соответствии с любым из [1]-[12] выше, или его фармацевтически приемлемую соль или гидрат.
Антисмысловой олигомер настоящего изобретения может индуцировать пропуск 53 в гене дистрофина человека с высокой эффективностью. Кроме того, симптомы мышечной дистрофии Дюшенна можно эффективно облегчить посредством введения фармацевтической композиции настоящего изобретения.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг. 1 демонстрируется эффективность пропуска экзона 53 в гене дистрофина человека в линии клеток рабдомиосаркомы (клеток RD) человека.
На фиг. 2 демонстрируется эффективность пропуска экзона 53 в гене дистрофина человека в клетках в случае, когда ген myoD человека вводят в происходящие из нормальных тканей человека фибробласты (клетки TIG-119) для индукции дифференциации в мышечные клетки.
На фиг. 3 демонстрируется эффективность пропуска экзона 53 в гене дистрофина человека в клетках в случае, когда ген myoD человека вводят в происходящие от являющегося человеком пациента с DMD фибробласты (клетки 5017) для индукции дифференциации в мышечные клетки.
На фиг. 4 демонстрируется эффективность пропуска экзона 53 в гене дистрофина человека в клетках в случае, когда ген myoD человека вводят в фибробласты от являющегося человеком пациента с DMD (с делецией экзонов 45-52) для индукции дифференциации в мышечные клетки.
На фиг. 5 демонстрируется эффективность пропуска экзона 53 в гене дистрофина человека в клетках в случае, когда ген myoD человека вводят в фибробласты от являющегося человеком пациента с DMD (с делецией экзонов 48-52) для индукции дифференциации в мышечные клетки.
На фиг. 6 демонстрируется эффективность пропуска экзона 53 в гене дистрофина человека в клетках в случае, когда ген myoD человека вводят в фибробласты от являющегося человеком пациента с DMD (с делецией экзонов 48-52) для индукции дифференциации в мышечные клетки.
На фиг. 7 демонстрируется эффективность пропуска экзона 53 в гене дистрофина человека в клетках в случае, когда ген myoD человека вводят в фибробласты от являющегося человеком пациента с DMD (с делецией экзонов 45-52 или делецией экзонов 48-52) для индукции дифференциации в мышечные клетки.
На фиг. 8 демонстрируется эффективность пропуска экзона 53 в гене дистрофина человека в клетках в случае, когда ген myoD человека вводят в фибробласты от являющегося человеком пациента с DMD (с делецией экзонов 45-52) для индукции дифференциации в мышечные клетки.
На фиг. 9 демонстрируется эффективность пропуска экзона 53 (2'-OMe-S-РНК) в гене дистрофина человека в клетках рабдомиосаркомы (клетках RD) человека.
На фиг. 10 демонстрируется эффективность пропуска экзона 53 (2'-OMe-S-РНК) в гене дистрофина человека в клетках рабдомиосаркомы (клетках RD) человека.
На фиг. 11 демонстрируется эффективность пропуска экзона 53 (2'-OMe-S-РНК) в гене дистрофина человека в клетках рабдомиосаркомы (клетках RD) человека.
На фиг. 12 демонстрируется эффективность пропуска экзона 53 (2'-OMe-S-РНК) в гене дистрофина человека в клетках рабдомиосаркомы (клетках RD) человека.
На фиг. 13 демонстрируется эффективность пропуска экзона 53 (2'-OMe-S-РНК) в гене дистрофина человека в клетках рабдомиосаркомы (клетках RD) человека.
На фиг. 14 демонстрируется эффективность пропуска экзона 53 (2'-OMe-S-РНК) в гене дистрофина человека в клетках рабдомиосаркомы (клетках RD) человека.
На фиг. 15 демонстрируется эффективность пропуска экзона 53 (2'-OMe-S-РНК) в гене дистрофина человека в клетках рабдомиосаркомы (клетках RD) человека.
На фиг. 16 демонстрируется эффективность пропуска экзона 53 (2'-OMe-S-РНК) в гене дистрофина человека в клетках рабдомиосаркомы (клетках RD) человека.
На фиг. 17 демонстрируется эффективность пропуска экзона 53 (2'-OMe-S-РНК) в гене дистрофина человека в клетках рабдомиосаркомы (клетках RD) человека.
На фиг. 18 демонстрируется эффективность пропуска экзона 53 в гене дистрофина человека в клетках рабдомиосаркомы (клетках RD) человека при соответствующих концентрациях олигомеров.
На фиг. 19 демонстрируется эффективность пропуска экзона 53 в гене дистрофина человека в клетках рабдомиосаркомы (клетках RD) человека при соответствующих концентрациях олигомеров.
ЛУЧШИЙ ВАРИАНТ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Ниже настоящее изобретение описывается подробно. Описываемые ниже варианты осуществления, как предполагается, представлены только в качестве примера для описания настоящего изобретения, а не ограничения лишь следующими вариантами осуществления. Настоящее изобретение может быть осуществлено различными способами без отступа от сущности настоящего изобретения.
Все публикации, опубликованные заявки на патенты, патенты и другие патентные документы, приведенные в описании настоящего изобретения, включены сюда посредством ссылки в их полном объеме. Описание настоящего изобретения, таким образом, включает посредством ссылки содержание описания изобретения и чертежей в заявке на патент Японии (№ 2010-196032), поданной 1 сентября 2011, на основании которой испрашивается приоритет.
1. Антисмысловой олигомер
Настоящим изобретением обеспечивается антисмысловой олигомер (в дальнейшем называемый «олигомером» настоящего изобретения»), который является причиной пропуска 53-го экзона в гене дистрофина человека, состоящий из нуклеотидной последовательности, комплементарной любой из последовательностей (в дальнейшем также называемых «последовательностями-мишенями»), состоящей из нуклеотидов с 31-го по 53-й; с 31-го по 54-й, с 31-го по 55-й; с 31-го по 56-й; с 31-го по 57-й; с 31-го по 58-й; с 32-го по 53-й; с 32-го по 54-й; с 32-го по 55-й; с 32-го по 56-й; с 32-го по 57-й; с 32-го по 58-й; с 33-го по 53-й; с 33-го по 54-й; с 33-го по 55-й; с 33-го по 56-й; с 33-го по 57-й; с 33-го по 58-й; с 34-го по 53-й; с 34-го по 54-й; с 34-го по 55-й; с 34-го по 56-й; с 34-го по 57-й; с 34-го по 58-й; с 35-го по 53-й; с 35-го по 54-й; с 35-го по 55-й; с 35-го по 56-й; с 35-го по 57-й; с 35-го по 58-й; с 36-го по 53-й; с 36-го по 54-й; с 36-го по 55-й; с 36-го по 56-й; с 36-го по 57-й или с 36-го по 58-й с 5'-конца 53-го экзона в гене дистрофина человека.
Экзон 53 в гене дистрофина человека
В настоящем изобретении термин «ген», как предполагается, означает ген в геноме, а также включает кДНК, предшественник мРНК и мРНК. Предпочтительно геном является предшественником мРНК, т.е. пре-мРНК.
В геноме человека ген дистрофина человека располагается в локусе Xp21.2. Ген дистрофина человека имеет размер, равный 3,0×106 п.о. и является самым большим геном среди известных генов человека. Однако кодирующие области гена дистрофина человека, рассредоточенные в виде 79 экзонов на всем протяжении гена дистрофина человека, составляют лишь 14 т.п.о. (Roberts, RG. et al., Genomics, 16: 536-538 (1993)). Пре-мРНК, которая является транскриптом гена дистрофина человека, подвергается сплайсингу с образованием зрелой мРНК размером 14 т.о. Нуклеотидная последовательность гена дистрофина человека дикого типа известна (№ доступа в GenBank - NM_004006).
Нуклеотидная последовательность экзона 53 в гене дистрофина человека дикого типа представлена SEQ ID NO: 1.
Олигомер настоящего изобретения предназначен для вызова пропуска экзона 53 в гене дистрофина человека, с модифицированием тем самым белка, кодируемого геном дистрофина типа DMD, в белок дистрофина типа BMD. Соответственно, экзон 53 в гене дистрофина, который является мишенью пропуска экзона с помощью олигомера настоящего изобретения, включает как дикий тип, так и мутантные типы.
В частности, мутанты экзона 53 гена дистрофина человека включают полинуклеотиды, определенные в (а) или (b) ниже.
(а) Полинуклеотид, который гибридизуется в жестких условиях с полинуклеотидом, состоящим из нуклеотидной последовательности, комплементарной нуклеотидной последовательности SEQ ID NO: 1; и
(b) Полинуклеотид, состоящий из нуклеотидной последовательности, идентичной на по крайней мере 90% нуклеотидной последовательности SEQ ID NO: 1.
Используемый здесь термин «полинуклеотид», как предполагается, означает ДНК или РНК.
Как здесь используется, «полинуклеотид, который гибридизуется в жестких условиях», относится, например, к полинуклеотиду, получаемому при гибридизации колоний, гибридизации бляшек, гибридизации по Саузерну или т.п., используя в качестве зонда весь полинуклеотид, состоящий из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, например, SEQ ID NO: 1, или его часть. Метод гибридизации, который может использоваться, включает методы, описанные, например, в “Sambrook & Russell, Molecular Cloning: A Laboratory Manual Vol. 3, Cold Spring Harbor, Laboratory Press 2001”, “Ausubel, Current Protocols in Molecular Biology, John Wiley & Sons 1987-1997” и т.д.
Используемый здесь термин «комплементарная нуклеотидная последовательность» не ограничивается только нуклеотидными последовательностями, которые образуют пары Уотсона-Крика с нуклеотидными последовательностями-мишенями, но, как предполагается, также включает нуклеотидные последовательности, которые образуют пары оснований неоднозначного соответствия. Используемый здесь термин «пара Уотсона-Крика» относится к паре нуклеиновых оснований, в которой водородные связи образуются между аденином и тимином, аденином и урацилом или гуанином и цитозином, а термин «пара оснований неоднозначного соответствия» относится к паре нуклеиновых оснований, в которой водородные связи образуются между гуанином и урацилом, инозином и урацилом, инозином и аденином или инозином и цитозином. Используемый здесь термин «комплементарная нуклеотидная последовательность» не только относится к нуклеотидной последовательности, комплементарной на 100% нуклеотидной последовательности-мишени, но также относится к комплементарной нуклеотидной последовательности, которая может содержать, например, 1-3, 1 или 2 или один нуклеотид, не комплементарный нуклеотидной последовательности-мишени.
Как здесь используются, «жесткие условия» могут быть любыми из условий «низкой жесткости», условий «средней жесткости» и чрезмерно жестких условий. Условиями «низкой жесткости» являются, например, 5х SSC, 5x раствор Денхардта, 0,5% SDS, 50% формамида при 32°С. Условиями «средней жесткости» являются, например, 5х SSC, 5x раствор Денхардта, 0,5% SDS, 50% формамида при 42οС или 5х SSC, 1% SDS, 50 мМ Трис-HCl (pH 7,5), 50% формамида при 42°С. Чрезмерно жесткими условиями являются, например, 5х SSC, 5x раствор Денхардта, 0,5% SDS, 50% формамида при 50°С или 0,2х SSC, 1% SDS при 65°С. В этих условиях ожидается, что полинуклеотиды с большей гомологией будут с успехом получены при более высоких температурах, хотя в жесткость гибридизации вовлечены разнообразные факторы, включающие температуру, концентрацию зонда, длину зонда, ионную силу, время, концентрацию соли и другие, и квалифицированные в данной области техники специалисты могут соответственно выбрать эти факторы для достижения соответствующей жесткости.
В случае использования для гибридизации имеющихся в продаже наборов может использоваться, например, Alkphos Direct Labeling and Detection System (GE Healthcare). В этом случае в соответствии с приложенным протоколом после культивирования с меченым зондом в течение ночи мембрану отмывают основным буфером для отмывки, содержащим 0,1% (в отношении веса к объему) SDS при 55°С с выявлением тем самым гибридизованных полинуклеотидов. Альтернативно, в случае создания зонда на основе всей нуклеотидной последовательности, комплементарной нуклеотидной последовательности SEQ ID NO: 1, или ее части гибридизацию можно выявить с помощью набора DIG Nucleic Acid Detection Kit (Roche Diagnostics), когда зонд метят дигоксигенином (DIG), используя имеющийся в продаже реагент (например, PCR Labeling Mix (Roche Diagnostics), и т.д.).
Помимо полинуклеотидов, описанных выше, другие полинуклеотиды, которые могут гибридизоваться, включают полинуклеотиды, идентичные на 90% или более, 91% или более, 92% или более, 93% или более, 94% или более, 95% или более, 96% или более, 97% или более, 98% или более, 99% или более, 99,1% или более, 99,2% или более, 99,3% или более, 99,4% или более, 99,5% или более, 99,6% или более, 99,7% или более, 99,8% или более, или 99,9% или более полинуклеотиду SEQ ID NO: 1, в соответствии с расчетом с использованием программ для поиска гомологии BLAST, используя параметры по умолчанию.
Идентичность между нуклеотидными последовательностями можно определить, используя алгоритм BLAST (средство поиска основного локального совмещения) Karlin и Altschul (Proc. Natl. Acad. Sci. USA 872264-2268, 1990; Proc. Natl. Acad. Sci. USA 90: 5873, 1993). Были разработаны программы, названные BLASTN и BLASTX, на основе алгоритма BLAST (Altschul SF et al., J. Mol. Biol. 215: 403, 1990). В случае установления нуклеотидной последовательности, используя BLASTX, параметрами являются, например, оценка = 100 и длина слова = 12. В случае использования программ BLAST и BLAST с использованием пропусков используются параметры по умолчанию для каждой программы.
Примеры нуклеотидных последовательностей, комплементарных последовательностям, состоящим из нуклеотидов с 31-го по 53-й; с 31-го по 54-й, с 31-го по 55-й; с 31-го по 56-й; с 31-го по 57-й; с 31-го по 58-й; с 32-го по 53-й; с 32-го по 54-й; с 32-го по 55-й; с 32-го по 56-й; с 32-го по 57-й; с 32-го по 58-й; с 33-го по 53-й; с 33-го по 54-й; с 33-го по 55-й; с 33-го по 56-й; с 33-го по 57-й; с 33-го по 58-й; с 34-го по 53-й; с 34-го по 54-й; с 34-го по 55-й; с 34-го по 56-й; с 34-го по 57-й; с 34-го по 58-й; с 35-го по 53-й; с 35-го по 54-й; с 35-го по 55-й; с 35-го по 56-й; с 35-го по 57-й; с 35-го по 58-й; с 36-го по 53-й; с 36-го по 54-й; с 36-го по 55-й; с 36-го по 56-й; с 36-го по 57-й или с 36-го по 58-й с 5'-конца экзона 53.
Предпочтительно, когда олигомер настоящего изобретения состоит из нуклеотидной последовательности, комплементарной любой из последовательностей, состоящей из нуклеотидов с 32-го по 56-й, с 33-го по 56-й, с 34-го по 56-й, с 35-го по 56-й или с 36-го по 56-й (например, SEQ ID NO: 11, SEQ ID NO: 17, SEQ ID NO: 23, SEQ ID NO: 29 или SEQ ID NO: 35) с 5'-конца 53-го экзона в гене дистрофина человека.
Предпочтительно олигомер настоящего изобретения состоит из нуклеотидной последовательности, комплементарной любой из последовательностей, состоящей из нуклеотидов с 32-го по 56-й или с 36-го по 56-й (например, SEQ ID NO: 11 или SEQ ID NO: 35) с 5'-конца 53-го экзона в гене дистрофина человека.
Термин «является причиной пропуска 53-го экзона в гене дистрофина человека», как предполагается, означает, что в результате связывания олигомера настоящего изобретения с сайтом, соответствующим экзону 53 транскрипта (например, пре-мРНК) с гена дистрофина человека, например, нуклеотидная последовательность, соответствующая 5'-концу экзона 54, соединяется с 3'-края нуклеотидной последовательности, соответствующей 3'-концу экзона 51, у пациентов с DMD с делецией экзона 52, когда транскрипт подвергается сплайсингу, что приводит тем самым к образованию зрелой мРНК, в которой нет сдвига рамки считывания.
Соответственно, не требуется, чтобы олигомер настоящего изобретения имел нуклеотидную последовательность, комплементарную на 100% последовательности-мишени, когда речь идет об олигомере, который вызывает пропуск экзона 53 в гене дистрофина человека. Олигомер настоящего изобретения может включать, например, 1-3, 1 или 2 или один нуклеотид, не комплементарный последовательности-мишени.
Здесь «связывание», описанное выше, как предполагается, означает, что когда олигомер настоящего изобретения смешивают с транкриптом с гена дистрофина человека, оба гибридизуются в физиологических условиях с образованием двухцепочечной нуклеиновой кислоты. Термин «в физиологических условиях» относится к условиям, заданным для воспроизводства in vivo окружения по показателю рН, состава солей и температуры. Условиями являются, например, 25-40°С, предпочтительно 37°С, рН 5-8, предпочтительно рН 7,4 и 150 мМ концентрация хлорида натрия.
Вызывается или нет пропуск экзона 53 в гене дистрофина человека, можно подтвердить посредством введения олигомера настоящего изобретения в клетку, экспрессирующую дистрофин, (например, клетки рабдомиосаркомы), амплифицирования района, окружающего экзон 53 мРНК с гена дистрофина человека, на основе тотальной РНК из клетки, экспрессирующей дистрофин, с помощью ОТ-ПЦР и выполнения «вложенной» ПЦР или анализа последовательности на амплифицированном с помощью ПЦР продукте.
Эффективность пропуска можно определить следующим образом. мРНК гена дистрофина человека выделяют из исследуемых клеток; в мРНК измеряют уровень «А» полинуклеотидной полосы в случае, когда экзон 53 пропущен, и уровень «В» полинуклеотидной полосы в случае, когда экзон 53 не пропущен. Используя эти величины измерений «А» и «В», эффективность рассчитывают согласно следующему уравнению:
Эффективность пропуска (%) = A/(A+B)×100
Олигомер настоящего изобретения включает, например, олигонуклеотид, морфолино олигомер или пептидо-нуклеиновую кислоту (ПНК), имеющий длину от 18 до 28 нуклеотидов. Предпочтительно длина составляет от 21 до 25 нуклеотидов, и предпочтительными являются морфолино олигомеры.
Описанный выше олигонуклеотид (в дальнейшем называемый «олигонуклеотидом настоящего изобретения») представляет собой олигомер настоящего изобретения, состоящий из нуклеотидов в качестве составных единиц. Такие нуклеотиды могут быть любыми из рибонуклеотидов, дезоксирибонуклеотидов и модифицированных нуклеотидов.
Модифицированный нуклеотид относится к нуклеотиду, имеющему полностью и частично модифицированные нуклеиновые основания, сахарные составляющие и/или области соединения через фосфатную группу, который является рибонуклеотидом или дезоксирибонуклеотидом.
Нуклеиновые основания включают, например, аденин, гуанин, гипоксантин, цитозин, тимин, урацил и их модифицированные основания. Примеры таких модифицированных нуклеиновых оснований включают, но без ограничения, псевдоурацил, 3-метилурацил, дигидроурацил, 5-алкилцитозины (например, 5-метилцитозин), 5-алкилурацилы (например, 5-этилурацил), 5-галогенурацилы (5-бромурацил), 6-азапиримидин, 6-алкилпиримидины (6-метилурацил), 2-тиоурацил, 4-тиоурацил, 4-ацетилцитозин, 5-(карбоксигидроксиметил)урацил, 5'-карбоксиметиламинометил-2-тиоурацил, 5'-карбоксиметиламинометилурацил, 1-метиладенин, 1-метилгипоксантин, 2,2-диметилгуанин, 3-метилцитозин, 2-метиладенин, 2-метилгуанин, N6-метиладенин, 7-метилгуанин, 5-метоксиаминометил-2-тиоурацил, 5-метиламинометилурацил, 5-метилкарбонилметилурацил, 5-метилоксиурацил, 5-метил-2-тиоурацил, 2-метилтио-N6-изопентениладенин, урацил-5-оксиуксусную кислоту, 2-тиоцитозин, пурин, 2,6-диаминопурин, 2-аминопурин, изогуанин, индол, имидазол, ксантин и т.д.
Модификация сахарной составляющей может включать, например, модификации в 2'-положении рибозы и модификации других положений сахара. Модификация в 2'-положении рибозы включает замену 2'-ОН рибозы на OR, R, R'OR, SH, SR, NH2, NHR, NR2, N3, CN, F, Cl, Br и I, где R представляет собой алкил или арил, а R' представляет собой алкилен.
Модификация в других положениях сахара включает, например, замену О в 4'-положении рибозы или дезоксирибозы на S, образование мостика между 2' и 4'-положениями сахара, например, LNA (закрытой нуклеиновой кислоты) или ENA (нуклеиновых кислот с 2'-О,4'-С-этиленовым мостиком), но без ограничения ими.
Модификация области соединения через фосфатную группу включает, например, модификацию с заменой фосфодиэфирной связи на фосфоротиоатную связь, фосфородитиоатную связь, алкилфосфонатную связь, фосфорамидатную связь или боранофосфатную связь (Enya et al., Bioorganic & Medicinal Chemistry, 2008, 18, 9154-9160) (см., например, отечественные повторные публикации в Японии РСТ-заявок с № 2006/129594 и 2006/038608).
Предпочтительно алкилом является неразветвленный или разветвленный алкил, содержащий от 1 до 6 атомов углерода. Конкретные примеры включают метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, н-пентил, изопентил, неопентил, трет-пентил, н-гексил и изогексил. Алкил может необязательно быть замещенным. Примерами таких заместителей являются галоген, алкокси, циано и нитро. Алкил может быть замещен 1-3 заместителями.
Предпочтительно циклоалкилом является циклоалкил, содержащий 5-12 атомов углерода. Конкретные примеры включают циклопентил, циклогексил, циклогептил, циклооктил, циклодецил и циклододецил.
Галоген включает фтор, хлор, бром и йод.
Алкокси представляет собой неразветвленный или разветвленный алкокси, содержащий 1-6 атомов углерода, такой как метокси, этокси, н-пропокси, изопропокси, н-бутокси, изобутокси, втор-бутокси, трет-бутокси, н-пентилокси, изопентилокси, н-гексилокси, изогексилокси и т.д. Среди прочего, алкокси, содержащий 1-3 атомов углерода, является предпочтительным.
Предпочтительно арилом является арил, содержащий 6-10 атомов углерода. Конкретные примеры включают фенил, α-нафтил и β-нафтил. Среди прочего, фенил является предпочтительным. Арил может быть необязательно замещенным. Примерами таких заместителей являются алкил, галоген, алкокси, циано и нитро. Арил может быть замещен одним-тремя такими заместителями.
Предпочтительно алкиленом является неразветвленный или разветвленный алкилен, содержащий от 1 до 6 атомов углерода. Конкретные примеры включают метилен, этилен, триметилен, тетраметилен, пентаметилен, гексаметилен, 2-(этил)триметилен и 1-(метил)тетраметилен.
Ацил включает неразветвленный или разветвленный алканоил или ароил. Примеры алканоила включают формил, ацетил, 2-метилацетил, 2,2-диметилацетил, пропионил, бутирил, изобутирил, пентаноил, 2,2-диметилпропионил, гексаноил и т.д. Примеры ароила включают бензоил, толуоил и нафтоил. Ароил может быть необязательно замещенным в замещаемых положениях и может быть замещен алкилом(ами).
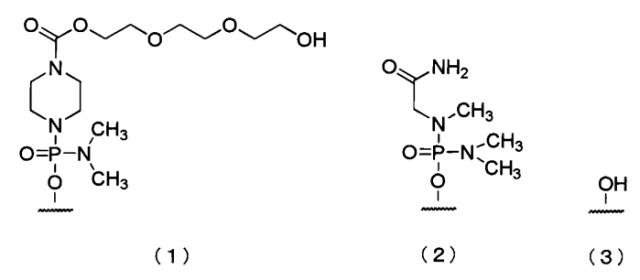
Предпочтительно олигонуклеотидом настоящего изобретения является олигомер настоящего изобретения, содержащий составную единицу, представляемую общей формулой ниже, причем группа -ОН в положении 2' рибозы замещена метокси, а областью соединения через фосфатную группу является фосфоротиоатная связь.
где основание представляет собой нуклеиновое основание.
Олигонуклеотид настоящего изобретения можно без труда синтезировать, используя различные автоматизированные синтезаторы (например, AKTA oligopilot plus 10/100 (GE Healthcare). В альтернативном случае синтез можно также поручить сторонней организации (например, Promega Inc. или Takara Co.) и т.д.
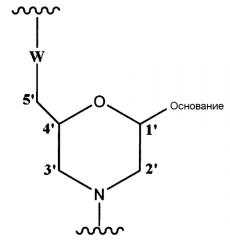
Морфолино олигомером настоящего изобретения является олигомер настоящего изобретения, содержащий составную единицу, представляемую общей формулой ниже:
где основание имеет то же определенное выше значение, и
W представляет собой группу, представленную любой из следующих групп:
где X представляет собой -CH2R1, -O-CH2R1, -S-CH2R1, -NR2R3 или F;
R1 представляет собой Н или алкил;
R2 и R3, которые могут быть одинаковыми или различными, представляют собой каждый Н, алкил, циклоалкил или арил;
Y1 представляет собой O, S, СН2 или NR1;
Y2 представляет собой O, S или NR1;
Z представляет собой O или S.
Предпочтительно морфолино олигомером является олигомер, содержащий составную единицу, представляемую общей формулой ниже, (морфолино-фосфородиамидатный олигомер (в дальнейшем называемый «РМО»)).
где основание, R2 и R3 имеют то же определенное выше значение.
Морфолино олигомер можно получить в соответствии, например, с WO 1991/009033 или WO 2009/064471. В частности, РМО можно получить с помощью процедуры, описанной в WO 2009/064471, или получить с помощью представленного ниже процесса.
Способ получения РМО
Вариантом РМО является, например, соединение, представляемое общей формулой (I) ниже, (в дальнейшем РМО (I)).
где основание, R2 и R3 имеют то же определенное выше значение, а
n является заданным целым числом от 1 до 99, предпочтительно заданным целым числом от 18 до 28.
РМО (I) можно получить в соответствии с известным способом, например можно получить посредством выполнения следующих стадий процедур.
Соединения и реагенты, используемые в стадиях ниже, особо не ограничиваются при условии, что они обычно используются для получения РМО.
Также все следующие стадии можно выполнить с использованием жидкофазного способа или твердофазного способа (используя руководства и имеющиеся в продаже автоматизированные устройства для твердофазного синтеза. При получении РМО твердофазным способом желательно использовать автоматизированный синтезатор ввиду простых технических требований и точного синтеза.
(1) Стадия А:
Осуществляют реакцию соединения, представляемого общей формулой (II) ниже (в дальнейшем называемого соединением (II)) с кислотой для приготовления соединения, представляемого общей формулой (III) ниже (в дальнейшем называемого соединением (III)):
где n, R2 и R3 имеют то же определенное выше значение, а
каждый BP независимо представляет собой нуклеиновое основание, которое может быть необязательно защищено;
Т представляет собой тритил, монометокситритил или диметокситритил; и
L представляет собой водород, ацил или группу, представляемую общей формулой (IV) ниже, (в дальнейшем называемую группой (IV).
В случае BP «нуклеиновое основание» включает то же нуклеиновое основание, что в случае «основания» при условии, что аминогруппу или гидроксильную группу в нуклеиновом основании, представленном BP, можно защитить.
Такая защитная группа для аминогруппы особо не ограничивается при условии, что она используется в качестве защитной группы для нуклеиновых кислот. Конкретные примеры включают бензоил, 4-метоксибензоил, ацетил, пропионил, бутирил, изобутирил, фенилацетил, феноксиацетил, 4-трет-бутилфеноксиацетил, 4-изопропилфеноксиацетил и (диметиламино)метилен. Конкретные примеры защитной группы для гидроксильной группы включают 2-цианоэтил, 4-нитрофенетил, фенилсульфонилэтил, метилсульфонилэтил и триметилсилилэтил, и фенил, который может быть замещен (1-5)электроноакцепторной группой в оптимальных замещаемых положениях, дифенилкарбамоил, диметилкарбамоил, диэтилкарбамоил