Стабильная при окислении, прочная на излом лекарственная форма
Иллюстрации
Показать всеГруппа изобретений относится к термоформируемой фармацевтической лекарственной форме, которая имеет сопротивление разрушению по крайней мере 300 Н, и к способу её получения. Указанная лекарственная форма содержит фармакологически активный ингредиент (А), выбранный из морфина, гидроморфона, оксикодона, гидрокодона, оксиморфона, (1R,2R-3-(3-диметиламино-1-этил-2-метил-пропил)фенола и их физиологически приемлемых солей, свободную физиологически приемлемую кислоту (В) в количестве 0,3±0,18 мас.% в пересчете на общую массу фармацевтической лекарственной формы, антиоксидант в количестве от 0,001 мас.% до 5,0 мас.% в пересчете на общую массу фармацевтической лекарственной формы и полиалкиленоксид (С), который имеет среднемассовую молекулярную массу Mw по крайней мере 200,000 г/моль. Способ получения данной лекарственной формы включает смешивание всех компонентов, нагревание до точки размягчения полиэтиленоксида (С), выдавливание через выходное отверстие экструдера, отделение пластичного экструдата и формирование фармацевтической лекарственной формы или охлаждение. Технический результат: повышение стабильности фармацевтической лекарственной формы при хранении. 2 н. и 11 з.п. ф-лы, 1 ил., 9 пр.
Реферат
Изобретение относится к фармацевтической лекарственной форме, которая является стабильной по отношению к окислению.
Многие фармакологические активные соединения имеют потенциал быть неверно употребленными и, таким образом, выгодно обеспечить фармацевтические лекарственные формы в форме, прочной на излом. Яркими примерами таких фармакологически активных соединений являются опиоиды.
Известно, что лица, которые злоупотребляют наркотиками, раздавливают обычные таблетки, которые содержат опиоиды, для того, чтобы аннулировать замедленное высвобождение «микроинкапсулирования» и затем принимать внутрь получившийся порошок орально, ректально или путем введения инъекционного раствора.
Были разработаны различные концепции для предотвращения злоупотребления наркотиками. Одна концепция опирается на механические свойства фармацевтических лекарственных форма, в частности увеличилось сопротивление разрушению (устойчивость к дроблению). Главное преимущество таких фармацевтических лекарственных форм в том, что измельчение, в частности порошкование с помощью обычных средств, таких как измельчение в ступке или дробление с помощью молотка, является невозможным, или, по крайней мере, существенно усложняется.
Такие фармацевтические формы полезны для предотвращения злоупотребления лекарственными средствами, содержащими фармакологически активное соединение, так как они не могут превращаться в порок с помощью обычных средств и таким образом не могут быть введенными в порошковой форме, например, через нос. Механические свойства, в частности высокое сопротивление разрушению этих фармацевтических лекарственных форм делает их устойчивыми к взлому. В контексте таких устойчивых к взлому фармацевтических лекарственных форм может быть сделана ссылка на, например, WO 2005/016313, WO 2005/016314, WO 2005/ 063214, WO 2005/102286, WO 2006/002883, WO 2006/002884, WO 2006/002886, WO 2006/082097, WO 2006/082099, и WO 2008/107149.
Эти устойчивые к взлому фармацевтические лекарственные формы содержат синтетический или натуральный полимер, наиболее часто высокомолекулярный полиэтиленоксид в качестве материала матрицы.
Полиэтиленоксиды, как и другие алифатические эфиры, могут поддаваться автоокислению в присутствии кислорода с образованием гидроперекисей (смотри, например, С.W.McGary Jr., J.Polymer Sci., 2003, 46, 51-57). Последующие радикальные реакции получившихся пероксидов приводят к разрыву цепи. Эти естественные процессы старения катализируются другими агентами окисления и ускоряются УФ светом и/или повышенной температурой. Окислительный процесс деструкции в значительной степени зависит от молекулярного веса. Высокомолекулярные полиэтиленоксиды особенно склонны к процессам автоокисления и деструктируют быстрее, чем низкомолекулярные полиэтиленоксиды.
Кроме того, чувствительные к окислению фармакологически активные ингредиенты, такие как опиоиды, такие как оксиморфон, гидроморфон и оксикодон, являются чувствительными по отношению к окислительной деструкции и процессам разрушения.
В результате процессов деструкции лекарственная форма, содержащая материал матрицы, поддающийся окислительной деструкции и/или чувствительные к окислению фармакологически активные ингредиенты могут быть серьезно поражены. Например, вероятно произойдут потеря содержания фармакологически активного ингредиента, а также обесцвечивание, уменьшение механической прочности и ускоренное высвобождение препарата из-за укороченной полимерной цепи. Особенно сопротивление разрушению в значительной степени зависит от молекулярного массы полиалкиленоксида, содержащегося в лекарственной форме и следовательно, напрямую зависит от процессов разрыва цепи.
Окисление может быть вызвано молекулярным кислородом или радикалами или пероксидами, образованными соединениями, которые вступают в непосредственную близость с этими чувствительными к окислению материалами матрицы и/или фармакологически активными ингредиентами.
Фармацевтические вспомогательные вещества, такие как, например, полиэтиленгликоли, могут вызвать или катализировать окислительную деструкцию, например, в ходе процесса изготовления фармацевтических лекарственных форм. Кроме того, молекулярный кислород может генерировать указанные радикалы или пероксиды.
Как правило, разложение контролируется стандартными тестами на стабильность при хранении, например, при ускоренных условиях хранения, таких как 40°С/75% отн. влажности. При этих условиях деструкция и разложение обычно происходят быстрее, чем в условиях окружающей среды. Органы, утверждающие лекарства, такие как СНМР (The Committee for Medicinal Products for Human Use - Комитет по медицинским продуктам, предназначенным для человека) и FDA (Food and Drug Administration - Комиссия по контролю за лекарствами и питательными веществами) и международные союзы гармонизации, такие как ICH (International Conference on Harmonisation -Международная конференция по гармонизации), имеют набор стандартных параметров при хранении, которые должны быть выполнены для того, чтобы фармацевтическая лекарственная форма была одобрена.
Особые проблемы возникают тогда, когда такие фармацевтические лекарственные формы, содержащие материал матрицы, который поддается окислительному разложению и/или чувствительные к окислению фармакологически активные ингредиенты должны быть подвержены повышенным температурам в ходе производственного процесса, такого как экструзия горячего расплава, покрытие пленкой и тому подобное. При этих условиях указанные соединения даже являются еще более чувствительными к окислению. Например, несколько известных процессов для изготовления фармацевтических лекарственных форм, имеющих увеличенное сопротивление разрушению требуют, чтобы фармацевтическая композиция, содержащая фармакологически активные ингредиенты подвергалась определенному количеству давления при определенной повышенной температуре в течении определенного периода времени. В зависимости от составляющих фармацевтической композиции и их количества, температура, давление и время могут меняться в определенных пределах. Тем не менее, если минимальные требования не выполняются, сопротивление разрушению в получающейся в результате фармацевтической лекарственной форме является слишком низким.
Следовательно, некоторые обычные процессы для производства фармацевтических лекарственных форм, в частности для фармацевтических лекарственных форм, которые имеют увеличенное сопротивление разрушению, требуют сравнительно жестких условий процесса и, таким образом, они являются до сих пор не применимыми для чувствительных к окислению материалов матрицы и/или фармакологически активных ингредиентов, например, опиоидов. В частности, разрыв цепи фармацевтических наполнителей, таких как полиэтиленоксид во время экструзии горячего расплава создает риск формирования свободных радикалов, таким образом увеличивая окислительный стресс.
Меньшие дозы чувствительных к окислению фармакологически активных ингредиентов часто показывают высший процент окислительной деструкции и разложения, чем большие дозы. Таким образом, фармацевтические лекарственные формы, содержащие меньшие дозы чувствительных к окислению фармакологически активных ингредиентов требуют особого внимания, насколько стабильность при хранении сохраняется.
Влияние окислительных механизмов и химических взаимодействий на устойчивость полимерных систем для аморфного Δ9-тетрагидроканнабинола (не-опиоид), полученного путем расплава полимера описан в М. Munjal et al., J.Pharrn. Sciences, 95(11), 2006, 2473-85. Исследование показало, что для этого крайне нестабильного лекарства сложный характер взаимодействия включает совместимость лекарства-вспомогательного вещества, применение антиоксидантов, сшивателей в полимерных матрицах, микро рН среды и влияние влажности.
К.С.Waterman и др., Pharm. Develop.Tech. 7(1), 2002, 1-32 обзор стабильности лекарств о окислительной деструкции. Предложены различные методы для снижения окисления. Авторы делают заключение, что, в конце концов, каждый препарат представляет собой уникальную ситуацию.
WO 2008/107149 описывает оральные лекарственные формы, которые имеют повышенное сопротивление разрушению, которые могут содержать окислительно-восстановительные стабилизаторы, такие как комплексообразующие агенты, например ЭДТА.
WO 2008/086804 относится к композиции с контролируемым высвобождением, содержащей композицию матрицы, которая включает а) полимер или смесь полимеров, Ь) активное вещество лекарства и необязательно с) один или больше фармацевтически приемлемых наполнителей, в которой доза высвобождения не индуцированная спиртом и имеют отличные свойства по отношению к избежанию злоупотребления лекарственными средствами. Предпочтительно композиция является устойчивой к выделению и/или растворению действующего вещества препарата из композиции путем дробления, плавления и/или экстракцией этанола, в результате чего композиция является устойчивой к злоупотреблению лекарственными средствами. Лимонная кислота может присутствовать в качестве ароматизатора. Пример 2 относится к композиции, содержащей 7 мас.-% лимонной кислоты.
WO 2008/148798 описывает композицию, нанесенную слоями с продленным высвобождением активного вещества для длительного эффекта и способ обеспечения длительного эффекта, например введение один раз в день обеспечивает оптимальную абсорбцию активного вещества через желудочно-кишечный тракт, т.е. от желудка до прямой кишки.
Не существует общего решения для успешного подавления окислительной деструкции материалов матрицы, таких как полиэтиленоксид и чувствительных к окислению лекарствах в фармацевтических лекарственных формах. Комплекс отдельных механизмов окисления, который важен для конкретного материала матрицы или лекарства, а также множество возможных факторов, которые оказывают влияние на окислительные процессы, требуют обширных исследований в каждом конкретном случае с учетом конкретных обстоятельств. Возможными способами защиты лекарственной формы от процессов окислительной деструкции является добавление антиоксидантов, хранение в инертной атмосфере или применение пленочного покрытия в качестве противокислородной защиты. Последние два метода, однако, трудно применять на всех этапах производственного процесса.
Далее известно, что процессы окислительной деструкции особенно ускоряются, когда лекарственные формы подвергаются жестким условиям процесса, например, во время производственного процесса. Например, высокомолекулярный полиэтиленоксид имеет тенденцию деструктировать при экструзии горячего расплава. Полимерная деструкция, тем не менее, может привести к неконтролируемой кривой высвобождения, в частности, когда активный ингредиент внедрен в матрицу полиэтиленоксида, и это может быть еще одной причиной для окислительной деструкции фармакологически активных ингредиентов радикалами. Когда добавляют подходящие вспомогательные вещества с целью стабилизации высокомолекулярного полиэтиленоксида, такого как α-токоферол, должно быть принято во внимание, что указанные вспомогательные вещества в свою очередь могут иметь отрицательное влияние на стабильность других ингредиентов фармацевтических препаратов, например, фармакологически активного соединения.
Целью настоящего изобретения является обеспечение устойчивых к взлому фармацевтических лекарственных форм, содержащих фармакологически активные ингредиенты, в частности чувствительные к окислению опиоиды, которые имеют преимущества по сравнению с фармацевтическими лекарственными формами, известными из уровня техники. Фармацевтические лекарственные формы должны иметь улучшенную стабильность при хранении, так что они могут содержать чувствительные к окислению опиоиды, даже при сравнительно низких дозах. Кроме того, должна быть возможность готовить фармацевтические лекарственные формы обычным путем при обычных условиях, таких как повышенная температура и давление (например, в ходе термоформования экструзией горячего расплава).
Эта задача была решена объектом изобретения, изложенным в формуле изобретения.
Изобретение относится к термоформируемой фармацевтической лекарственной форме, которая имеет сопротивление разрушению по крайней мере 300 Н и включает
- фармакологически активный ингредиент (А),
- свободную физиологически приемлемую кислоту (В) в количестве от 0.001 до 5.0 мас.%, основанную на общей массе фармацевтической лекарственной формы, и
- полиалкиленоксид (С), который имеет среднемассовую молекулярную массу Mw по крайней мере 200,000 г/моль.
Неожиданно было обнаружено, что фармацевтические лекарственные формы, которые содержат полимеры, которые поддаются окислительной деструкции, такие как высокомолекулярный полиэтиленоксид можно предотвратить от окислительной деструкции и разрушения наличием подходящего количества кислоты (В) в фармацевтических лекарственных формах согласно изобретению. С помощью этого метода неожиданно было обнаружено, что определенные свойства материала лекарственной формы согласно изобретению, такие как сопротивление разрушению и замедленное высвобождение активного ингредиента могут быть сохранены в течении более длительного периода хранения.
Таким образом, повышенная стабильность полимерной матрицы отражена улучшенной стабильностью in vitro кривой высвобождения при хранении и/или улучшенной стабильностью механических свойств лекарственных форм. Оба свойства существенно зависят от материала полимерной матрицы.
Еще неожиданно было обнаружено, что некоторые производные морфинана, такие как оксиморфон являются окислительно деструктированными до N-оксидов (например, оксиморфон-N-оксид, N-оксиды в общем часто говорят являются токсичными и возможно канцерогенными) при производстве и хранении соответствующих лекарственных форм и что формирование указанных N-оксидов и других продуктов разложения может быть подавлено наличием подходящего количества кислоты (В) в фармацевтических лекарственных формах согласно изобретению.
Таким образом, увеличилась стабильность при хранении фармакологически активного ингредиента (А), что отражается уменьшением примесей, если таковые имеются и соответственно снижением уменьшения фармакологически активного ингредиента (А) во время хранения, если таковое происходит.
Хотя это не предназначено, для привязки к какой-либо теории, кислота (В) имеет влияние на значение микро-рН фармацевтического препарата, тем самым каким-то образом увеличивая его стабильность при хранении. Таким образом, насколько стабильность при хранении фармакологически активного ингредиента связана, стабилизирующий эффект кислоты (В) можно коррелировать с помощью значения pKA чувствительных к окислению лекарств. Например, значение pKA оксиморфона составляет 8.3. Обычные композиции оксиморфона, которые являются устойчивыми к взлому из-за их повышенного сопротивление разрушению, но которые не показывают желаемого срока хранения, дают значениие рН около 7.5, будучи диспергированными в воде. В этих условиях значительное количество оксиморфона присутствует в виде свободного основания (т.е. не протонированного), который может быть более чувствителен к окислению, чем (протонированная) солевая форма.
Эта концепция подтверждается также тем, что в отсутствие кислоты (В), лекарственные формы, как правило, имеют желтоватый, бежевый цвет, в то время как присутствие кислоты (В) приводит к более белым, например бесцветным таблеткам. Таким образом, присутствие кислоты (В) может уменьшить значение рН в пределах лекарственной формы, повышая таким образом стойкость лекарства и/или полимерную стойкость к окислительной деструкции.
По-видимому, кислотный характер кислоты (В) несет ответственность за его стабилизирующий эффект, но не за другие свойства. Эта концепция подтверждается тем фактом, что неорганические, также как органические кислоты оба повышают стабильность при хранении лекарственной формы. Неожиданно было обнаружено, что фармацевтические вспомогательные вещества, которые обычно применяют в целях улучшения устойчивости лекарства к окислительному разрушению, в особенности некоторые антиоксиданты, например, α-токоферол, могут быть анти-производительными и в значительной степени ухудшать, чем улучшать стабильность лекарства к окислительному разрушению.
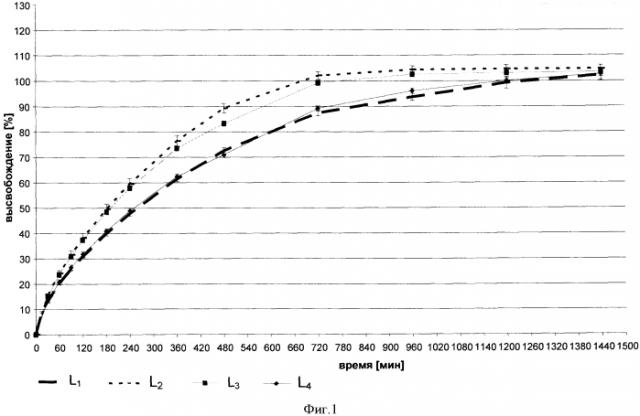
Фигура 1 показывает in vitro кривую высвобождения фармацевтических лекарственных форм согласно изобретению примеры L1 и L3 и сравнительные примеры L2 и L4.
Фармацевтическая лекарственная форма согласно изобретению является темоформируемой, преимущественно путем экструзии, хотя также другие методы термоформования могут быть использованы в целях производства фармацевтической лекарственной формы согласно изобретения, такие как литье под давлением при повышенной температуре или нагревание таблеток, которые были изготовлены обычным сжатием на первом этапе и затем нагреваются выше температуры размягчения полимера в таблетке на втором этапе для формирования твердых таблеток. В преимущественном воплощении, фармацевтическая лекарственная форма является термоформируемой экструзией горячего расплава.
Преимущественно, фармацевтическая лекарственная форма представляет собой монолитную массу. Фармацевтическая лекарственная форма является преимущественно полученной путем экструзии горячего расплава. Расплав экструдированных стренг преимущественно нарезают в монолиты, которые затем преимущественно формируют в таблетки. В этой связи термин "таблетки" преимущественно не стоит понимать как лекарственные формы, которые были сделаны путем сжатия порошка или гранул (сжимаемость), а скорее, как форму эктрудатов.
Фармацевтическая лекарственная форма согласно изобретению содержит как компонент (А) фармакологически активный ингредиент (А), преимущественно чувствительный к окислению фармакологический активный ингредиент. Для целей описания, термин фармакологически активный ингредиент (А) также включает свободное основание и его физиологически приемлемые соли.
Для целей описания термин чувствительный к окислению фармакологически активный ингредиент включает все фармакологически активные ингредиенты, которые содержат одну или более функциональную группу, которая окисляется в процессе окислительной деструкции. Функциональные группы, чье окисление может привести фармакологически активный ингредиент к нестабильности по отношению к окислению, имеют двойные связи, кроме того, альдегидо, кето, гидроксильные группы, эфир ендиол, фенол и аминогруппы.
Лекарственная форма согласно изобретению в частности предпочтительно содержит один или более фармакологически активных ингредиентов (А), которые выбраны из группы, которая состоит из
- агенты для лечения и профилактики заболеваний пищеварительной системы и обмена веществ [А]; в частности, стоматологические препараты [А01], агенты для лечения и профилактики кислотнозависимых заболеваний [А02], агенты для лечения и профилактики функциональных расстройств желудочно-кишечного тракта [А03], серотонин 5НТЗ антагонисты [А04АА], антигистаминные препараты [А04АВ], агенты для терапии желчи и печени [А05], слабительные средства [А06], противоинфекционные препараты для желудочно-кишечного тракта [А07А], кишечные адсорбирующие препараты [А07В], электролиты с углеводами [А07С], противовоспалительные препараты для желудочно-кишечного тракта [А07Е], микробные антидиарейные средства [A07F], дижестивы, включающие энзимы [А09], препараты для лечения сахарного диабета [А10], витамины [АН], минералы [А12], анаболические средства для системного применения [А14] и стимуляторы аппетита [А15];
- агенты для лечения и профилактики заболеваний крови и кроветворных органов [В]; в частности антитромботические агенты [В01], останавливающие кровотечение [В02], противоанемические препараты [В03] и другие гематологические агенты [В06];
- агенты для лечения и профилактики заболеваний кардиоваскулярной системы [С]; в частности агенты для сердечной терапии [С01], противогипертонические лекарства [С02], мочегонные средства [С03], периферические сосудорасширяющие средства [С04], сосудозащищающие вещества [С05], антигипотензивные вещества [С06А], β-адренорцептора антагонисты [С07], блокаторы кальциевых канальцев [С08], агенты, воздействующие на ренин-ангиотензиновую систему [С09] и липидные восстанавливающие агенты [С10];
- дерматологические средства [D]; в частности противогрибковые средства для системного применения [D01B], антипсориатические вещества для системного применения [D05B], противоугревые препараты для системного применения [D10B];
- агенты для лечения и профилактики заболеваний мочеполовой системы и половых гормонов [G]; в частности гинекологические антимикробные средства и антисептики [G01], препараты, повышающие тонус миометрия [G02A], симпатомиметические супрессоры родовой деятельности [G02CA], ингибиторы пролактина [G02CB], гормональные контрацептивы для систематического применения [G03] и урологические средства [G04];
- системные гормональные препараты за исключением половых гормонов и инсулинов [Н]; в частности гипофизные и гипоталамические гормоны и аналоги [Н01], кортикостероиды для системного применения [Н02], препараты для щитовидной железы [Н03], гормоны поджелудочной железы [Н04], и агенты для регулирования гомеостаза кальция [Н05];
- противомикробные средства для системного применения [J]; в частности антибиотики для системного применения [J01], противогрибковые средства для системного применения [J02], антимикробактериальные вещества [J04], антивирусные препараты для системного применения [J05], антисыворотка и иммуноглобулины [J06], и вакцины [J07]);
- противоопухолевые и иммуномодулирующие средства [L] (в частности антинеопластические агенты [L01], агенты для эндокринной терапии [L02], иммуностимулирующие средства [L03] и иммуноподавляющие агенты [L04];
- агенты для лечения и профилактики заболеваний мускульно-костной системы [М]; в частности противовоспалительные и противоревматические средства [М01], мышечные релаксанты периферического действия [М03А], мышечные релаксанты прямого действия [М03С], противоподагрические препараты [М04] и агенты для лечения костных заболеваний [М05];
- агенты для лечения и профилактики заболеваний нервной системы [N]; в частности салициловая кислота, ее производные [N02BA], пиразолоны [N02BB], анилиды [N02BE], алкалоиды спорыньи [N02CA], производные кортикостероидов [N02CB], селективные агонисты серотинина-5НТ1 [N02CC], производные гидантоина [N03AB], производные оксазолидина [N03AC], производные сукцинимида [N03AD], производные карбоксамида [N03AF], производные жирных кислот [N03AG], лекарства против паркинсона [N04]), нейролептические препараты [N05A], антидепрессанты [N06A], лекарства от умственного снижения [N06D], парасимпатомиметики [N07A] и препараты против головокружения [N07C];
- противопаразитарные продукты, инсектициды и репелленты [Р]; в частности антипротозойные агенты [Р01], глистогонные средства [Р02] и электропаразитициды, включая средства от чесотки, инсектициды и репелленты [Р03];
- агенты для лечения и профилактики заболеваний респираторной системы [R]; в частности назальные препараты [R01], горловые препараты [R02], лекарства для обструктивных заболеваний дыхательных путей [R03], отхаркивающие средства, за исключением комбинаций средств от кашля [R05C] и антигистаминных средств для системного применения [R06];
- агенты для лечения и профилактики заболеваний органов чувств [S]; в частности отологические агенты [S02]; и
- продукты общей диеты [V06] и терапевтические радиофармпрепараты [V10],
где аббревиатуры, находящиеся в квадратных скобках здесь (и далее) соответствуют АТС Индексу, который используется как WHO для классификации фармацевтических веществ (предпочтительная версия: 2010).
В предпочтительном воплощении, лекарственная форма согласно изобретению содержит один или более фармакологически активных ингредиентов (А), выбранных из группы, которая состоит из агентов для сердечной терапии [С01], предпочтительно выбранных из группы, которая состоит из сердечных гликозидов [С01А], антиаритмических препаратов, класса i и iii [C01B], сердечных стимуляторов за исключением сердечных гликозидов [C01C], сосудорасширяющих средств, используемых при сердечных заболеваниях [C01D], и другие сердечные препараты [С01Е].
В другом предпочтительном воплощении, лекарственная форма согласно изобретению содержит один или более фармакологически активных ингредиентов (А), которые выбраны из группы, которая состоит из из противогипертонических средств [С02], предпочтительно выбранных из группы, которая состоит из антиадренергических веществ центрального действия [С02А], антиадренергических веществ, блокирующих кистозные образования [С02В], антиадренергических веществ поверхностного действия [С02С], агентов воздействующих на артериолярные гладкие мышцы [C02D], другие противогипертонические средства [С02К], противогипертонические средства и диуретические средства в сочетании [C02I], и комбинации противогипертонических средств in atc-gr. C02 [C02N].
В еще другом предпочтительном воплощении, лекарственная форма согласно изобретению содержит один или более фармакологически активных ингредиентов (А), которые выбраны из группы, которая состоит из диуретических средств [С03], предпочтительно выбранных из группы, которая состоит из низко-насыщаемых диуретических средств, тиазидов [С03А], низконасыщаемых диуретических средств, за исключением таизидов [С03В], высоконасыщаемых диуретических средств [С03С], калийсберегающих мочегонных средств [C03D], диуретических средств и калийсберегающих мочегонных средств в сочетании [С03Е], и других диуретических средств [С03Х].
В еще другом предпочтительном воплощении, лекарственная форма согласно изобретению содержит один или более фармакологически активных ингредиентов (А), которые выбраны из группы, которая состоит из средств с сосудорасширяющим фактором периферийного действия [С04], предпочтительно выбранные из группы, которая состоит из сосудорасширяющих средств периферийного действия [С04А].
В еще другом предпочтительном воплощении, лекарственная форма согласно изобретению содержит один или более фармакологически активных ингредиентов (А) которые выбраны из группы, которая состоит из сосудозащищающих средств [С05], предпочтительно выбраны из группы, которая состоит из агентов для лечения геморроидальных узлов и анальных трещин для местного применения [С05А], противоварикозной терапии [С05В], и капиллярных стабилизаторов [С05С].
В еще другом предпочтительном воплощении, лекарственная форма согласно изобретению содержит один или более фармакологически активных ингредиентов (А), которые выбраны из группы, которая состоит из антигипотензивных средств [С06А].
В еще другом предпочтительном воплощени, лекарственная форма согласно изобретению содержит один или более фармакологически активных ингредиентов (А), которые выбраны из группы, которая состоит из антагонистов □адренорецепторов [С07], предпочтительно выбранных из группы, которая состоит из бэта блокирующих агентов [С07А], бэта блокирующих агентов и тиазидов [С07В], бэта блокирующих агентов и других диуретических средств [С07С], бэта блокирующих агентов, тиазидов и других диуретических средств [C07D], бэта блокирующих агентов и сосудорасширяющих средств [С07Е], и бэта блокирующих агентов и других противогипертонических средств [C07F].
В еще другом предпочтительном воплощении, лекарственная форма согласно изобретению содержит один или более фармакологически активных ингредиентов (А) которые выбраны из группы, которая состоит из блокаторов кальциевых канальцев [С08], предпочтительно выбраны из группы, которая состоит из селективных блокаторов кальциевых канальцев с преимущественными сосудистыми эффектами [С08С], селективных блокаторов кальциевых канальцев с направленными сердечными эффектами [C08D], неселективных блокаторов кальциевых канальцев [С08Е], и блокаторов кальциевых канальцев и мочегонных средств [C08G].
В еще другом предпочтительном воплощении, лекарственная форма согласно изобретению содержит один или более фармакологически активных ингредиентов (А), которые выбраны из группы, которая состоит из агентов, действующих на ренин-ингиотензиновую систему [С09], предпочтительно выбранные из группы, которая состоит из АПФ ингибиторов, обычных [С09А], АПФ ингибиторов, комбинаций [С09В], антагонистов ангиотензина ii, обычных [С09С], антагонистов ангиотензина ii, комбинаций [C09D], и других агентов, воздейтствующих на ренин-ингиотензиновую систему [С09Х].
В еще предпочтительном воплощении, лекарственная форма согласно изобретению содержит один или более фармакологически активных ингредиентов (А), которые выбраны из группы, которая состоит из липидных восстанавливающих агентов [с10], предпочтительно выбраны из группы, которая состоит из липидных модифицирующих агентов, обычных [С10А], и липидных модифицирующих агентов, комбинаций [С10В].
В преимущественном воплощении, фармакологически активным ингредиентом (А) является ингибитор ангиотензинпревращающего фермента (АПФ), более предпочтительно АПФ-ингибитор выбран из группы, включающей беназеприл, каптоприл, цилазаприл, эналаприл, фзиноприл, имидаприл, лизиноприл, моэксиприл, периндоприл, хинаприл, рамиприл, спираприл, трандолаприл и зофеноприл.
В другом преимущественном воплощении, фармакологически активным ингредиентом является опиоид, более предпочтительно чувствительный к окислению опиоид, наиболее предпочтительно оксиморфон или оксикодон.
Согласно индексу АТС, опиоиды делятся на природные алкалоиды опиума, производные фенилпиперидина, производные дифенилпропиламина, производные бензоморфана, производные орипавина, производные морфинана и другие. Примерами природных алкалоидов опиума является морфин, опиум, никоморфин, оксикодон, дигидрокодеин, диаморфин, пантопон и кодеин. Дополнительными опиоидами (А) являются, например, этилморфин, гидрокодон, оксиморфон, и их физиологически приемлемые производные или соединения, преимущественно их соли и сольваты, преимущественно их гидрохлориды, физиологически приемлемые энантиомеры, стереоизомеры, диастереомеры и рацематы и их физиологически приемлемые производные, преимущественно этеры, эстеры или амиды.
Дополнительные преимущественные опиоиды включают N-(1-метил-2-пиперидиноэтил)-N-(2-пиридил)пропионамид, (1R,2R)-3-(3-диметиламино-1-этил-2-метил-пропил)фенол, (1R,2R,4S)-2-(диметиламино)метил-4-(р-фторбензилокси)-1-(m-метоксифенил)циклогексанол, (1R,2R)-3-(2-диметиламинометил-циклогексил)фенол, (1S,2S)-3-(3-диметиламино-1-этил-2-метил-пропил)фенол, (2R,3R)-1-диметиламино-3(3-метоксифенил)-2-метил-пентан-3-ол, (1RS,3RS,6RS)-6-диметиламинометил-1-(3-метоксифенил)-циклогексан-1,3-диол, преимущественно как рацемат, 3-(2-диметиламинометил-1-гидрокси-циклогексил)фенил 2-(4-изобутил-фенил)пропионат, 3-(2-диметиламинометил-1-гидрокси-циклогексил)фенил 2-(6-метокси-нафтален-2-ил)пропионат, 3-(2-диметиламинометил-циклогекс-1-энил)-фенил 2-(4-изобутил-фенил)пропионат, 3-(2-диметиламинометил-циклогекс-1-энил)-фенил 2-(6-метокси-нафтален-2-ил)пропионат, 3-(2-диметиламинометил-1-гидрокси-циклогексил)-фениловый сложный эфир (RR-SS)-2-ацетокси-4-трифторметил-бензойной кислоты, 3-(2-диметиламинометил-1-гидрокси-циклогексил)-фениловый сложный эфир (RR-SS)-2-гидрокси-4-трифторметил-бензойной кислоты, 3-(2-диметиламинометил-1-гидрокси-циклогексил)-фенил сложный эфир (RR-SS)-4-хлоро-2-гидрокси-бензойной кислоты, 3-(2-диметиламинометил-1-гидрокси-циклогексил)-фениловый сложный эфир (RR-SS)-2-гидрокси-4-метил-бензойной кислоты, 3-(2-диметиламинометил-1-гидрокси-циклогексил)-фениловый сложный эфир (RR-SS)-2-гидрокси-4-метокси-бензойной кислоты, 3-(2-диметиламинометил-1-гидрокси-циклогексил)-фенил сложный эфир (RR-SS)-2-гидрокси-5-нитро-бензойной кислоты, 3-(2-диметиламинометил-1-гидрокси-циклогексил)-фенил сложный эфир (RR-SS)-2',4'-дифторо-3-гидрокси-бифенил-4-карбоновой кислоты, 1,1-(3-диметиламино-3-фенилпентаметилен)-6-фтор-1,3,4,9-тетрагидропропан[3,4-b]индол, в частности его гемицитрат; 1,1-[3-диметиламино-3-(2-тиенил)пентаметилен]-1,3,4,9-тетрагидропропан[3,4-b]индол, в частности его цитрат; и 1,1-[3-диметиламино-3-(2-тиенил)пентаметилен]-1,3,4,9-тетрагидропропан[3,4-b]-6-фторо-индол, в частности его гемицитрат, и соответствующие стереоизомерные соединения, в каждом случае их соответствующие производные, физиологически приемлемые энантиомеры, стереоизомеры, диастереомеры и рацематы и их физиологически приемлемые производные, например этеры, эстеры или амиды, и в каждом случае их физиологически приемлемые соединения, в частности их соли и сольваты, например гидрохлориды.
Преимущественные опиоиды представлены общей формулой (I)
где
R1 представляет собой -Н, -ОН или -OC1-6-алкил;
R2 представляет собой -Н или -C1-6-алкил;
R3 представляет собой -Н или -ОН и R4 представляет собой -Н; или R3 и R4 вместе =O; и
---- представляет собой необязательно двойную связь;
или их физиологические соли.
В частности, преимущественные опиоиды включают оксиморфон, оксикодон, гидроморфон и их приемлемые физиологические соли.
В другом преимущественном воплощении, тем не менее, фармацевтическая лекарственная форма согласно изобретению не содержит ни одного опиоида, преимущественно ни одного чувствительного к окислению опиоида, как указано выше.
Содержание фармакологически активного ингредиента (А) в фармацевтической лекарственной форме является не ограниченным.
Преимущественно, его содержание находится в пределах от около 0.01 до 80 мас.%, более предпочтительно от 0.1 до 50 мас.%, еще более предпочтительно от 1 до 25 мас.%, основанного на общей массе фармацевтической лекарственной формы. В преимущественном воплощении, содержание фармакологически активного ингредиента (А) находится в диапазоне около 7±6 мас.%, более предпочтительно 7±5 мас.%, еще более предпочтительно 5±4 мас.%, 7±4 мас.% или 9±4 мас.%, наиболее предпочтительно 5±3 мас.%, 7±3 мас.% или 9±3 мас.%, и в частности 5±2 мас.%, 7±2 мас.% или 9±2 мас.%, основанного на общей массе фармацевтической лекарственной формы. В другом преимущественном воплощении, содержание фармакологически активного ингредиента (А) находится в пределах около 11±10 мас.%, более предпочтительно 11±9 мас.%, еще более предпочтительно 9±6 мас.%, 11±6 мас.%, 13±6 мас.% или 15±6 мас.%, наиболее предпочтительно 11±4 мас.%, 13±4 мас.% или 15±4 мас.%, и в частности 11±2 мас.%, 13±2 мас.% или 15±2 мас.%, основанного на общей массе фармацевтической лекарственной формы. В еще одном предпочтительном варианте, содержание фармакологически активного ингредиента (А) находится в пределах около 20±6 мас.%, более предпочтительно 20±5 мас.%, еще более предпочтительно 20±4 мас.%, наиболее предпочтительно 20±3 мас.%, и в частности 20±2 мас.%, основанного на общей массе фармацевтической лекарственной формы.
Преимущественно, общее количество фармакологически активного ингредиента (А), которое содержится в фармацевтической лекарственной форме находится в пределах от 0.01 до 200 мг, более предпочтительно от 0.1 до 190 мг, еще более предпочтительно от 1.0 до 180 мг, еще более предпочтительно от 1.5 до 160 мг, наиболее предпочтительно от 2.0 до 100 мг и, в частности, от 2.5 до 80 мг.
В предпочтительном воплощении, фармакологически активный ингредиент (А), содержится в фармацевтической лекарственной форме в количестве около 7.5±5 мг, 10±5 мг, 20±5 мг, 30±5 мг, 40±5 мг, 50±5 мг, 60±5 мг, 70±5 мг, 80±5 мг, 90±5 мг, 100±5 мг, 110±5 мг, 120±5 мг, 130±5 мг, 140±5 мг, 150±5 мг, или 160±5 мг. В другом предпочтительном варианте, фармакологически активный ингредиент (А) содержится в фармацевтической лекарственной форме в количестве около 5±2.5 мг, 7.5±2.5 мг, 10±2.5 мг, 15±2.5 мг, 20±2.5 мг, 25±2.5 мг, 30±2.5 мг, 35±2.5 мг, 40±2.5 мг, 45±2.5 мг, 50±2.5 мг, 55±2.5 мг, 60±2.5 мг, 65±2.5 мг, 70±2.5 мг, 75±2.5 мг, 80±2.5 мг, 85±2.5 мг, 90±2.5 мг, 95±2.5 мг, 100±2.5 мг, 105±2.5 мг, 110±2.5 мг, 115±2.5 мг, 120±2.5 мг, 125±2.5 мг, 130±2.5 мг, 135±2.5 мг, 140±2.5 мг, 145±2.5 мг, 150±2.5 мг, 155±2.5 мг, или 160±2.5 мг.
В особенно предпочтительном варианте фармакологически активным ингредиентом (А), преимущественно опиоидом является оксиморфон, предпочтительно его HCl соль, и фармацевтическая лекарственная форма адаптирована для введения дважды в день. В этом варианте, опиоид (А) преимущественно содержит