Способ определения глубины залегания липидных ядер атеросклеротических бляшек методом ик-фурье спектроскопии
Иллюстрации
Показать всеИзобретение относится к медицине и может быть использовано для определения глубины залегания липидных ядер, являющихся центром атеросклеротических бляшек. Изобретение представляет способ определения глубины залегания липидных ядер атеросклеротических бляшек методом ИК-Фурье спектроскопии, заключающийся в том, что подготавливаются срезы атеросклеротически измененного участка сосудистого русла, записываются инфракрасные спектры пропускания подготовленных срезов, идентифицируются характеристические пики поглощения, отличающийся тем, что определяется срез, имеющий максимальное поглощение в диапазоне 1720-1760 см-1, соответствующем валентным колебаниям связей C=O сложных эфиров холестерина, который отвечает глубине залегания липидного ядра. Изобретение обеспечивает определение качественного состава атеросклеротических бляшек и глубину залегания липидных ядер. 2 ил.
Реферат
Предлагаемое изобретение относится к медицине и может быть использовано для определения глубины залегания липидных ядер, являющихся центром атеросклеротических бляшек (АСБ).
Известен способ обнаружения и определения состояния атеросклеротических бляшек посредством внутрисосудистого ультразвукового исследования [1]. Способ позволяет исследовать структуру сосудистой стенки и состав АСБ, а также дает возможность проводить в реальном масштабе времени тонкий структурный анализ атеросклеротически измененного участка артерии, выявить осложненные и структурно нестабильные бляшки.
Недостатком такого способа является то, что он дает информацию только о структурных особенностях АСБ, не позволяет исследовать их качественный состав и определять уровень залегания липидных ядер.
Известен способ обнаружения воспаленных АСБ, который предполагает введение конъюгата лиганда к макрофагам и флюрофора с последующей регистрацией флюоресценции [2].
Недостатком такого способа является то, что он дает информацию только о наличие воспаленной АСБ, но не об ее структурных особенностях, качественном составе и глубине залегания липидных ядер.
Также известен способ обнаружения атеросклеротических бляшек с измененной метаболической активностью [3]. Способ заключается во введении 5-аминолевулинной кислоты, измерении спектров флуоресценции при возбуждении в диапазоне длин волн 390-650 нм, определении участков с повышенным накоплением 5-АЛК-индуцированного протопорфирина IX и выявлении среди этих участков областей с пиком флуоресценции в диапазоне 670-680 нм.
Недостатком такого способа является отсутствие возможности определить качественный состав АСБ и уровень залегания липидных ядер.
Наиболее близким по технической сущности к предлагаемому решению является способ, позволяющий изучать содержание свободных жирных кислот, триглицеридов а также эфиров холестерина в аорте мышей с атеросклерозом [4]. Способ заключается в том, что подготавливается срез атеросклеротически измененного участка аорты; с помощью метода ИК-Фурье спектроскопии записываются инфракрасные спектры (ИК-спектры) пропускания среза; идентифицируются характеристические полосы и пики поглощения для установления качественного состава исследуемого среза.
Недостатком такого способа является то, что он не позволяет определять глубину залегания липидного ядра АСБ.
Технический результат настоящего изобретения состоит в том, что с помощью метода ИК-Фурье спектроскопии определяют качественный состав АСБ и уровень залегания липидных ядер.
Сущность предлагаемого способа заключается в том, что подготавливаются срезы атеросклеротически измененного участка сосудистого русла; записываются ИК-спектры пропускания подготовленных срезов; идентифицируются характеристические пики поглощения; определяется срез, имеющий максимальное поглощение в диапазоне 1720-1760 см-1, соответствующем валентным колебаниям связей С=O сложных эфиров холестерина, который отвечает глубине залегания липидного ядра.
Такое сочетание экспериментальных и теоретических данных позволяет определить качественных состав АСБ и уровень залегания липидных ядер с помощью ИК-Фурье спектроскопии.
Пример выполнения способа. Определение качественного состава и глубины залегания липидных ядер в брюшной части аорты человека.
1. Подготовка срезов нормированной толщины атеросклеротически измененного участка сосудистого русла.
1.1. Забор биологического материала. Для исследований использовался нативный препарат брюшной части аорты человека размером 1×1 см2.
1.2. Погружение изъятого биологического материала в изотонический (0,9%) раствор натрия хлорида до момента изготовления срезов различной толщины на замораживающем микротоме.
1.3. Приготовление срезов без этапа фиксации в несколько этапов:
а) глубокое замораживание образцов до температуры -18°С;
б) выполнение послойных срезов для исследования образцов с различной глубины сосудистой стенки. Приготовление первого и последующих срезов осуществлялось с помощью замораживающего микротома МЗ-2. Полученные образцы имели нормированную толщину, равную 40 мкм.
1.4. Погружение образцов для исследования в кюветы с дистиллированной водой, каждая из которых соответствует определенной толщине конкретно среза.
1.5. Размещение срезов на алюминиевой фольге толщиной 14 мкм, играющей роль зеркала, при снятии ИК-спектров пропускания с использованием приставки зеркального отражения.
1.6. Сушка срезов в течение 10-15 минут при температуре 37°С в электрическом суховоздушном термостате АТ-2.
2. Запись ИК-спектров пропускания подготовленных срезов. ИК-спектры срезов нативных препаратов брюшной части аорты человека записывали на ИК-Фурье спектрометре ФСМ 1201 (ООО «Инфраспек», г. Санкт-Петербург, Россия) с использованием приставки зеркального отражения ПЗО30.
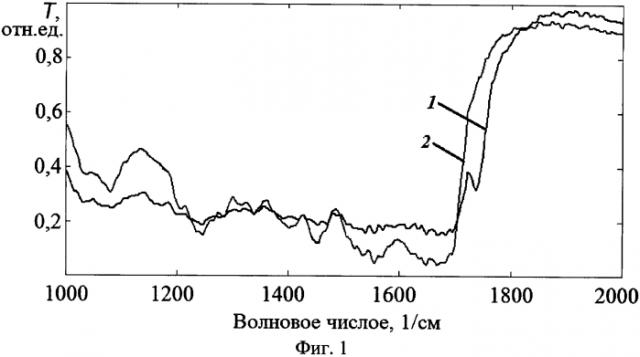
На фиг. 1 представлены ИК-спектры пропускания нативного препарата брюшной части аорты человека подверженного (кривая 1) и не подверженного (кривая 2) атеросклеротическим изменениям.
3. Идентификация характеристических пиков поглощения.
ИК-спектры пропускания, представленные на фиг. 1, содержат полосы поглощения, соответствующие частотам 1670, 1543, 1240 см-1, относящиеся к амидным I, II и III колебаниям. Частота 1670 см-1 соответствует валентным С=O колебаниям (амид I), частота 1543 см-1 - валентным CN и деформационным NH колебаниям (амид II), а частота 1240 см-1 - валентным CNH колебаниям (амид III). Полосы поглощения 1455 и 1340-1 относятся, вероятно, к деформационным симметричным и асимметричным колебаниям С-Н в молекулах протеинов. Данные группы полос поглощения соответствуют белкам, таким как коллаген и эластин, из которых на 50% сухого веса состоит нормальная интима аорты брюшной части.
В спектре пропускания нормальной (не подверженной атеросклеротическим изменениям) tunica intima аорты не наблюдается других значительных полос поглощения - кривая 2 на фиг. 1. Существенным отличием спектра «больной» (подверженной атеросклеротическим изменениям) аорты является смещение полосы пропускания амид I в область более высоких волновых чисел, а полосы пропускания амид II - в область более низких. Кроме того, в спектрах «больной» аорты имеются полосы поглощения на частотах 1745 и 1157 см-1, что специфично для сложных эфиров холестерина (например, олеата холестерина). Частота поглощения 1745 см-1 соответствует валентным колебаниям связи С=O, частота 1157 см-1 - валентным колебаниям СО сложных эфиров.
Необходимо отметить, что спектр пропускания здоровой аорты практически не зависит от глубины исследуемого слоя в диапазоне 0-500 мкм, что является существенным отличием от пораженных атеросклерозом сосудов.
4. Определение среза, имеющего максимальное поглощение в диапазоне 1720-1760 см-1, который отвечает глубине залегания липидного ядра.
На фиг. 2 представлены ИК-спектры пропускания срезов с различной глубины стенки брюшной аорты (кривая 1 - 120 мкм; кривая 2 - 160 мкм; кривая 3 - 200 мкм; кривая 4 - 240 мкм; кривая 5 - 280 мкм). Анализ данных графиков показывает, что максимальное поглощение на частоте 1745 см-1 наблюдается у срезов, взятых на глубине 240 мкм. Это указывает на залегание липидного ядра АСБ на расстоянии 200-240 мкм от внутренней поверхности брюшной части аорты.
Заявляемый способ может найти применение при определении точных механизмов развития атеросклероза для дальнейшего целенаправленного лечения.
Источники информации
1. Черкавская О.В., Атьков О.Ю., Савченко А.П. Внутрисосудистое ультразвуковое исследование коронарных артерий. Клиническое применение // Визуализация в клинике. 2001. - №18. - С. 45-50.
2. Philip Stewart Low Diagnostic method for atherosclerosis // Патент США 7977058 B2, МПК G01N 33/53 от 12.07.2011.
3. Васильченко С.Ю., Лощенов В.Б., Ефремова Ю.Е., Тарарак Э.М., Кузьмин С.Г., Ворожцов Г.Н. Способ обнаружения бляшек с измененной метаболической активностью // Патент РФ №2480143, МПК А61В 5/00 (Бюллетень №12 от 27.04.2013).
4. Wrobel Т.Р., Mateuszuk L., Chlopicki S., Malekab K., Baranska M. Imaging of lipids in atherosclerotic lesion in aorta from ApoE/LDLR miceby FT-IR spectroscopy and Hierarchical Cluster Analysis // Analyst. 2011. - V. 136. - P. 5247-5255.
Способ определения глубины залегания липидных ядер атеросклеротических бляшек методом ИК-Фурье спектроскопии, заключающийся в том, что подготавливаются срезы атеросклеротически измененного участка сосудистого русла, записываются инфракрасные спектры пропускания подготовленных срезов, идентифицируются характеристические пики поглощения, отличающийся тем, что определяется срез, имеющий максимальное поглощение в диапазоне 1720-1760 см-1, соответствующем валентным колебаниям связей C=O сложных эфиров холестерина, который отвечает глубине залегания липидного ядра.