Нуклеозидные ингибиторы рнк-полимеразы hcv ns5b, способы их получения и применения
Иллюстрации
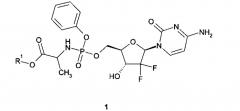
Показать всеИзобретение относится к С3алкиловым эфирам (S)-2-{[(2R,3R,5R)-5-(4-амино-2-оксо-2Н-пиримидин-1-ил)-4,4-дифтор-3-гидрокси-тетрагидрофуран-2-илметокси]фенокси-фосфориламино}-пропионовой кислоты общей формулы 1 и их фармацевтически приемлемым солям. Соединения обладают свойствами нуклеозидных ингибиторов РНК-полимеразы HCV NS5B и могут найти применение для лечения и профилактики вирусных заболеваний, таких как гепатит C. В формуле 1
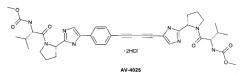
R1 представляют собой С1-С4алкил. Фармацевтическая композиция на основе соединения формулы 1 может дополнительно содержать ингибитор РНК-полимеразы NS5A, такой как Рибавирин, Рибамидин или гидрохлорид метилового эфира [(S)-1-((S)-2-{5-[4-(4-{2-[(S)-1-((S)-2-метоксикарбониламино-3-метил-бутирил)пирролидин-2-ил-3H-имидазол-4-ил]бута-1,3-диинил)фенил]-1H-имидазол-2-ил}пирролидин-1-карбонил)-2-метил-пропил]}-карбаминовой кислоты (AV-4025). 7 н. и 3 з.п. ф-лы, 1 табл., 12 пр.
Реферат
Настоящее изобретение относится к нуклеозидным ингибиторам РНК-полимеразы HCV NS5B, их использованию в качестве средства для ингибитора РНК-полимеразы HCV NS5B и лечения вирусных заболеваний. Более конкретно изобретение относится к нуклеозидным ингибиторам РНК-полимеразы HCV NS5B, которые представляют собой алкиловые эфиры (S)-2-{[(2R,3R,5R)-5-(4-амино-2-оксо-2Н-пиримидин-1-ил)-4,4-дифтор-3-гидрокси-тетрагидрофуран-2-илметокси]фенокси-фосфориламино}-пропионовой кислоты. Эти ингибиторы являются полезными для лечения гепатита С в организме млекопитающих.
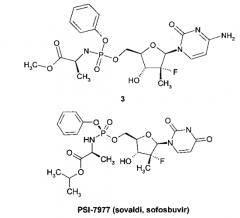
Примером такого ингибитора может служить PSI-7977 [М. J. Sofia, D. Bao, W. Chang et al. Discovery of a β-D-20-Deoxy-20-r-fluoro-20-β-C-methyluridine Nucleotide Prodrug (PSI-7977) for the Treatment of Hepatitis С Virus. J. Med. Chem. 2010, 53, 7202-7218] известного, как sovaldi and sofosbuvir [http://en.wikipedia.org/wiki/Sofosbuvir].
В настоящее время существует ограниченное количество одобренных терапевтических методов, которые повсеместно были бы признаны пригодными для лечения HCV-инфекции. В этой связи поиск новых высокоэффективных противофлавивирусных лекарственных препаратов в настоящее время по-прежнему является одним из основных направлений создания новых фармакологических средств для лечения широкого и разнообразного круга вирусных инфекций, в том числе HCV. Поэтому до настоящего времени является актуальным поиск новых ингибиторов NS5B, пригодных в качестве противовирусных активных компонентов для фармацевтических композиций и терапевтических средств для лечения HCV.
Ниже приведены определения терминов, которые использованы в описании этого изобретения.
«Алкил» означает алифатическую углеводородную линейную или разветвленную группу с 1-12 атомами углерода в цепи. Разветвленная означает, что алкильная цепь имеет один или несколько «низших алкильных» (C1-C6)алкильных заместителей. Предпочтительными алкильными группами являются низший (C1-C6) алкил или метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, циклопропилметил, циклобутилметил, циклопентилметил, н-пентил, 2-пентил, 3-пентил, неопентил, н-гексил, циклогексил. Алкил может иметь заместители.
«Активный компонент» (лекарственное вещество, лекарственная субстанция, drug-substance) означает физиологически активное вещество синтетического или иного (биотехнологического, растительного, животного, микробного и прочего) происхождения, обладающее фармакологической активностью и являющееся активным началом фармацевтической композиции, используемой для производства и изготовления лекарственного препарата (средства).
«Лекарственное средство (препарат)» - вещество (или смесь веществ в виде фармацевтической композиции) в виде таблеток, капсул, инъекций, мазей и других готовых форм, предназначенное для восстановления, исправления или изменения физиологических функций у человека и животных, а также для лечения и профилактики болезней, диагностики, анестезии, контрацепции, косметологии и прочего.
«Низший алкил» означает линейный или разветвленный алкил с 1-6 атомами углерода.
«Терапевтический коктейль» представляет одновременно администрируемую комбинацию двух и более лекарственных препаратов, обладающих различным механизмом фармакологического действия и направленных на различные биомишени, участвующие в патогенезе заболевания.
«Фармацевтическая композиция» обозначает композицию, включающую в себя несколько или один активный компонент и фармацевтически приемлемые и фармакологически совместимые наполнители, растворители, разбавители, носители, вспомогательные и распределяющие средства, средства доставки, такие как консерванты, стабилизаторы, наполнители, измельчители, увлажнители, эмульгаторы, суспендирующие агенты, загустители, подсластители, отдушки, ароматизаторы, антибактериальные агенты, фунгициды, лубриканты, регуляторы пролонгированной доставки, выбор и соотношение которых зависит от природы и способа назначения и дозировки. Примерами суспендирующих агентов являются этоксилированный изостеариловый спирт, полиоксиэтилен, сорбитол и сорбитовый эфир, микрокристаллическая целлюлоза, метагидроксид алюминия, бентонит, агар-агар и трагакант, а также смеси этих веществ. Защита от действия микроорганизмов может быть обеспечена с помощью разнообразных антибактериальных и противогрибковых агентов, например, таких как парабены, хлорбутанол, сорбиновая кислота и подобные им соединения. Композиция может включать также изотонические агенты, например, сахара, хлористый натрий и им подобные. Пролонгированное действие композиции может быть обеспечено с помощью агентов, замедляющих абсорбцию активного начала, например, моностеарат алюминия и желатин. Примерами подходящих носителей, растворителей, разбавителей и средств доставки являются вода, этанол, полиспирты, а также их смеси, растительные масла (такие как оливковое масло) и инъекционные органические сложные эфиры (такие как этилолеат). Примерами наполнителей являются лактоза, молочный сахар, цитрат натрия, карбонат кальция, фосфат кальция и им подобные. Примерами измельчителей и распределяющих средств являются крахмал, альгиновая кислота и ее соли, силикаты. Примерами лубрикантов являются стеарат магния, лаурилсульфат натрия, тальк, а также полиэтиленгликоль с высоким молекулярным весом. Фармацевтическая композиция для перорального, сублингвального, трансдермального, внутримышечного, внутривенного, подкожного, местного или ректального введения активного начала, одного или в комбинации с другим активным началом, может быть введена животным и людям в стандартной форме введения в виде смеси с традиционными фармацевтическими носителями. Пригодные стандартные формы введения включают пероральные формы, такие как таблетки, желатиновые капсулы, пилюли, порошки, гранулы, жевательные резинки и пероральные растворы или суспензии, сублингвальные и трансбуккальные формы введения, аэрозоли, имплантаты, местные, трансдермальные, подкожные, внутримышечные, внутривенные, интраназальные или внутриглазные формы введения и ректальные формы введения.
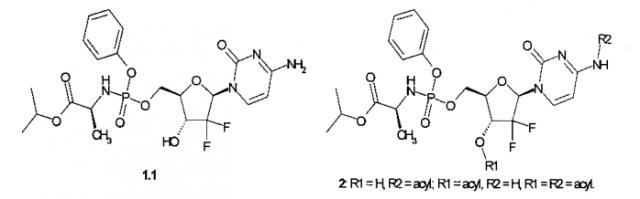
Известен, изопропиловый эфир (S)-2-{[(2R,3R,5R)-5-(4-амино-2-оксо-2Н-пиримидин-1-ил)-4,4-дифтор-3-гидрокси-тетрагидрофуран-2-илметокси]фенокси-фосфориламино}-пропионовой кислоты (1.1), который используется в качестве полуподукта синтеза его ацилпроизводных общей формулы 2 [Патент РФ 2534613 (2014)]. Известное соединение 1.1 испытывалось также в качестве потенциального противоракового препарата, однако оно показало по отношению к четырем раковым клеточным линиям (L1210, СЕМ, МР-2, ВхРС-3) низкую (IC50>5 μM) активность [M. Slusarczyk, M.H. Lopez, J. Balzarini, at al. Application of ProTide Technology to Gemcitabine: A Successful Approach to Overcome the Key Cancer Resistance Mechanisms Leads to a New Agent (NUC-1031) in Clinical Development. J. Med. Chem. 2014, 57, 1531-1542].
Известен также монофторзамещенный нуклеозид 3, обладающий слабой активностью (IC90=19.15 μM) по отношению к генотипу 1b (GT1b) NS5B [WO 2008121634]
Авторы данного изобретения неожиданно обнаружили, что известное соединение 1.1 оказалось мощным ингибитором NS5B (GT1b) с IC50=13.1 nM и IC90=28.2 nM (среднее из трех опытов), активность которого не только в 679 раз выше активности своего монофторзамещенного аналога 3, но и в ~5 выше активности PSI-7977 (IC50=64.8 nM и IC90=151.8 nM, в условиях, идентичных с условиями измерения активности соединения 1.1). Активность соединения 1.1 превышает также активность его ацильных аналогов 2 (IC50 от 14.4 nM до 60.9 nM) [Патент РФ 2534613 (2014)].
Предметом данного изобретения является нуклеозидный ингибитор РНК-полимеразы, представляющий собой алкиловый эфир (S)-2-{[(2R,3R,5R)-5-(4-амино-2-оксо-2Н-пиримидин-1-ил)-4,4-дифтор-3-гидрокси-тетрагидрофуран-2-илметокси]фенокси-фосфориламино}-пропионовой кислоты общей формулы 1 или его фармацевтически приемлемая соль
где R1 представляют собой C1-C4алкил.
Лучшие результаты достигаются, если нуклеозидный ингибитор РНК-полимеразы представляет собой изопропиловый эфир (S)-2-{[(2R,3R,5R)-5-(4-амино-2-оксо-2H-пиримидин-1-ил)-4,4-дифтор-3-гидрокси-тетрагидрофуран-2-илметокси]фенокси-фосфориламино}-пропионовой кислоты (1.1) или его фармацевтически приемлемую соль.
Предметом данного изобретения является активный компонент, обладающий свойствами нуклеозидного ингибитора РНК-полимеразы HCV NS5B, представляющий собой алкиловый эфир (S)-2-{[(2R,3R,5R)-5-(4-амино-2-оксо-2H-пиримидин-1-ил)-4,4-дифтор-3-гидрокси-тетрагидрофуран-2-илметокси]фенокси-фосфориламино}-пропионовой кислоты общей формулы 1 или его фармацевтически приемлемая соль.
Более предпочтительным активным компонентом является изопропиловый эфир (S)-2-{[(2R,3R,5R)-5-(4-амино-2-оксо-2Н-пиримидин-1-ил)-4,4-дифтор-3-гидрокси-тетрагидрофуран-2-илметокси]фенокси-фосфориламино}-пропионовой кислоты (1.1) или его фармацевтически приемлемая соль.
Предметом данного изобретения является фармацевтическая композиция для лечения и профилактики гепатита С в форме таблеток, капсул или инъекций, помещенных в фармацевтически приемлемую упаковку, не обязательно содержащая интерферон или пегилированный интерферон, ингибитор инозин-5-монофосфат дегидрогеназы, и/или ингибитор протеазы гепатита С NS3, и/или ингибитор протеазы гепатита С NS3/4A, и/или ингибитор РНК-полимеразы NS5A, включающая в терапевтически эффективном количестве соединение общей формулы 1 или его фармацевтически приемлемую соль.
Предпочтительной является фармацевтическая композиция, в которой в качестве ингибитора инозин-5-монофосфата дегидрогеназы используют Рибамидин, в качестве ингибитора протеазы гепатита С NS3 используют Asunaprevir (BMS-650032), в качестве ингибитора протеазы гепатита С NS3/4A используют Sofosbuvir (ТМС435), а в качестве ингибитора РНК-полимеразы NS5A используют Daclatasvir (BMS-790052) или AV-4025. Использование такой композиции позволяет избежать возникновения резистентных форм HCV.
Более предпочтительной является также фармацевтическая композиция, содержащая в терапевтически эффективном количестве изопропиловый эфир (S)-2-{[(2R,3R,5R)-5-(4-амино-2-оксо-2Н-пиримидин-1-ил)-4,4-дифтор-3-гидрокси-тетрагидрофуран-2-илметокси]фенокси-фосфориламино}-пропионовой кислоты (1.1) или его фармацевтически приемлемую соль и гидрохлорид метилового эфира [(S)-1-((S)-2-{5-[4-(4-{2-[(S)-1-((S)-2-метоксикарбониламино-3-метил-бутирил)пирролидин-2-ил-3H-имидазол-4-ил]бута-1,3-диинил)фенил]-1Н-имидазол-2-ил}пирролидин-1-карбонил)-2-метил-пропил]}-карбаминовой кислоты (AV-4025) в качестве ингибитора NS5A по патенту RU 2452735 (2012).
Предметом данного изобретения является лекарственное средство, содержащее в качестве активного начала эффективное количество соединения общей формулы 1 или его фармацевтически приемлемую соль для лечения любого состояния, обусловленного вирусом гепатита С.
Предпочтительным является лекарственное средство, содержащее в качестве активного начала эффективное количество изопропилового эфира (S)-2-{[(2R,3R,5R)-5-(4-амино-2-оксо-2Н-пиримидин-1-ил)-4,4-дифтор-3-гидрокси-тетрагидрофуран-2-илметокси]фенокси-фосфориламино}-пропионовой кислоты (1.1) или его фармацевтически приемлемую соль.
Более предпочтительным является также лекарственное средство, содержащее в качестве активного начала эффективное количество изопропилового эфира (S)-2-{[(2R,3R,5R)-5-(4-амино-2-оксо-2H-пиримидин-1-ил)-4,4-дифтор-3-гидрокси-тетрагидрофуран-2-илметокси]фенокси-фосфориламино}-пропионовой кислоты (1.1) или его фармацевтически приемлемую соль и гидрохлорида метилового эфира [(S)-1-((S)-2-{5-[4-(4-{2-[(S)-1-((S)-2-метоксикарбониламино-3-метил-бутирил)пирролидин-2-ил-3H-имидазол-4-ил]бута-1,3-диинил)фенил]-1Н-имидазол-2-ил}пирролидин-1-карбонил)-2-метил-пропил]-карбаминовой кислоты (AV-4025).
Лекарственные средства могут вводиться перорально или парентерально (например, внутривенно, подкожно, внутрибрюшинно, местно или ректально). Клиническая дозировка активного компонента (субстанции), фармацевтической композиции или лекарственного комбинированного средства, включающих фармацевтически эффективное количество активного компонента, у пациентов может корректироваться в зависимости от терапевтической эффективности и биодоступности активных ингредиентов в организме, скорости их обмена и выведения из организма, а также в зависимости от возраста, пола и стадии заболевания пациента, при этом суточная доза у взрослых обычно составляет 10-500 мг, предпочтительно - 50-300 мг. Поэтому во время приготовления фармацевтических композиций по настоящему изобретению в виде единиц дозировки необходимо учитывать вышеназванную эффективную дозировку, при этом каждая единица дозировки препарата должна содержать 10-500 мг, предпочтительно - 50-300 мг. В соответствии с указаниями врача или фармацевта данные препараты могут приниматься несколько раз в течение определенных промежутков времени (предпочтительно - от одного до шести раз).
Предметом данного изобретения является способ лечения заболевания, обусловленного вирусом гепатита С, который включает введение терапевтически эффективного количества соединения общей формулы 1, или его фармацевтически приемлемой соли, или фармацевтической композиции, содержащей соединения общей формулы 1 или его фармацевтически приемлемой соли.
Более предпочтительным способом лечения заболевания, обусловленного вирусом гепатита С у субъектов, нуждающихся в этом, является способ, который включает введение терапевтически эффективного количества изопропилового эфира (S)-2-{[(2R,3R,5R)-5-(4-амино-2-оксо-2Н-пиримидин-1-ил)-4,4-дифтор-3-гидрокси-тетрагидрофуран-2-илметокси]фенокси-фосфориламино}-пропионовой кислоты (1.1) или его фармацевтически приемлемой соли.
Более предпочтительным способом лечения заболевания, обусловленного вирусом гепатита С у субъектов, нуждающихся в этом, является также способ, который включает введение терапевтически эффективного количества изопропилового эфира (S)-2-{[(2R,3R,5R)-5-(4-амино-2-оксо-2Н-пиримидин-1-ил)-4,4-дифтор-3-гидрокси-тетрагидрофуран-2-илметокси]фенокси-фосфориламино}-пропионовой кислоты (1.1) или его фармацевтически приемлемой соли и гидрохлорида метилового эфира [(S)-l-((S)-2-{5-[4-(4-{2-[(S)-1-((S)-2-метоксикарбониламино-3-метил-бутирил)пирролидин-2-ил-3Н-имидазол-4-ил]бута-1,3-диинил)фенил]-1Н-имидазол-2-ил}пирролидин-1-карбонил)-2-метил-пропил]}-карбаминовой кислоты (AV-4025).
Клиническая дозировка фармацевтической композиции для лечения и профилактики вирусных инфекций, включая гепатит С, в форме таблеток, капсул или инъекций, помещенных в фармацевтически приемлемую упаковку, не обязательно содержащей ингибитор инозин-5-монофосфат дегидрогеназы, и/или ингибитор протеазы гепатита С NS3, и/или ингибитор протеазы гепатита С NS3/4A, и/или ингибитор РНК-полимеразы NS5A, включающая соединение общей формулы 1 или его фармацевтически приемлемую соль, у пациентов может корректироваться в зависимости от: терапевтической эффективности и биодоступности активных ингредиентов в организме, скорости их обмена и выведения из организма, а также в зависимости от возраста, пола и стадии заболевания пациента, при этом суточная доза у взрослых обычно составляет 10~500 мг. Поэтому во время приготовления фармацевтических композиций по настоящему изобретению в виде единиц дозировки необходимо учитывать вышеназванную эффективную дозировку, при этом каждая единица дозировки препарата должна содержать 10~500 мг нового нуклеозидного ингибитора РНК-полимеразы HCV NS5B общей формулы 1 или его фармацевтически приемлемую соль. В соответствии с указаниями врача или фармацевта данные препараты могут приниматься несколько раз в течение определенных промежутков времени (предпочтительно - от одного до шести раз).
Для комбинированной терапии любые классы агентов, которые могут оказаться полезными, будучи объединены с соединениями настоящего изобретения в фармацевтическую композицию, и которые могут подразумевать, например, нуклеозидные и ненуклеозидные ингибиторы HCV-полимеразы, ингибиторы протеазы, ингибиторы геликазы и медицинские агенты, которые функционально ингибируют внутренний рибосомный сайт вхождения (IRES) и другие медикаменты, которые ингибируют прикрепление или вхождение вируса в клетки, транскрибирование HCV RNA, репликацию, созревание или ослабление вируса. Специфические соединения в этих классах и полезные в этом изобретении включают, но не ограничивают макроциклические, гетероциклические и линейные ингибиторы протеазы HCV, такие как telaprevir (VX-950), boceprevir (SCH-503034), narlaprevir (SCH-900518), ITMN-191 (R-7227), TMC-435350 (a.k.a. TMC-435), MK-7009, BI-201335, BI-2061 (ciluprevir), ACH-1625, ACH-1095 (HCV NS4A ингибитор сопутствующего фактора протеазы) VX-500, VX-813, PHX-1766, PHX2054, IDX-136, IDX-316, АВТ-450 EP-013420 (и родственные) и VBY-376; ингибиторы нуклеозидной HCV-полимеразы (репликазы), полезные в данном изобретении, включают, но не ограничены следующим: R7128, IDX-184, IDX-102, R1479, UNX-08189, PSI-6130, PSI-938 и PSI-879 и различные другие нуклеозиды и нуклеотидные аналоги и HCV-ингибиторы, включающие (но не ограничивающие) происходящие от 2′-С-метил модифицированные нуклеозиды и нуклеотиды; и 7′-деаза модифицированные нуклеозиды и нуклеотиды. Ингибиторы не-нуклеозидной HCV-полимеразы (репликазы), полезные в данном изобретении, включают, но не ограничены: HCV-796, HCV-371, VCH-759, VCH-916, VCH-222, ANA-598, МК-3281, АВТ-333, АВТ-072, PF-00868554, BI-207127, GS-9190, А-837093, JKT-109, GL-59728 и GL-60667.
Кроме того, новые нуклеозидные ингибиторы РНК-полимеразы HCV NS5B общей формулы 1 или их фармацевтически приемлемые соли могут быть использованы в фармацевтической композиции в комбинации с антагонистами циклофиллина и имунофиллина (например, без ограничений DEBIO соединения, NM-811, а также циклоспорин и его производные), ингибиторы киназ, ингибиторы протеинов теплового шока (напр. HSP90, HSP70), другие иммуномодуляторные агенты, которые могут включать без ограничения интерфероны (альфа-, бета-, омега-, гамма-, lambda или синтетические), такие как Intron A™, Roferon- A™, Canferon-A300™, Advaferon™, Infergen™, Humoferon™, Sumiferon MP™, Alfaferon™, IFN-β™, Feron™, и подобные интерфероновые соединения, дериватизированные полиэтиленгликолем (pegylated), такие как: PEG interferon-α-2a (Pegasys™), PEG interferon-α-2b (PEGIntron™), pegylated IFN-α-con 1 и подобные; пролонгированные формулы и производные интерфероновых соединений, такие как альбумин-конденсированный интерферон, Albuferon™, Locteron™, и подобные; интерфероны с различными типами контролируемой доставки (напр, 1ТСА-638, омега-интерферон, доставляемый DUROS подкожной системой доставки); соединения, которые стимулируют синтез интерферона в клетках, такие как resiquimod и подобные; интерлейкины; соединения, которые улучшают развитие отклика клетки type 1 helper T, такие как SCV-07 и подобные; TOLL- подобные агонисты рецепторов, такие как: CpG-10101 (action), isotorabine, ANA773 и подобные; thymosin α-1, ANA-245 и ANA-246, гистамин дигидрохлорид, propagermanium; tetrachlorodecaoxide; ampligen; IMP-321; KRN-7000; антитела, такие как: civacir, XTL-6865 и подобные профилактические и терапевтические вакцины, такие как: Inno Vac, HCV E1E2/MF59 и подобные. В добавление, любой из вышеописанных методов, включающий введение NS5B ингибитора, агонист рецептора интерферона типа 1 (напр. IFN-α) и агонист рецептора интерферона типа Π (напр. IFN-γ) могут быть усилены введением эффективного количества TNF-α антагониста. Типичные неограничивающие TNF-α антагонисты, которые подходят для использования в такой комбинированной терапии, - ENBREL™ и HUMIRA™.
В дополнение, новый нуклеозидный ингибитор РНК-полимеразы HCV NS5B общей формулы 1 или его фармацевтически приемлемая соль могут быть использованы в фармацевтической композиции в комбинации с антипротозоанами, а другие антивирусы считаются эффективными при лечении HCV-инфекции, такие как: пролекарство nitazoxanide. Nitazoxanide может быть использован как агент в комбинации с соединениями, раскрытыми в этом изобретении, а также в комбинации с другими агентами, полезными при лечении HCV-инфекции, такими как: peginterferon alfa-2a и ribavarin (напр. Rossignol, JF и Keeffe, ЕВ, Future Microbiol. 3:539-545, 2008).
Новый нуклеозидный ингибитор РНК-полимеразы HCV NS5B общей формулы 1 или его фармацевтически приемлемая соль могут быть также использованы в фармацевтической композиции с альтернативными формами интерферонов и пегилированных интерферонов, ribavirin или его аналоги (напр. Tarabavarin, levovirion), microRNA, маловредные RNA-соединения (напр. SIRPLEX-140-N и подобные), аналоги нуклеотидов или нуклеозидов, иммуноглобулины, гепатопротекторы, противовоспалительные агенты и другие ингибиторы NS5B. Ингибиторы других мишеней в жизненном цикле HCV включают ингибиторы NS3 геликазы; ингибиторы NS4A кофактора, ингибиторы антисмысловых олигонуклеотидов, такие как: ISIS-14803, AVI-4065 и подобные; вектор-зашифрованная короткая «шпилька» RNA (shRNA); HCV специфические рибозимы такие как: heptazyme, RPI, 139199 и подобные; ингибиторы вхождения, такие как: НереХ-С, HuMax-НерС и подобные; ингибиторы альфа-глюкозидазы, такие как: celgosivir, UT-231B и подобные; КРЕ-02003002 и BIVN 401 и IMPDH ингибиторы. Другие показательные соединения - ингибиторы HCV включают ингибиторы, раскрытые в известных научных и патентных публикациях.
Дополнительно, комбинации, например, рибавирина и интеферона могут быть введены как комбинированная терапия, по крайней мере, с одним новым нуклеозидным ингибитором РНК-полимеразы HCV NS5B общей формулы 1 или его фармацевтически приемлемой солью. Настоящее изобретение не ограничивается вышеуказанными классами или соединениями и рассматривает известные и новые соединения и комбинации биологически активных агентов. Имеется в виду, что комбинированные терапии настоящего изобретения включают любые химические совместимые комбинации нового нуклеозидного ингибитора РНК-полимеразы HCV NS5B общей формулы 1 или его фармацевтически приемлемой соли с другими соединениями этой патентуемой группы или другими соединениями вне этой патентной группы, а также комбинация не исключает антивирусную активность соединения этой патентной группы или антивирусную активность самой фармацевтической композиции.
Комбинированная терапия может быть последовательной, т.е. лечение сначала одним агентом, а затем другим (например, когда каждый этап лечения подразумевает другое соединение настоящего изобретения, или когда один этап лечения включает соединение настоящего изобретения, а другой подразумевает один или более биологически активных агентов) или, может быть, лечение с обоими агентами одновременно. Последовательная терапия может включать существенное время после завершения первой терапии и до начала второй терапии. Лечение обоими агентами в одно и то же время может осуществляться в одной ежедневной дозе или в разных дозах. Комбинированная терапия не нуждается в ограничении двумя агентами и может включать три или более агентов. Дозы для одновременной и последовательной комбинированной терапии будут зависеть от всасывания, распределения, скоростей обмена веществ и выведения компонентов комбинированной терапии, а также других факторов, хорошо известных специалисту. Размер дозы будет также изменяться в зависимости от тяжести состояния, которое нужно облегчить. Следует понимать, что для каждого особого субъекта специфическая схема приема доз и расписание могут быть отрегулированы по времени в соответствии с потребностью индивидуума и профессиональным суждением лица, которое лечит или наблюдает за лечением методом комбинированной терапии.
Несмотря на то, что вышеприведенное изобретение было описано в некоторых деталях с помощью иллюстраций и примеров с целью облегчить понимание, для специалиста в этой области совершенно очевидно, что с учетом основной идеи этого изобретения возможны некоторые изменения и модификации, не отклоняясь от цели и объема изобретения, как определено в приложенной формуле изобретения.
Представленные ниже примеры иллюстрируют, но не ограничивают данное изобретение.
Пример 1. Способ получения алкил (S)-2-{[(2R,3R,5R)-5-(4-амино-2-оксо-2H-пиримидин-1-ил)-4,4-дифтор-3-гидрокси-тетрагидрофуран-2-илметокси]фенокси-фосфориламино}-пропионатов общей формулы 1. Раствор 1,83 ммоль 4-амино-1-((2R,4R,5R)-3,3-дифтор-4-гидрокси-5-гидроксиметил-тетрагидрофуран-2-ил)-lH-пиримидин-2-она и 10,98 ммоль (875 мкл) N-метилимидазола в 10 мл ТГФ перемешивают 30 мин при 0°C, добавляют по каплям раствор 5,49 ммоль (S)-алкил-2-(хлор(фенокси)фосфориламино)пропионата в 10 мл дихлорметана при 0°C и перемешивают в течение 16 часов при комнатной температуре. К реакционной массе добавляют 0,3 мл метанола, перемешивают 10 мин. Затем к реакционной массе добавляют 20 мл этилацетата, промывают 5% соляной кислотой, нас. раствором NaHCO3, сушат над NA2SO4 и упаривают в вакууме. Остаток хроматографируют на силикагеле, элюент хлороформ:метанол 9:1. Если необходимо, проводят дополнительную очистку при помощи ВЭЖХ без кислоты. Получают целевой продукт общей формулы 1, в том числе: изопропил (S)-2-{[(2R,3R,5R)-5-(4-амино-2-оксо-2H-пиримидин-l-ил)-4,4-дифтор-3-гидрокси-тетрагидрофуран-2-илметокси]фенокси-фосфориламино}-пропионат (1.1), LC-MS m/e 533 (М+1), 1H ЯМР (DMSO-d6, 400 МГц):7,70 (д, J=9,6 Гц, 1H), 7,40 (м, 4Н), 7,21 (м, 3Н), 6,30 (м, 1Н), 6,20 (м, 1Н), 5,80 (д, J=9,6 Гц, 1Н), 5,20 (уш. с, 1Н), 5,01 (м, 1Н), 4,86 (м, 1Н), 4,05 (м, 1Н), 3,78 (м, 2Н), 3,61 (м, 1Н), 1,25 (м, 3Н), 1,16 (м, 6Н); метил (S)-2-{[(2R,3R,5R)-5-(4-амино-2-оксо-2Н-пиримидин-1-ил)-4,4-дифтор-3-гидрокси-тетрагидрофуран-2-илметокси]фенокси-фосфориламино}-пропионат (1.2), LC-MS m/r 505 (М+1).
Пример 2. Фармацевтическая композиция в форме таблеток. Смешивают 34 г крахмала, 34 г измельченной лактозы, 10 г талька и 20 г изопропил (S)-2-{[(2R,3R,5R)-5-(4-амино-2-оксо-2Н-пиримидин-1-ил)-4,4-дифтор-3-гидрокси-тетрагидрофуран-2-илметокси]фенокси-фосфориламино}-пропионата (1.1). Полученный брусок измельчают в гранулы и просеивают через сита, собирая гранулы размером 14-16 меш. Полученные гранулы таблетируют в подходящую форму таблетки весом 600 мг каждая.
Пример 3. Фармацевтическая композиция в форме таблеток. Смешивают 34 г крахмала, 34 г измельченной лактозы, 10 г талька и 20 г изопропил (S)-2-{[(2R,3R,5R)-5-(4-амино-2-оксо-2Н-пиримидин-1-ил)-4,4-дифтор-3-гидрокси-тетрагидрофуран-2-илметокси]фенокси-фосфориламино}-пропионата (1.1) и 2 г гидрохлорида метилового эфира [(S)-1-((S)-2-{5-[4-(4-{2-[(S)-1-((S)-2-метоксикарбониламино-3-метил-бутирил)пирролидин-2-ил-3Н-имидазол-4-ил]бута-1,3-диинил)фенил]-1Н-имидазол-2-ил}пирролидин-1-карбонил)-2-метил-пропил]}-карбаминовой кислоты (AV-4025). Полученный брусок измельчают в гранулы и просеивают через сита, собирая гранулы размером 14-16 меш. Полученные гранулы таблетируют в подходящую форму таблетки весом 600 мг каждая.
Пример 4. Фармацевтическая композиция в форме таблеток. Смешивают 34 г крахмала, 34 г измельченной лактозы, 10 г талька и 20 г изопропил (S)-2-{[(2R,3R,5R)-5-(4-амино-2-оксо-2Н-пиримидин-1-ил)-4,4-дифтор-3-гидрокси-тетрагидрофуран-2-илметокси]фенокси-фосфориламино}-пропионата (1.1). Полученный брусок измельчают в гранулы и просеивают через сита, собирая гранулы размером 14-16 меш. Полученные гранулы таблетируют в подходящую форму таблетки весом 600 мг каждая, которые используют совместно с таблетками AV-4025.
Пример 5. Фармацевтическая композиция в форме таблеток. Смешивают 34 г крахмала, 34 г измельченной лактозы, 10 г талька и 20 г изопропил (S)-2-{[(2R,3R,5R)-5-(4-амино-2-оксо-2Н-пиримидин-1-ил)-4,4-дифтор-3-гидрокси-тетрагидрофуран-2-илметокси]фенокси-фосфориламино}-пропионата (1.1). Полученный брусок измельчают в гранулы и просеивают через сита, собирая гранулы размером 14-16 меш. Полученные гранулы таблетируют в подходящую форму таблетки весом 600 мг каждая, которые используют совместно с таблетками Рибавирина.
Пример 6. Фармацевтическая композиция в форме капсул. Тщательно смешивают изопропил (S)-2-{[(2R,3R,5R)-5-(4-амино-2-оксо-2H-пиримидин-1-ил)-4,4-дифтор-3-гидрокси-тетрагидрофуран-2-илметокси]фенокси-фосфориламино}-пропионат (1.1) с порошком лактозы в соотношении 2:1. Полученную порошкообразную смесь упаковывают по 300 мг в желатиновые капсулы подходящего размера.
Пример 7. Фармацевтическая композиция в форме капсул. Тщательно смешивают изопропил (S)-2-{[(2R,3R,5R)-5-(4-амино-2-оксо-2H-пиримидин-1-ил)-4,4-дифтор-3-гидрокси-тетрагидрофуран-2-илметокси]фенокси-фосфориламино}-пропионат (1.1) с порошком лактозы в соотношении 2:1. Полученную порошкообразную смесь упаковывают по 300 мг в желатиновые капсулы подходящего размера, которые используют совместно с таблетками или капсулами AV-4025.
Пример 8. Фармацевтическая композиция в форме капсул. Тщательно смешивают изопропил (S)-2-{[(2R,3R,5R)-5-(4-амино-2-оксо-2Н-пиримидин-1-ил)-4,4-дифтор-3-гидрокси-тетрагидрофуран-2-илметокси]фенокси-фосфориламино}-пропионат (1.1) и с порошком лактозы в соотношении 2:1. Полученную порошкообразную смесь упаковывают по 300 мг в желатиновые капсулы подходящего размера, которые используют совместно с таблетками Рибавирина.
Пример 9. Фармацевтическая композиция в форме капсул. Тщательно смешивают изопропил (S)-2-{[(2R,3R,5R)-5-(4-амино-2-оксо-2Н-пиримидин-1-ил)-4,4-дифтор-3-гидрокси-тетрагидрофуран-2-илметокси]фенокси-фосфориламино}-пропионат (1.1) и AV-4025 с порошком лактозы в соотношении 2: 0,2: 1. Полученную порошкообразную смесь упаковывают по 320 мг в желатиновые капсулы подходящего размера.
Пример 10. Фармацевтическая композиция в форме капсул. Тщательно смешивают изопропил (S)-2-{[(2R,3R,5R)-5-(4-амино-2-оксо-2Н-пиримидин-1-ил)-4,4-дифтор-3-гидрокси-тетрагидрофуран-2-илметокси]фенокси-фосфориламино}-пропионат (1.1) и AV-4025 с порошком лактозы в соотношении 2: 0,2: 1. Полученную порошкообразную смесь упаковывают по 640 мг в желатиновые капсулы подходящего размера.
Пример 11. Определение противовирусной активности (EC50) нуклеозидных ингибиторов РНК-полимеразы HCV NS5B общей формулы 1.
Противовирусную активность (EC50) нуклеозидных ингибиторов РНК-полимеразы HCV NS5B общей формулы 1 (далее - тестируемые вещества) определяли в клеточной линии гепатомы человека Huh7, содержащей субгеномный РНК-репликон HCV (генотип 1b, 1а и 2а). Для количественного определения вирусной репликации был использован вариант иммунного теста ИФА на вирусный кор-антиген в 96-луночном формате. Цитотоксичность (ЦК50) тестируемых веществ оценивали в параллельном режиме. В качестве препарата сравнения использовался PSI-7977. Клетки Huh7 высевались в 96-луночные планшеты (7.5×103 клеток на лунку в 100 мкл питательной среды). Растворы тестируемых соединений в среде ДМЕМ {DMEM) IX; Источник: Cellgro; Каталог: 10-013-CV} готовились непосредственно перед использованием. Всего готовилось одиннадцать серийных трехкратных разведений с концентрацией от 20 нМ до 0,2 пМ. Через 4 часа после высевания клеток серийные разведения препаратов добавлялись к клеткам (100 мкл на лунку). Конечная концентрация тестируемых соединений составляла от 10 нМ до 0,1 пМ, а ДМСО - 0.5%. При необходимости исследовались более высокие концентрации тестируемых веществ. Каждое разведение препарата тестировалось на двух идентичных лунках. Далее клетки инкубировали в течение трех дней при 37°C/5% CO2. Клетки фиксировали добавлением 250 мкл/лунку смеси ацетон/метанол (1:1). Через 1 минуту клетки трижды промывали раствором PBS (Phosphate Buffered Saline). После этого клетки блокировали добавлением 150 мкл/лунку 10% фетальной телячьей сыворотки в растворе PBS на 1 час при комнатной температуре. Далее клетки инкубировали с мышиными моноклональными антителами к кор-антигену HCV, клон С7-50 (Источник: Affinity BioReagents; Каталог: МА1-080) (100 мкл/лунку, рабочее разведение - 1:500 в 10% фетальной телячьей сыворотке в растворе PBS) в течение двух часов при 37°C. Клетки промывали 6 раз раствором PBS/0.05% Твин 20, после чего инкубировали в течение 1 часа с антителами козы к иммуноглобулинам мыши (конъюгированными с пероксидазой хрена, 100 мкл/лунку, рабочее разведение - 1:2500 в 10% фетальной телячьей сыворотке в растворе PBS). Клетки промывали 6 раз раствором PBS/0.05% Твин 20, один раз раствором PBS, после чего добавляли 100 мкл/лунку субстрата (1 таблетка ОПД + 12 мл цитрат/фосфатного буфера + 5 мкл 30% H2O2). Планшеты выдерживали 30 мин в темноте при комнатной температуре. Реакцию останавливали добавлением 100 мкл/лунку 2N H2SO4, и измеряли оптическую плотность (длина волны 490 нм) при помощи многоканального спектрофотометра Victor3 V 1420 (Perkin Elmer). Значения ИК50 (концентрация тестируемого вещества, понижающая уровень вирусного РНК-репликона на 50%) для каждого вещества рассчитывали при помощи программы XLfit 4. Результаты представлены в Таблице 1.
Пример 12. Определение цитотоксичности нуклеозидных ингибиторов РНК-полимеразы HCV NS5B общей формулы 1.
Цитотоксичность (ЦК50) тестируемых веществ изучалась в опытах на культуре линии клеток гепатомы человека Huh7. Метаболическую активность клеток определяли при помощи набора ATPLite (Perkin Elmer, Бостон, США) в соответствии с инструкциями производителя. Цитотоксическое действие оценивали, высеивая клетки в черной микроплате с прозрачным дном (96 ячеек, 104 клеток на лунку). Для каждого тестируемого вещества использовали три независимых повтора. Тестируемые вещества добавляли через 18 часов, после чего клетки инкубировали с веществами в течение 96 часов. Промывали дважды каждую лунку фосфатно-солевым буфером (0,2 мл/лун) и затем лизировали клетки добавлением клеточного буфера (50 мкл/лун) (все указанные реактивы входят в комплект набора ATPLite). Микроплату инкубировали в течение 5 минут на вращающейся платформе при 600 об/мин, после чего добавляли в каждую лунку 50 мкл раствора субстрата (часть набора ATPLite). Инкубировали еще 5 минут на вращающейся платформе при 600 об/мин, выдерживали 10 минут в темноте и затем измеряли люминесценцию на приборе TopCount NXT (Packard, Perkin Elmer). В качестве количественного параметра для оценки цитотоксичности использовали величину ЦК50, которая соответствует концентрации тестируемого вещества, при которой погибает 50% клеток. Расчет параметра ЦК50: для расчета эффективности ингибирования (% Инг) использовали формулу: % Инг=[(Лпоз-Лэкс)/Лпоз-Лотр)]*100%, где Лпоз - положительный контроль, люминесценция в ячейках с клетками без вещества; Лотр - отрицательный контроль, люминесценция в ячейках со средой без клеток; Лэкс - люминесценция в ячейках с веществом в определенной концентрации. Значения ЦК50 затем расчитывали при помощи программы XLfit 4. Результаты представлены в Таблице 1.
1. Алкиловый эфир (S)-2-{[(2R,3R,5R)-5-(4-амино-2-оксо-2H-пиримидин-1-ил)-4,4-дифтор-3-гидрокси-тетрагидрофуран-2-илметокси]фенокси-фосфориламино}-пропионовой кислоты общей формулы 1 или его фармацевтически приемлемая соль, обладающие свойствами нуклеозидного ингибитора РНК-полимеразы HCV NS5B где R1 представляют собой C3алкил.
2. Применение соединения общей формулы 1 или его фармацевтически приемлемой соли в качестве активного компонента, обладающего свойствами нуклеозидного ингибитора РНК-полимеразы HCV NS5B где R1 имеет вышеуказанное значение.
3. Применение по п. 2, где активный компонент представляет собой изопропиловый эфир (S)-2-{[(2R,3R,5R)-5-(4-амино-2-оксо-2H-пиримидин-1-ил)-4,4-дифтор-3-гидрокси-тетрагидрофуран-2-илметокси]фенокси-фосфориламино}-пропионовой кислоты формулы 1.1 или его фармацевтически приемлемую соль
4. Способ ингибирования РНК-полимеразы HCV NS5B контактированием РНК-полимеразы HCV NS5B с соединением общей формулы 1 или его фармацевтически приемлемой солью.
5. Фармацевтическая композиция, обладающая свойствами ингибитора РНК-полимеразы HCV NS5B, пригодная для лечения и профилактики гепатита C, содержащая в терапевтически эффективном количестве соединение общей формулы 1 или его фармацевтически приемлемую соль по п. 1 или активный компонент по любому из пп. 2 и 3.
6. Фармацевтическая композиция, обладающая свойствами ингибитора РНК-полимеразы HCV NS5B, пригодная для лечения и профилактики гепатита С, содержащая в терапевтически эффективном количестве соединение общей формулы 1 или его фармацевтически приемлемую соль по п. 1, активный компонент по любому из пп. 2 и 3 и активный компонент, выбранный из группы, включающей ингибитор инозин-5-монофосфат дегидрогеназы и ингибитор РНК-полимеразы NS5A.
7. Фармацевтическая композиция по п. 6, в которой в качестве ингибитора инозин-5-монофосфата дегидрогеназы выбран Рибавирин или Рибамидин.
8. Фармацевтическая композиция по п. 6, в которой в качестве ингибитора РНК-полимеразы NS5A выбран гидрохлорид метилового эфира [(S)-1-((S)-2-{5-[4-(4-{2-[(S)-1-((S)-2-метоксикарбониламино-3-метил-бутирил)пирролидин-2-ил-3H-имидазол-4-ил]бута-1,3-диинил)фенил]-1H-имидазол-2-ил}пирролидин-1-карбонил)-2-метил-пропил]}-карбаминовой кислоты (AV-4025).
9. Лекарственное средство для лечения и профилактики гепатита C, содержащее в эффективном количестве соеди