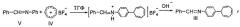Способ получения 4-(7-циклогепта-1,3,5-триенил)анилина и его гидрохлорида, проявляющих антимикробную активность
Иллюстрации
Показать всеИзобретение относится к улучшенному способу получения 4-(7-циклогепта-1,3,5-триенил)анилина формулы I. Указанное соединение обладает противомикробной активностью и является малотоксичным соединением. Способ заключается в тропилировании N-бензилиденанилина тетрафторборатом тропилия в течение 3-18 часов, с последующей нейтрализацией полученного соединения для получения N-бензилиден-4-(7-циклогепта-1,3,5-триенил)анилина, который гидролизуют соляной кислотой в среде бензола, полученный гидрохлорид обрабатывают основанием. Способ осуществляют согласно следующей схеме
,
Способ позволяет получить продукт с высоким выходом и упростить процесс за счет исключения токсичных и взрывоопасных веществ. Способ может быть использован в производственных масштабах. 3 пр.
Реферат
Изобретение относится к области органической химии, а именно способу получения 4-(7-циклогепта-1,3,5-триенил)анилина, обладающего высокой антимикробной активностью в отношении ряда грамположительных бактерий рода Staphylococcus, а также рода Streptococcus и Salmonella.
В связи с ухудшением экологической ситуации в большинстве стран и связанным с ней снижением естественного иммунитета участились случаи гнойно-септических поражений тканей и органов, вызванных коагулазоотрицательными видами, которые встречаются на коже и слизистых оболочках человека (Staphylococcus epidermis, Staphylococcus saprophyticus, Staphylococcus cohnii, Staphylococcus haemolyticus, Staphylococcus auricularis и др.).
Известен способ получения пара-аминофенилтропилидена, заключающийся во взаимодействии анилина с 7-этокси-1,3,5-циклогептатриеном в присутствии кислот (K. Takahashi, S. Takenaka and Т. Nozoe, «Cyclic Cross-Conjugated Hydrocarbons Having Inserted p-Quinoid Ring-I′». Tetrahedron, Vol. 30, 1974. pp. 2191 - to 2195).
Недостатком этого способа является образование трудноразделимой смеси изомеров пара-аминофенилтропилидена.
Наиболее близким способом получения 4-(7-циклогепта-1,3,5-триенил)анилина [другое название этого же соединения - 4-(1-циклогепта-2,4,6-триенил)анилин] является способ его получения, заключающийся во взаимодействии анилина с перхлоратом тропилия (Патент №2479571, кл. С07С 13/24, С07С 211/44, А61Р 31/04, А61Р 31/10, опубл. 20.04.2013, RU).
Недостатком данного способа является использование для синтеза 4-(7-циклогепта-1,3,5-триенил)анилина взрывчатого перхлората тропилия.
Технический результат изобретения - разработка безопасного способа получения соединения 4-(7-циклогепта-1,3,5-триенил)анилина формулы I, позволяющего избежать применение взрывчатого перхлората тропилия и получить продукт в производственных масштабах.
Сущность изобретения заключается в следующем.
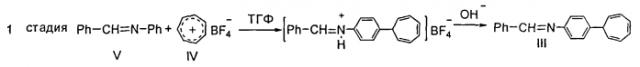
Соединение формулы I получают в 2 стадии: 1-я стадия - синтез N-бензилиден-4-(7-циклогепта-1,3,5-триенил)анилина формулы II осуществляют взаимодействием эквимолярных количеств тетрафторбората тропилия формулы III с N-бензилиденанилином формулы IV, используемых в соотношении 1:1 в среде тетрагидрофурана при перемешивании смеси при комнатной температуре в течение 3-18 часов и последующей ее нейтрализации до рН=7; 2-я стадия - гидролиз продукта формулы II 2 н соляной кислотой в присутствии бензола, сопровождающийся образованием соединения формулы V, щелочная обработка которого приводит к продукту формулы I. Реакции идут по схеме 1:
Схема 1
Синтез соединения формулы I через промежуточный продукт формулы II по схеме 1 позволяет избежать использования взрывчатого перхлората тропилия, что дает возможность рекомендовать соединение формулы I для дальнейших исследований с целью внедрения в производственную практику.
Изобретение иллюстрируется следующими примерами.
Пример 1. Получение N-бензилиден-4-(7-циклогепта-1,3,5-триенил)анилина формулы II.
Реакционную смесь, содержащую 0,9 г N-бензилиденанилина формулы IV и 0,9 г тетрафторбората тропилия формулы III в 15 мл тетрагидрофурана, перемешивают в течение 3 часов при комнатной температуре, затем нейтрализуют до рН=7. Выпавший осадок соединения формулы II перекристаллизовывают из этанола. Выход 0,7 г (52%), Т. пл. = 60°С. ЯМР 1H-спектр (CDCl3), δ, м.д. (J, Гц): 2.75 (1Н, т, J1,2=5.7, J2,3=5.4, С7Н в С7Н7); 5.41-5.46 (2Н, д.д, J=5.4, С1,6Н в С7Н7); 6.24-6.28 (2Н, м, С2,5Н в С7Н7); 6.75 (2Н, т, J1,2=3.3, J2,3=3.0 С3,4Н в С7Н7); 7.22-7.26 (2Н, д.д, орто-C6H4-N); 7.39 (2Н, д, J=8.4, мета-C6H4-N); 7.46-7.49 (3Н, м, мета- и пара-С6Н5-СН); 7.89-7.92 (2Н, д.д, орто-C6H5-CH); 8.49 (1Н, с, CH=N). Масс-спектр, м/z (Iотн. %): 271 (100), 194 (6), 180 (2), 167 (80), 91 (5), 77 (6). Найдено, %: С, 88.05; Н, 5.86; N, 4.98. Вычислено, %: С, 88.52; Н, 6.31; N, 5.16. C20H17N.
Пример 2. Получение N-бензилиден-4-(7-циклогепта-1,3,5-триенил)анилина формулы II. Синтез осуществляют аналогично примеру 1, отличие - время реакции 18 часов. Выход соединения формулы II 1 г (79%).
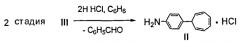
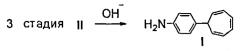
Пример 3. Получение [4-(7-циклогепта-1,3,5-триенил)анилина]·HCl формулы V и 4-(7-циклогепта-1,3,5-триенил)анилина формулы I.
Соединение формулы II (0,27 г) растворяют при нагревании в 3 мл 2 н HCl до полного растворения и добавляют 3 мл бензола, смесь перемешивают в течение 15 мин, отделяют водный слой, охлаждают, выделившиеся кристаллы отфильтровывают. Выход соединения формулы V 0,2 г (63%). Обработка соединения формулы V водным раствором 10% гидроксида аммония при комнатной температуре приводит к соединению формулы I с количественным выходом. Соединение формулы I идентично описанному в патенте RU №2479571, опубл. 20.04.2013. C2,4H в C7H7); 6.75 (2Н, т, J1,2=3.3, J2,3=3.0 C3,4H в C7H7); 7.22-7.26 (2Н, д.д, орто-C6H4-N); 7.39 (2Н, д, J=8.4, мета-C6H4-N); 7.46-7.49 (3Н, м, мета- и пара-C6H5CH-CH); 7.89-7.92 (2Н, д.д, орто-C6H5-CH); 8.49 (1Н, с, CH=N). Масс-спектр, м/z (Iотн.%): 271 (100), 194 (6), 180 (2), 167 (80), 91 (5), 77 (6). Найдено, %: C, 88.05; H, 5.86; N, 4.98. Вычислено, %: C, 88.52; H, 6.31; N, 5.16. C20H17N.
Пример 2. Получение N-бензилиден-4-(7-циклогепта-1,3,5-триенил)анилина формулы III. Синтез осуществляют аналогично примеру 1, отличие - время реакции 18 часов. Выход соединения формулы III 1 г (79%).
Пример 3. Получение [4-(7-циклогепта-1,3,5-триенил)анилина]-HCl формулы II и 4-(7-циклогепта-1,3,5-триенил)анилина формулы I.
Соединение формулы III (0,27 г) растворяют при нагревании в 3 мл 2 н HCl до полного растворения и добавляют 3 мл бензола, смесь перемешивают в течение 15 мин, отделяют водный слой, охлаждают, выделившиеся кристаллы отфильтровывают. Выход соединения формулы II 0,2 г (63%). Обработка соединения формулы II водным раствором 10% гидроксида аммония при комнатной температуре в течение 1 часа приводит к соединению формулы I с количественным выходом. Соединения формулы I и формулы II идентичны описанным в патенте RU №2479571, опубл. 20.04.2013.
Способ получения 4-(7-циклогепта-1,3,5-триенил)анилина формулы I включающий тропилирование соединением тропилия в среде тетрагидрофурана при комнатной температуре, отличающийся тем, что в качестве соединения тропилия используют тетрафторборат тропилия и тропилированию подвергают N-бензилиденанилин в течение 3-18 часов, с последующей нейтрализацией полученного соединения для получения N-бензилиден-4-(7-циклогепта-1,3,5-триенил)анилина, который гидролизуют соляной кислотой в среде бензола, полученный гидрохлорид обрабатывают основанием.