Способ прогнозирования риска развития преэклампсии на основе комбинаций генов цитокинов
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к акушерству и гинекологии, и предназначено для выявления риска развития преэклампсии. Для прогнозирования риска развития преэклампсии у женщин русской национальности, уроженок Центрального Черноземья, выделяют ДНК из периферической венозной крови и проводят анализ полиморфизмов генов цитокинов. Прогнозируют минимальный риск развития преэклампсии при сочетании трех генетических вариантов четырех генетических полиморфизмов: G I-ТАС (rs4512021) и +36 GG TNFR1; +250 A Ltα, G I-TAC (rs4512021) и +36 GG TNFR1; +250 G Ltα (rs909253), +36 A TNFR1 (rs767455), -403 G/A RANTES (rs2107538). Использование изобретения позволяет повысить эффективность выявления риска развития преэклампсии. 4 ил., 2 табл., 4 пр.
Реферат
Изобретение относится к области медицинской диагностики, может быть использовано в акушерстве и гинекологии для прогнозирования риска развития преэклампсии на основе генов цитокинов.
Преэклампсия (ПЭ) или гестоз - это осложнение беременности, возникающее во второй ее половине и характеризующееся появлением отеков, протеинурии артериальной гипертензии. В настоящее время общепринятым считается полиэтиологичность ПЭ. Это специфичное для беременности осложнение и развитие его связано с особенностями самого гестационного процесса. Несмотря на высокий интерес к проблеме, генез данной патологии остается малоизученным [Сидорова, И.С. Эндотелиальная дисфункция в развитии гестоза [Текст] / И.С. Сидорова, И.Л. Галинова // Вопросы гинекологии, акушерства и перинатологии. - 2006. - Т. 5, №1. - С. 75-81; Characterization of five marker levels of the hemostatic system and endothelial status in normotensive pregnancy and preeclampsia [Text] / M. Hayashi, T. Inoue, K. Hoshimoto [et al.] // Eur. J. Haematol. - 2007. - Vol. 69, №5-6. - P. 297-302].
ПЭ характеризуется триадой типичных клинических симптомов: артериальной гипертензией, протеинурией, отеками, а также глубокими расстройствами функции сосудистой системы, гемостаза, иммунитета, гемодинамики и микроциркуляции, фетоплацентарной недостаточностью, нарушением функции почек, печени, легких, по сути при тяжелых формах преэклампсии развивается тяжелая полиорганная недостаточность и эндогенная интоксикация.
По данным статистических исследований, частота ПЭ практически не снижается на протяжении последних двадцати лет и составляет по данным разных авторов 7-20% [Novel approaches for mechanistic understanding and predicting preeclampsia [Text] / S. Kalkunte, Z. Lai, W. Norris [et al.] // J. Reprod. Immunol. - 2009. - Vol. 83, №1-2. - P. 134-138; Качалина, Т.С. Антиоксидантная терапия плацентарной недостаточности при гестозе [Текст] / Т.С. Качалина, Н.В. Лебедева, Л.Н. Ильина // Практическая медицина. - 2010. - №43. - С. 98-99; Радзинский, В.Е. Иммунохимическая оценка перинатального риска [Текст] / В.Е. Радзинский, С.Г. Морозов, Л.А. Чугунова // Вестник Российского университета дружбы народов. Сер. Медицина. - 2010. - №5. - С. 7-12].
Согласно литературным данным к факторам риска развития данной патологии беременности относятся: ПЭ при предыдущей беременности, возраст, первая беременность, многоплодие, генетические факторы, социальные аспекты, профессиональные вредности, вредные привычки, неудовлетворительная экологическая обстановка, недостаточное и несбалансированное питание, осложненный акушерско-гинекологический анамнез, воспалительные заболевания гениталий, которые, как правило, сочетаются с поражением мочевыводящих путей, патология сосудистой системы [Сидорова, И.С. Эндотелиальная дисфункция в развитии гестоза [Текст] / И.С.Сидорова, И.Л. Галинова // Вопросы гинекологии, акушерства и перинатологии. - 2006. - Т. 5, №1. - С. 75-81; Айламазян Э.К., Мозговая Е.В. [Текст] Гестоз: теория и практика. М.: МЕДпресс-информ, 2008. 272 с.; Risk factors for a prolonged length of stay in women hospitalized for preeclampsia in Texas / Z.D. Mulla, B.S. Nuwayhid, К.M. Garcia [et al.] [Text] // Hypertens Pregnancy. 2010. Vol. 29, №1. P. 54-68].
В настоящее время известно свыше 30 генов-кандидатов преэклампсии. Локальные генные сети преэклампсии включают гены метаболизма, гены эндотелиальной дисфункции, гены сосудистой системы, гены ростовых факторов и цитокинов, гены эндокринной системы, гены главного комплекса гистосовместимости [Генетический паспорт - основа индивидуальной и предиктивной медицины [Текст]: [коллектив. моногр. / В.С. Баранов, А.С. Глотов, Т.Э. Иващенко и др.]; под ред. В.С. Баранова. - Санкт-Петербург: Изд-во Н-Л, 2009. - 527 с.: ил.]. К настоящему времени выявлены ассоциации различных генетических полиморфизмов с ПЭ [A low СОМТ activity haplotype is associated with recurrent preeclampsia in a Norwegian population cohort (HUNT2) [Text] / L.T. Roten, M.H. Fenstad, S. Forsmo [et al.] // Mol. Hum. Reprod. - 2011. - Vol. 17, №7. - P. 439-446; Young, В.C. Pathogenesis of preeclampsia [Text] / В.C. Young, R.J. Levine, S.A. Karumanchi // Annu Rev. Pathol. - 2010. - Vol. 5. - P. 173-192].
Согласно данным литературы Ltα представляет собой гликопротеид, который продуцируется стимулированными митогенами Т-лимфоцитами и лейкоцитами, а также секретируется фибробластами, астроцитами, миеломными клетками, эпителио- и эндотелиоцитами [Кетлинский С.А., Калинина Н.М., 1995; Титов В.Н., 2003]. Ген Ltα находится на шестой хромосоме (6р21.3), содержит 4 экзона. Ltα обладает способностью вызывать геморрагический некроз опухолей [Hollegaard M.V. et al., 2006; Brian E.С., 2009], проявляет частичную агонистическую активность. Ltα является хемоаттрактантом для нейтрофилов [Suzuki J., 1998; Mentula P., 2005; Кетлинский С.С. и др. 2008].
Ген TNFR1 у человека расположен на хромосоме 12р13 [Idriss Н.Т., Naismith J.H., 2000; Brian Е.С., 2009]. Рецептор фактора некроза опухоли первого типа ответственен за острый воспалительный ответ и экспрессируется в большинстве типов клеток. Растворимый TNFR1 стабилизирует циркулирующий TNF и увеличивает период полураспада данного цитокина [Aggarwal В.В. et al., 2000; Chan F.M. et al., 2000; Paludan S.R. et al., 2001; Eissner G. et al. 2004; Гейниц O.A. и др., 2004; Brian E.C., 2009].
CCL5/RANTES (Regulated on Activation Normal T-cell Expressed and Secreted/Регулятор активности нормальной экспрессии и секреции Т-клеток).
Низкомолекулярный протеин (молекулярная масса у человека колеблется между 7,8 и 8,7 кДа) находится на хромосоме 17q12. Принадлежит к b-семейству СС-хемокинов. Регулирует активность и секрецию Т-лимфоцитов.
Хемоаттрактант селективен по отношению к субпопуляциям CD4+/CD45RO+-T-лимфоцитов, а также моноцитам и эозинофильным гранулоцитам. Хемокин RANTES влияет на биологическую активность лейкоцитов [Kaburagi Y et al., 2001].
I-TAC (CXCL11) (Интерферон-индуцируемых Т-клеток альфа хемоатрактант) является членом семейства хемокинов малых секреторных белков, участвующих в иммунных и воспалительных реакций. Ген I-TAC находится на хромосоме 4q11.12. Этот хемокин играет ключевую роль в воспалительных процессах путем активации различных субпопуляций лейкоцитов [Mackay 2001], индуцирует противовоспалительные цитокины в нейтрофилах, моноцитах, макрофагах, Т-клетках, астроцитах, фибробластах и эндотелиальных клетках [Fernandez E.J. et al. 2002].
Из области техники известен «Способ прогнозирования гестоза» по патенту РФ №2191384 по заявке №2000115821/14, 16.06.2000. Заявляемый способ позволяет прогнозировать развитие гестоза за 2-4 недели до его клинических проявлений (артериальная гипертензия, протеинурия, отеки). Определяемое у беременных время устойчивости эритроцитов к перекисному гемолизу характеризует суммарный показатель состояния клеточных мембран.
Недостаток указанного способа заключается в том, что не рассматриваются генетические полиморфизмы и их сочетания с риском развития ПЭ.
За прототип выбран «Способ оценки тяжести преэклампсии» по патенту РФ №2478966, опубликован 10.04.2013 г., включающий анализ плазмы периферической венозной крови беременных, вынашивающих плод мужского пола, у которых после 20 недель беременности определяют концентрацию плодной ДНК в плазме венозной крови и при ее содержании менее 0,9 нг/мл прогнозируют неосложненное течение беременности, при концентрации плодного генетического материала от 1,8 до 2,6 нг/мл прогнозируют ПЭ средней степени тяжести и при концентрации 2,6 нг/мл и выше - ПЭ тяжелой степени.
Недостаток указанного способа заключается в том, что не рассматриваются генетические полиморфизмы и их сочетания с риском развития ПЭ.
Задачей настоящего исследования является расширение арсенала способов диагностики, а именно создание способа прогнозирования риска развития ПЭ на основе комбинаций генов цитокинов.
Технический результат использования изобретения - получение критериев оценки риска развития преэклампсии на основе генов цитокинов.
В соответствии с поставленной задачей был разработан способ прогнозирования риска развития преэклампсии у женщин русской национальности, уроженок Центрального Черноземья, на основе комбинаций генов цитокинов, включающий:
- выделение ДНК из периферической венозной крови;
- анализ полиморфизмов генов цитокинов +250 A/G Ltα (rs909253), +36 A/G TNFR1 (rs767455), -403 G/A RANTES (rs2107538), A/G I-TAC (rs4512021);
- прогнозирование минимального риска развития преэклампсии на основе генов цитокинов по трем сочетаниям генетических вариантов четырех генетических полиморфизмов: G I-TAC (rs 4512021) и +36 GG TNFR1; +250 A Ltα, G I-TAC (rs4512021) и +36 GG TNFR1; +250 G Ltα (rs909253), +36 A TNFR1 (rs767455), -403 G/A RANTES (rs2107538).
Новизна и изобретательский уровень заключается в том, что из уровня техники не известна возможность прогноза развития преэклампсии по наличию различных сочетаний генетических вариантов полиморфных локусов на основе комбинаций генов цитокинов +250A/G Ltα (rs909253), +36 A/G TNFR1 (rs767455), -403 G/A RANTES (rs2107538), A/G I-TAC (rs4512021).
Способ осуществляют следующим образом.
Выделение геномной ДНК из периферической крови осуществлялось методом фенольно-хлороформной экстракции (Mathew, 1984) в два этапа. На первом этапе к 4 мл крови добавляли 25 мл лизирующего буфера, содержащего 320 мМ сахарозы, 1% тритон Х-100, 5 мМ MgCl2, 10 мМ трис-HCl (pH=7,6). Полученную смесь перемешивали и центрифугировали при 4°C, 4000 об/мин в течение 20 минут. После центрифугирования надосадочную жидкость сливали, к осадку добавляли 4 мл раствора, содержащего 25 мМ ЭДТА (pH=8,0) и 75 мМ NaCl, ресуспензировали. Затем прибавляли 0,4 мл 10% SDS, 35 мкл протеиназы К (10 мг/мл) и инкубировали образец при 37°C в течение 16 часов.
На втором этапе из полученного лизата последовательно проводили экстракцию ДНК равными объемами фенола, фенол-хлороформа (1:1) и хлороформа с центрифугированием при 4000 об/мин в течение 10 минут. После каждого центрифугирования производили отбор водной фазы. ДНК осаждали из раствора двумя объемами охлажденного 96% этанола. Сформированную ДНК растворяли в бидистиллированной, деионизованной воде и хранили при -20°C. Выделенную ДНК использовали для проведения полимеразной цепной реакции синтеза ДНК.
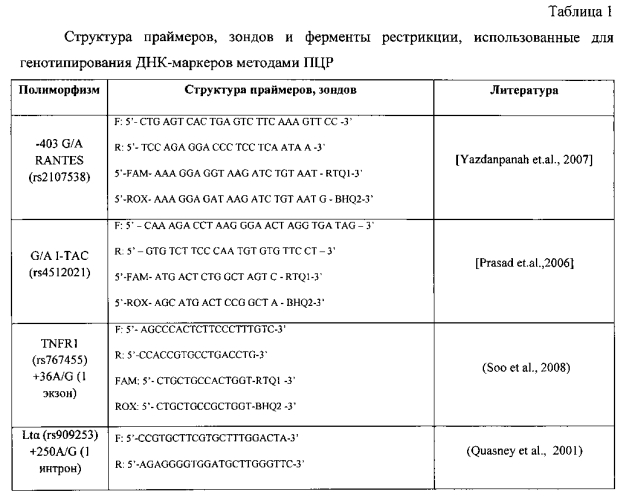
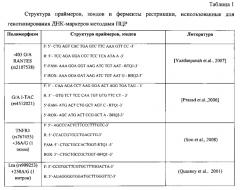
Генотипирование локусов ДНК-маркеров +250 A/G Ltα (rs909253), +36 A/G TNFR1 (rs767455), -403 G/A RANTES (rs2107538), A/G I-TAC (rs4512021) производилось методом анализа полиморфизма длины рестрикционных фрагментов (ПДРФ) продуктов ПЦР-амплификации специфических участков генома с использованием соответствующих ферментов рестрикции производства фирмы «Сибэнзим» (Новосибирск) (табл. 1).
Изобретение характеризуется фигурами.
Фиг. 1. Дискриминация аллелей по локусу - 403 G/A RANTES (rs2107538) (где: ● - гомозиготы - 403GG, ■ - гомозиготы - 403АА, ▲ - гетерозиготы - 403GA, ♦ - отрицательный контроль).
Фиг. 2. Дискриминация аллелей по локусу G/A I-TAC (rs4512021) (где: ● - гомозиготы GG, ■ - гомозиготы АА, ▲ - гетерозиготы AG, ♦ - отрицательный контроль).
Фиг. 3. Дискриминация аллелей по локусу +250 A/G Ltα (где: ● - гомозиготы +250GG, ■ - гомозиготы +250АА, ▲ - гетерозиготы +250AG, ♦ - отрицательный контроль).
Фиг. 4. Дискриминация аллелей по локусу +36 A/G TNFR1 (rs767455) (где: ● - гомозиготы +36АА TNFR1, ■ - гомозиготы +36GG TNFR1, ▲ - гетерозиготы +36AG TNFR1, ♦ - неопределенный образец).
Генотипирование локусов +250 A/G Ltα (rs909253), +36 A/G TNFR1 (rs167455), -403 G/A RANTES (rs2107538), A/G I-TAC (rs4512021) осуществлялось методом детекции TagMan зондов по данным величин RFU (уровень относительной флуоресценции) каждого зонда на амплификаторе IQ5 с детектирующей системой в режиме реального времени. Для дискриминации аллелей использовалось программа «Bio-Rad IQ5-Standart Edition».
Анализ ассоциаций сочетаний генетических вариантов с преэклампсией проведен с помощью программного обеспечения APSampler (http://sources.redhat.com/cygwin/), использующего метод Монте-Карло марковских цепей и байесовскую непараметрическую статистику.
Статистическая обработка данных проводилась на персональном компьютере с использованием программных пакетов «STATISTICA for Windows 6.0» и «Microsoft Excel 2002».
Возможность использования предложенного способа для оценки риска возникновения и развития ПЭ подтверждает анализ результатов наблюдений 247 пациенток с ПЭ и 245 женщин контрольной группы. Общий объем исследуемой выборки составил 492 человека. Средний возраст женщин с ПЭ составил 31,2±7,5 лет (варьировал от 18 до 42 лет), а в контрольной группе 31,7±7,3 лет (варьировал от 18 до 43 лет) (p>0,05). В исследуемые выборки включались индивидуумы русской национальности, являющиеся уроженцами Центрального Черноземья России и не имеющие родства между собой. Таким образом, контрольная группа не отличалась от группы беременных с ПЭ по полу, возрасту (p>0,05), месту рождения и национальности.
Все клинические и клинико-лабораторные исследования проводились на базе Перинатального центра Белгородской областной клинической больницы, с информированного согласия пациенток на использовании материалов лечебно-диагностических мероприятий проводимых, за период госпитализации и после, связанной с ПЭ, для научно-исследовательских целей и протоколировались по стандартам этического комитета Российской Федерации. Анализ ассоциаций сочетаний генетических вариантов с ПЭ проведен с помощью программного обеспечения APSampler (http://sources.redhat.com/cygwin/), использующего метод Монте-Карло марковскими цепями и байесовскую непараметрическую статистику [A Gibbs sampler for identification of symmetrically structured, spaced DNA motifs with improved estimation of the signal length [Text] / A.V. Favorov, M.S. Gelfand, A.V. Gerasimova [et al.] // Bioinformatics. - 2005. - Vol. 21, №10. - P. 2240-2245].
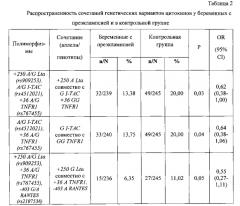
Как свидетельствуют результаты настоящего исследования, выявлены особенности «генетической конституции» беременных с ПЭ на основе комбинаций генов цитокинов (табл. 2).
Установлено, что сочетание аллелей +250 A Ltα и G I-TAC (rs4512021) с генотипом +36 GG TNFR1 наблюдается у 13,38% беременных с ПЭ, тогда как в контрольной группе оно выявлено у 20,00% (р=0,03). Данное сочетание имеет протективное значение для развития ПЭ (OR=0,62, 95% CI 0,38-1,00). Наряду с этим, сочетание аллеля G I-TAC (rs4512021) с генотипом +36 GG TNFR1 отмечается среди беременных с ПЭ в 1,5 раза реже, чем в контрольной группе (13,75% и 20,00%, соответственно р=0,04). При наличии этого сочетания полиморфных маркеров генов цитокинов риск развития ПЭ значительно снижен (OR=0,64, 95% CI 0,38-1,06). Протективная направленность зарегистрирована и по следующему сочетанию исследуемых полиморфизмов генов цитокинов. В контрольной группе сочетание аллелей +250 G Ltα (rs909253), +36 A TNFR1 (rs767455), -403A RANTES (rs2107538) (11,2%) встречается в 1,7 раза чаще по сравнению с беременными с ПЭ (6,35%, р=0,05, OR=0,55, 95% CI 0,27-1,11).
Примеры конкретного применения.
1. У беременной А., русской национальности, уроженки Центрального Черноземья, была взята венозная кровь, при генотипировании ДНК-маркеров было выявлено сочетание двух генетических вариантов G I-TAC (rs4512021) и +36 GG TNFR1, что позволило отнести ее в группу беременных с пониженным риском развития ПЭ. Это подтвердило дальнейшее наблюдение. В течение беременности у нее не было выявлено признаков ПЭ.
2. У женщины В., при прегравидарной подготовке была взята венозная кровь, при генотипировании ДНК-маркеров было выявлено сочетание трех генетических вариантов +250 A Ltα, G I-TAC (rs4512021) и +36 GG TNFR1, что позволило отнести ее в группу беременных с пониженным риском развития ПЭ. Это подтвердило дальнейшее наблюдение. При возникновении беременности у нее не было выявлено признаков ПЭ.
3. У беременной Е., русской национальности, уроженки Центрального Черноземья, была взята венозная кровь, при генотипировании ДНК-маркеров было выявлено сочетание аллелей +250 G Ltα (rs909253), +36 A TNFR1 (rs767455), -403А RANTES (rs2107538), что позволило отнести ее в группу беременных с пониженным риском развития ПЭ. Это подтвердило дальнейшее наблюдение. У нее не было выявлено признаков ПЭ.
4. У беременной Г., русской национальности, уроженки Центрального Черноземья, была взята венозная кровь, при генотипировании ДНК-маркеров было выявлено сочетание аллелей +250 G Ltα (rs909253), +36 A TNFR1 (rs767455), -403А RANTES (rs2107538), что позволило отнести ее в группу беременных с пониженным риском развития ПЭ. Это подтвердило дальнейшее наблюдение. У нее не было выявлено признаков ПЭ.
Применение данного способа позволит формировать среди женщин при прегравидарной подготовке и на ранних сроках беременности группы риска и своевременно реализовывать в этих группах необходимые лечебно-профилактические мероприятия по предупреждению развития ПЭ.
Способ прогнозирования риска развития преэклампсии у женщин русской национальности, уроженок Центрального Черноземья, включающий выделение ДНК из периферической венозной крови, анализ полиморфизмов генов цитокинов и прогнозирование минимального риска развития преэклампсии на основе генов цитокинов по трем сочетаниям генетических вариантов четырех генетических полиморфизмов: G I-ТАС (rs4512021) и +36 GG TNFR1; +250 A Ltα, G I-TAC (rs4512021) и +36 GG TNFR1; +250 G Ltα (rs909253), +36 A TNFR1 (rs767455), -403 G/A RANTES (rs2107538).