Способ прогнозирования риска развития преэклампсии тяжелого течения
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к акушерству и гинекологии, и предназначено для выявления риска развития и степени тяжести преэклампсии. Для прогнозирования риска возникновения преэклампсии тяжелого течения у женщин русской национальности, уроженок Центрального Черноземья, выделяют ДНК из периферической венозной крови и анализируют генетические полиморфизмы: -308 G/A TNFα (rs1800629), +36 A/G TNFR1 (rs767455), -801 G/A SDF 1(rs1801157), C/G MCP-1 (rs285765). Повышенный риск развития преэклампсии тяжелого течения прогнозируют при наличии сочетания генетических вариантов -801A SDF1, +36 GG TNFR1 и -308 A TNFα. Пониженный риск развития преэклампсии тяжелого течения прогнозируют при наличии сочетания генетических вариантов -801 G SDF1 и G МСР (rs 285765). Использование изобретения позволяет повысить эффективность выявления тяжелого течения преэклампсии. 4 ил., 2 табл., 4 пр.
Реферат
Изобретение относится к области медицинской диагностики, может быть использовано в акушерстве для прогнозирования осложнений во второй половине беременности, а именно риска развития преэклампсии (ПЭ) и степени ее тяжести по генетическим данным.
Преэклампсия или гестоз - это осложнение беременности, возникающее во второй ее половине и характеризующееся появлением отеков, протеинурии, артериальной гипертензии, а также глубокими расстройствами функции сосудистой системы, гемостаза, иммунитета, гемодинамики и микроциркуляции, развитием плацентарной недостаточности, нарушений функции почек, печени, легких [Сидорова, И.С. Эндотелиальная дисфункция в развитии гестоза [Текст] / И.С. Сидорова, И.Л. Галинова // Вопросы гинекологии, акушерства и перинатологии. - 2006. - Т. 5, №1. - С. 75-81.].
В настоящее время ПЭ является одной из самых актуальных проблем современного акушерства ввиду широкой распространенности, сложности этиопатогенеза, высокой частоты материнской и перинатальной заболеваемости и смертности [Киселева, Н.И. Маркеры дисфункции эндотелия при гестозе [Текст] / Н.И. Киселева, С.Н. Занько, А.П. Солодков // Дисфункция эндотелия: эксперим. и клинич. исслед.: тр. III междунар. науч.-практ. конф., Витебск, 18-20 мая 2004 г./ Белорус. респ. Фонд фундамент. исслед.; Витеб. гос. мед. ун-т. - Витебск, 2004. - С.201-204]. ПЭ может варьироваться от легкой до тяжелой формы. Как правило, в тяжелых случаях преэклампсии единственным способом улучшить состояние пациентки является ее родоразрешение.
Для ПЭ характерно прогрессирующее течение. Это выражается в неуклонном нарастании тяжести отдельных ее проявлений или присоединении новых клинических признаков. У большинства женщин определяется медленное прогрессирование патологии. Однако в некоторых случаях ПЭ прогрессирует очень быстро до тяжелой формы - за несколько дней или недель. В самых тяжелых случаях прогрессирование может быть молниеносным - в течение нескольких дней или часов [Патогенез гестоза как проявление иммуно-комплексной патологии эндотелия (острый иммунный эндотелиоз) [Текст] / И.С. Сидорова, О.И. Турина, А.П. Милованов [и др.] // Акушерство и гинекология. - 2008. - №6. - С. 13-17]. В итоге развиваются такие критические состояния, как отслойка плаценты, ДВС-синдром, церебральные кровоизлияния, печеночная недостаточность, острая почечная недостаточность, гипотрофия, ЗВРП и гибель плода, эклампсия [Эндотелиальная дисфункция при гестозе. Патогенез, генетическая предрасположенность, диагностика и профилактика [Текст]: метод, рекомендации / Е.В. Мозговая, О.В. Малышева, Т.Э. Иващенко [и др.]; ред. Э.К. Айламазян. - Санкт-Петербург: Изд-во Н-Л, 2003. - 32 с.].
В настоящее время многие исследователи рассматривают ПЭ как острую патологию эндотелия - генерализованное поражение эндотелия сосудов или эндотелиальную дисфункцию, приводящую к нарушению сосудистого тонуса, сосудистой проницаемости, баланса между тромбогенным потенциалом сосудистой стенки и ее тромборезистентностью [Киселева, Н.И. Маркеры дисфункции эндотелия при гестозе [Текст] / Н.И. Киселева, С.Н. Занько, А.П. Солодков // Дисфункция эндотелия: эксперим. и клинич. исслед.: тр. III междунар. науч.-практ. конф., Витебск, 18-20 мая 2004 г./ Белорус. респ. Фонд фундамент. исслед.; Витеб. гос. мед. ун-т. - Витебск, 2004. - С. 201-204., Марков, X.М. Молекулярные механизмы дисфункции сосудистого эндотелия [Текст] / X.М. Марков // Кардиология. - 2005. - Т. 45, №12. - С. 62-72., Шифман, Е.М. Преэклампсия, эклампсия, HELLP-синдром [Текст] / Е.М. Шифман; Респ. перинат. центр М-ва здравоохранения Респ. Карелия. - Петрозаводск: ИнтелТек, 2002. - 432 с.].
Как свидетельствуют результаты ряда исследований, значимую роль в развитии преэклампсии играют генетические факторы. Среди генов-кандидатов важное значение в развитии ПЭ отводится генам цитокинам, активация которых происходит после запуска цепи иммуновоспалительных реакций. К этой группе генов цитокинов относятся: - 308 G/A TNFα (rs1800629), +36 A/G TNFR1 (rs767455), - 801 G/A SDF 1(rs1801157), C/G MCP-1 (rs 285765).
TNFα - гликопротеин с молекулярной массой 17 кДа, является продуктом моноцитов/макрофагов, эндотелиальных, тучных и миелоидных клеток, клеток нейроглии, в особых случаях - активированных Т-лимфоцитов [Suzuki J. et al., 1998; Hollegaard M.V. et al., 2006; Brian E.C., 2009]. Ген TNFα расположен на шестой хромосоме человека (6р21.3) в локусе, кодирующем молекулы главного комплекса гистосовместимости первого (HLA-A, В, С) и второго классов (HLA-DP, DQ, DR) [Байнак О.В. и др., 2005; Seidemann К. et al., 2005]. TNFα синтезируется в основном моноцитарно-макрофагальными и тучными клетками.
Ген TNFR1 у человека расположен на хромосоме 12р13 [Idriss Н.Т., Naismith J.H., 2000; Brian Е.С., 2009]. Рецептор фактора некроза опухоли первого типа ответственен за острый воспалительный ответ и экспрессируется в большинстве типов клеток. Растворимый TNFR1 стабилизирует циркулирующий TNF и увеличивает период полураспада данного цитокина [Aggarwal В.В. et al., 2000; Chan F.M. et al., 2000; Paludan
S.R. et al., 2001; Eissner G. et al. 2004; Гейниц O.A. и др., 2004; Brian E.C., 2009].
SDF-1 (производный фактор стромальных клеток-1) содержит 4 экзона и находится на хромосоме 10q12. Встречается в двух формах, SDF-1α/CXCL12α и SDF-1β/CXCL12B [Bajetto A. et al.,2001]. SDF-1 во время эмбриогенеза определяет миграцию гемопоэтических клеток и формирование кровеносных сосудов. Играет важную роль в ангиогенезе путем привлечения эндотелиальных клеток-предшественников из костного мозга через CXCR4-зависимый механизм [Shih С.С et al., 2000].
Ген МСР-1 находится на 17 хромосоме в области 17q11.2 - q12. МСР-1 проявляет наиболее сильную хемотаксическую активность по отношению к моноцитам и Т-лимфоцитам. Является промотором миграции циркулирующих лимфоцитов из периферической крови в ткани и очаги воспаления, одновременно влияя на их активацию и прилипание к сосудистой стенке. МСР-1 стимулирует моноциты к продукции провоспалительных цитокинов и образованию аниона перекиси водорода [Chazov E.I. et al., 2007; Ukkonen M. et al., 2007]. Этот хемокин способствует окислению липопротеинов низкой плотности в моноцитах, эндотелиальных и васкулярных клетках гладких мышц человека [Carr M.W. et al., 1994; Rollins В.J., 1996; Takahara N. et al., 1997].
Известен способ по заявке РФ №2012131290 (дата публикации заявки 27.01.2014), согласно которому для раннего выявления риска развития преэклампсии у беременной женщины на ранней стадии беременности на сроке от 14 до 16 недель беременности до развития обычных клинических симптомов проводят анализ исследуемого биологического образца для определения концентрации 5-гидрокситриптофана, причем пониженная концентрация 5-гидрокситриптофана относительно контрольной концентрации при нормальной беременности коррелирует с риском развития преэклампсии у беременной женщины. Где контрольная концентрация представляет собой концентрацию 5-гидрокситриптофана в биологическом образце, полученном у субъекта, у которого действительно развилась преэклампсия, и в котором повышенная концентрация 5-гидрокситриптофана относительно контрольной концентрации коррелирует с риском развития преэклампсии у беременной женщины. Одновременно проводят анализ для определения концентрации по существу всех биомаркеров: 5-гидрокситриптофана, моносахарида, деканоилкарнитина, метилглутаровой кислоты и/или адипиновой кислоты, олеиновой кислоты, докозагексаеновой кислоты и/или докозатрииновой кислоты, Y-бутиролактона и/или оксолан-3-она, 2-оксовалериановой кислоты и/или оксометилбутановой кислоты, ацетоуксусной кислоты, гексадеценоилэйкозатетраеноил-sn-глицерина, сфингозин-1-фосфата, сфинганин-1-фосфата и производных витамина D3, и установления кореляции концентрации и комбинации всех биомаркеров с риском развития преэклампсии у беременной женщины.
В заявке на получение патента РФ №2012123860 (дата публикации заявки 20.12.2013) предложен способ оценки риска возникновения патологии беременности, заключающийся в том, что для оценки риска возникновения преэклампсии, преждевременных родов, а также преэклампсии на фоне артериальной гипертензии проводят анализ биологических жидкостей человека, а именно сыворотки крови, с помощью обращено-фазовой жидкостной хроматографии с регистрацией результата анализа в ультрафиолетовой области спектра, а в качестве биомаркеров патологии беременности используются гипоксантин, ксантин, мочевая кислота.
В заявке на получение патента РФ №2011125546 (дата публикации заявки 27.12.2012) прогноз повышенного риска развития преэклампсии осуществляют на основании того, что концентрация Н2-релаксина, полученного из организма беременной женщины до проявления симптома преэклампсии, меньше предельного значения нижнего квартиля концентрации, равной примерно 500 пг/мл, характерной для беременной женщины. При этом концентрацию Н2-релаксина измеряют с использованием антитела к Н2-релаксину с помощью твердофазного иммуноферментного анализа (ELISA). Кроме того, дополнительно измеряют концентрацию С-реактивного белка (CRP) в биологическом образце и определяют, что беременная женщина имеет повышенный риск развития преэклампсии, если концентрация CRP больше чем примерно 13,5 мкг/мл или меньше чем 1,5 мкг/мл, даже если концентрация Н2-релаксина больше чем примерно 500 пг/мл.
В патенте РФ №2481578 по заявке №2012107573/15, 28.02.2012, опубликованном 10.05.2013, раскрыт способ прогнозирования развития тяжелой преэклампсии с помощью анализа крови, отличающийся тем, что у беременной во втором триместре рассчитывают лейкоцитарный индекс интоксикации и при его значении выше 1,6 прогнозируют развитие тяжелой преэклампсии.
За прототип выбран «Способ прогнозирования гестоза» по патенту РФ №2191384 по заявке №2000115821, 16.06.2000. Заявляемый способ позволяет прогнозировать развитие гестоза за 2-4 недели до его клинических проявлений (артериальная гипертензия, протеинурия, отеки). Способ заключается в том, что у женщин с 16-й недели беременности определяют устойчивость эритроцитов к перекисному гемолизу, инициированному двухвалентным железом и гемолизатом аутокрови. При этом за 2-4 недели до появления клинических признаков гестоза (артериальная гипертензия, протеинурия, отеки) время устойчивости эритроцитов составляет менее 150 с; при показателе больше 150 с гестоз у беременных не развивается. Изобретение позволяет просто и надежно осуществить прогнозирование гестоза.
Общий недостаток указанных способов заключается в том, что не рассматриваются генетические полиморфизмы и их сочетания с риском развития преэклампсии и ее тяжелого течения.
Задачей настоящего исследования является расширение арсенала способов диагностики, а именно создание способа прогнозирования риска развития ПЭ и тяжелого течения по данным о генетических полиморфизмах -308 G/A TNFα (rs1800629), +36 A/G TNFR1 (rs767455), -801 G/A SDF 1(rs1801157), C/GMCP-1 (rs285765).
Технический результат использования изобретения - получение критериев оценки риска развития преэклампсии тяжелого течения.
В соответствии с поставленной задачей был разработан способ прогнозирования преэклампсии тяжелого течения у женщин русской национальности, уроженок Центрального Черноземья, включающий:
- выделение ДНК из периферической венозной крови;
- анализ полиморфизмов генов цитокинов -308 G/A TNFα (rs1800629), +36 A/G TNFR1 (rs767455), -801 G/A SDF 1(rs1801157), C/GMCP-1 (rs285765);
- прогнозирование повышенного риска развития преэклампсии тяжелого течения при наличии сочетания генетических вариантов -801 A SDF1, +36 GG TNFR1 и -308 А TNFα;
- прогнозирование пониженного риска развития преэклампсии тяжелого течения при наличии сочетания генетических вариантов -801 G SDF1 и G МСР (rs 285765).
Новизна и изобретательский уровень заключается в том, что из уровня техники не известна возможность прогноза развития преэклампсии и ее тяжелого течения по наличию различных сочетаний генетических вариантов полиморфных локусов -308 G/A TNFα (rs1800629), +36 A/G TNFR1 (rs767455), -801 G/A SDF 1(rs1801157), C/GMCP-1 (rs285765).
Способ осуществляют следующим образом.
ДНК выделяют из образцов периферической венозной крови пациентки в 2 этапа. На первом этапе к 4 мл крови добавляют 25 мл лизирующего буфера, содержащего 320 мМ сахарозы, 1% тритон Х-100, 5 мМ MgC12, 10 мМ трис-HCl (рН 7,6). Полученную смесь перемешивают и центрифугируют при 4°C, 4000 об/мин в течение 20 минут. После центрифугирования надосадочную жидкость сливают, к осадку добавляют 4 мл раствора, содержащего 25 мМ ЭДТА (рН 8,0) и 75 мМ NaCl, ресуспензируют. Затем прибавляют 0,4 мл 10% SDS, 35 мкл протеиназы К (10 мг/мл) и инкубируют образец при 37°C в течение 16 часов.
На втором этапе из полученного лизата последовательно проводят экстракцию ДНК равными объемами фенола, фенол-хлороформа (1:1) и хлороформа с центрифугированием при 4000 об/мин в течение 10 минут. После каждого центрифугирования производят отбор водной фазы. ДНК осаждают из раствора двумя объемами охлажденного 96% этанола. Сформированную ДНК растворяют в бидистиллированной, деионизованной воде и хранят при -20°C.
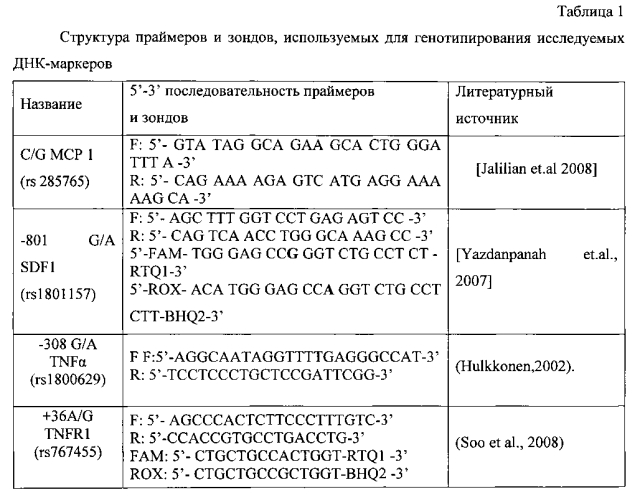
Выделенную ДНК затем подвергают полимеразной цепной реакции с использованием стандартных олигонуклеотидных праймеров (таблица 1).
Изобретение характеризуется следующими графическими материалами.
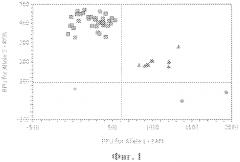
Фиг. 1. Дискриминации аллелей методом детекции TaqMan зондов по данным величин УОФ (уровень относительной флуоресценции) каждого зонда на амплификаторе IQ5 с детектирующей системой в режиме реального времени полиморфизма C/G МСР1 (rs 2857657) (где ● - гомозиготы GG, ■ - гомозиготы СС, ▲ - гетерозиготы GC, ♦ - отрицательный контроль).
Фиг. 2. Дискриминации аллелей методом детекции TaqMan зондов по данным величин УОФ (уровень относительной флуоресценции) каждого зонда на амплификаторе IQ5 с детектирующей системой в режиме реального времени полиморфизма - 801 G/A SDF1 (rs1801157) (где ● - гомозиготы - 801GG, ■ - гомозиготы - 801АА, ▲ - гетерозиготы - 801GA, ♦ - отрицательный контроль).
Фиг. 3. Электрофоретическое разделение продуктов амплификации - 308 G/A TNFα (где ● - гомозиготы - 308АА, ■ - гомозиготы - 308GG, ▲ - гетерозиготы - 308GA, ♦ - отрицательный контроль).
Фиг. 4. Дискриминации аллелей методом детекции TaqMan зондов по данным величин УОФ (уровень относительной флуоресценции) каждого зонда на амплификаторе IQ5 с детектирующей системой в режиме реального времени полиморфизма +36A/G TNFR1 (rc767455) (где ● - гомозиготы +36АА TNFR1, ■ - гомозиготы +36GG TNFR1, ▲ - гетерозиготы +36AG TNFR1, ♦ - неопределенный образец).
Анализ генетического полиморфизма C/G МСР 1 (rs285765) в проводили методом полимеразной цепной реакции синтеза ДНК на амплификаторе IQ5 (Bio-Rad) с использованием стандартных олигонуклеотидных праймеров и зондов с последующим анализом полиморфизма методом дискриминации аллелей. Реакционная смесь объемом 25 мкл включает: 67 мМ трис-HCl (рН 8,8), 2,5 мМ MgCl2, 0,1 мкг геномной ДНК, по 10 пМ каждого праймера, по 5 пмоль каждого зонда, по 200 мкМ dATP, dGTP, dCTP, dTTP и 1 единицу активной Taq-полимеразы. После денатурации (3 мин при t+95°C) выполняли 40 циклов амплификации по схеме: отжиг праймеров - 1 мин при t +51,5°C; денатурация -15 с при t +95°C.
При проведении ПЦР в амплификаторе с флюоресцентной детекцией (на амплификаторе IQ5) генотипирование осуществлялось методом Tag Man зондов по данным величин RFU (уровень относительной флуоресценции) каждого зонда. Зонд с флуоресцентным красителем ROX соответствует аллелю С, зонд с красителем FAM - аллелю G. (фиг. 1).
Анализ полиморфизма гена -801 G/A SDF1 (rs1801157) проводили методом ПЦР синтеза ДНК на амплификаторе IQ5 (Bio-Rad) с использованием стандартных олигонуклеотидных праймеров и зондов (табл. 2) с последующим анализом полиморфизма методом дискриминации аллелей. Реакционная смесь объемом 25 мкл включает: 67 мМ трис-HCl (рН 8,8), 2,5 мМ MgCl2, 0,1 мкг геномной ДНК, по 10 пМ каждого праймера, по 5 пмоль каждого зонда, по 200 мкМ dATP, dGTP, dCTP, dTTP и 1 единицу активной Taq-полимеразы. После денатурации (4 мин при 95°C) выполняли 40 циклов амплификации по схеме: отжиг праймеров - 1 мин при t +66°C; денатурация - 15 с при t +95°C (фиг. 2).
Анализ полиморфизма гена TNFα проводили методом полимеразной цепной реакции синтеза ДНК на амплификаторе IQ5 (Bio-Rad) с использованием соответствующих олигонуклеотидных праймеров и зондов [Hulkkonen J., 2002] (табл. 2) с последующим анализом полиморфизма методом дискриминации аллелей.
Реакционная смесь объемом 25 мкл включает: 67 мМ трис-HCl (рН 8,8), 2,5 мМ MgCl2, 0,1 мкг геномной ДНК, по 10 пМ каждого праймера, по 5 пмоль каждого зонда, по 200 мкМ dATP, dGTP, dCTP, dTTP и 1 единицу активной Taq-полимеразы. После денатурации (5 мин при 95°C) выполняли 40 циклов амплификации по схеме: отжиг праймеров - 1 мин при 52°C; денатурация - 15 с при 95°C (фиг. 3).
Анализ полиморфизма гена TNFR1 в области 1 экзона проводили методом полимеразной цепной реакции синтеза ДНК на амплификаторе IQ5 (Bio-Rad) с использованием стандартных олигонуклеотидных праймеров и зондов (табл. 2) с последующим анализом полиморфизма методом дискриминации аллелей. Реакционная смесь объемом 25 мкл включает: 67 мМ трис-HCl (рН=8,8), 2,5 мМ MgCl2, 0,1 мкг геномной ДНК, по 10 пМ каждого праймера, по 5 пмоль каждого зонда, по 200 мкМ dATP, dGTP, dCTP, dTTP и 1 единицу активной Taq-полимеразы. После денатурации (4 мин при t +95°C) выполняли 40 циклов амплификации по схеме: отжиг праймеров - 1 мин при t +59°C; денатурация - 15 с при t +95C (фиг. 4).
Возможность использования предложенного способа для оценки риска возникновения и развития ПЭ подтверждает анализ результатов наблюдений 247 пациенток с ПЭ и 245 женщин контрольной группы. Общий объем исследуемой выборки составил 492 человека. Средний возраст женщин с ПЭ составил 31,2±7,5 лет (варьировал от 18 до 42 лет), а в контрольной группе 31,7±7,3 лет (варьировал от 18 до 43 лет) (p>0,05). В исследуемые выборки включались индивидуумы русской национальности, являющиеся уроженцами Центрального Черноземья России и не имеющие родства между собой. Таким образом, контрольная группа не отличалась от группы беременных с ПЭ по полу, возрасту (p>0,05), месту рождения и национальности.
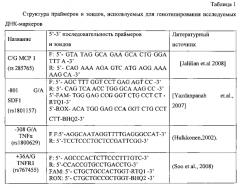
Все клинические и клинико-лабораторные исследования проводились на базе Перинатального центра Белгородской областной клинической больницы с информированного согласия пациенток на использование материалов лечебно-диагностических мероприятий, проводимых за период госпитализации и после, связанной с ПЭ, для научно-исследовательских целей и протоколировались по стандартам этического комитета Российской Федерации. Анализ ассоциаций сочетаний генетических вариантов с ПЭ проведен с помощью программного обеспечения APSampler (http://sources.redhat.com/cygwin/), использующего метод Монте-Карло марковскими цепями и байесовскую непараметрическую статистику [A Gibbs sampler for identification of symmetrically structured, spaced DNA motifs with improved estimation of the signal length [Text] / A.V. Favorov, M.S. Gelfand, A.V. Gerasimova [et al.] // Bioinformatics. - 2005. - Vol. 21, №10. - P. 2240-2245.].
Выявлены особенности «генетической конституции» беременных с ПЭ тяжелого течения по исследуемым генам цитокинам (табл. 2). Комбинация генетических вариантов -801 A SDF1, +36 GG TNFR1 и -308 A TNFα встречается у 4,66% беременных с ПЭ тяжелого течения, что в 3,82 раза выше аналогичного показателя контрольной группы -1,22%. Эта комбинация является фактором риска развития ПЭ с тяжелым течением (р=0,04, OR=3,95, 95% CI 1,01-15,51).
Наоборот, сочетание аллелей -801 G SDF1 и G МСР (rs285765) имеет протективное значение для формирования ПЭ тяжелого течения (р=0,02, OR=0,59, 95% CI 0,36-0,98).
Данная комбинация генетических вариантов зарегистрирована у 21,43% беременных с ПЭ тяжелого течения и 31,43% в контрольной группе (р=0,02).
Итак, резюмируя полученные в данном разделе работы данные, можно сделать вывод о значимой роли генетических полиморфизмов -308 G/A TNFα (rs1800629), +36 A/G TNFR1 (rs767455), -801 G/A SDF 1 (rs1801157), C/G MCP-1 (rs285765) в формировании ПЭ тяжелого течения. Сочетания полиморфных вариантов -801 G SDF1 и G МСР (rs285765) (OR=0,59), -801 A SDF1, +36 GG TNFR1 и -308 A TNFα (OR=3,95) маркируют развитие ПЭ тяжелого течения.
Примеры конкретного выполнения
1. У беременной А., русской национальности, уроженки Центрального Черноземья, была взята венозная кровь, при генотипировании ДНК - маркеров было выявлено сочетание двух генетических вариантов -801 G SDF1 и G МСР (rs285765), что позволило отнести ее в группу беременных с пониженным риском развития ПЭ. Это подтвердило дальнейшее наблюдение. В течение беременности у нее не было выявлено признаков ПЭ.
2. У женщины Г., при прегравидарной подготовке, была взята венозная кровь, при генотипировании ДНК-маркеров было выявлено сочетание двух генетических вариантов -801 G SDF1 и G МСР (rs285765), что позволило отнести ее в группу беременных с пониженным риском развития ПЭ. Это подтвердило дальнейшее наблюдение. При возникновении беременности у нее не было выявлено признаков ПЭ.
3. У женщины Л., при прегравидарной подготовке, была взята венозная кровь, при генотипировании ДНК-маркеров было выявлено сочетание -801 A SDF1, +36 GG TNFR1 и -308 A TNFα, что позволило отнести ее в группу беременных с повышенным риском развития ПЭ тяжелого течения. Это подтвердило дальнейшее наблюдение. При возникновении беременности были выявлены признаки ПЭ тяжелого течения.
4. У беременной М., русской национальности, уроженки Центрального Черноземья, была взята венозная кровь, при генотипировании ДНК-маркеров было выявлено сочетание -801 A SDF1, +36 GG TNFR1 и -308 A TNFα, что позволило отнести ее в группу беременных с повышенным риском развития ПЭ тяжелого течения. Это подтвердило дальнейшее наблюдение. При возникновении беременности были выявлены признаки ПЭ тяжелого течения.
Применение данного способа позволит формировать среди женщин при прегравидарной подготовке и на ранних сроках беременности группы риска и своевременно реализовывать в этих группах необходимые лечебно-профилактические мероприятия по предупреждению развития ПЭ тяжелого течения.
Способ прогнозирования риска возникновения преэклампсии тяжелого течения у женщин русской национальности, уроженок Центрального Черноземья, включающий выделение ДНК из периферической венозной крови, анализ генетических полиморфизмов -308 G/A TNFα (rs1800629), +36 A/G TNFR1 (rs767455), -801 G/A SDF 1(rs1801157), C/G MCP-1 (rs285765) и прогнозирование:- повышенного риска развития преэклампсии тяжелого течения при наличии сочетания генетических вариантов -801A SDF1, +36 GG TNFR1 и -308 A TNFα,- пониженного риска развития преэклампсии тяжелого течения при наличии сочетания генетических вариантов -801 G SDF1 и G МСР (rs285765).