N-(2-ацетамидопурин-6-ил)глицин, обладающий противотуберкулезной активностью
Иллюстрации
Показать всеИзобретение относится к новому N-(2-ацетамидопурин-6-ил)глицину указанной ниже формулы, обладающему противотуберкулезной активностью, в том числе по отношению к штаммам микобактерий с множественной лекарственной устойчивостью. Изобретение может найти применение в медицине и ветеринарии. 1 табл., 1 пр.
Реферат
Изобретение относится к области органической химии, а именно к новому производному пурина, N-(2-ацетамидопурин-6-ил)глицину, которое обладает противотуберкулезной активностью и может найти применение в медицине и ветеринарии.
На сегодняшний день самой распространенной инфекцией - убийцей является туберкулез (http://www.who.int/tb/en (2009); Global Tuberculosis Control: Survelliance, Planning, Financing; WHO Report 2009; World Health Organization: Geneva, 2009). Статистика показывает, что в 2013 г. в мире им заболело 8 млн. человек и умерло 1.5 млн., из них 360000 ВИЧ-инфицированных. В России в 2013 г. зарегистрировано 142000 случаев заболевания туберкулезом. Эти данные свидетельствуют, насколько велико социально-экономическое значение туберкулеза, соизмеримое по своим негативным последствиям с любым стихийным бедствием или биологической катастрофой. К сожалению, борьба с туберкулезом методами современной химиотерапии должного эффекта не имеет. Основной причиной является то, что микобактерия туберкулеза (МБТ) гипермутабельна - при попадании внутрь клетки начинаются ее многочисленные мутации, ведущие к ее резистентности, повышению скорости роста и других неприятных качеств этого патогена.
В 2013 г. зарегистрировано 480000 случаев заболеваний, вызванных резистентными штаммами микобактерий с множественной лекарственной устойчивостью (MDR), в том числе почти 44000 случаев в России. Заболевания, вызванные MDR-штаммами М. tuberculosis, имеют остро прогрессирующий характер и плохо поддаются лечению существующими препаратами. Поэтому существует острая необходимость в разработке новых противотуберкулезных средств, обладающих нетрадиционным механизмом действия на патоген.
Среди производных пурина найдены соединения, обладающие противотуберкулезной активностью, например соединения 1 и 2 [Scozzafava, А.; Mastrolorenzo, A.; Supuran, С.Т. Antimycobacterial activity of 9-sulfonylated/sulfenylated-6-mercaptopurine derivatives. Bioorg. Med. Chem. Lett. 2001, 11, 1675-1678; Gundersen, L.-L.; Nissen-Meyer, J.; Spilsberg, B. Synthesis and antimycobacterial activity of 6-arylpurines: the requirements for the N-9 substituent in active antimycobacterial purines. J. Med. Chem. 2002, 45, 1383-1386; Pathak, A.K.; Pathak, V.; Seitz, L.E.; Suling, W.J.; Reynolds, R.C. 6-Oxo and 6-thio purine analogs as antimycobacterial agents. Bioorg. Med. Chem. 2013, 21, 1685-1695]:
О противотуберкулезной активности ближайших структурных аналогов N-(2-ацетамидопурин-6-ил)глицина, таких, например, как N-(пурин-6-ил)глицин (3) [Ward, D.N.; Wade, J.; Walborg, E.F., Jr.; Osdene, T.S. The synthesis N-(6-purinyl)amino acids. Amino acids with a single reactive amino group. J. Org. Chem. 1961, 26, 5000-5005; Matsubara, S.; Fujii, Т.; Nishitani, T. Cytokinin activities of N-(purin-6-yl)amino acids, N-(purin-6-yl)peptidesand related compounds. Sci. Rep. Kyoto Prefect. Univ., Nat. Sci. Living Sci. 1988, 39, 1-6] и его гомологи (4) [Schäfer, K.; Büllesbach, E.E.; Jollès, P.; Zahn, H. The synthesis and some biological properties of N-(6-purinyl)peptides. Biol. Chem. Hoppe-Seyler 1986, 367, 757-768], сведения отсутствуют.
В литературе отмечалось, что механизм туберкулостатического действия производных пурина невозможно предсказать, поскольку метаболизм пурина в микобактериях не вполне изучен [Pathak, А.K.; Pathak, V.; Seitz, L.Е.; Suling, W.J.; Reynolds, R.C. 6-Oxo and 6-thio purine analogs as antimycobacterial agents. Bioorg. Med. Chem. 2013, 21, 1685-1695].
Задача предлагаемого изобретения - поиск нового соединения с высокой антимикобактериальной активностью, в том числе по отношению к мультирезистентным штаммам микобактерий, расширяющего арсенал известных противотуберкулезных средств.
Техническим результатом данного изобретения является создание нового химического соединения - N-(2-ацетамидопурин-6-ил)глицина формулы (5):
Соединение 5, его физико-химические характеристики, а также способ его получения в литературе не описаны.
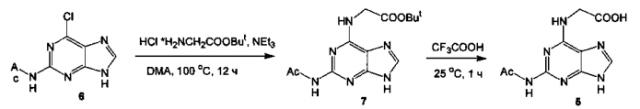
Соединение формулы (5) может быть получено в две стадии [Bowles, W.А.; Schneider, F.Н.; Lewis, L.R.; Robins, R.K. Synthesis and Antitumor Activity of 9-(Tetrahydro-2-furyl)purine Analogs of Biologically Important Deoxynucleosides. J. Med. Chem. 1963, 6, 471-480] из доступного 2-ацетамидо-6-хлорпурина (6).
Соединение 6 нагревают с гидрохлоридом трет-бутилового эфира глицина в N,N-диметилацетамиде (DMA) в присутствии триэтиламина. В результате выделяют трет-бутиловый эфир N-(2-ацетамидопурин-6-ил)глицина (7), кислотный гидролиз которого под действием трифторуксусной кислоты приводит к целевому соединению 5.
Характеристики новых соединений приведены в примерах конкретного выполнения.
Структуры полученных соединений подтверждают методами масс-спектрометрии высокого разрешения, элементного анализа, ИК, ЯМР 1Н и 13С спектроскопии. Индивидуальность соединений подтверждают методами ТСХ и ОФ ВЭЖХ.
Температуры плавления соединений определяют на приборе Stuart SMP3 (Barloworld Scientific).
Элементный анализ выполнен на автоматическом CHNS-O анализаторе РЕ 2400 серия II (Perkin Elmer).
Спектры ЯМР 1Н зарегистрированы на приборах Bruker DRX-400 (400 МГц) или Bruker Avance 500 (500 МГц) в ДМСО-d6 с SiMe4 в качестве внутреннего стандарта при 25 или при 100°C. Химические сдвиги (δ) приведены в миллионных долях (м.д.), а константы спин-спинового взаимодействия (J) в герцах.
Спектры ЯМР 13С зарегистрированы на приборе Bruker Avance 500 (125 МГц) в ДМСО-d6 с SiMe4 в качестве внутреннего стандарта при 25°C. Химические сдвиги (5) приведены в миллионных долях (м.д.).
ИК спектры зарегистрированы на приборе FT-IR Spectrometer Spectrum One (Perkin-Elmer) для твердых образцов с приставкой диффузного отражения.
Масс-спектры зарегистрированы после хроматографического разделения на квадрупольном жидкостном хроматомасс-спектрометре LCMS QP-2010 (Shimadzu). Колонка Supelcosil LC-18 250×4,6 мм, обращенно-фазовый сорбент С18, 5 мкм. Элюент ацетонитрил-вода, 85:15. Скорость потока 0,45 мл/мин. Рабочее напряжение на игле 4,5 кВ. Химическая ионизация при атмосферном давлении (APSI), 400°C. Газ-носитель - азот, скорость потока 2,5 л/мин.
Аналитическая обращенно-фазовая ВЭЖХ (ОФ ВЭЖХ) выполнена на жидкостном хроматографе «Agilent-1100» (Agilent Technologies), колонка Phenomenex Luna С(18), 250×4,6 мм, сорбент 5 мкм, детектирование при длинах волн 230 и 254 нм, элюирование в градиенте от ацетонитрил - 0,2% водная трифторуксусная кислота, от 1:9 до 9:1 за 30 мин. Скорость потока 0,8 мл/мин.
Масс-спектр высокого разрешения зарегистрирован на масс-спектрометре MicrOTOF-Q II (Bruker Daltonics), оснащенном устройством прямого ввода kd Scientific (скорость потока 180 мкл/час). Ионизация электрораспылением (ESI). Программное обеспечение micrOTOFcontrol 2.3 patch 1 и HyStar 3.2 (Bruker Daltonics). Номинальное разрешение прибора 17500. Масс-спектрометр работал в режиме регистрации отрицательных ионов в диапазоне масс m/z=50-900 Да. Напряжение на капилляре источника ионизации составляло 3000 В, а на выходе из стеклянного капилляра потенциал напряжения был 166 В. Давление распылительного газа 0,4 бар, скорость потока газа-осушителя 4 л/мин. Температура нагревателя газа 180°C. Время транзита ионов 70 микросекунд, а радиочастота гексаполя 150 Vpp. Калибровка прибора внешняя, по 6 реперным точкам пиков кластеров формиата лития при введении в прибор 10 ммоль/л раствора LiOH в смеси изопропиловый спирт - 0,2% водная муравьиная кислота, 1:1.
Для ТСХ использованы пластинки Sorbfil (ООО «Имид», Россия). Проявление в УФ свете.
Примеры конкретного выполнения.
Пример 1. Синтез N-(2-ацетамидопурин-6-ил)глицина (5).
1 стадия - получение трет-Бутилового эфир N-(2-ацетамидопурин-6-ил)глицина (7).
К суспензии 420,8 мг (1,99 ммоль) 2-ацетамидо-6-хлорпурина (6) в 4,0 мл N,N-диметилацетамида прибавляют 1,00 г (5,97 ммоль, 3 экв.) гидрохлорида трет-бутилового эфира глицина и 1,11 мл (7,956 ммоль, 4 экв.) триэтиламина. Смесь нагревают при 100°C в течение 12 ч, затем приливают 50 мл дистиллированной воды. После охлаждения в холодильнике осадок отфильтровывают, промывают водой и сушат в вакууме. Получают 482 мг (79%) светло-коричневого твердого вещества. ТСХ: Rf=0,54 (CHCl3-МеОН-АсОН, 10:1:0,1). К полученному продукту добавляют 7 мл 95% этанола, нагревают до кипения (полного растворения не происходит) и после охлаждения отфильтровывают осадок, сушат в вакууме. Получают 415 мг (68%) светло-желтого твердого вещества. Т пл.=307-310°С (разложение без плавления).
Найдено: С 51,12; Н 6,17; N 27,74. Вычислено для C13H18N6O3 (М 306,33): С 50,97; Н 5,92; N 27,44.
Спектр ЯМР 1H (400 МГц, ДМСО-d6, 100°C): 1,41 (с, 9Н, But); 2,26 (с, 3Н, Ме-Ас); 4,19 (д, 2Н, СН2, J=6,1 Гц); 7,24 (с, 1Н, C6NH); 7,87 (с, 1Н, С8Н); 9,08 (с, 1Н, NHAc); 12,43 (уш.с, 1Н, N9H).
Спектр ЯМР 13С (125 МГц, ДМСО-d6, 25°C): 24,65 (Me-Ас); 27,68 (Ме-But); 42,31 (СН2); 80,44 (С-But); 115,75 (С-5′); 138,32 (С-8′); 150,62 и 152,50, и 154,12 (С-4′, С-2′, С-6′); 169,38 и 169,58 (СО Ас, CO2H).
ИК спектр (ν, см-1): 3328, 3139, 3092, 2940, 1728, 1708, 1627, 1593, 1518.
Хромато-масс-спектр (Supelcosil LC 18): τR=6,7 мин, m/z [отнесение] (Iотн., %): 251 [М-t-Bu+2Н]+ (19,2); 307 [М+Н]+ (100,0); 329 [М+Na]+ (14,0).
ОФ ВЭЖХ: τR=12,2 мин.
2 стадия - получение N-(2-Ацетамидопурин-6-ил)глицина (5).
К 1,53 г (4,99 ммоль) трет-бутилового эфира N-(2-ацетамидопурин-6-ил)глицина (7) приливают 12,5 мл трифторуксусной кислоты. Перемешивают при комнатной температуре (20°C) в течение 1 часа, упаривают до малого объема (~1 мл), приливают 25 мл 0,5 М водного NaOH (среда остается кислая, pH~1), выпавший осадок отфильтровывают, промывают водой на фильтре, сушат в вакууме. С целью очистки осадок растворяют в 11 мл 1 М водного NaOH, раствор фильтруют, подкисляют 0,1 М водным HCl до pH~6, выпавший осадок отфильтровывают, промывают водой на фильтре и сушат в вакууме при 70°C. Получают 782 мг (63%) продукта в виде бесцветного твердого вещества. ТСХ: Rf=0,56 (CHCl3-МеОН-10% водный NH3, 10:10:1).
Т пл.=304-306°C (разложение без плавления).
Спектр ЯМР 1Н (500 МГц, ДМСО-d6, 25°C): 2,20 (с, 3Н, СН3-Ас); 4,12 (с, 1Н, СН2, таутомер А, 86%); 4,55 (уш.с, 1Н, СН2, таутомер Б, 14%); 7,00 (уш.с, 1Н, C6NH, таутомер Б, 14%); 7,83 (уш.с, 1Н, C6NH, таутомер А, 86%); 8,00 (с, 1Н, С8Н); 9,82 (с, 1Н, NH-Ac); 12,57 (уш.с, 1Н, N9H или CO2H); 12,82 (уш.с, 1Н, CO2H или N9H).
Спектр ЯМР 13С (125 МГц, ДМСО-d6, 25°C): 24,54 (Ме-Ас); 41,55 (СН2); 115,44 (С-5′); 138,64 (С-8′); 150,99 и 152,47, и 153,96 (С-4′, С-2′, С-6′); 169,38 и 171,67 (СО Ас, CO2H).
ИК спектр (ν, см-1): 3527, 3395, 3302, 3228, 3061, 2934, 1716, 1698, 1648, 1608, 1535.
Масс-спектр высокого разрешения: m/z [отнесение]: 249,0732 [М-Н]-, 255,0814 [М-2Н+Li]-. Расчет для C9H10N6O3: 249,0731 [М-Н]- 255,0813 [М-2Н+Li]-.
Биологическая активность.
Соединения исследованы в лаборатории экспериментальных и диагностических исследований ФГБУ «УНИИФ» Минздрава России, г. Екатеринбург.
Изучение туберкулостатической активности соединений проводят методом вертикальной диффузии с использованием лабораторного штамма H37Rv на плотной питательной среде «Новая».
Питательную среду разливают в пробирки по 5 мл, свертывая в наклонном положении таким образом, чтобы 1/2 часть дна пробирки оставалась свободной. Свернутую среду засевают по 0,1 мл взвеси микобактерий туберкулеза (МБТ) штамма H37Rv, разведенного по стандарту мутности 10 ед. ГКИ, и в наклонном положении помещают в термостат на 24 часа для выращивания МБТ. Через сутки пробирки ставят в вертикальное положение и по свободному краю закапывают по 0,3 мл раствора соединений в исследуемых концентрациях: 12,5; 6,2; 3,1; 1,2; 0,6; 0,3 мкг/мл. Затем пробирки помещают в термостат при температуре 37°C и инкубируют в течение 10 суток. Оценку роста МБТ проводят по стандартной методике, где появление зон задержки роста МБТ (более 10 мм) свидетельствует о наличии туберкулостатических свойств в исследуемой концентрации соединений. Величина зоны задержки роста МБТ (в мм) пропорциональна степени туберкулостатической активности соединений. Задержка роста 100 мм и более расценивается как полная задержка роста МБТ. Соединение 5 проявило высокую бактериостатическую активность в отношении лабораторного штамма H37Rv (таблица 1).
Изучение туберкулостатической активности в отношении резистентных штаммов проводят методом вертикальной диффузии на плотной питательной среде «Новая» с использованием лабораторных и клинических штаммов микобактерий туберкулеза с множественной лекарственной устойчивостью (МЛУ и XDR), выделенных от больных, находящихся на лечении в клинике ФГБУ «УНИИФ».
Питательную среду разливают в пробирки по 5 мл, свертывая в наклонном положении таким образом, чтобы 1/2 часть дна пробирки оставалась свободной. Свернутую среду засевают по 0,1 мл суспензией микобактерий различных штаммов, разведенных по стандарту мутности 10 ед. ГКИ, и в наклонном положении помещают в термостат на 24 часа для выращивания МБТ. Через сутки пробирки ставят в вертикальное положение и по свободному краю закапывают по 0,3 мл раствора соединений в исследуемых концентрациях: 12,5; 6,2; 3,1; 1,5; 0,7 мкг/мл. Затем пробирки помещают в термостат при температуре 37°С и инкубируют в течение 10 суток. Оценку роста МБТ проводят по стандартной методике, где появление зон задержки роста МБТ (более 10 мм) свидетельствует о наличии туберкулостатических свойств в исследуемой концентрации соединений. Величина зоны задержки роста МБТ (в мм) пропорциональна степени туберкулостатической активности соединений. Задержка роста 100 мм и более расценивается как полная задержка роста МБТ. Данные представлены в таблице 1.
Из данных таблицы 1 следует, что соединение 5 проявляет высокую туберкулостатическую активность (МИК 0,7 мкг/мл) как в отношении лабораторного штамма H37Rv, так и в отношении ряда лекарственно устойчивых штаммов МБТ. Следует подчеркнуть, что соединение 5 проявило активность в отношении штамма МЛУ, в отношении которого известный противотуберкулезный препарат, изониазид, не активен.
N-(2-ацетамидопурин-6-ил)глицин формулы ,обладающий противотуберкулезной активностью.