Способ получения замещенных 3-формилиндол-5,6-дикарбонитрилов
Иллюстрации
Показать всеИзобретение относится к способу получения замещенных 3-формилиндол-5,6-дикарбонитрилов, где R=ALK, или Аr, или Неt, которые могут быть использованы в качестве прекурсоров для синтеза биологически активных веществ, лекарственных субстанций. Способ получения 3-формилиндол-5,6-дикарбонитрилов заключается во взаимодействии 2-замещенных 1-метоксииндол-5,6-дикарбонитрилов с фосфорил-хлоридом. Использование предложенного метода синтеза замещенных 3-формилиндол-5,6-дикарбонитрилов позволяет получать новые ранее неописанные в литературе орто-дикарбонитрилы, содержащие индольный цикл. 4 пр.
Реферат
Изобретение относится к способу получения новых азотсодержащих гетероциклических соединений, а именно замещенных 3-формилиндол-5,6-дикарбонитрилов, которые могут быть использованы в качестве прекурсоров для синтеза биологически активных веществ, лекарственных субстанций.
Данные соединения являются новыми, и из уровня техники нам не известны способы получения таких соединений.
Задачей изобретения является разработка способа получения замещенных 3-формилиндол-5,6-дикарбонитрилов:
где R=ALK, или Ar, или Het.
Поставленная задача решается тем, что предлагается способ получения замещенных 3-формилиндол-5,6-дикарбонитрилов путем взаимодействия 2-замещенных 1-метоксииндол-5,6-дикарбонитрилов (субстрат) и фосфорилхлорида (реагент) по следующей реакции:
при условиях, описанных ниже.
Взаимодействие субстрата и реагента протекает при температуре 85 … 110°C и мольном соотношении 1:3, соответственно, в течение 2-3 ч в растворе диметилформамида.
После окончания реакции полученную реакционную массу охлаждают, выливают в 3-15%-ный раствор NaHCO3. Выпавший кристаллический осадок замещенного 3-формилиндол-5,6-дикарбонитрила отфильтровывают, промывают ацетоном, перекристаллизовывают из спирта, сушат на воздухе.
Все приведенные признаки являются существенными, и заявляемая совокупность признаков позволяет достичь технического результата.
Строение всех синтезированных соединений определено на основании совокупности данных ИК-, ЯМР-спектроскопий и масс-спектрометрии.
Изобретение иллюстрируется следующими примерами.
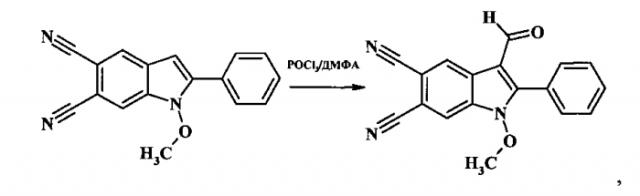
Пример 1. 3-формил-1-метокси-2-фенил-1H-индол-5,6-дикарбонитрил:
К раствору 0.001 моль 2-замещенного 1-метокси-2-фенил-1H-индол-5,6-дикарбонитрила в 5 мл диметилформамида прибавляют 0.003 моль фосфорилхлорида, перемешивают при температуре 90°C в течение 2 ч, затем реакционную массу охлаждают, выливают в 3-15%-ный раствор Na-НСО3, выпавший кристаллический осадок отфильтровывают, промывают ацетоном и перекристаллизовывают из спирта. Сушат на воздухе. Получают 0.2 г (53% от теории) 3-формил-1-метокси-2-фенил-1H-индол-5,6-дикарбонитрила - кристаллический осадок белого цвета, Тпл=236-238°C. ИК (ν/cm-1):2227 ( C ≡ N ) , 1664 (С=O), 1607 (Ar). Масс-спектр (m/z, %):301 [М+] (30), 270 [М+-ОМе] (100), 241(13), 215(36), 77(11). ЯМР 1H (ДМСО-d6 δ, м.д., J/Гц): 3.93(s, 3H, ОМе), 7.68 (m, 3Н, Н-5′, Н-3′, Н-4′), 7.87 (d, 2Н, Н-2′, Н-6′, J=7.4), 8.71 (s, 1H, H-4), 8.81 (s, 1Н, H-7), 9.81 (s, 1H, СОН). ЯМР 13C (ДМСО-d6 δ, м.д.): 185.35, 149.12, 132.09, 131.31, 130.88, 129.09, 127.45, 124.49, 122.90, 116.92, 116.69, 116.56, 110.74, 108.65, 108.20, 67.19 Найдено (%): С 71.62, Н 3.76, N 13.89. C18H11N3O2. Вычислено (%): С 71.75, Н 3.68, N 13.95.
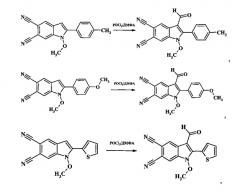
Пример 2. 3-формил-1-метокси-2-(4-мелилфенил)-1H-индол-5,6-дикарбонитрил:
К раствору 0.001 моль 2-замещенного 1-метокси-2-(4-мелилфенил)-1H-индол-5,6-дикарбонитрила в 5 мл диметилформамида прибавляют 0.003 моль фосфорилхлорида, перемешивают при температуре 85°C в течение 2,5 ч, затем реакционную массу охлаждают, выливают в 3-15%-ный раствор NaHCO3, выпавший кристаллический осадок отфильтровывают, промывают ацетоном и перекристаллизовывают из спирта. Сушат на воздухе. Получают 0.30 г (77% от теории) 3-формил-1-метокси-2-(4-мелилфенил)-1H-индол-5,6-дикарбонитрила кристаллический осадок белого цвета, Тпл.=240-241°C. ИК (ν/cm-1):2228 ( C ≡ N ) , 1658 (С=O), 1609 (Ar). Масс-спектр (m/z, %): 315 [M+] (43), 300(41), 284 M+-ОМе] (100), 254 (16). ЯМР 1H (ДМСО-d6 δ, м.д., J/Гц): 2.46(s, 3Н, Me), 3.92 (s, 3Н, ОМе), 7.50 (d, 2Н, Н-5′, Н-3′, J=8.2), 7.76 (d, 2Н, Н-2′, Н-6′, J=8.2), 8.69 (s, 1Н, Н-4), 8.78 (s, 1Н, H-7), 9.80 (s, 1H, СОН). Найдено (%): C 72.09, H 4.08, N 13.30. С19Н13О2. Вычислено (%): С 72.37, Н 4.16, N 13.33.
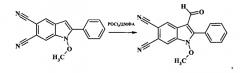
Пример 3. 3-формил-1-метокси-2-(4-метоксифенил)-1H-индол-5,6-дикарбонитрил:
К раствору 0.001 моль 2-замещенного 1-метокси-2-(4-метоксифенил)-1H-индол-5,6-дикарбонитрила в 5 мл диметилформамида прибавляют 0.003 моль фосфорилхлорида, перемешивают при температуре 90°C в течение 2,5 ч, затем реакционную массу охлаждают, выливают в 3-15%-ный раствор NaHCO3, выпавший кристаллический осадок отфильтровывают, промывают ацетоном и перекристаллизовывают из спирта. Сушат на воздухе. Получают 0.17 г (44% от теории) 3-формил-1-метокси-2-(4-метоксифенил)-1H-индол-5,6-дикарбонитрила - кристаллический осадок белого цвета, Тпл.=246-248°C (с разложением). ИК (ν/cm-1):2228 ( C ≡ N ) , 1664 (С=O), 1611 (Ar). Масс-спектр (m/z, %): 331 [М+] (51), 300 [М+-МеО] (100), 257(51), 228(18). ЯМР 1H (ДМСО-d6 δ, м.д, J/Гц): 3.89 (s, 3Н, ОМе), 3.91(s, 3Н, ОМе), 7.23 (d, 2Н, Н-5′, Н-3′, J=8.8), 7.82 (d, 2Н, Н-2′, Н-6′, J=8.8), 8.66 (s, 1Н, Н-4), 8.81 (s, 1Н, Н-7), 9.82 (s, 1Н, СОН). Найдено (%): С 68.56, Н 3.78, N 12.59. C19H13N3O3. Вычислено (%): С 68.88, Н 3.95, N 12.68.
Пример 4. 3-формил-1-метокси-2-(тиофен-2-ил)-1H-индол-5,6-дикарбонитрил:
К раствору 0.001 моль 2-замещенного 1-метокси-2-(тиофен-2-ил)-1H-индол-5,6-дикарбонитрила в 5 мл диметилформамида прибавляют 0.003 моль фосфорилхлорида, перемешивают при температуре 110°C в течение 3 ч, затем реакционную массу охлаждают, выливают в 3-15%-ный раствор NaHCO3, выпавший кристаллический осадок отфильтровывают, промывают ацетоном и перекристаллизовывают из спирта. Сушат на воздухе. Получают 0.12 г (70% от теории) 3-формил-1-метокси-2-(тиофен-2-ил)-1H-индол-5,6-дикарбонитрила - кристаллический осадок белого цвета, Тпл.=242-244°C (с разложением) ИК (ν/cm-1): 2226 ( C ≡ N ) , 1660 (С=O), 1605 (Ar). Масс-спектр (m/z, %): 307 [М+] (53), 276 [М+-МеО] (100), ЯМР 1Н (ДМСО-d6 δ, м.д., J/Гц): 4.08 (s, 3Н, ОМе), 7.42 (d. d, 1Н, Н-4′, 7=5.0, J=3.8), 8.06 (d. d., 1H, H-3′, J=3.8, J=1.0), 8.12 (d. d, 1H, H-5′, J=5.0, J=1.0), 8.69 (s, 1H, H-4), 8.81 (s, 1H, H-7), 10.12 (s, 1H, СОН). Найдено (%): C 62.37, H 2.81, N 13.61. C16H9N3O2S. Вычислено (%): С 62.53, H 2.95, N 13.67.
Техническим результатом изобретения является получение новых химических соединений достаточной степени чистоты, которые могут быть использованы в качестве прекурсоров для синтеза биологически активных веществ, лекарственных субстанций.
Способ получения 3-формилиндол-5,6-дикарбонитрилов общей формулы: где R=ALK, или Ar, или Het,заключающийся во взаимодействии 2-замещенных 1-метоксииндол-5,6-дикарбонитрилов (субстрат) с фосфорилхлоридом (реагент), которое протекает при температуре 85-110°C и мольном соотношении реагентов 1:3, соответственно, в течение 2-3 ч в растворе диметилформамида, после окончания реакции полученную реакционную массу охлаждают, выливают в 3-15%-ный раствор NaHCO3, выпавший кристаллический осадок замещенного 3-формилиндол-5,6-дикарбонитрила отфильтровывают, промывают ацетоном, перекристаллизовывают из спирта, сушат на воздухе.