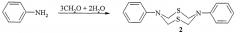Способ получения n-арил-1,5,3-дитиазациклоундеканов
Иллюстрации
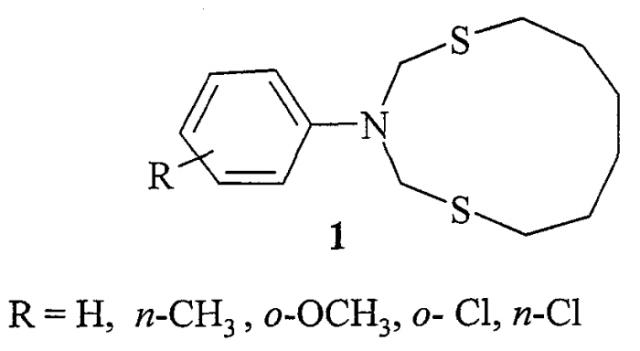
Показать всеИзобретение относится к способу получения N-арил-1,5,3-дитиазациклоундеканов формулы
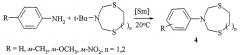
Сущность способа заключается во взаимодействии Ν,Ν-бис(метоксиметил)-N-арил(фенил, n-толуидин, o-анизидин, o-хлорфенил, n-хлорфенил)аминов с 1,6-гександитиолом в присутствии катализатора кристаллогидрата азотнокислого самария, нанесенного на γ-оксид алюминия (Sm(NO3)3·6H2O/γ-Al2O3), взятыми в соотношении N,N-бис(метоксиметил))-N-арил(фенил, n-толуидин, o-анизидин, o-хлорфенил, n-хлорфенил)амин (ммоль) : 1,5-пентандитиол (ммоль) : Sm(NO3)3·6H2O/γ-Al2O3 (мас.%) = 1:1:0.05, при комнатной (~20°C) температуре и атмосферном давлении в этиловом эфире уксусной кислоты в качестве растворителя в течение 4-6 ч. Выход соответствующих N-арил-1,5,3-дитиазациклоундеканов общей формулы (1) составляет 68-82%. Указанные соединения могут найти применение в качестве биологически активных соединений, селективных сорбентов и экстрагентов благородных и драгоценных металлов. 1 табл., 1пр.
Реферат
Изобретение относится к области органической химии, конкретно к способу получения N-арил-1,5,3-дитиазациклоундеканов общей формулы (1)
Циклические азот- и серусодержащие соединения перспективны в качестве биологически активных соединений [Z. Brzozowski, F. Saczewski, M. Gdaniec. Bioorganic & Medicinal Chemistry, 2003, №11, p 3673; R.B. Pawar, V.V. Mulwad. ХГС, 2004, №2, с. 257], селективных сорбентов и экстрагентов благородных и драгоценных металлов [Муринов Ю.И., Майстренко В.Н., Афзалетдинова Н.Г. Экстракция металлов S,N-органическими соединениями. - М.: Наука, 1993, 192 с.].
Известен способ (Ахметова В.Р., Ниатшина З.Т., Хабибуллина Г.Р., Бушмаринов И.С., Борисова А.О., Старикова З.А., Коржова Л.Ф., Кунакова Р.В. Синтез, кристаллическая структура и взаимные превращения новых N-арил-1,3,5-дитиазинанов, 1,3,5-тиадиазинанов и 1,5-дитиа-3,7-диазациклооктанов // Изв. АН. Сер. хим., 2010, 5, с. 980-986) получения восьмичленных N,S-содержащих гетероциклов, а именно N,N′-дифенил-1,5-дитиа-3,7-диазациклооктанов (2) взаимодействием анилина, водного формальдегида (37%) и сероводорода при температуре 0°C по схеме
Известным способом не могут быть получены N-арил-1,5,3-дитиазациклоундеканы общей формулы (1).
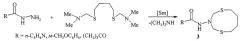
Известен способ (Хайруллина P.P., Акманов Б.Ф., Кунакова Р.В., Ибрагимов А.Г., Джемилев У.М. Эффективное каталитическое тиометилирование гидразидов карбоновых кислот // Изв. АН. Сер. хим., 2013, 1, с. 98-103) получения N-(1,5,3-дитиазонан-3-ил)амидов (3) взаимодействием N1,N1,N8,N8-тетраметил-2,7-дитиаоктан-1,8-диамина с гидразидами карбоновых кислот в хлороформе в присутствии SmCl3·H2O по схеме
Известным способом не могут быть получены N-арил-1,5,3-дитиазациклоундеканы общей формулы (1).
Известен способ (Н.Н. Мурзакова, К.И. Прокофьев, Т.В. Тюмкина, А.Г. Ибрагимов. Синтез N-арил-1,5,3-дитиазепинанов и N-арил-1,5,3-дитиазоцинанов с участием Sm- и Co-содержащих катализаторов // ЖОрХ. 2012. Т. 48. Вып. 4. С. 590) получения 3-арил-1,5,3-дитиазепинанов или 3-арил-1,5,3-дитиазоцинанов общей формулы (4) взаимодействием ариламинов с N-трет-бутил-1,5,3-дитиазепинаном или N-трет-бутил-1,5,3-дитиазоцинаном в присутствии катализатора Sm(NO3)3·6H2O, с выходом 63-86% по схеме
По известному способу N-арил-1,5,3-дитиазациклоундеканы общей формулы (1) не образуются.
Предлагается новый способ получения N-арил-1,5,3-дитиазациклоундеканов общей формулы (1).
Сущность способа заключается во взаимодействии N,N-бис(метоксиметил)-N-арил(фенил, n-толуидин, o-анизидин, o-хлорфенил, n-хлорфенил)амина с 1,6-гександитиолом в присутствии катализатора кристаллогидрата азотнокислого самария, нанесенного на γ-оксид алюминия (Sm(NO3)3·6H2O/γ-Al2O3), взятыми в соотношении N,N-бис(фенил, n-толуидин, o-анизидин, o-хлорфенил, n-хлорфенил)-N-ариламин (ммоль) : 1,6-гександитиол (ммоль) : Sm(NO3)3·6H2O/γ-Al2O3 (мас.%) = 1:1:(0.03-0.07), предпочтительно 1:1:0.05, при комнатной (~20°C) температуре и атмосферном давлении в этиловом эфире уксусной кислоты в качестве растворителя в течение 4-6 ч, предпочтительно 5 ч. Выход соответствующих N-арил-1,5,3-дитиазациклоундеканов общей формулы (1) составляет 68-82%. Реакция протекает по схеме
N-Арил-1,5,3-дитиазациклоудеканы общей формулы (1) образуются только лишь с участием N,N-бис(метоксиметил)-N-ариламинов и 1,6-гександитиола, взятых в стехиометрических количествах. При другом соотношении исходных реагентов снижается селективность реакции. Без катализатора реакция не идет.
Проведение указанной реакции в присутствии катализатора Sm(NO3)3·6H2O/γ-Al2O3 больше 7 мас.% в расчете на исходный N,N-бис(метоксиметил)-N-ариламин не приводит к существенному увеличению выхода целевого продукта (1). Использование катализатора Sm(NO3)3·6H2O/γ-Al2O3 менее 3 мас.% снижает выход (1), что связано, возможно, со снижением каталитически активных центров в реакционной массе. Реакции проводили при температуре 20°C. При температуре выше 20°C (например, 60°C) увеличиваются энергозатраты, а при температуре ниже 20°C (например, 10°C) снижается скорость реакции. Опыты проводили в этиловом эфире уксусной кислоты, т.к. в нем хорошо растворяются исходные реагенты и целевые продукты.
Существенные отличия предлагаемого способа:
В известном способе реакция идет с образованием 3-арил-1,5,3-дитиазепинанов и 3-арил-1,5,3-дитиазоцинанов общей формулы (4) взаимодействием ариламинов с N-трет-бутил-1,5,3-дитиазепинаном или N-трет-бутил-1,5,3-дитиазоцинаном в присутствии Sm(NO3)3·6H2O с выходами 63-86%. Реакция протекает в присутствии гомогенного катализатора Sm(NO3)3·6H2O, который не может быть регенерирован и использован повторно.
В предлагаемом способе в качестве исходных реагентов применяются N,N-бис(метоксиметил)-N-арил(фенил, n-толуидин, o-анизидин, o-хлорфенил, n-хлорфенил)амины и 1,6-гександитиол, а в качестве катализатора Sm(NO3)3·6H2O/γ-Al2O3, который может быть использован многократно без регенерации. В отличие от известных предлагаемый способ с участием гетерогенного катализатора позволяет синтезировать N-арил-1,5,3-дитиазациклоундеканы общей формулы (1) с выходом 68-82%.
Катализатор Sm(NO3)3·6H2O/γ-Al2O3 готовят в соответствии с известными общими принципами приготовления нанесенных катализаторов [Пахомов Н.А. Научные основы приготовления катализаторов: введение в теорию и практику. - Новосибирск: Издательство СО РАН, 2011, с. 262] путем пропитки носителя γ-Al2O3 раствором нитрата самария с последующей сушкой при 120-130°C. Катализатор содержит 12.8 мас.% Sm(NO3)3·6H2O и 87.2 мас.% γ-Al2O3.
Способ поясняется следующими примерами:
ПРИМЕР 1. В сосуд Шленка, установленный на магнитной мешалке, в атмосфере аргона помещают 0.18 г (1 ммоль) N,N-бис(метоксиметил)-N-фениламина и 0.15 г (1 ммоль) 1,6-гександитиола, 5 мл этилацетата, 0.009 г (5 мас.% в расчете на N,N-бис(метоксиметил)-N-фениламин) Sm(NO3)3·6H2O/γ-Al2O3, перемешивают при комнатной (~20°C) температуре 5 ч, выделяют N-фенил-1,5,3-дитиазациклоундекан (1) с выходом 75%.
Другие примеры, подтверждающие способ, приведены в таблице.
Все опыты проводили при эквимольном соотношении N,N-бис(метоксиметил)-N-ариламина и 1,6-гександитиола в этиловом эфире уксусной кислоты при комнатной температуре (~20°C). Во всех опытах повторное (трехкратное) применение гетерогенного катализатора Sm(NO3)3·6H2O/γ-Al2O3 не приводит к существенному снижению выхода целевого продукта (1).
Спектральные характеристики N-фенил-1,5,3-дитиазациклоудекана:
| Спектр ЯМР 1H (δ, м.д., CDCl3, J/Гц): 1.30-1.59 (м., 8H, CH2 (7-10)); 2.55 (м., 4H, CH2 (6,11)); 4.67 (с., 4H, CH2 (2,4)); 6.87-6.89 (м., 2H, CH (13,17)); 6.97-6.99 (м., H, CH (15)); 7.26-7.30 (м., 2H, CH (14,16)). Спектр ЯМР 13C (δ, м.д., J/Гц): 28.49 (C-8,9); 29.96 (C-7,10); 31.61 (C-6,11); 53.73 (C-2,4); 115.78 (C-17,13); 119.65 (C-15); 129.27 (C-14,16); 147.29 (C-12). |
Спектральные характеристики N-(n-метилфенил)-1,5,3-дитиазациклоундекана:
| Спектр ЯМР 1H (δ, м.д., CDCl3, J/Гц): 1.31-1.61 (м., 8H, CH2 (7-10)); 2.32 (с., 3H, CH3 (18)); 2.51-2.70 (м., 4H, CH2 (6,11)); 4.67 (с., 4H, CH2 (2,4)); 7.06 (д., 2H, CH (12,16) J=8 Гц); 7.12 (д., 2H, CH (13,15) J=8 Гц). Спектр ЯМР 13C (δ, м.д., J/Гц): 20.90 (С-18); 28.35 (C-8,9); 29.82 (C-7,10); 31.45 (C-6,11); 54.02 (C-2,4); 116.36 (C-13,17); 127.62 (C-15); 129.83 (C-14,16); 145.21 (C-12). |
Спектральные характеристики N-(o-метоксилфенил)-1,5,3-дитиазациклоундекана:
| Спектр ЯМР 1H (δ, м.д., CDCl3, J/Гц): 1.32-1.61 (м., 6H, CH2 (7-10)); 3.83 (с., 3H, CH3 (18)); 2.41-2.57 (м., 4H, CH2 (6,11)); 4.58 (с., 4H, CH2 (2,4)); 6.62-7.03 (м., 4H, CH (13-16)). Спектр ЯМР 13C (δ, м.д., J/Гц): 27.56 (C-8,9); 29.78 (C-7,10); 31.84 (C-6,11); 54.18 (C-2,4); 55.56 (C-18); 109.72 (C-16); 111.37 (C-13); 117.69 (C-14); 121.17 (C-15); 135.60 (C-17); 147.18 (C-12). |
Спектральные характеристики N-(o-хлорфенил)-1,5,3-дитиазациклоундекана:
| Спектр ЯМР 1H (δ, м.д., CDCl3, J/Гц): 1.32-1.59 (м., 6H, CH2 (7-10)); 2.48-2.60 (м., 4H, CH2 (6,11)); 4.45 (с., 4H, CH2 (2,4)); 6.71-7.31 (м., 4H, CH (14-17)). Спектр ЯМР 13C (δ, м.д., J/Гц): 27.94 (C-8,9); 29.66 (C-7,10); 31.36 (C-6,11); 54.34 (C-2,4); 112.86 (C-17); 118.50 (C-15); 119.80 (C-13); 127.77 (C-14); 129.27 (C-16); 141.86 (C-12). |
Спектральные характеристики N-(n-хлорфенил)-1,5,3-дитиазациклоундекана:
| Спектр ЯМР 1H (δ, м.д., CDCl3, J/Гц): 1.39-1.69 (м., 8H, CH2 (7-10)); 2.52-2.67 (м., 4H, CH2 (6,11)); 4.62 (с., 4H, CH2 (2,4)); 6.88 (д., 2H, CH (12,16) J=5 Гц); 7.22 (д., 2H, CH (13,15) J=5 Гц). Спектр ЯМР 13C (δ, м.д., J/Гц): 28.41 (C-8,9); 29.81 (C-7,10); 31.56 (C-6,11); 54.59 (C-2,4); 116.95 (C-13,17); 124.59 (C-15); 129.10 (C-14,16); 145.67 (C-12). |
Способ получения N-арил-1,5,3-дитиазациклоундеканов общей формулы (1) отличающийся тем, N,N-бис(метоксиметил)-N-арил(фенил, n-толуидин, o-анизидин, o-хлорфенил, n-хлорфенил)амины подвергают взаимодействию с 1,6-гександитиолом в присутствии катализатора кристаллогидрата азотнокислого самария, нанесенного на γ-оксид алюминия (Sm(NO3)3·6H2O/γ-Al2O3) при соотношении N,N-бис(метоксиметил)-N-арил(фенил, n-толуидин, o-анизидин, o-хлорфенил, n-хлорфенил)амин (ммоль) : 1,6-гександитиол (ммоль) : Sm(NO3)3·6H2O/γ-Al2O3 (мас.%) = 1:1:0.03-0.07 в этиловом эфире уксусной кислоты в качестве растворителя, при комнатной температуре (~20°C), атмосферном давлении, в течение 4-6 ч.