Антигенсвязывающая молекула, способная к многократному связыванию двух или более молекул антигена
Иллюстрации
Показать всеНастоящее изобретение относится к области биохимии. Предложены способы скрининга антитела IgG, обладающего повышенной способностью элиминировать антиген в плазме, основанные на отборе IgG, антигенсвязывающая активность которого при рН от 6,7 до 10,0 выше антигенсвязывающей активности при рН от 4,0 до 6,5. Антитела IgG, обладающие более слабой антигенсвязывающей активностью при рН внутри ранних эндосом, чем при рН в плазме, способны к многократному связыванию с антигеном, имеют длительный период полужизни в плазме и увеличенные продолжительности периода времени, в течение которого они могут связываться с антигеном. Таким образом, антитела IgG, полученные способами по данному изобретению, обладают улучшенной фармакокинетикой и увеличенным числом раз связывания с антигеном in vivo. 4 н. и 5 з.п. ф-лы, 29 ил., 17 табл., 18 пр.
Реферат
Область техники
Настоящее изобретение относится к способам улучшения фармакокинетики антигенсвязывающих молекул и способам увеличения числа раз связывания с антигенами антигенсвязывающих молекул, а также к антигенсвязывающим молекулам, обладающим улучшенной фармакокинетикой, антигенсвязывающим молекулам, характеризующимся увеличенным числом раз связывания с антигенами, и способам продуцирования таких молекул.
Предпосылки создания изобретения
Антитела обращают на себя внимание в качестве лекарственных средств, поскольку они являются в высокой степени устойчивыми в плазме и имеют немногочисленные побочные эффекты. В настоящее время на рынке имеются лекарственные средства в виде антител IgG-типа, и намного больше лекарственных средств в виде антител в настоящее время находятся в процессе разработки (непатентные документы 1 и 2). Между тем, были разработаны различные способы, применимые для получения лекарственных средств в виде антител второго поколения, в том числе те, которые усиливают эффекторную функцию, способность к связыванию антигенов, фармакокинетику и устойчивость, и те, которые уменьшают угрозу иммуногенности (непатентный документ 3). Обычно требуемая доза лекарственного средства в виде антитела является очень высокой. Это, в свою очередь, привело к таким проблемам, как высокие затраты на продукцию, а также трудности производства препаратов для подкожного введения. Теоретически дозу лекарственного средства в виде антитела можно снизить путем улучшения фармакокинетики антител или увеличения аффинности между антителами и антигенами.
В литературе были приведены сообщения о способах улучшения фармакокинетики антител, используя искусственную замену аминокислот в константных областях (непатентные документы 4 и 5). Так же сообщалось о созревании аффинности в качестве метода усиления способности к связыванию антигенов или антигеннейтрализующей активности (непатентный документ 6). Этот метод позволяет усилить антигенсвязывающую активность путем введения аминокислотных мутаций в участок CDR вариабельной области или т.п. Усиление способности к связыванию антигенов позволяет увеличить in vitro биологическую активность или снизить дозу и, кроме того, позволяет увеличить in vivo эффективность (непатентный документ 7).
Способность к нейтрализации антигенов одной молекулы антитела зависит от ее аффинности. При увеличении аффинности антиген можно нейтрализовать меньшим количеством антитела. Для увеличения аффинности антитела можно использовать различные способы. Кроме того, если бы аффинность можно было сделать очень большой при ковалентном связывании антитела с антигеном, одна молекула антитела могла бы нейтрализовать одну молекулу антигена (двухвалентное антитело может нейтрализовать две молекулы антигена). Однако нейтрализация в стехиометрическом соотношении: одно антитело против одного антигена (одно двухвалентное антитело против двух антигенов) является пределом уже существующих способов, и, следовательно, невозможно полностью нейтрализовать антиген количеством антитела, меньшим количества антигена. Другими словами, эффект увеличения аффинности имеет предел (непатентный документ 9). Для продления эффекта нейтрализации нейтрализующего антитела на определенный период времени антитело должно вводиться в дозе, превышающей количество антигена, продуцируемого в организме в течение этого же периода. Несмотря на описанное выше улучшение фармакокинетики антител или метод созревания аффинности, существует, таким образом, предел снижения требуемой дозы антитела.
В результате, для поддержания антигеннейтрализующего эффекта в течение целевого периода времени с использованием количества антитела, меньшего количества антигена, одно антитело должно нейтрализовать множество антигенов. Способы нейтрализации множества антигенов одним антителом включают инактивацию антигенов с использованием каталитических антител, которые являются антителами, которым сообщена каталитическая функция. Когда антиген является белком, он может быть инактивирован при гидролизе его пептидных связей. Антитело может многократно нейтрализовать антигены путем катализирования такого гидролиза (непатентный документ 8). Существует множество предшествующих опубликованных сообщений о каталитических антителах и методах их продуцирования. Однако не было сообщений о каталитических антителах, обладающих достаточной каталитической активностью, в качестве фармацевтического средства. В частности, при in vivo исследовании антител в отношении определенного антигена не было публикации, касающейся каталитических антител, которые, по сравнению с обычным некаталитическим нейтрализующим антителом, могут вызывать сравнимый или более сильный эффект даже при низких дозах или вызывать более продолжительный эффект даже при одной и той же дозе.
Как описано выше, не было сообщений об антителах, которые могут вызывать больший in vivo эффект, чем обычные нейтрализующие антитела, благодаря нейтрализации множества молекул антигена одним антителом. Таким образом, с точки зрения снижения дозы и удлинения срока службы, существует потребность в новых методах, которые позволяют продуцировать новые молекулы антител, обладающие более сильным in vivo эффектом, чем обычные нейтрализующие антитела, благодаря нейтрализации в индивидуальном порядке множества молекул антигена.
Имеющие отношение к настоящему изобретению документы, касающиеся известного уровня техники, представлены ниже:
Документы, касающиеся известного уровня техники
Непатентные документы
Непатентный документ 1: Monoclonal antibody successes in the clinic. Janice M Reichert, Clark J Rosensweig, Laura B Faden & Matthew C Dewitz, Nature Biotechnology 23, 1073-1078 (2005).
Непатентный документ 2: Pavlou AK, Belsey MJ. The therapeutic antibodies market to 2008. Eur. J. Pharm. Biopharm. 2005 Apr; 59(3): 389-396.
Непатентный документ 3: Kim SJ, Park Y, Hong HJ. Antibody engineering for the development of therapeutic antibodies. Mol Cells. 2005 Aug 31; 20(1): 17-29. Review.
Непатентный документ 4: Hinton PR, Xiong JM, Johlfs MG, Tang MT, Keller S, Tsurushita N. An engineered human IgG1 antibody with longer serum half-life. J Immunol. 2006 Jan 1; 176(1):346-356.
Непатентный документ 5: Ghetie V, Popov S, Borvak J, Radu C, Matesoi D, Medesan C, Ober RJ, Ward ES. Increasing the serum persistence of an IgG fragment by random mutagenesis. Nat. Biotechnol. 1997 Jul; 15(7):637-640.
Непатентный документ 6: Rajpal A, Beyaz N, Haber L, Cappuccilli G, Yee H, Bhatt RR, Takeuchi T, Lerner RA, Crea R. A general method for greatly improving the affinity of antibodies by using combinatorial libraries. Proc. Natl. Acad. Sci USA. 2005 Jun 14; 102(24):8466-8471, Epub 2005 Jun 6.
Непатентный документ 7: Wu H, Pfarr DS, Johnson S, Brewah YA, Woods RM, Patel NK, White WI, Young JF, Kiener PA. Development of Motavizumab, an Ultra-potent Antibody for the Prevention of Respiratory Syncytial Virus Infection in the Upper and Lower Respiratory Tract. J. Mol. Biol. 2007, 368, 652-665.
Непатентный документ 8: Hanson CV, Nishiyama Y, Paul S. Catalytic antibodies and their applications. Curr. Opin. Biotechnol. 2005 Dec; 16(6):631-636.
Непатентный документ 9: Rathanaswami P, Roalstad S, Roskos L, Su QJ, Lackie S, Babcook J. Demonstration of an in vivo generated sub-picomolar affinity fully human monoclonal antibody to interleukin-8. Biochem. Biophys. Res. Commun. 2005 Sep 9;334(4):1004-1013.
Краткое изложение сущности изобретения
Задачи, решаемые настоящим изобретением
Отмеченные выше обстоятельства привели к открытиям настоящего изобретения. В результате, целью настоящего изобретения является обеспечение способов многократного связывания антигенсвязывающих молекул с антигенами и способов улучшения фармакокинетики антигенсвязывающих молекул, а также антигенсвязывающих молекул, которые способны к многократному связыванию с антигенами, антигенсвязывающих молекул, обладающих улучшенной фармакокинетикой, фармацевтических композиций, содержащих такие антигенсвязывающие молекулы, и способов продуцирования таких молекул и композиций.
Способ решения задач
В настоящем описании были проведены исследования, посвященные способам многократного связывания полипептидов, обладающих способностью к связыванию антигенов, таких как антигенсвязывающие молекулы, с антигенами и способам увеличения времени полужизни таких молекул в плазме (крови) (улучшения их фармакокинетики). В результате было обнаружено, что, если антигенсвязывающая активность антигенсвязывающей молекулы при рН в ранних эндосомах ниже ее антигенсвязывающей активности при рН плазмы (крови), она могла связываться с антигенами многократно и иметь большее время полужизни в плазме.
В результате, настоящее изобретение относится к способам многократного связывания антигенсвязывающих молекул с антигенами, способам улучшения фармакокинетики антигенсвязывающих молекул и способам продуцирования антигенсвязывающих молекул с улучшенной фармакокинетикой; настоящее изобретение также относится к антигенсвязывающим молекулам, которые способны к многократному связыванию с антигенами, и к антигенсвязывающим молекулам с улучшенной фармакокинетикой. Конкретнее, настоящим изобретением обеспечиваются:
[1] антигенсвязывающая молекула, имеющая значение KD(pH 5,8)/KD(pH 7,4), определяемое как соотношение между KD для антигена при рН 5,8 и KD для антигена при pH 7,4, составляющее 2 или больше;
[2] антигенсвязывающая молекула в соответствии с [1], значение KD(pH 5,8)/KD(pH 7,4) которой составляет 10 или больше;
[3] антигенсвязывающая молекула в соответствии с [1], значение KD(pH 5,8)/KD(pH 7,4) которой составляет 40 или больше;
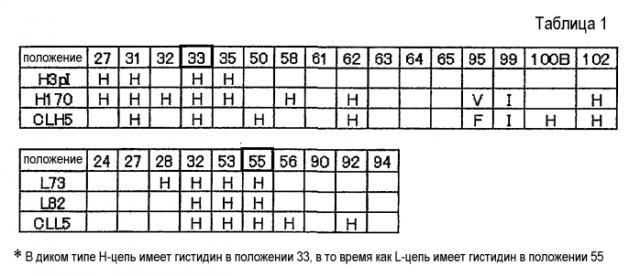
[4] антигенсвязывающая молекула в соответствии с любым из [1]-[3], по крайней мере одна аминокислота которой была замещена гистидином, или в которую был вставлен по крайней мере один гистидин;
[5] антигенсвязывающая молекула в соответствии с любым из [1]-[4], которая обладает антагонистической активностью;
[6] антигенсвязывающая молекула в соответствии с любым из [1]-[5], которая связывается с мембранным антигеном или растворимым антигеном;
[7] антигенсвязывающая молекула в соответствии с любым из [1]-[6], которая является антителом;
[8] фармацевтическая композиция, включающая антигенсвязывающую молекулу в соответствии с любым из [1]-[7];
[9] способ улучшения фармакокинетики антигенсвязывающей молекулы путем ослабления антигенсвязывающей активности антигенсвязывающей молекулы при pH 5,8 по сравнению с указанной активностью при pH 7,4;
[10] способ увеличения числа раз связывания с антигеном для антигенсвязывающей молекулы путем ослабления антигенсвязывающей активности антигенсвязывающей молекулы при pH 5,8 по сравнению с указанной активностью при pH 7,4;
[11] способ увеличения числа антигенов, которое может быть связано антигенсвязывающей молекулой, путем ослабления антигенсвязывающей активности антигенсвязывающей молекулы при pH 5,8 по сравнению с указанной активностью при pH 7,4;
[12] способ диссоциации внутри клетки антигена от связавшейся с ним внеклеточно антигенсвязывающей молекулы путем ослабления антигенсвязывающей активности антигенсвязывающей молекулы при pH 5,8 по сравнению с указанной активностью при pH 7,4;
[13] способ высвобождения антигенсвязывающей молекулы, которая связалась с антигеном и подверглась интернализации в клетку, в свободной от антигена форме наружу из клетки путем ослабления антигенсвязывающей активности антигенсвязывающей молекулы при pH 5,8 по сравнению с указанной активностью при pH 7,4;
[14] способ увеличения способности антигенсвязывающей молекулы к элиминации антигена в плазме путем ослабления антигенсвязывающей активности антигенсвязывающей молекулы при pH 5,8 по сравнению с указанной активностью при pH 7,4;
[15] способ в соответствии с любым из [9]-[14], в котором значение KD(pH 5,8)/KD(pH 7,4), определяемое как соотношение между KD для антигена при рН 5,8 и KD для антигена при pH 7,4, составляет 2 или больше;
[16] способ в соответствии с любым из [9]-[14], в котором значение KD(pH 5,8)/KD(pH 7,4) составляет 10 или больше;
[17] способ в соответствии с любым из [9]-[14], в котором значение KD(pH 5,8)/KD(pH 7,4) составляет 40 или больше;
[18] способ улучшения фармакокинетики антигенсвязывающей молекулы путем замены по крайней мере одной аминокислоты антигенсвязывающей молекулы гистидином или вставки по крайней мере одного гистидина в антигенсвязывающую молекулу;
[19] способ увеличения числа раз связывания с антигеном для антигенсвязывающей молекулы путем замены по крайней мере одной аминокислоты антигенсвязывающей молекулы гистидином или вставки по крайней мере одного гистидина в антигенсвязывающую молекулу;
[20] способ увеличения числа антигенов, которые могут быть связаны антигенсвязывающей молекулой, путем замены по крайней мере одной аминокислоты антигенсвязывающей молекулы гистидином или вставки по крайней мере одного гистидина в антигенсвязывающую молекулу;
[21] способ диссоциации внутри клетки антигена от связавшейся с ним внеклеточно антигенсвязывающей молекулы путем замены по крайней мере одной аминокислоты антигенсвязывающей молекулы гистидином или вставки по крайней мере одного гистидина в антигенсвязывающую молекулу;
[22] способ высвобождения антигенсвязывающей молекулы, которая связалась с антигеном и подверглась интернализации в клетку, в свободной от антигена форме наружу из клетки путем замены по крайней мере одной аминокислоты антигенсвязывающей молекулы гистидином или вставки по крайней мере одного гистидина в антигенсвязывающую молекулу;
[23] способ увеличения способности антигенсвязывающей молекулы к элиминации антигена в плазме путем замены по крайней мере одной аминокислоты антигенсвязывающей молекулы гистидином или вставки по крайней мере одного гистидина в антигенсвязывающую молекулу;
[24] способ в соответствии с любым из [18]-[23], в котором замена гистидином или его вставка увеличивает значение KD(pH 5,8)/KD(pH 7,4), определяемое как соотношение между антигенсвязывающей активностью при pH 5,8 и антигенсвязывающей активностью при pH 7,4, по сравнению со значением KD(pH 5,8)/KD(pH 7,4) до замены гистидином или его вставки;
[25] способ в соответствии с любым из [9]-[24], в котором антигенсвязывающая молекула обладает антагонистической активностью;
[26] способ в соответствии с любым из [9]-[25], в котором антигенсвязывающая молекула связывается с мембранным антигеном или растворимым антигеном;
[27] способ в соответствии с любым из [9]-[26], в котором антигенсвязывающей молекулой является антитело;
[28] способ скрининга антигенсвязывающих молекул, который включает стадии:
(a) определения антигенсвязывающей активности антигенсвязывающей молекулы при pH от 6,7 до 10,0;
(b) определения антигенсвязывающей активности антигенсвязывающей молекулы при pH от 4,0 до 6,5; и
(c) отбора антигенсвязывающей молекулы, антигенсвязывающая активность которой при pH от 6,7 до 10,0 выше антигенсвязывающей активности при pH от 4,0 до 6,5;
[29] способ скрининга в соответствии с [28], который включает стадию отбора антитела, антигенсвязывающая активность которого при pH от 6,7 до 10,0 - дважды или более антигенсвязывающей активности при pH от 4,0 до 6,5;
[30] способ скрининга антигенсвязывающих молекул, который включает стадии:
(a) связывания антигенсвязывающей молекулы с антигеном при параметре pH, составляющем от 6,7 до 10,0;
(b) помещения антигенсвязывающей молекулы, которая связалась с антигеном на стадии (a), при параметре pH, составляющем от 4,0 до 6,5; и
(c) получения антигенсвязывающей молекулы, которая подвергалась диссоциации при параметре pH, составляющем от 4,0 до 6,5;
[31] способ скрининга для получения антигенсвязывающей молекулы, активность связывания которой при первом рН превышает активность связывания при втором рН, который включает стадии:
(a) связывания антигенсвязывающей молекулы с колонкой с иммобилизованным антигеном при параметре первого рН;
(b) элюирования антигенсвязывающей молекулы, которая связалась с колонкой при первом рН, с колонки при параметре второго pH; и
(c) сбора подвергшейся элюции антигенсвязывающей молекулы;
[32] способ скрининга для получения антигенсвязывающей молекулы, активность связывания которой при первом рН превышает активность связывания при втором рН, который включает стадии:
(a) связывания библиотеки антигенсвязывающих молекул с колонкой с иммобилизованным антигеном при параметре первого рН;
(b) элюирования антигенсвязывающей молекулы с колонки при параметре второго pH;
(c) амплификации гена, кодирующего элюируемую антигенсвязывающую молекулу гена; и
(d) получения элюируемой антигенсвязывающей молекулы;
[33] способ скрининга в соответствии с [31] или [32], в котором первый pH составляет от 6,7 до 10,0, а второй pH составляет от 4,0 до 6,5;
[34] способ скрининга в соответствии с любым из [28]-[33], в котором по крайней мере одна или более аминокислот антигенсвязывающей молекулы была замещена гистидином, или по крайней мере один гистидин был вставлен в антигенсвязывающую молекулу;
[35] способ скрининга в соответствии с любым из [28]-[33] для получения антигенсвязывающей молекулы, которая превосходит в сохранении в плазме;
[36] способ скрининга в соответствии с любым из [28]-[33] для получения антигенсвязывающей молекулы, которая способна к связыванию антигена два или более раз;
[37] способ скрининга в соответствии с любым из [28]-[33] для получения антигенсвязывающей молекулы, которая способна к связыванию большего числа антигеном, чем число ее антигенсвязывающих сайтов;
[38] способ скрининга в соответствии с любым из [28]-[33] для получения антигенсвязывающей молекулы, которая подвергает диссоциации связавшийся с ней внеклеточно антиген внутри клетки;
[39] способ скрининга в соответствии с любым из [28]-[33] для получения антигенсвязывающей молекулы, которая связывается с антигеном и подвергается интернализацию в клетку, и высвобождается наружу из клетки в свободной от антигена форме;
[40] способ скрининга в соответствии с любым из [28]-[33] для получения антигенсвязывающей молекулы, которая обладает увеличенной способностью к элиминации антигена в плазме;
[41] способ скрининга в соответствии с любым из [28]-[40], в котором антигенсвязывающая молекула используется в виде фармацевтической композиции;
[42] способ скрининга в соответствии с любым из [28]-[41], в котором антигенсвязывающей молекулой является антитело;
[43] способ продуцирования антигенсвязывающей молекулы, который включает стадии:
(a) определения антигенсвязывающей активности антигенсвязывающей молекулы при pH от 6,7 до 10,0;
(b) определения антигенсвязывающей активности антигенсвязывающей молекулы при pH от 4,0 до 6,5;
(c) отбора антигенсвязывающей молекулы, антигенсвязывающая активность которой при pH от 6,7 до 10,0 выше антигенсвязывающей активности при pH от 4,0 до pH 6,5;
(d) получения гена, кодирующего антигенсвязывающую молекулу, отобранную на стадии (c); и
(e) продуцирования антигенсвязывающей молекулы, используя полученный на стадии (d) ген;
[44] способ продуцирования антигенсвязывающей молекулы, который включает стадии:
(a) связывания антигенсвязывающей молекулы с антигеном при параметре pH, составляющем от 6,7 до 10,0;
(b) допущения нахождения антигенсвязывающей молекулы, связанной с антигеном на стадии (a), при параметре рН, составляющем от 4,0 до 6,5;
(c) сбора антигенсвязывающей молекулы, которая подвергалась диссоциации при параметре pH, составляющем от 4,0 до 6,5;
(d) получения гена, кодирующего антигенсвязывающую молекулу, полученную на стадии (c); и
(e) продуцирования антигенсвязывающей молекулы, используя полученный на стадии (d) ген;
[45] способ продуцирования антигенсвязывающей молекулы, активность связывания которой при первом рН превышает активность связывания при втором рН, который включает стадии:
(a) связывания антигенсвязывающей молекулы с колонкой с иммобилизованным антигеном при параметре первого рН;
(b) элюирования антигенсвязывающей молекулы, которая связалась с колонкой при первом рН, с колонки при параметре второго pH;
(c) сбора подвергшейся элюции антигенсвязывающей молекулы;
(d) получения гена, кодирующего антигенсвязывающую молекулу, полученную на стадии (c); и
(e) продуцирования антигенсвязывающей молекулы, используя полученный на стадии (d) ген;
[46] способ продуцирования антигенсвязывающей молекулы, активность связывания которой при первом рН превышает активность связывания при втором рН, который включает стадии:
(a) связывания библиотеки антигенсвязывающих молекул с колонкой с иммобилизованным антигеном при параметре первого рН;
(b) элюирования антигенсвязывающей молекулы с колонки при параметре второго pH;
(c) амплификации гена, кодирующего элюируемую антигенсвязывающую молекулу;
(d) сбора подвергшейся элюции антигенсвязывающей молекулы;
(e) получения гена, кодирующего антигенсвязывающую молекулу, собранную на стадии (d); и
(f) продуцирования антигенсвязывающей молекулы, используя полученный на стадии (е) ген;
[47] способ продуцирования в соответствии с [45] или [46], в котором первый pH составляет от 6,7 до 10,0, а второй pH составляет от 4,0 до 6,5;
[48] способ продуцирования в соответствии с любым из [43]-[47], который, кроме того, включает стадию замещения по крайней мере одной аминокислоты антигенсвязывающей молекулы гистидином или вставки по крайней мере одного гистидина в антигенсвязывающую молекулу;
[49] способ продуцирования в соответствии с любым из [43]-[48], в котором антигенсвязывающей молекулой является антитело;
[50] фармацевтическая композиция, включающая антигенсвязывающую молекулу, полученную способом продуцирования в соответствии с любым из [43]-[49].
Эффекты настоящего изобретения
Настоящим изобретением обеспечиваются способы изготовления связывающих один антиген молекул для многократного связывания с множеством молекул антигена. Когда антигенсвязывающая молекула связывается с множеством молекул антигена, фармакокинетику антигенсвязывающей молекулы можно улучшить, и такая молекула может вызывать in vivo эффекты, превосходящие эффекты, вызываемые обычными антигенсвязывающими молекулами.
Краткое описание чертежей
Фиг. 1 представляет собой схему, на которой представлен путь деградации антител, связавшихся со связанным с мембраной антигеном.
Фиг. 2 представляет собой схему, на которой представлен механизм возвращения молекул IgG с помощью FcRn.
Фиг. 3 представляет собой схему, представляющую повторное связывание молекул IgG с новым антигеном после диссоциации от связанного с мембраной антигена внутри эндосом.
Фиг. 4 представляет собой схему, представляющую повторное связывание молекул IgG с новым антигеном после диссоциации от растворимого антигена внутри эндосом.
Фиг. 5 представляет собой схему, на которой представлен процесс пэннинга, в котором используется колонка с иммобилизованным антигеном.
Фиг. 6 представляет собой графики, на которых представлены результаты ELISA фагов для клонов, полученных с помощью пэннинга, в котором используется колонка. Верхний график отображает WT, а нижний график отображает CL5.
Фиг. 7 представляет собой график, на котором отображена биологическая нейтрализующая активность связывающихся в зависимости от рН антител против рецептора IL-6.
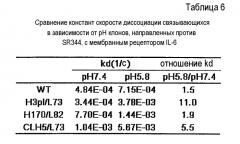
Фиг. 8 представляет собой графики, на которых представлены результаты Biacore - сенсограммы для связывания связывающихся в зависимости от рН антител против рецептора IL-6 с растворимым рецептором IL-6 при рН 7,4. Верхний график отображает WT; второй график сверху отображает H3pI/L73; третий график сверху отображает H170/L82, и нижний график отображает CLH5/L73.
Фиг. 9 представляет собой графики, на которых представлены результаты Biacore - сенсограммы для связывания связывающихся в зависимости от рН антител против рецептора IL-6 с растворимым рецептором IL-6 при рН 5,8. Верхний график отображает WT; второй график сверху отображает H3pI/L73; третий график сверху отображает H170/L82, и нижний график отображает CLH5/L73.
Фиг. 10 представляет собой графики, на которых представлены результаты Biacore - сенсограммы для ассоциации (при рН 7,4) и диссоциации (при рН 5,8) связывающихся в зависимости от рН антител против рецептора IL-6 с рецептором IL-6 мембранного типа и от него, соответственно. Верхний график отображает WT; второй график сверху отображает H3pI/L73; третий график сверху отображает H170/L82, и нижний график отображает CLH5/L73.
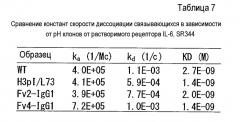
Фиг. 11 представляет собой полученную с помощью Biacore сенсограмму, свидетельствующую о многократном связывании связывающихся в зависимости от рН антител против рецептора IL-6 с SR344.
Фиг. 12 представляет собой график, на котором представлено общее количество связанного антигена в эксперименте повторного связывания связывающихся в зависимости от рН антител против рецептора IL-6 с SR344.
Фиг. 13 представляет собой график, на котором представлены зависимости от времени концентраций в плазме связывающихся в зависимости от рН антител против рецептора IL-6 у трансгенных по рецептору IL-6 человека мышей.
Фиг. 14 представляет собой график, на котором представлены зависимости от времени концентраций в плазме связывающихся в зависимости от рН антител против рецептора IL-6 у яванских макак.
Фиг. 15 представляет собой график, на котором представлены зависимости от времени концентраций CRP у яванских макак, относительно связывающихся в зависимости от рН антител против рецептора IL-6.
Фиг. 16 представляет собой график, на котором представлены зависимости от времени концентраций рецептора IL-6 яванского макака несвязанного типа у яванских макак, относительно связывающихся в зависимости от рН антител против рецептора IL-6.
Фиг. 17 представляет собой графики, на которых представлены результаты Biacore - сенсограммы для ассоциации (при рН 7,4) и диссоциации (при рН 5,8) связывающихся в зависимости от рН антител против рецептора IL-6 с рецептором IL-6 мембранного типа и от него, соответственно. В порядке перемещения сверху вниз представлены результаты для WT, H3pI/L73-IgG1, Fv2-IgG1 и Fv4-IgG1.
Фиг. 18 представляет собой график, на котором представлены зависимости от времени концентраций в плазме связывающихся в зависимости от рН антител против рецептора IL-6 (WT, H3pI/L73-IgG1, Fv2-IgG1 и Fv4-IgG1) у трансгенных по рецептору IL-6 человека мышей.
Фиг. 19 представляет собой графики, на которых представлены результаты Biacore - сенсограммы для ассоциации (при рН 7,4) и диссоциации (при рН 5,8) связывающихся в зависимости от рН антител против рецептора IL-6 с рецептором IL-6 мембранного типа и от него, соответственно. В порядке перемещения сверху вниз представлены результаты для WT, Fv4-IgG1, Fv4-IgG2 и Fv4-M58.
Фиг. 20 представляет собой график, на котором представлены зависимости от времени концентраций в плазме связывающихся в зависимости от рН антител против рецептора IL-6 (WT, Fv4-IgG1, Fv4-IgG2 и Fv4-M58) у трансгенных по рецептору IL-6 человека мышей.
Фиг. 21 представляет собой графики, на которых представлены результаты Biacore - сенсограммы для ассоциации (при рН 7,4) и диссоциации (при рН 5,8) связывающихся в зависимости от рН антител против рецептора IL-6 с рецептором IL-6 мембранного типа и от него, соответственно. Перемещаясь сверху вниз, представлены результаты для Fv1-M71, Fv1-M73, Fv3-M71 и Fv3-M73.
Фиг. 22 представляет собой график, на котором представлены зависимости от времени концентраций в плазме связывающихся в зависимости от рН антител против рецептора IL-6 у яванских макак, во время введения H3pI/L73-IgG1, Fv1-M71, Fv1-M73, Fv2-IgG1, Fv3-M73 и Fv4-M73 в дозе 0,5 мг/кг и во время введения Ат с большой аффинностью в дозе 1,0 мг/кг.
Фиг. 23 представляет собой график, на котором представлены зависимости от времени концентраций CRP у яванских макак, относительно связывающихся в зависимости от рН антител против рецептора IL-6 (групп, которым вводили H3pI/L73-IgG1, Fv1-M71, Fv1-M73, Fv2-IgG1, Fv3-M73, Fv4-M73 и Ат с большой аффинностью).
Фиг. 24 представляет собой график, на котором представлены зависимости от времени концентраций рецептора IL-6 яванского макака несвязанного типа у яванских макак, относительно связывающихся в зависимости от рН антител против рецептора IL-6 (групп, которым вводили H3pI/L73-IgG1, Fv1-M71, Fv1-M73, Fv2-IgG1, Fv3-M73, Fv4-M73 и Ат с большой аффинностью).
Фиг. 25 представляет собой схематическое представление, отображающее FR1, FR2, FR3 и FR4 вместе с CDR1, CDR2 и CDR3 тяжелых цепей (VH1, VH2, VH3, VH4) и легких цепей (VL1, VL2, VL3). Звездочки указывают на положения, в которых существуют аминокислотные мутации в совмещенных последовательностях.
Фиг. 26 представляет собой полученную с помощью Biacore сенсограмму, отображающую зависящее от рН связывание антитела против IL-6, анти-IL6 клона 2, с IL-6 при pH 7,4 и pH 5,5. Кривые в сенсограмме при pH 7,4 соответствуют 100, 50, 25, 12,5 и 6,25 нг/мл IL-6, сверху.
Фиг. 27 представляет собой полученную с помощью Biacore сенсограмму, отображающую зависящее от рН связывание антитела против рецептора IL-31, анти-IL31R клона 1, с рецептором IL-31 при pH 7,4 и pH 5,5. Кривые в сенсограмме при pH 5,5 соответствуют 100, 50, 25 и 12,5 нг/мл рецептора IL-31, сверху.
На фиг. 28 представлена зависимость от времени концентрации антитела в плазме после внутривенного введения мыши раствора смеси, содержащего SR344 и антитело против рецептора IL-6 человека.
На фиг. 29 представлена зависимость от времени концентрации SR344 в плазме после внутривенного введения мыши раствора смеси, содержащего SR344 и антитело против рецептора IL-6 человека.
Вариант осуществления изобретения
Настоящим изобретением обеспечиваются способы увеличения числа раз связывания с антигенами для антигенсвязывающих молекул. Конкретнее, настоящим изобретением обеспечиваются способы увеличения числа раз связывания с антигенами для антигенсвязывающих молекул путем ослабления способности к связыванию антигенов антигенсвязывающих молекул при кислотном pH по сравнению с указанной способностью при нейтральном рН. Кроме того, настоящим изобретением обеспечиваются способы увеличения числа раз связывания с антигенами для антигенсвязывающих молекул путем замещения гистидином по крайней мере одной аминокислоты в антигенсвязывающих молекулах или вставки по крайней мере одного гистидина в антигенсвязывающие молекулы. Кроме того, настоящим изобретением обеспечиваются способы увеличения числа раз связывания с антигенами для антигенсвязывающих молекул путем замены, делеции, добавления и/или вставки аминокислот в характерную для антитела константную область антигенсвязывающих молекул.
Настоящим изобретением также обеспечиваются способы увеличения числа антигенов, которое может быть связано антигенсвязывающей молекулой. Конкретнее, настоящим изобретением обеспечиваются способы увеличения числа антигенов, которое может быть связано антигенсвязывающей молекулой, путем ослабления способности к связыванию антигенов при кислотном pH по сравнению с указанной способностью при нейтральном рН. Кроме того, настоящим изобретением обеспечиваются способы увеличения числа антигенов, которое может быть связано антигенсвязывающей молекулой, путем замещения гистидином по крайней мере одной аминокислоты в антигенсвязывающих молекулах или вставки по крайней мере одного гистидина в антигенсвязывающие молекулы. Кроме того, настоящим изобретением обеспечиваются способы увеличения числа антигенов, которое может быть связано антигенсвязывающей молекулой, благодаря замене, делеции, добавлению и/или вставке аминокислот в характерную для антитела константную область антигенсвязывающих молекул.
Настоящим изобретением также обеспечиваются способы диссоциации внутри клетки антигена от связавшейся с ним внеклеточно антигенсвязывающей молекулы. Конкретнее, настоящим изобретением обеспечиваются способы диссоциации внутри клетки антигена от связавшейся с ним внеклеточно антигенсвязывающей молекулы путем ослабления способности к связыванию антигена при кислотном pH по сравнению с указанной способностью при нейтральном рН. Кроме того, настоящим изобретением обеспечиваются способы диссоциации внутри клетки антигена от связавшейся с ним внеклеточно антигенсвязывающей молекулы путем замещения гистидином по крайней мере одной аминокислоты в антигенсвязывающих молекулах или вставки по крайней мере одного гистидина в антигенсвязывающую молекулу. Кроме того, настоящим изобретением обеспечиваются способы диссоциации внутри клетки антигена от связавшейся с ним внеклеточно антигенсвязывающей молекулы благодаря замене, делеции, добавлению и/или вставке аминокислот в характерную для антитела константную область антигенсвязывающих молекул.
Настоящим изобретением также обеспечиваются способы высвобождения антигенсвязывающей молекулы, которая была связана с антигеном и подвергнута интернализации в клетку, в свободной от антигена форме наружу из клетки. Конкретнее, настоящим изобретением обеспечиваются способы высвобождения антигенсвязывающей молекулы, которая была связана с антигеном и подвергнута интернализации в клетку, в свободной от антигена форме наружу из клетки путем ослабления способности к связыванию антигенов при кислотном pH по сравнению с указанной способностью при нейтральном рН. Кроме того, настоящим изобретением обеспечиваются способы высвобождения антигенсвязывающей молекулы, которая была связана с антигеном и подвергнута интернализации в клетку, в свободной от антигена форме наружу из клетки путем замещения гистидином по крайней мере одной аминокислоты в антигенсвязывающей молекуле или вставки по крайней мере одного гистидина в антигенсвязывающую молекулу. Кроме того, настоящим изобретением обеспечиваются способы высвобождения антигенсвязывающей молекулы, которая была связана с антигеном и подвергнута интернализации в клетку, в свободной от антигена форме наружу из клетки благодаря замене, делеции, добавлению и/или вставке аминокислот в характерную для антитела константную область антигенсвязывающей молекулы.
Настоящим изобретением также обеспечиваются способы увеличения способности антигенсвязывающей молекулы к элиминации антигенов в плазме. Конкретнее, настоящим изобретением обеспечиваются способы увеличения способности антигенсвязывающей молекулы к элиминации антигенов в плазме путем ослабления способности к связыванию антигенов при кислотном pH по сравнению с указанной способностью при нейтральном рН. Кроме того, настоящим изобретением обеспечиваются способы увеличения способности антигенсвязывающей молекулы к элиминации антигенов в плазме путем замещения гистидином по крайней мере одной аминокислоты в антигенсвязывающих молекулах или вставки по крайней мере одного гистидина в антигенсвязывающие молекулы. Кроме того, настоящим изобретением обеспечиваются способы увеличения способности антигенсвязывающей молекулы к элиминации антигенов в плазме благодаря замене, делеции, добавлению и/или вставке аминокислот в характерную для антитела константную область антигенсвязывающей молекулы.
Настоящим изобретением также обеспечиваются способы улучшения фармакокинетики антигенсвязывающих молекул. Конкретнее, настоящим изобретением обеспечиваются способы улучшения фармакокинетики антигенсвязывающих молекул (удлинению сохранения в плазме) путем ослабления способности к связыванию антигенов при кислотном pH по сравнению с указанной способностью при нейтральном рН. Кроме того, настоящим изобретением обеспечиваются способы улучшения фармакокинетики антигенсвязывающих молекул путем замещения гистидином по крайней мере одной аминокислоты в антигенсвязывающих молекулах или вставки по крайней мере одного гистидина в антигенсвязывающие молекулы. Кроме того, настоящим изобретением обеспечиваются способы улучшения фармакокинетики антигенсвязывающих молекул путем замены, делеции, добавления и/или вставки аминокислот в характерную для антитела константную область антигенсвязывающих молекул.
Кроме того, настоящим изобретением обеспечиваются способы увеличения способности антигенсвязывающих молекул к элиминации антигенов в плазме. Конкретнее, настоящим изобретением обеспечиваются способы увеличения способности антигенсвязывающих молекул к элиминации антигенов в плазме путем ослабления способности к связыванию антигенов при кислотном pH по сравнению с указанной способностью при нейтральном рН. Кроме того, настоящим изобретением обеспечиваются способы увеличения способности антигенсвязывающих молекул к элиминации антигенов в плазме путем замещения гистидином по крайней мере одной аминокислоты в антигенсвязывающих молекулах или вставки по крайней мере одного гистидина в антигенсвязывающие молекулы. Кроме того, настоящим изобретением обеспечиваются способы увеличения способности антигенсвязывающих молекул к элиминации антигенов в плазме путем замены, делеции, добавления и/или вставки аминокислот в характерную для антитела константную о