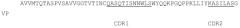Антитела против нейропилина и способы их применения
Иллюстрации
Показать всеИзобретения относятся к области биохимии. Описана группа изобретений, включающая выделенное антитело или его фрагмент, связывающееся с нейропилином 1 (варианты), способ получения антитела или его фрагмента, выделенная нуклеиновая кислота, кодирующая вышеуказанное антитело или его фрагмент, клетка-хозяин для экспрессии вышеуказанного антитела или его фрагмента, иммуноконъюгат, содержащий антитело или его фрагмент, способ обнаружения нейропилина 1. В одном варианте антитело содержит HVR-H1 с аминокислотной последовательностью SEQ ID NO: 3, HVR-H2 с SEQ ID NO: 4, HVR-H3 с SEQ ID NO: 5, HVR-L1 с SEQ ID NO: 8, HVR-L2 с SEQ ID NO: 9, и HVR-L3 с SEQ ID NO: 10. В другом варианте антитело содержит последовательности VH SEQ ID NO: 2 и VL SEQ ID NO: 7. Изобретение расширяет арсенал антител, связывающихся с нейропилином 1 (NRP1). 7 н. и 5 з.п. ф-лы, 2 ил., 1 табл., 2 пр.
Реферат
РОДСТВЕННЫЕ ЗАЯВКИ
По настоящей заявке испрашивается приоритет предварительной заявки на патент США № 61/363121, поданной 9 июля 2010, описание которой в полном объеме включено в настоящий документ в качестве ссылки для любой цели.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к антителам против нейропилина и способам их применения.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Нейропилин 1 (NRP1) является многофункциональным рецептором, который вносит вклад в развитие нервной и сердечнососудистой систем. Сначала NRP1 был описан как рецептор, который связывает лиганд семафорин 3A, действуя вместе с корецепторами плексинами для регулирования аксонального наведения (He and Tessier-Lavigne, Cell (1997) 90: 739-751). Позже было установлено, что NRP1 также связывает члены семейства лигандов факторов роста эндотелия сосудов (VEGF) для посредничества в развитии сосудов (Soker et al., Cell (1998) 92:735-45; Kawasaki et al., Development (1999) 126:4895-902). Кроме того, в результате нескольких исследований было сделано предположение о роли NRP1 в биологии опухолей в результате регулирования функций клеток сосудов и/или опухолевых клеток (Bielenberg et al., Exp Cell Res (2006) 312: 584-93).
Pan и др. (J. Biol Chem (2007) 282:24049-56) установили, что моноклональное антитело, которое связывается с NRP1, уменьшает VEGF-опосредованную миграцию эндотелиальных клеток in vitro (см. также публикацию PCT-заявки № WO2007/056470). Блокирование взаимодействия VEGF с NRP1 in vivo уменьшало ангиогенез и ремоделирование сосудов. Антитело против NRP1 в качестве единственного средства замедляло рост опухоли; предполагают, что это обусловлено опосредуемым антителом против NRP1 уменьшением прорастания сосудов благодаря VEGF-зависимому процессу. Антитело против NRP1 усиливало антиангиогенные и противоопухолевые эффекты блокировки VEGF с помощью антитела против VEGF. Эти данные указывают на то, что в результате уменьшения ремоделирования сосудов с помощью антитела против NRP1 сосуды, вероятно, сохраняют более незрелый фенотип. Поскольку незрелые сосуды, как полагают, являются более VEGF-зависимыми, может повыситься чувствительность кровеносных сосудов в подвергнутых лечению антителом против NRP1 опухолях к терапии с использованием антитела против VEGF, тем самым приводя к эффективности комбинированной терапии в моделях опухолей при объединении обеих терапий (Pan et al., Cancer Cell (2007) 11: 53-67). Принимая во внимание роль NRP1 в ангиогенезе, желательны дополнительные средства для обнаружения NRP1.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к антителам против NRP1 и способам их применения. В одном из вариантов осуществления настоящее изобретение относится к выделенному антителу, которое связывается с нейропилином 1 (NRP1), где антитело содержит (a) HVR-H1, содержащий аминокислотную последовательность SEQ ID NO:3, (b) HVR-H2, содержащий аминокислотную последовательность SEQ ID NO:4, и (c) HVR-H3, содержащий аминокислотную последовательность SEQ ID NO:5. В некоторых вариантах осуществления антитело, кроме того, содержит (a) HVR-L1, содержащий аминокислотную последовательность SEQ ID NO:8; (b) HVR-L2, содержащий аминокислотную последовательность SEQ ID NO:9, и (c) HVR-L3, содержащий аминокислотную последовательность SEQ ID NO:10.
Также изобретение относится к выделенному антителу, которое связывается с нейропилином 1 (NRP1), где антитело содержит (a) HVR-L1, содержащий аминокислотную последовательность SEQ ID NO:8; (b) HVR-L2, содержащий аминокислотную последовательность SEQ ID NO:9; и (c) HVR-L3, содержащий аминокислотную последовательность SEQ ID NO:10.
В другом варианте осуществления настоящее изобретение относится к выделенному антителу, которое связывается с нейропилином 1 (NRP1), где антитело содержит (a) последовательность VH, которая по крайней мере на 95% идентична аминокислотной последовательности SEQ ID NO:2; (b) последовательность VL, которая по крайней мере на 95% идентична аминокислотной последовательности SEQ ID NO:7; или (c) последовательность VH как в (a) и последовательность VL как в (b). В некоторых вариантах осуществления антитело содержит последовательность VH SEQ ID NO:2. В некоторых вариантах осуществления антитело содержит последовательность VL SEQ ID NO:7. Также изобретение относится к выделенному антителу, которое связывается с нейропилином 1 (NRP1), где антитело содержит последовательность VH SEQ ID NO:2 и последовательность VL SEQ ID NO:7.
В некоторых вариантах осуществления антитело по настоящему изобретению представляет собой антитело изотипа IgG1. В некоторых вариантах осуществления антитело является фрагментом антитела, который связывает нейропилин, например, антителом, в котором отсутствует Fc-часть, структурой в виде F(ab')2, Fab или Fv. В другом аспекте настоящее изобретение относится к иммуноконъюгату, содержащему любое антитело по настоящему изобретению.
Настоящее изобретение также относится к выделенной нуклеиновой кислоте, кодирующей любое антитело против NRP1 по настоящему изобретению. В одном из вариантов осуществления изобретение относится к вектору, содержащему нуклеиновую кислоту. В одном из вариантов осуществления изобретение относится к клетке-хозяина, содержащей этот вектор или содержащей эту нуклеиновую кислоту. В одном из вариантов осуществления клетка-хозяин является эукариотической. В одном из вариантов осуществления клеткой-хозяином является клетка CHO. В одном из вариантов осуществления изобретение относится к способу получения антитела против NRP1, предусматривающему культивирование клетки-хозяина в условиях, подходящих для экспрессии нуклеиновой кислоты, кодирующей антитело, так что продуцируется антитело. В некоторых вариантах осуществления способ, кроме того, предусматривает выделение антитела, полученного с помощью этих способов.
В одном из аспектов изобретение относится к способу обнаружения NRP1 в биологическом образце, который предусматривает приведение биологического образца в контакт с антителом по настоящему изобретению в условиях, при которых возможно связывание антитела с NRP1, и обнаружение связанного антитела, например, путем определения образуется ли комплекс между антителом и NRP1. Таким образом, в настоящем описании описано антитело по настоящему изобретению, использующееся для обнаружения NRP1 в биологическом образце. В некоторых вариантах осуществления обнаружение NRP1 проводят иммуногистохимическим исследованием.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг. 1A-D представлены результаты иммуногистохимического исследования, используя моноклональное антитело против NRP1 -7130 (1A: клетки HEK-293, трансфицированные полноразмерным NRP1 человека (положительный контроль); 1B: клетки HEK-293, трансфицированные пустым вектором (отрицательный контроль); 1C: срез ткани почки; 1D: срез ткани плаценты).
На фиг. 2A-C представлены результаты иммуногистохимического исследования, используя моноклональное антитело против NRP1 -7130 (2A: срез ткани пациента с колоректальным раком (CRC); 2B: срез ткани пациента с раком молочной железы (BC); 2C: срез ткани пациента с немелкоклеточным раком легкого (NSCLC)).
ПОДРОБНОЕ ОПИСАНИЕ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
I. ОПРЕДЕЛЕНИЯ
Для целей настоящего изобретения «акцепторная каркасная область человека» представляет собой каркасную область, содержащую аминокислотную последовательность каркасной области вариабельного домена легкой цепи (VL) или каркасной области вариабельного домена тяжелой цепи (VH), полученную из каркасной области иммуноглобулина человека или консенсусной каркасной области человека, определенной ниже. Акцепторная каркасная область человека, «полученная из» каркасной области иммуноглобулина человека или консенсусной каркасной области человека, может содержать ту же самую аминокислотную последовательность, или она может содержать изменения аминокислотной последовательности. В некоторых вариантах осуществления число аминокислотных замен равно 10 или менее, 9 или менее, 8 или менее, 7 или менее, 6 или менее, 5 или менее, 4 или менее, 3 или менее, или 2, или менее. В некоторых вариантах осуществления последовательность акцепторной каркасной области VL человека идентична последовательности каркасной области VL иммуноглобулина человека или консенсусной последовательности каркасной области человека.
«Аффинность» относится к силе общей суммы нековалентных взаимодействий между одним сайтом связывания молекулы (например, антитела) и ее партнером по связыванию (например, антигеном). Кроме особо оговоренных случаев, используемый в настоящем описании термин «аффинность связывания» относится к присущей аффинности связывания, которая отражает взаимодействие в соотношении 1:1 между членами связывающейся пары (например, антителом и антигеном). Аффинность молекулы Х к ее партнеру Y может быть обычно представлена с помощью константы диссоциации (Kd). Аффинность можно измерить с помощью обычных способов, известных в данной области техники, включающих те, которые описаны в настоящем описании. Конкретные иллюстративные и приводимые в качестве примера варианты измерения аффинности связывания описываются ниже.
Антитело с «созревшей аффинностью» относится к антителу с одним или несколькими изменениями в одном или нескольких гипервариабельных участках (HVR) по сравнению с родительским антителом, в котором нет таких изменений, при этом такие изменения приводят к повышению аффинности антитела к антигену.
Термины «антитело против нейропилина 1», «антитело против NRP1» и «антитело, которое связывается с NRP1» относятся к антителу, которое способно к связыванию NRP1 с достаточной аффинностью, так что антитело применимо в качестве диагностического и/или терапевтического средства для воздействия на NRP1. В одном из вариантов осуществления величина связывания антитела против NRP1 с неродственным, не являющимся NRP1 белком составляет менее чем приблизительно 10% от связывания антитела с NRP1, как определено, например, с помощью радиоиммуноанализа (RIA). В некоторых вариантах осуществления антитело, которое связывается с NRP1, характеризуется константой диссоциации (Kd) ≤1 мкМ, ≤100 нМ, ≤10 нМ, ≤1 нМ, ≤0,1 нМ, ≤0,01 нМ или ≤0,001 нМ (например, 10-8 M или менее, например, от 10-8 M до 10-13 M, например, от 10-9 M до 1013 M). В некоторых вариантах осуществления антитело против NRP1 связывается с эпитопом NRP1, который является консервативным среди NRP1 различных видов.
Термин «антитело» используется в настоящем описании в самом широком значении и охватывает различные структуры антител, включающие, но ими не ограничиваются, моноклональные антитела, поликлональные антитела, полиспецифические антитела (например, биспецифические антитела) и фрагменты антител, если они проявляют желаемую антигенсвязывающую активность.
«Фрагмент антител» относится к отличной от интактного антитела молекуле, которая содержит часть интактного антитела, которая связывается с антигеном, с которым связывается интактное антитело. Примеры фрагментов антител включают, но ими не ограничиваются, Fv, Fab, Fab', Fab'-SH, F(ab')2; диатела; линейные антитела; одноцепочечные молекулы антител (например, scFv) и полиспецифические антитела, образованные из фрагментов антител.
«Антитело, которое связывается с тем же эпитопом», что и контрольное антитело, относится к антителу, которое блокирует связывание контрольного антитела со своим антигеном в анализе конкуренции на 50% или более, и наоборот, контрольное антитело блокирует связывание антитела со своим антигеном в анализе конкуренции на 50% или более. В описании представлен приводимый в качестве примера анализ конкуренции.
Термин «химерное» антитело относится к антителу, в котором часть тяжелой и/или легкой цепи происходит из конкретного источника или вида, в то время как оставшаяся часть тяжелой и/или легкой цепи происходит из отличного источника или вида.
«Класс» антитела относится к типу константного домена или константной области, который имеет его тяжелая цепь. Существует пять основных классов антител: IgA, IgD, IgE, IgG и IgM, и некоторые из них можно далее подразделить на подклассы (изотипы), например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2. Константные домены тяжелой цепи, которые соответствуют различным классам иммуноглобулинов, называются α, δ, ε, γ и µ, соответственно.
Используемый в настоящем описании термин «цитотоксическое средство» относится к веществу, ингибирующему или препятствующему функционированию клеток и/или приводящему к гибели или разрушению клеток. Цитотоксические средства включают, но ими не ограничиваются, радиоактивные изотопы (например, At211, I131, I125, Y90, Re186, Re188, Sm153, Bi212, P32, Pb212 и радиоактивные изотопы Lu), химиотерапевтические средства или лекарственные препараты (например, метотрексат, адриамицин, винкаалкалоиды (винкристин, винбластин, этопозид), доксорубицин, мелфалан, митомицин С, хлорамбуцил, даунорубицин или другие интеркалирующие средства), ингибирующие рост средства, ферменты и их фрагменты, такие как нуклеазы, антибиотики, токсины, такие как токсины в виде небольших молекул или ферментативно активные токсины бактериального, грибкового, растительного или животного происхождения, в том числе их фрагменты и/или варианты, и различные противоопухолевые или средства против злокачественных новообразований, раскрытые ниже.
«Эффекторные функции» относятся к таким биологическим активностям, которые можно отнести к Fc-области антитела и меняются в зависимости от изотипа антитела. Примеры эффекторных функций антител включают связывание C1q и комплементзависимую цитотоксичность (CDC); связывание с рецептором Fc; антителозависимую клеточноопосредованную цитотоксичность (ADCC); фагоцитоз; супрессию рецепторов клеточной поверхности (например, рецепторов В-клеток) и активацию В-клеток.
«Эффективное количество» средства, например, фармацевтического препарата, относится к количеству, эффективному, в требуемых дозах и в течение требуемых периодов времени, для достижения желаемого терапевтического или профилактического результата.
Термин «Fc-область» используется в настоящем описании для определения C-концевой области тяжелой цепи иммуноглобулина, которая содержит по крайней мере часть константной области. Термин включает Fc-области с природными последовательностями и варианты Fc-областей. В одном из вариантов осуществления Fc-область тяжелой цепи IgG человека простирается от Cys226, или от Pro230, до карбоксильного конца тяжелой цепи. Однако C-концевой лизин (Lys447) Fc-области может присутствовать или может не присутствовать. Кроме особо оговоренных в настоящем описании случаев, аминокислотные остатки в Fc-области или константной области пронумерованы в соответствии с системой нумерации EU, также называемой индексом EU, как описано в Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD, 1991.
«Каркасная область» или «FR» относится к остаткам вариабельного домена, отличным от остатков гипервариабельного участка (HVR). FR вариабельного домена, как правило, состоит из четырех FR-доменов: FR1, FR2, FR3 и FR4. Соответственно, последовательности HVR и FR, как правило, обнаруживаются в следующем порядке в VH (или VL): FR1-H1(L1)-FR2-H2(L2)-FR3-H3(L3)-FR4.
Термины «полноразмерное антитело», «интактное антитело» и «полное антитело» используются в настоящем описании взаимозаменяемо для обозначения антитела, имеющего структуру, по существу схожую со структурой природного антитела, или имеющего тяжелые цепи, которые содержат Fc-область, определенную в настоящем описании.
Термины «клетка-хозяин», «линия клеток-хозяев» и «культура клеток-хозяев» используются взаимозаменяемо и относятся к клеткам, в которые была введена экзогенная нуклеиновая кислота, в том числе потомству таких клеток. Клетки-хозяева включают «трансформанты» и «трансформированные клетки», которые включают первоначально трансформированную клетку и полученное от нее потомство независимо от числа пассажей. Потомство может не быть полностью идентично по содержанию информации в нуклеиновой кислоте родительской клетке, но может содержать мутации. Сюда включены потомки-мутанты, которые имеют функцию или биологическую активность, одинаковую с таковой, отобранной для первоначальной трансформированной клетки.
«Антитело человека» представляет собой антитело, обладающее аминокислотной последовательностью, которая соответствует аминокислотной последовательности антитела, продуцируемого человеком или клеткой человека, или полученного из не являющегося человеком источника, который использует репертуары антител человека или добавочные кодирующие антитела человека последовательности. Это определение антитела человека, в частности, исключает гуманизированное антитело, содержащее нечеловеческие антигенсвязывающие остатки.
«Консенсусная каркасная область человека» представляет собой каркасную область, в которой представлен наиболее часто встречающийся аминокислотный остаток в выборке последовательностей каркасных областей VL или VH иммуноглобулинов человека. Как правило, выборка последовательностей VL или VH иммуноглобулинов человека происходит из подгруппы последовательностей вариабельных доменов. Как правило, эта подгруппа последовательностей является подгруппой как в Kabat et al., Sequences of Proteins of Immunological Interest, Fifth Edition, NIH Publication 91-3242, Bethesda MD (1991), vols. 1-3. В одном из вариантов осуществления подгруппой для VL является подгруппа каппа I как Kabat и др., выше. В одном из вариантов осуществления подгруппой для VH является подгруппа III как Kabat et al., выше.
«Гуманизированное антитело» относится к химерному антителу, содержащему аминокислотные остатки из нечеловеческих HVR и аминокислотные остатки из FR человека. В некоторых вариантах осуществления гуманизированное антитело будет содержать по существу все из по крайней мере одного и обычно двух вариабельных доменов, в которых все или по существу все HVR (например, CDR) соответствуют HVR нечеловеческого антитела, и все или по существу все FR соответствуют FR антитела человека. Необязательно гуманизированное антитело может содержать по крайней мере часть константной области антитела, происходящей из антитела человека. «Гуманизированная форма» антитела, например нечеловеческого антитела, относится к антителу, которое было подвергнуто гуманизации.
Используемый в настоящем описании термин «гипервариабельный участок» или «HVR» относится к каждому из участков вариабельного домена антитела, которые являются гипервариабельными по последовательности и/или образуют структурно определяемые петли («гипервариабельные петлевые участки»). Как правило, природные четырехцепочечные антитела содержат шесть HVR; три в VH (Н1, Н2, Н3) и три в VL (L1, L2, L3). Как правило, HVR содержат аминокислотные остатки из гипервариабельных петлевых участков и/или из «определяющих комплементарность участков» (CDR), при этом последние характеризуются наибольшей вариабельностью последовательности и/или вовлечены в распознавание антигена. HVR-участок, как в настоящем описании используется, содержит любое число остатков, находящихся в положениях 24-36 (в случае L1), 46-56 (в случае L2), 89-97 (в случае L3), 26-35B (в случае H1), 47-65 (в случае H2) и 93-102 (в случае H3). Следовательно, HVR включает остатки в положениях, описанных ранее:
A) 26-32 (L1), 50-52 (L2), 91-96 (L3), 26-32 (H1), 53-55 (H2) и 96-101 (H3) (Chothia and Lesk, J. Mol. Biol. 196: 901-917 (1987);
B) 24-34 L1, 50-56 L2, 89-97 L3, 31-35B H1, 50-65 H2 и 95-102 H3 (Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD (1991);
C) За исключением CDR1 в VH, CDR, как правило, содержат аминокислотные остатки, которые образуют гипервариабельные петлевые участки. CDR также содержат «определяющие специфичность остатки» или «SDR», которые являются остатками, которые вступают в контакт с антигеном. SDR содержатся внутри районов CDR, называемых укороченными CDR или a-CDR. Примерные a-CDR (a-CDR-L1, a-CDR-L2, a-CDR-L3, a-CDR-H1, a-CDR-H2 и a-CDR-H3) соответствуют аминокислотным остаткам 31-34 L1, 50-55 L2, 89-96 L3, 31-35B H1, 50-58 H2 и 95-102 H3. (См. Almagro and Fransson, Front. Biosci. 13: 1619-1633 (2008).) За исключением особо оговоренных случаев, остатки HVR и другие остатки в вариабельном домене (например, остатки FR) пронумерованы в настоящем описании в соответствии с Kabat и др., выше.
«Иммуноконъюгат» представляет собой антитело, конъюгированное с одной или более гетерологичных молекул, включающих, но ими не ограничиваются, цитотоксическое средство.
«Индивидуумом» является млекопитающее. Млекопитающие включают, но ими не ограничиваются, одомашненных животных (например, коров, овец, кошек, собак и лошадей), приматов (например, людей и не являющихся людьми приматов, таких как обезьяны), кроликов и грызунов (например, мышей и крыс). В некоторых вариантах осуществления индивидуумом является человек.
«Выделенное» антитело представляет собой антитело, которое было отделено от компонента его природного окружения. В некоторых вариантах осуществления антитело очищено до превышающей 95% или 99% степени чистоты, как определено с помощью, например, электрофоретических методов (например, электрофора в SDS-ПААГ, изоэлектрофокусировки (IEF), капиллярного электрофореза) или хроматографических методов (например, ионообменной HPLC или HPLC с обращенной фазой). Для обзора способов оценки чистоты антитела см., например, Flatman et al., J. Chromatogr. B 848: 79-87 (2007).
«Выделенная» нуклеиновая кислота относится к молекуле нуклеиновой кислоты, которая была отделена от компонента ее природного окружения. Выделенная нуклеиновой кислоты включает молекулу нуклеиновой кислоты, содержащуюся в клетках, которые обычно содержат молекулу нуклеиновой кислоты, но молекула нуклеиновой кислоты присутствует экстрахромосомно или в положении в хромосоме, которое отличается от ее естественного положения в хромосоме.
«Выделенная нуклеиновая кислота, кодирующая антитело против NRP1», относится к одной или нескольким молекулам нуклеиновых кислот, кодирующим тяжелую и легкую цепи (или их фрагменты) антитела, включающим такую(ие) молекулу(ы) нуклеиновой(ых) кислоты (кислот) в одном векторе или отдельных векторах, и такую(ие) молекулу(ы) нуклеиновой(ых) кислоты (кислот), которая(ые) присутствует в одном или более положений в клетке-хозяине.
Используемый в настоящем описании термин «моноклональное антитело» относится к антителу, полученному из популяции по существу гомогенных антител, т.е. отдельные антитела, входящие в состав популяции, являются идентичными и/или связываются с одним и тем эпитопом, за исключением возможных вариантов антител, например, содержащих природные мутации или возникающих во время получения препарата моноклональных антител, при этом такие варианты, как правило, присутствуют в незначительных количествах. В отличие от препаратов поликлональных антител, которые обычно включают различные антитела, направленные против различных детерминант (эпитопов), каждое моноклональное антитело препарата моноклональных антител направлено против одной антигенной детерминанты. Таким образом, определение «моноклональное» указывает на то, что свойством антитела является то, что его получают из по существу гомогенной популяции антител, и его не следует рассматривать как требование получения антитела каким-либо конкретным способом. Например, моноклональные антитела, применимые в соответствии с настоящим изобретением, можно получить с помощью методов, включающих, но ими не ограничивающихся, гибридомную технологию, методы создания рекомбинантных ДНК, методы фагового дисплея и методы, в которых используются трансгенные животные, содержащие все локусы иммуноглобулинов человека или их часть, при этом такие методы и другие, приводимые в качестве примера методы получения моноклональных антител описываются в настоящем описании.
«Голое антитело» относится к антителу, которое не конъюгировано с гетерологичной составляющей (например, цитотоксической составляющей) или радиоактивной меткой. “Голое” антитело может присутствовать в фармацевтическом препарате.
«Природные антитела» относятся к природным молекулам иммуноглобулинов с меняющимися структурами. Например, природные антитела класса IgG представляют собой гетеротетрамерные гликопротеины с М.м., составляющей приблизительно 150000 дальтон, состоящие из двух идентичных легких цепей и двух идентичных тяжелых цепей, которые соединены дисульфидной связью. От N-конца к C-концу, каждая тяжелая цепь имеет вариабельную область (VH), также называемую вариабельным доменом тяжелой цепи, за которой следуют три константных домена (CH1, CH2 и CH3). Так же, от N-конца к C-концу, каждая легкая цепь имеет вариабельную область (VL), также называемую вариабельным доменом легкой цепи, за которой следует константный домен легкой цепи (CL). Легкую цепь антитела можно отнести к одному из двух типов, называемых каппа (κ) и лямбда (λ), на основе аминокислотной последовательности ее константного домена.
Термин «листовка-вкладыш», как используется в настоящем описании, относится к инструкциям, обычно включаемым в торговые упаковки терапевтических продуктов, которые содержат информацию о показаниях, применении, дозе, введении, комбинированной терапии, противопоказаниях и/или предостережениях, касающихся использования таких терапевтических продуктов.
«Процент (%) идентичности аминокислотной последовательности» по отношению к контрольной полипептидной последовательности определяется как процент аминокислотных остатков в отобранной для испытания последовательности, которые идентичны аминокислотным остаткам в контрольной полипептидной последовательности после совмещения последовательностей и введения пропусков, если необходимо, для получения максимального процента идентичности последовательности и не принятия во внимание любых консервативных замен в качестве части идентичности последовательности. Совмещения для целей определения процента идентичности аминокислотной последовательности можно достичь различными способами, которыми обладает данная область техники, например, используя общедоступное компьютерное программное обеспечение, такое как программное обеспечение BLAST, BALST-2, ALIGN или Megalign (DNASTAR). Квалифицированные в данной области специалисты могут определить соответствующие параметры для совмещения последовательностей, включающие любые алгоритмы, необходимые для достижения максимального совмещения на протяжении полной длины сравниваемых последовательностей. Для целей настоящего изобретения, однако, значения % идентичности аминокислотной последовательности получают с использованием компьютерной программы для сравнения последовательностей ALIGN-2. Компьютерная программа для сравнения последовательностей ALIGN-2 была создана Genentech, Inc., и исходный текст программы был подан вместе с документацией пользователя в Ведомство по охране авторских прав США, Washington D.C., 20559, где он был зарегистрирован под № регистрации авторского права в США - TXU510087. Программа ALIGN-2 находится в свободном доступе от Genentech, Inc., South San Francisco, California, или ее можно компилировать, исходя из исходного текста программа. Программу ALIGN-2 следует компилировать при использовании на операционной системе UNIX, предпочтительно, цифровой UNIX V4.0D. Все параметры сравнения последовательностей устанавливаются программой ALIGN-2 и не меняются.
В ситуациях, когда для сравнений аминокислотных последовательностей используется ALIGN-2, % идентичности данной аминокислотной последовательности А данной аминокислотной последовательности В (что можно альтернативно перефразировать как данная аминокислотная последовательность А, идентичная аминокислотной последовательности В на некий %) рассчитывают следующим образом:
100 × дроби X/Y,
где Х представляет собой число аминокислотных остатков, оцененных как идентичные сопоставления программой ALIGN-2 для совмещения последовательностей при совмещении этой программой А и В, и где Y представляет собой общее число аминокислотных остатков в В. Понятно, что если длина аминокислотной последовательности А не равна длине аминокислотной последовательности В, % идентичности аминокислотной последовательности А последовательности В не будет равен % идентичности аминокислотной последовательности В последовательности А. Если только специально не указано иное, все значения % идентичности аминокислотной последовательности, используемые в настоящем описании, получают, как описывается в непосредственно предшествующем параграфе, используя компьютерную программу ALIGN-2.
Термин «фармацевтический препарат» относится к препарату, который находится в такой форме, которая позволяет биологической активности активного ингредиента, содержащегося в нем, быть эффективной, и который не содержит дополнительные компоненты, которые являются неприемлемо токсичными для индивида, которому будут вводить препарат.
«Фармацевтически приемлемый носитель» относится к ингредиенту в фармацевтическом препарате, отличному от активного ингредиента, который является нетоксичным для индивида. Фармацевтически приемлемый носитель включает, но ими не ограничивается, буфер, наполнитель, стабилизатор или консервант.
Используемый в настоящем описании термин «нейропилин-1» или «NRP1» относится к любому природному NRP1 из любого являющегося позвоночным животным источника, включающего млекопитающих, таких как приматы (например, люди) и грызуны (например, мыши и крысы), кроме особо оговоренных случаев. Термин охватывает «полноразмерный», не подвергнутый процессированию NRP1, а также любую форму NRP1, которая является результатом процессирования в клетке. Этот термин также охватывает природные варианты NRP1, например варианты сплайсинга или аллельные варианты. Основная структура нейропилинов содержит пять доменов: три экстраклеточных домена (ala2, blb2 и c), трансмембранный домен и цитоплазматический домен. Домен ala2, который обычно содержит четыре остатка цистеина, которые образуют два дисульфидных мостика, гомологичен компонентам комплемента Clr и Cls (CUB). Домен blb2 гомологичен факторам V и VIII свертывания крови. Центральная часть домена c называется MAM вследствие ее гомологии с меприном, A5 и белками тирозинфосфатазами µ рецепторного типа. Домены ala2 и blb2 ответственны для связывания лиганда, тогда как домен c важен для гомодимеризации или гетеродимеризации (Gu et al. (2002) J. Biol. Chem. 277: 18069-76; He and Tessier-Lavigne (1997) Cell 90: 739-51).
Термин «вариабельная область» или «вариабельный домен» относится к домену тяжелой или легкой цепи антитела, который вовлечен в связывание антитела с антигеном. Вариабельные домены тяжелой цепи и легкой цепи (VH и VL, соответственно) природного антитела, как правило, имеют схожие структуры, при этом каждый домен содержит четыре консервативные каркасные области (FR) и три гипервариабельных участка (HVR). (См., например, Kindt et al. Kuby Immunology, 6th ed., W.H. Freeman and Co., page 91 (2007).) Один VH- или VL-домен может быть достаточен для придания специфичности связывания с антигеном. Кроме того, антитела, которые связываются с конкретным антигеном, можно выделить, используя VH- или VL-домен антитела, которое связывает этот антиген, для скрининга библиотеки комплементарных VL- или VH-доменов, соответственно. См., например, Portolano et al., J. Immunol. 150: 880-887 (1993); Clarkson et al., Nature 352: 624-628 (1991).
Используемый в настоящем описании термин «вектор» относится к молекуле нуклеиновой кислоты, способной переносить другую нуклеиновую кислоту, с которой она связана. Термин включает вектор в виде самореплицирующейся структуры нуклеиновой кислоты, а также вектор, включаемый в геном клетки-хозяина, в которую он введен. Некоторые векторы способны к управлению экспрессией нуклеиновых кислот, с которыми они функционально связаны. Такие векторы называют в настоящем описании «векторами экспрессии».
II. КОМПОЗИЦИИ И СПОСОБЫ
Настоящее изобретение относится к новым антителам, которые связываются с NRP1. Антитела по настоящему изобретению применимы, например, для обнаружения NRP1, например, в биологических образцах.
А. Приводимые в качестве примера антитела против NRP1
Настоящее изобретение относится к антителам против NRP1, подходящим, например, для диагностических применений. В одном из вариантов осуществления настоящее изобретение относится к антителу против NRP1 со следующими последовательностями тяжелой и легкой цепей:
Тяжелая цепь:
Аминокислотная последовательность вариабельной области тяжелой цепи является следующей:
QLVEESGGGLVTPGGTLTLTCTASGFTISNYHMSWVRQAPGKGLEWIGIIYAVSAATWSA TWVKGRFTISKTLTTVDLKMTSLTAADTATYFCARVRAPGDSTYYDLWGPGTLVTVSS (SEQ ID NO:2).
Аминокислотные последовательности CDR Kabat тяжелой цепи являются следующими: CDR1: NYHMS (SEQ ID NO:3); CDR2: IIYAVSAATWSTWVKG (SEQ ID NO:4); CDR3: VRAPGDSTYYDL (SEQ ID NO:5).
Легкая цепь:
Аминокислотная последовательность вариабельной области легкой цепи является следующей: AVVMTQTASPVSAVVGGTVTINCQASQTISNNWLSWYQQKPGQPPKLLIYKASILASGVP SRFSGSGSGTEFTLTISGVQCDDAATYYCLYGHYITTSAHNAFGGGTEVVVKGD (SEQ ID NO: 7).
Аминокислотные последовательности CDR Kabat легкой цепи являются следующими: CDR1: QASQTISNNWLS (SEQ ID NO:8); CDR2: KASILAS (SEQ ID NO:9); CDR3: LYGHYITTSAHNA (SEQ ID NO:10).
В одном из аспектов настоящее изобретение относится к антителу против NRP1, содержащему по крайней мере один, два, три, четыре, пять или шесть HVR, выбираемых из (a) HVR-H1, содержащего аминокислотную последовательность SEQ ID NO:3; (b) HVR-H2, содержащего аминокислотную последовательность SEQ ID NO:4; (c) HVR-H3, содержащего аминокислотную последовательность SEQ ID NO:5; (d) HVR-L1, содержащего аминокислотную последовательность SEQ ID NO:8; (e) HVR-L2, содержащего аминокислотную последовательность SEQ ID NO:9; и (f) HVR-L3, содержащего аминокислотную последовательность SEQ ID NO:10.
В одном из аспектов настоящее изобретение относится к антителу, содержащему по крайней мере одну, по крайней мере две или все три последовательности HVR VH, выбираемые из (a) HVR-H1, содержащего аминокислотную последовательность SEQ ID NO:3; (b) HVR-H2, содержащего аминокислотную последовательность SEQ ID NO:4; и (c) HVR-H3, содержащего аминокислотную последовательность SEQ ID NO:5. В одном из вариантов осуществления антитело содержит HVR-H3, содержащий аминокислотную последовательность SEQ ID NO:5. В другом варианте осуществления антитело содержит HVR-H3, содержащий аминокислотную последовательность SEQ ID NO:3, и HVR-L3, содержащий аминокислотную последовательность SEQ ID NO:10. В дальнейшем варианте осуществления антитело содержит (a) HVR-H1, содержащий аминокислотную последовательность SEQ ID NO:3; (b) HVR-H2, содержащий аминокислотную последовательность SEQ ID NO:4; и (c) HVR-H3, содержащий аминокислотную последовательность SEQ ID NO:5.
В другом аспекте настоящее изобретение относится к антителу, содержащему по крайней мере одну, по крайней мере две или все три последовательности HVR VL, выбираемые из (a) HVR-L1, содержащего аминокислотную последовательность SEQ ID NO:8; (b) HVR-L2, содержащего аминокислотную последовательность SEQ ID NO:9; и (c) HVR-L3, содержащего аминокислотную последовательность SEQ ID NO:10. В одном из вариантов осуществления антитело содержит (a) HVR-L1, содержащий аминокислотную последовательность SEQ ID NO:8; (b) HVR-L2, содержащий аминокислотную последовательность SEQ ID NO:9; и (c) HVR-L3, содержащий аминокислотную последовательность SEQ ID NO:10.
В другом аспекте антитело по настоящему изобретению содержит (a) VH-домен, содержащий по крайней мере одну, по крайней мере две или все три последовательности HVR VH, выбираемые из (i) HVR-H1, содержащего аминокислотную последовательность SEQ ID NO:3; (ii) HVR-H2, содержащего аминокислотную последовательность SEQ ID NO:4; и (iii) HVR-H3, содержащего аминокислотную последовательность SEQ ID NO:5; и (b) VL-домен, содержащий по крайней мере одну, по крайней мере две или все три последовательности HVR VL, выбираемые из (i) HVR-L1, содержащего аминокислотную последовательность SEQ ID NO:8; (ii) HVR-L2, содержащего аминокислотную последовательность SEQ ID NO:9; и (iii) HVR-L3, содержащего аминокислотную последовательность SEQ ID NO:10.
В другом аспекте настоящее изобретение относится к антителу, содержащему (a) HVR-H1, содержащий аминокислотную последовательность SEQ ID NO:3; (b) HVR-H2, содержащий аминокислотную последовательность SEQ ID NO:4; (c) HVR-H3, содержащий аминокислотную последовательность SEQ ID NO:5; (d) HVR-L1, содержащий аминокислотную последовательность SEQ ID NO:8; (e) HVR-L2, содержащий аминокислотную последовательность SEQ ID NO:9; и (f) HVR-L3, содержащий аминокислотную последовательность, выбираемую из SEQ ID NO:10.
В другом аспекте антитело против NRP1 содержит последовательность вариабельного домена тяжелой цепи (VH), которая по крайней мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательност