Способы выявления препаратов и аутоантител против tnf
Иллюстрации
Показать всеГруппа изобретений относится к способам детектирования и измерения наличия или уровня лекарственных препаратов против TNFα и аутоантител в образцах и включает сравнение количества меченого комплекса и количества свободного меченого TNFα или лекарственного средства против TNFα со стандартной кривой. Группа изобретений применяется для оптимизации лечения и мониторинга пациентов, получающих лекарственные препараты против TNFα, для выявления наличия или уровня аутоантител (например, НАСА и/или НАНА) против препарата. 2 н. и 18 з.п. ф-лы, 25 ил., 5 табл., 12 пр.
Реферат
Настоящая заявка претендует на приоритет от Предварительной заявки на патент США No. 61/255,048, поданной 26 октября 2009 г., Предварительной заявки на патент США No. 61/262,877, поданной 19 ноября 2009 г., Предварительной заявки на патент США No. 61/324,635, поданной 15 апреля 2010 г., Предварительной заявки на патент США No. 61/345,567, поданной 17 мая 2010 г.. редварительной заявки на патент США No. 61/351,269, поданной 3 июня 2010 г., Предварительной заявки на патент США No. 61/389,672, поданной 4 октября 2010 г., и Предварительной заявки на патент США No. 61/393,581, поданной 15 октября 2010 г., содержание которых включено путем ссылки во всей полноте на все случаи.
Уровень техники
Аутоиммунные заболевания представляют значительную и широко распространенную медицинскую проблему. Например, аутоиммунным заболеванием является ревматоидный артрит (RA), затрагивающий более двух миллионов людей в США. RA вызывает хроническое воспаление суставов и обычно является прогрессирующим заболеванием, которое может вызвать разрушение суставов и функциональную нетрудоспособность. Причина ревматоидного артрита неизвестна, хотя генетическая предрасположенность, инфекционные агенты и факторы окружающей среды - все были вовлечены в этиологию заболевания. При активном RA симптомы могут включать усталость, отсутствие аппетита, небольшую лихорадку, боль в мышцах и суставах и тугоподвижность. Также во время вспышек болезни суставы часто краснеют, набухают, становятся болезненными вследствие воспаления синовиальной оболочки. Более того, поскольку RA является системным заболеванием, воспаление может задевать не только суставы, но и другие органы и участки тела, включая железы глаз и рта, выстилку легких, перикард и кровеносные сосуды.
Традиционные способы лечения RA и других воспалительных заболеваний включают быстродействующие препараты первого ряда и действующие медленнее препараты второго ряда. Препараты первого ряда уменьшают боль и воспаление. Примерами таких препаратов первого ряда являются аспирин, напроксен, ибупрофен, этодолак и другие нестероидные противовоспалительные средства (NSAIDs), а также кортикостероиды, принимаемые внутрь или в виде инъекций непосредственно в ткани и суставы. Препараты второго ряда способствуют ослаблению болезни и предотвращают прогрессирующее разрушение суставов, их также называют модифицирующими противоревматическими препаратами или DMARDs. Примерами препаратов второго ряда являются золото, гидрохлорохин, азулфидин и такие иммуносупрессорные средства, как метотрексат, азатиоприн, циклофосфамид, хлорамбуцил и циклоспорин. Однако многие из этих препаратов могут иметь вредные побочные эффекты. Поэтому ведутся поиски других способов лечения ревматоидного артрита и других аутоиммунных заболеваний.
Фактор некроза опухолей альфа (TNF-α) - это цитокин, вырабатываемый различными типами клеток, включая моноциты и макрофаги, который изначально был идентифицирован по его способности индуцировать некроз определенных опухолей у мышей. Впоследствии было показано, что фактор, именуемый кахектином и связанный с кахексией (истощением), идентичен TNF-α. TNF-α вовлекается в патофизиологию целого ряда других заболеваний человека, включая шок, сепсис, инфекции, аутоиммунные заболевания, RA, болезнь Крона, отторжение трансплантатов и реакцию "трансплантат против хозяина".
Вследствие пагубной роли TNF-α человека (hTNF-α) в ряде заболеваний человека разрабатывались стратегии лечения, призванные ингибировать или противодействовать активности hTNF-α. В частности, велись поиски антител, связывающих и нейтрализи-рующих hTNF-α в качестве средства ингибирования активности hTNF-α. Первыми из таких антител были моноклональные антитела (mAbs) мыши, секретируемые гибридомами, полученными из лимфоцитов мышей, иммунизированных hTNF-α (например, см. U.S. Pat. No. 5,231,024 to Moeller et al.). Хотя эти мышиные антитела против hTNF-α часто проявляли высокое сродство к hTNF-α и были способны нейтрализовать активность hTNF-α, их применение in vivo было ограничено из-за проблем, связанных с введением мышиных антител людям, таких как короткое время полужизни в сыворотке, неспособность запускать некоторые эффекторные функции человека и индуцирование нежелательной иммунной реакции против мышиных антител у человека (реакция "человека против антител мыши" (НАМА)).
Совсем недавно стали применять биологические подходы к лечению таких аутоиммунных заболеваний, как ревматоидный артрит.Например, для лечения ревматоидного артрита были одобрены FDA четыре ингибитора TNFα: REMICADE™ (инфликсимаб) - химерное mAb против TNFα, ENBREL™ (этанерцепт) - слитый белок TNFR-Fc Ig, HUMIRA™ (адалимумаб) - человеческое mAb против TNFα и CIMZIA® (цертолизумаб-пегол) - ПЭГилированный Fab-фрагмент.CIMZIA® также применяется для лечения болезни Крона (CD) в умеренной и тяжелой форме. Хотя такие биологические способы лечения оказались успешными при лечении ревматоидного артрита и других аутоиммунных заболеваний типа CD, однако не все субъекты, подвергавшиеся лечению, реагировали или хорошо реагировали на такое лечение. Более того, применение ингибиторов TNFα может индуцировать иммунную реакцию на лекарство и приводить к образованию аутоантител, таких как человеческие против химерных антител (НАСА), человеческие против гуманизированных антител (НАНА) и человеческие против антител мыши (НАМА). Такие иммунные реакции типа НАСА, НАЛА или НАМА могут быть связаны с реакциями гиперчувствительности и тяжелыми изменениями фармакокинетики и биораспределения иммунотерапевтического ингибитора TNFα, которые препятствуют дальнейшему лечению этим препаратом. Таким образом, в данной области существует потребность в методах детектирования наличия биопрепаратов против TNFα и/или аутоантител к ним в образцах пациентов для мониторинга терапии ингибиторами TNFα и принятия решений по лечению. Настоящее изобретение удовлетворяет эту потребность, а также обеспечивает и другие преимущества.
Сущность изобретения
TNFα вовлечен в воспалительные заболевания, аутоиммунные заболевания, вирусные, бактериальные и паразитические инфекции, раковые заболевания и/или нейродегенеративные заболевания и является полезной мишенью для специфической биологической терапии при таких заболеваниях, как ревматоидный артрит и болезнь Крона. Ингибиторы TNFα, как-то антитела против TNFα, представляют собой важный класс терапевтических средств. Нужны методы детектирования наличия биопрепаратов против TNFα и/или аутоантител к ним.
Поэтому в одном воплощении настоящим изобретением предусмотрен способ детектирования наличия или уровня препарата против TNFα в образце, который включает:
(a) контактирование меченого TNFα с образцом, содержащим или предположительно содержащим препарат против TNFα, с образованием меченого комплекса (т.е. иммунокомплекса или конъюгата) с препаратом против TNFα (при этом меченый TNFα и препарат против TNFα не связаны ковалентно друг с другом);
(b) подвергание меченого комплекса эксклюзионной хроматографии для отделения меченого комплекса (например, от свободного меченого TNFα); и
(c) детектирование меченого комплекса,
таким образом детектируется наличие или уровень препарата против TNFα. В определенных случаях способы применимы для измерения уровня REMICADE™ (инфликсимаба), ENBREL™ (этанерцепта), HUMIRA™ (адалимумаба) и CIMZIA® (цертолизумаба-пегола) в образце, например, от субъекта, получающего лечение препаратом против TNFα.
В другом воплощении настоящим изобретением предусмотрен способ детектирования наличия или уровня аутоантител к препарату против TNFα в образце, который включает:
(a) контактирование меченого препарата против TNFα с образцом, содержащим или предположительно содержащим аутоантитела к препарату против TNFα, с образованием меченого комплекса (т.е. иммунокомплекса или конъюгата) с аутоантителом (при этом меченый препарат против TNFα и аутоантитело не связаны ковалентно друг с другом);
(b) подвергание меченого комплекса эксклюзионной хроматографии для отделения меченого комплекса (например, от свободного меченого препарата против TNFα); и
(c) детектирование меченого комплекса, таким образом детектируя наличие или уровень аутоантител.
В определенных случаях способы применимы для измерения уровня аутоантител, включая, без ограничения, человеческие против химерных антител (НАСА), человеческие против гуманизированных антител (НАНА) и человеческие против антител мыши (НАМА) в образце, например, от субъекта, получающего лечение препаратом против TNFα.
В следующем воплощении настоящим изобретением предусмотрен способ детектирования наличия или уровня аутоантител к препарату против TNFα в образце, который включает:
(a) контактирование меченого препарата против TNFα и меченого TNFα с образцом, содержащим или предположительно содержащим аутоантитела к препарату против TNFα, с образованием первого меченого комплекса (т.е. иммунокомплекса или конъюгата) между меченым препаратом против TNFα, меченым TNFα и аутоантителом (при этом компоненты первого меченого комплекса не связаны ковалентно друг с другом) и второго меченого комплекса (т.е. иммунокомплекса или конъюгата) между меченым препаратом против TNFα и аутоантителом (при этом компоненты второго меченого комплекса не связаны ковалентно друг с другом), причем меченый препарат против TNFα и меченый TNFα содержат разные метки;
(b) подвергание первого меченого комплекса и второго меченого комплекса эксклюзионной хроматографии для отделения первого меченого комплекса и второго меченого комплекса (например, друг от друга и от свободного меченого TNFα и свободного меченого препарата против TNFα); и
(с) детектирование первого меченого комплекса и второго меченого комплекса, таким образом детектируя наличие или уровень не-нейтрализующей формы аутоантител (при этом аутоантитело не мешает связыванию между препаратом против TNFα и TNFα), если присутствует и первый меченый комплекс, и второй меченый комплекс, и детектируется наличие или уровень нейтрализующей формы аутоантител (при этом аутоантитело мешает связыванию между препаратом против TNFα и TNFα), если присутствует только второй меченый комплекс.
В определенных случаях способы применимы для измерения уровня аутоантител, включая, без ограничения, человеческие против химерных антител (НАСА), человеческие против гуманизированных антител (НАНА) и человеческие против антител мыши (НАМА) в образце, например, от субъекта, получающего лечение препаратом против TNFα.
В родственном воплощении настоящим изобретением предусмотрен способ детектирования наличия или уровня аутоантител к препарату против TNFα в образце, который включает;
(a) контактирование меченого препарата против TNFα с образцом, содержащим или предположительно содержащим аутоантитела к препарату против TNFα, с образованием первого меченого комплекса (т.е. иммунокомплекса или конъюгата) между меченым препаратом против TNFα и аутоантителом (при этом меченый препарат против TNFα и аутоантитело не связаны ковалентно друг с другом);
(b) подвергание первого меченого комплекса первой эксклюзионной хромато-графии для отделения первого меченого комплекса (например, от свободного меченого препарата против TNFα);
(c) детектирование первого меченого комплекса, таким образом детектируется наличие или уровень аутоантител;
(d) контактирование меченого TNFα с первым меченым комплексом с образованием второго меченого комплекса (т.е. иммунокомплекса или конъюгата) между меченым препаратом против TNFα и меченым TNFα (при этом меченый препарат против TNFα и меченый TNFα не связаны ковалентно друг с другом), причем меченый препарат против TNFα и меченый TNFα содержат разные метки;
(e) подвергание второго меченого комплекса второй эксклюзионной хромато-графии для отделения второго меченого комплекса (например, от свободного меченого TNFα); и
(f) детектирование второго меченого комплекса, таким образом детектируя наличие или уровень нейтрализующей формы аутоантител (при этом аутоантитело мешает связыванию между препаратом против TNFα и TNFα).
В определенных случаях способы применимы для измерения уровня аутоантител, включая, без ограничения, человеческие против химерных антител (НАСА), человеческие против гуманизированных антител (НАНА) и человеческие против антител мыши (НАМА) в образце, например, от субъекта, получающего лечение препаратом против
'TNFα.
В следующем воплощении настоящим изобретением предусмотрен способ определения эффективного количества препарата против TNFα у субъекта, получающего лечение препаратом против TNFα, который включает:
(a) измерение уровня препарата против TNFα в первом образце от субъекта, включающее:
(i) контактирование первого образца с некоторым количеством меченого TNFα с образованием первого комплекса, содержащего меченый TNFα и препарат против TNFα; и
(ii) детектирование первого комплекса методом эксклюзионной хроматографии, таким образом измеряя уровень препарата против TNFα;
(b) измерение уровня аутоантител к препарату против TNFα во втором образце от субъекта, включающее:
(i) контактирование второго образца с некоторым количеством меченого препарата против TNFα с образованием второго комплекса, содержащего меченый препарат против TNFα и аутоантитело; и
(ii) детектирование второго комплекса методом эксклюзионной хроматографии, таким образом измеряя уровень аутоантител;
(c) вычитание уровня аутоантител, измеренного на стадии (b), из уровня препарата против TNFα, измеренного на стадии (а), таким образом определяя эффективное количество препарата против TNFα.
В следующем воплощении настоящим изобретением предусмотрен способ оптимизации терапевтического количества препарата против TNFα у субъекта, получающего лечение препаратом против TNFα, который включает:
(a) определение эффективного количества препарата против TNFα в соответствии со способом настоящего изобретения;
(b) сравнение эффективного количества препарата против TNFα с уровнем препарата против TNFα; и
(c) определение последующей дозы препарата против TNFα для субъекта, исходя из сравнения на стадии (b), таким образом оптимизируя терапевтическое количество препарата против TNFα.
В следующем воплощении настоящим изобретением предусмотрен способ оптимизации лечения и/или снижения токсичности препарата против TNFα у субъекта, получающего лечение препаратом против TNFα, который включает:
(a) измерение уровня препарата против TNFα в первом образце от субъекта;
(b) измерение уровня аутоантител к препарату против TNFα во втором образце от субъекта; и
(c) определение последующего курса лечения для субъекта, исходя из уровня препарата против TNFα и уровня аутоантител, таким образом оптимизируется лечение и/или снижается токсичность препарата против TNFα.
В следующем воплощении настоящим изобретением предусмотрен способ определения наличия или уровня препарата против TNFα относительно внутреннего контроля в образце, содержащем или предположительно содержащем препарат против TNFα, который включает:
(a) контактирование некоторого количества меченого TNFα и некоторого количества внутреннего контроля с образцом с образованием комплекса меченого TNFα и препарата против TNFα;
(b) детектирование меченого TNFα и меченого внутреннего контроля методом эксклюзионной хроматографии;
(c) интегрирование площади под кривой для пика меченого TNFα на графике интенсивности сигнала в зависимости от времени элюирования при эксклюзионной хроматографии;
(d) интегрирование площади под кривой для пика меченого внутреннего контроля на графике интенсивности сигнала в зависимости от времени элюирования при эксклюзионной хроматографии;
(e) определение первого соотношения путем деления количества меченого TNFα на количество меченого внутреннего контроля;
(f) определение второго соотношения путем деления результата интегрирования из стадии (с) на результат интегрирования из стадии (d); и
(g) сравнение первого соотношения, определенного на стадии (е), со вторым соотношением, определенным на стадии (f), при этом определяется наличие или уровень препарата против TNFα относительно внутреннего контроля.
В следующем воплощении настоящим изобретением предусмотрен способ оптимизации терапевтического количества препарата против TNFα у субъекта, получающего лечение препаратом против TNFα, который включает: определение последующей дозы препарата против TNFα для субъекта, исходя из сравнения соотношения меченого TNFα к меченому внутреннему контролю на стадии (е) предыдущего параграфа с соотношением меченого TNFα к меченому внутреннему контролю на стадии (f) предыдущего параграфа, таким образом оптимизируется терапевтическое количество препарата против TNFα.
В некоторых воплощениях настоящим изобретением предусмотрен способ определения наличия или уровня аутоантител к препарату против TNFα относительно внутреннего контроля в образце, содержащем или предположительно содержащем аутоантитела, который включает:
(a) контактирование некоторого количества меченого препарата против TNFα и некоторого количества внутреннего контроля с образцом с образованием комплекса меченого препарата против TNFα и аутоантитела;
(b) детектирование меченого препарата против TNFα и меченого внутреннего контроля методом эксклюзионной хроматографии;
(c) интегрирование площади под кривой для пика меченого препарата против TNFα на графике интенсивности сигнала в зависимости от времени элюирования при эксклюзионной хроматографии;
(d) интегрирование площади под кривой для пика меченого внутреннего контроля на графике интенсивности сигнала в зависимости от времени элюирования при эксклюзионной хроматографии;
(e) определение первого соотношения путем деления количества меченого препарата против TNFα на количество меченого внутреннего контроля;
(f) определение второго соотношения путем деления результата интегрирования из стадии (с) на результат интегрирования из стадии (d); и
(g) сравнение первого соотношения, определенного на стадии (е), со вторым соотношением, определенным на стадии (f), таким образом определяя наличие или уровень аутоантител относительно внутреннего контроля.
В следующем воплощении настоящим изобретением предусмотрен набор для измерения наличия или уровня препарата против TNFα и наличия или уровня аутоантител к препарату против TNFα в образце, который включает:
(a) первый измерительный субстрат, содержащий некоторое количество меченого TNFα;
(b) второй измерительный субстрат, содержащий некоторое количество меченого препарата против TNFα;
(c) необязательно третий измерительный субстрат, содержащий некоторое количество меченого TNFα и некоторое количество меченого внутреннего контроля;
(d) необязательно четвертый измерительный субстрат, содержащий некоторое количество меченого препарата против TNFα и некоторое количество меченого внутреннего контроля;
(e) необязательно средство для экстрагирования образца от субъекта; и
(f) необязательно брошюру с инструкциями по применению набора. Другие цели, особенности и преимущества настоящего изобретения станут понятными специалистам из следующего подробного описания и фигур.
Краткое описание фигур
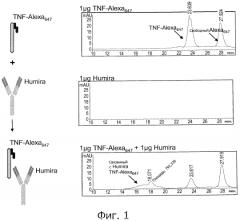
На фиг.1 представлено типичное воплощение способов определения по настоящему изобретению, в котором для детектирования связывания между TNFα-Alexa647 и HUMIRA™ применяется метод эксклюзионной хроматографии HPLC.
На фиг.2 представлены графики "доза-ответ" для связывания HUMIRA™ с TNFα-Alexa647.
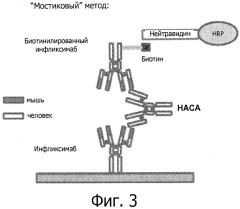
На фиг.3 представлен текущий способ на основе ELISA для измерения уровня НАСА, известный как мостиковый метод (bridging assay).
На фиг.4 представлена типичная схема способов детектирования аутоантител по настоящему изобретению для измерения концентраций НАСА/НАНА, вырабатываемых против REMICADE™.
На фиг.5 представлен анализ типа "доза-ответ" для связывания антитела против IgG человека с REMICADE™-Alexa647.
На фиг.6 представлен второй анализ типа "доза-ответ" для связывания антитела против IgG человека с REMICADE™-Alexa647.
На фиг.7 представлены графики "доза-ответ" для связывания антитела против IgG человека с REMICADE™-Alexa647.
На фиг.8 представлено образование иммунокомплекса REMICADE™-Alexa647 в нормальной сыворотке человека и НАСА-положительной сыворотке.
На фиг.9 представлена сводка по измерению НАСА в образцах сыворотки от 20 пациентов, которые проводились мостиковым методом или же анализом изменения подвижности по настоящему изобретению.
На фиг.10 представлена сводка и сравнение текущих способов измерения концентрации НАСА в сыворотке с новым способом определения НАСА по настоящему изобретению.
На фиг.11 представлены профили SE-HPLC меченого флуорофором (Fl) IFX при инкубации с нормальной (NHS) или НАСА-положительной (HPS) сывороткой. Добавление в инкубационную смесь возрастающих количеств НАСА-положительной сыворотки вызывало дозозависимое смещение пика IFX-F1 в область элюатов с более высокой молекулярной массой С1 и С2.
На фиг.12 представлены графики "доза-ответ" для связанного и свободного IFX-F1, составленные в присутствии возрастающих разведении НАСА-положительной сыворотки определенный анализом изменения подвижности. (А) Возрастающие разведения НАСА-положительной сыворотки инкубировали с 37,5 нг IFX-F1. Чем большее разведение (меньше НАСА), тем больше свободного IFX-F1 обнаруживается при анализе методом SE-HPLC. (В) Возрастающие разведения НАСА-положительной сыворотки инкубировали с 37,5 нг IFX-F1. Чем большее разведение (меньше НАСА), тем меньше связанного с НАСА IFX-F1 обнаруживается при анализе методом SE-HPLC.
На фиг.13 представлены профили SE-HPLC TNFα-F1 при инкубации с нормальной (NHS) сывороткой или сывороткой с добавлением IFX. Добавление в инкубационную смесь возрастающих количеств сыворотки с добавлением IFX вызывало дозозависимое смещение пика флуоресцентного TNFα в область элюатов с более высокой молекулярной массой.
На фиг.14 представлены графики "доза-ответ" для связанного и свободного TNFα, составленные в присутствии возрастающих разведении сыворотки с добавлением IFX определенный анализом изменения подвижности. Повышение концентрации IFX, добавленного в инкубационную смесь, вызывает снижение содержания свободного TNFα и повышение содержания связанного TNFα.
На фиг.15 представлено измерение относительного уровня НАСА и концентрации IFX в анализе изменения подвижности у больных IBD, получавших IFX в различные моменты времени.
На фиг.16 представлено лечение пациентов - измерение уровня НАСА и концентрации IFX в сыворотке больных IBD, получавших IFX в различные моменты времени.
На фиг.17 представлены типичные воплощения методов определения по настоящему изобретению для детектирования присутствия (А) не-нейтрализующих или (В) нейтрализующих аутоантител типа НАСА.
На фиг.18 представлено альтернативное воплощение методов определения по настоящему изобретению для детектирования присутствия нейтрализующих аутоантител типа НАСА.
На фиг.19 представлены профили изменения подвижности F1-меченого ADL при инкубации с нормальной сывороткой человека (NHS) в присутствии различного количества антител против IgG человека. Добавление в инкубационную смесь возрастающих количеств антител против IgG человека вызывало дозозависимое смещение пика F1-ADL (FA) в область элюатов с более высокой молекулярной массой С1 и С2, тогда как пик внутреннего контроля (1C) не изменялся.
На фиг.20 представлен график влияния антител против IgG человека на изменение подвижности (сдвиг) свободного F1-ADL. Возрастающие количества антител против IgG человека инкубировали с 37,5 нг F1-ADL и внутренним контролем. Чем больше антител добавляли в реакционную смесь, тем больше снижалось соотношение между свободным F1-ADL и внутренним контролем.
На фиг.21 представлены профили изменения подвижности F1-меченого TNF-α при инкубации с нормальной сывороткой человека (NHS) в присутствии различного количества ADL. Ех=494 нм, Ет=519 нм. Добавление в инкубационную смесь возрастающих количеств ADL вызывало дозозависимое смещение пика свободного TNF-F1 (FT) в область элюатовх с более высокой молекулярной массой, тогда как пик внутреннего контроля (1C) не изменялся.
На фиг.22 представлен график влияния ADL на изменение подвижности свободного TNF-α-F1. Возрастающие количества ADL инкубировали со 100 нг TNF-α-F1 и внутренним контролем. Чем больше ADL добавляли в реакционную смесь, тем больше снижалось соотношение между свободным TNF-α-F1 и внутренним контролем.
На фиг.23 представлены профили изменения подвижности F1-меченого REMICADE (IFX) при инкубации с нормальной сывороткой (NHS) или объединенной сывороткой НАСА-положительных пациентов.
На фиг.24 представлены профили изменения подвижности F1-меченого HLJMIRA (ADL) при инкубации с нормальной сывороткой (NHS) или антителом мыши против IgGI человека.
На фиг.25 представлены профили изменения подвижности F1-меченого HUMIRA (ADL) при инкубации с нормальной сывороткой (NHS) или объединенной сывороткой НАНА-положительных пациентов.
Раскрытие сущности изобретения
I. Введение
Настоящее изобретение частично основывается на открытии того, что гомогенный анализ изменения (сдвига) подвижности методом эксклюзионной хроматографии особенно предпочтителен для измерения присутствия или уровня ингибиторов TNFα, а также аутоантител (например, НАСА, НАНА и др.), вырабатываемых против них. В частности, настоящим изобретением предусмотрены способы определения типа "смешать и измерить", которые не требуют никаких стадий отмывания. При этом образовавшие комплекс и некомплексированные белковые препараты легко отделяются друг от друга. Кроме того, при использовании способов настоящего изобретения сводятся к минимуму любые возможные помехи со стороны свободного препарата. Напротив, типичный метод ELISA для измерения уровня НАСА или НАНА не может выполняться, пока ингибитор TNFα не будет удален из организма, что может занять до 3 месяцев. Более того, настоящее изобретение в общем приложимо к широкому спектру белковых препаратов наряду с антителами против TNFα. Способы настоящего изобретения также дают преимущество в том, что они не требуют прикрепления антигенов к твердой поверхности, устраняют неспецифическое связывание посторонних IgG, детектируют антитела со слабым сродством и проявляют повышенную чувствительность и специфичность перед доступными в настоящее время методами детектирования типа ферментного иммуноанализа.
Важность измерения концентрации биопрепаратов против TNFα в сыворотке, равно как и других иммунотерапевтических препаратов иллюстрируется тем, что FDA требует проводить фармакокинетические исследования и исследования на толерантность (например, иммунный ответ) во время клинических испытаний. Настоящее изобретение также находит применение при мониторинге пациентов, принимающих эти лекарства, чтобы удостовериться, что они получают правильную дозу, что препарат не выводится из организма слишком быстро и что они не развивается иммунный ответ против препарата. Более того, настоящее изобретение применимо для назначения перехода на другие лекарства вследствие несостоятельности первоначального препарата.
II. Определения
В настоящем изобретении следующие термины имеют приданные им значения, если не указано иначе.
Термины "препарат против TNF-α" или "ингибитор TNF-α" в настоящем изобретении охватывают вещества, включая белки, антитела, фрагменты антител, слитые белки (например, слитые белки Ig или слитые белки Fc), мультивалентные связывающие белки (например, DVD-Ig), небольшие молекулы-антагонисты TNF-α и подобные им природные или искусственные молекулы и/или их рекомбинантные и/или сконструированные формы, которые, прямо или косвенно, ингибируют активность TNF-α, как-то ингибируют взаимодействие TNF-α с рецептором TNF-α на клеточной поверхности, ингибируют вырабатывание белка TNF-α, ингибируют экспрессию гена TNF-α, ингибируют секрецию TNF-α из клеток, ингибируют сигналирование через рецептор TNF-α или любые другим образом приводят к снижению активности TNF-α у субъекта. Термин "препарат против TNF-α" или "ингибитор TNF-α" предпочтительно включает вещества, которые ухудшают активность TNF-α. Примеры ингибиторов TNF-α включают этанерцепт (ENBREL™, Amgen), инфликсимаб (REMICADE™, Johnson and Johnson), моноклональное антитело человека против TNF адалимумаб (D2E7/HUMIRA™, Abbott Laboratories), цертолизумаб-пегол (CIMZIA®, UCB, Inc.), CDP 571 (Celltech) и CDP 870 (Celltech), а также другие соединения, ингибирующие активность TNF-α таким образом, что при введении субъекту, страдающему или подвергающемуся риску возникновения заболевания, при котором активность TNF-α вредна (например, RA), происходит лечение заболевания.
Термин "прогнозирование восприимчивости к ингибитору TNF-α" в настоящем изобретении обозначает способность оценить вероятность того, что лечение субъекта ингибитором TNF-α будет или не будет эффективным (например, принесет ощутимую пользу) для субъекта. В частности, такая способность оценить вероятность того, что лечение будет или не будет эффективным, как правило, применяется после того, как лечение началось и показатель эффективности (например, показатель ощутимой пользы) наблюдался у субъекта. Особенно предпочтительными ингибиторами TNF-α являются биологические препараты, одобренные FDA для применения на людях при лечении вызванных TNF-α заболеваний, таких, например, как ревматоидный артрит или воспалительный колит (IBD), и к таким препаратам относятся адалимумаб (HUMIRA™), инфликсимаб (REMICADE™), этанерсепт (ENBREL™) и цертолизумаб-пегол (CIMZIA®, UCB, Inc.).
Термин "эксклюзионная хроматография" (SEC) служит для обозначения метода хроматографии, при котором молекулы в растворе разделяются на основе их размера и/или гидродинамического объема. Он применяется к большим молекулам или макро-молекулярным комплексам типа белков и их конъюгатов. Как правило, если для пропускания образца через колонку используется водный раствор, то метод называется гель-фильтрационная хроматография.
Термины "комплекс", "иммунокомплекс", "конъюгат" и "иммуноконъюгат" охватывают, без ограничения, TNF-α, связанный (например, нековалентно) с препаратом против TNF-α, препарат против TNF-α, связанный (например, нековалентно) с аутоантителом к препарату против TNF-α, и препарат против TNF-α, связанный (например, нековалентно) и с TNF-α, и с аутоантителом к препарату против TNF-α.
В настоящем изобретении то, что определяется термином "меченые", включает любые частицы, молекулы, белки, ферменты, антитела, фрагменты антител, цитокины и им подобные, конъюгированные с другой молекулой или химической частицей, которая поддается детектированию. Химические вещества, пригодные в качестве метки для меченых частиц, включают, без ограничения, флуоресцентные красители, например, красители Alexa Fluor® типа Alexa Fluor® 647, квантовые точки, оптические красители, люминесцентные красители и радионуклиды, например, I.
Термин "эффективное количество" включает дозу лекарства, способную оказать терапевтический эффект у нуждающегося в этом субъекта, а также биодоступное количество субстанции. Термин "биодоступный" означает ту долю введенной дозы лекарства, которая доступна для терапевтической активности. Например, эффективным количеством препарата, применимого для лечения тех заболеваний, в патофизиологию которых вовлечен TNF-α, например, без ограничения, шока, сепсиса, инфекций, ауто-иммунных заболеваний, RA, болезни Крона, отторжения трансплантатов и реакции "трансплантат против хозяина", может быть такое количество, которое способно предотвращать или ослаблять один или несколько симптомов, связанных с ними.
Выражение "площадь под кривой" является математическим термином, который применяется для описания интегрирования части двухмерного графика. Например, на графике интенсивности сигнала в зависимости от времени выхода из колонки при эксклюзионной хроматографии различные пики на графике соответствуют определенным молекулам. Интегрирование этих пиков охватывает площадь, ограниченную минимальным значением на оси у, например, основанием двухмерного графика, и самим двухмерным графиком. Интегрирование пика равным образом описывается вычислительной формулой: площадь под кривой = ∫ a b f ( x ) d x , где f(x) - функция, описывающая двухмерный график, а переменные "а" и "b" означают границы интегрируемого пика на оси х.
Выражение "детектирование флуоресцентной метки" включает средство детектирования флуоресцентной метки. Средства детектирования включают, без ограничения, спектрометры, флуориметры, фотометры, детектирующие устройства, обычно встроенные в прибор для хроматографии, в том числе эксклюзионной или высокоэффективной жидкостной хроматографии, к примеру, установку Agilent-1200 HPLC System.
Скобки "[]" указывают на то, что выражение в скобках относится к концентрации.
Выражение "оптимизация терапии" включает оптимизацию дозы (например, эффективного количества или уровня) и/или типа индивидуальной терапии. Например, оптимизация дозы препарата против TNF-α включает увеличение или уменьшение количества препарата против TNF-α, впоследствии вводимого пациенту. В некоторых случаях оптимизация типа препарата против TNF-α включает замену одного вводимого препарата против TNF-α на другой препарат (например, другой препарат против TNF-α).
В некоторых других случаях оптимизация терапии включает совместное введение дозы препарата против TNF-α (например, в большей, меньшей или той же самой дозе, что и предыдущая доза) в комбинации с иммуносупрессорным препаратом.
Термин "совместное введение" означает введение более чем одного активного агента с тем, что продолжительность физиологического эффекта одного активного агента накладывается на физиологический эффект второго активного агента.
Термин "субъект", "пациент" или "индивид" обычно относится к людям, но также и к другим животным, включая, например, других приматов, грызунов, собак, кошек, лошадей, овец, свиней и др.
Термин "курс лечения" включает любые терапевтические подходы, предпринимаемые для ослабления или предотвращения одного или нескольких симптомов, связанных с вызванным TNF-α заболеванием. Термин охватывает назначение любого соединения, препарата, процедуры и/или режима, полезных для улучшения здоровья индивида с вызванным TNF-α заболеванием, и включает любые описанные здесь терапевтические средства. Специалистам должно быть известно, что можно изменить сам курс лечения или дозу при текущем курсе лечения (например, увеличить или уменьшить), исходя из присутствия или уровня концентрации препарата против TNF-α и/или аутоантител к препарату против TNF-α.
Термин "иммунодепрессивный препарат" или "иммунодепрессивное средство" охватывает любые субстанции, способные давать иммунодепрессивный эффект, например, предотвращение или уменьшение иммунного ответа, как-то при облучении или введении таких лекарств, как антиметаболиты, антилимфоцитарная сыворотка, антитела и т.д. Примеры подходящих иммунодепрессивных препаратов включают, без ограничения, тиопуриновые препараты типа азатиоприна (AZA) и его метаболитов, антиметаболиты типа метотрексата (МТХ); сиролимус (рапамицин); темсиролимус; эверолимус; такролимус (FK-506); FK-778; антилимфоцитарные глобулиновые антитела, антитимо-цитарные глобулиновые антитела, антитела против CD3, антитела против CD4 и конъюгаты типа антитело-токсин; циклоспорин; микофенолат; мизорибин монофосфат; скопарон; глатирамер ацетат; их метаболиты; их фармацевтически приемлемые соли; их производные; их пролекарственные формы; и их комбинации.
Термин "тиопуриновый препарат" охватывает азатиоприн (AZA), 6-меркаптопурин (6-МР) и любые их метаболиты, обладающие терапевтической эффективностью, в том числе 6-тиогуанин (6-TG), 6-метилмеркаптопурин-рибозид, 6-тиоинозиновые нуклеотиды (например, 6-тиоинозин монофосфат, 6-тиоинозин дифосфат, 6-тиоинозин трифосфат), 6-тиогуаниновые нуклеотиды (например, 6-тиогуанозин монофосфат, 6-тиогуанозин дифосфат, 6-тиогуанозин трифосфат), 6-тиоксантозиновые нуклеотиды (например, 6-тиоксантозин монофосфат, 6-тиоксантозин дифосфат, 6-тиоксантозин трифосфат), их производные, их аналоги и их комбинации.
Термин "образец" охватыва