Специфическая сочетанная терапия злокачественных опухолей цитостатиком и его модификатором
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к онкологии, и может быть использовано для лечения злокачественных гематологических заболеваний или меланомы. Для этого вводят один или несколько цитостатиков от 1/4 до 1/2 стандартной терапевтической дозы, после чего подкожно вводят N-ацетил-D-глюкозаминил-β-(1-4)-N-ацетилмурамил-L-аланил-D-глутаминовую кислоту (ГМДП-А) в эффективном количестве 1 раз в сутки в течение 4-20 дней. Способ позволяет повысить результативность лечения за счет синергетического эффекта иммунного модификатора и цитостатика при снижении терапевтической дозы цитостатиков без снижения их противоопухолевой эффективности. 3 з.п. ф-лы, 4 табл., 4 пр.
Реферат
Изобретение относится к медицине, конкретно к лечению больных со злокачественными опухолями сочетанием цитостатической и биотерапии.
Несмотря на безусловные достижения современной онкологии, проблема повышения эффективности методов терапии при злокачественных новообразованиях остается крайне актуальной.
Химиотерапия является приоритетным методом лечения больных с распространенными злокачественными процессами, однако нередко она недостаточно эффективна и высокотоксична. В значительной степени это обусловлено необходимостью проводить химиотерапию на неблагоприятном фоне иммуносупрессии, индуцированной опухолевым процессом и усугубляющейся под действием большинства применяемых цитостатиков.
Иммунотерапия как самостоятельный вид противоопухолевого лечения малоперспективна, поскольку иммунные препараты в подавляющем большинстве случаев не обладают цитостатической активностью. Фактически, только эндогенные цитокины - интерлейкины и интерфероны применяются в медицинской практике для лечения больных с некоторыми формами злокачественных новообразований, но спектр их противоопухолевого действия очень ограничен, а побочные реакции достаточно выражены (Deepika Narasimha MD, et al. The International Journal of Targeted Therapies in Cancer; Immunotherapy in Advanced Melanoma; June, 3, 2012, p. 37-41).
Сочетание цитостатической и биотерапии иммунными препаратами в ряде случаев позволяет существенно повысить эффективность лечения.
К средствам биотерапии, применяемым для таких сочетанных схем лечения злокачественных опухолей, относят вакцины, синтетические пептиды, моноклональные антитела, цитокины, а также другие продукты современных биотехнологий. Биотерапевтические лекарственные средства активируют защитные компоненты иммунной системы и стимулируют их противоопухолевое действие, а также воздействуют на факторы и механизмы, контролирующие процессы пролиферации и гибели клеток, благодаря чему достигается синергетический эффект от сочетанного применения в схеме лечения цитостатика и биопрепарата (Gonzalez АВ, Jimenez RB, Delgado PJR, et al. Biochemotherapy in the treatment of metastatic melanoma in selected patients. Clin Transl Oncol 2009; 11(6): 382-6.); (Cohen DJ, Hochster HS, Rationale for combining biotherapy in the treatment of advanced colon cancer. Gastrointest Cancer Res 2008; 2(3): 145-51). To есть биопрепарат выполняет одновременно функции модификатора, усиливающего эффективность противоопухолевого средства, и протектора, защищающего организм от иммуносупрессивного (иммунотоксического) действия цитостатика.
Однако в настоящее время отсутствует системный подход к подбору триады «злокачественное новообразование - цитостатик - средство биотерапии». Существующий уровень техники/знаний не позволяет a priori экстраполировать позитивный опыт лечения одной гистологической формы опухоли парой «цитостатик - средство биотерапии» на другую форму. Поскольку эффективность лечения зависит от многих факторов: способа применения лекарственных средств, выбора их доз, схемы лечения и др., неоптимальный выбор ряда параметров при применении иммунных препаратов может привести к обратному эффекту: вместо торможения роста опухоли можно вызвать ее рост. Это обусловливает актуальность поиска оптимальных сочетаний химио- и биотерапии, а также расширения арсенала лекарственных средств для противоопухолевой биотерапии, особенно для резистентных к традиционным цитостатикам опухолей.
Современные лекарственные средства - продукты высоких технологий: вакцины, синтетические пептиды, моноклональные антитела, цитокины при современном уровне техники имеют очень высокую стоимость, производятся ограниченно и реально малодоступны практикующим клиницистам. Поэтому внимание практической медицины при поиске способов лечения рака сочетанными методами цитостатической и биотерапии обращено к известным иммуномодуляторам, выпускаемым промышленностью, либо пригодным к промышленному выпуску традиционными методами химии.
Настоящее изобретение направлено на расширение арсенала иммунных препаратов, модулирующих (усиливающих) эффективность цитостатиков при лечении резистентных к цитостатической терапии иммунозависимых онкологических заболеваний способом сочетания химио- и биотерапии.
Известен состав для терапии опухолей, содержащий цитостатик и мурамилпептид, который был успешно применен для лечения больных с рецидивирующей остеосаркомой путем сочетания цитостатической и биотерапии (Nardin A, Lefebvre ML, Labroquère К, Faure О, Abastado JP. Liposomal muramyl tripeptide phosphatidylethanolamine: Targeting and activating macrophages for adjuvant treatment of osteosarcoma. Curr Cancer Drug Targets. 2006 Mar; 6(2): 123-33). У больных, получивших сочетанное лечение, наблюдалась более длительная безрецидивная и общая выживаемость.
Этому клиническому исследованию предшествовало экспериментальное изучение эффективности сочетания различных цитостатиков с мурамилпептидом у собак со спонтанными остеосаркомами и гемангиосаркомами селезенки (MacEwen E.G., Kurzman I.D., Helfand S., Vail D., London C., Kisseberth W., Rosenthal R.C., et al. Current studies of liposome murarmyl tripeptide (CGP 19835A lipid) therapy for metastasis in spontaneous tumors: a progress review. J. Drug Target, 1994; 2(5): 391-6). При лечении остеосарком у собак многократное введение цисплатина дополняли многократным введением мурамилпептида. Собак с гемангиосаркомами лечили сочетанием внутривенного введения доксорубицина с циклофосфамидом с многократным внутривенным введением мурамилпептида. В обоих случаях мурамилпептид представлял собой N-ацетилмурамоил-аланил-D-изоглутаминил-аланил-2-(1,2-дипальмитоил)-sn-глицеро-3-офорил-этиламид. Продолжительность жизни животных с обеими формами опухолей, леченных сочетанием химио- и биотерапии, была выше таковой у животных, получивших монотерапию цитостатиками. Однако применение иммунного препарата не привело к снижению дозы химиопрепаратов, что свидетельствует о недостаточном модулирующем (потенциирующем) действии примененного мурамилпептида на цитостатические агенты.
Наиболее близким к предлагаемому изобретению является способ уничтожения ФНО-альфа-чувствительных опухолевых клеток составом, в котором в качестве средства биотерапии, добавляемого к цитостатику, служит композиция ФНО-альфа и мурамилпептида (RU 2209078 C1). Предложенная композиция модифицирует эффективность цитостатика и приводит к достижению синергетического эффекта, позволяющего снизить терапевтическую дозу цитостатика. То есть она оказывает на цитостатик потенциирующее действие. В качестве мурамилпептидов предложено использовать N-ацетил-D-глюкозаминил-β-(1-4)-N-ацетилмурамоил-L-аланил-D-изоглутамин (ГМДП) и N-ацетил-D-глюкозаминил-β-(1-4)-N-ацетилмурамоил-L-аланил-D-глутаминовую кислоту (ГМДП-А). В качестве цитостатических препаратов - цисплатин, доксорубицин или актиномицин D. По данному способу раздельно, растворением в физиологическом растворе, готовят растворы заданной концентрации цитостатика, ФНО-альфа и ГМДП, а затем смешивают их в определенных пропорциях. Тестированием цитолиза опухолевых клеток под влиянием заявленного состава установлено, что цитолиз ФНО-альфа-чувствительных опухолевых клеток составляет от 72 до 100%. В опыте с животными (мыши) указанный смешанный состав внутрибрюшинно вводят животным с внутрибрюшинно имплантированнной асцитной карциномой Эрлиха. Выживаемость мышей достигает 100% при дозе цитостатика в 4 раза меньшей, чем при стандартной монотерапии этим цитостатиком. При воздействии только химиопрепаратом или его комбинацией с одним из биотерапевтических компонентов (ФНО-альфа или мурамилпептидом) такой эффективности лечения не наблюдалось.
Реализация терапевтического действия состава для ингибирования роста ФНО-чувствительных опухолевых клеток в опытах in vivo и in vitro продемонстрирована для композиции {ГМДП:цисплатин:ФНО-альфа=1:1,6:0,0050} (массовое соотношение компонентов). ГМДП-А в заявленном составе протестирована не была.
Недостатком предложенного способа является использование в сочетанной терапии ФНО-альфа и ГМДП. ФНО-альфа является высокотоксичным соединением (Недоспасов С.Α., Купраш Д.В. Онкоиммунология: некоторые фундаментальные проблемы иммунотерапии рака. Молекулярная биология 2007; 41(2); 355-368) и может усилить иммуносупрессию у субъекта с опухолевым заболеванием. ГМДП проявляет пирогенный эффект при внутривенном введении, что препятствует его применению в онкологической клинической практике. Вероятно, именно по этим причинам данное исследование не получило дальнейшего развития.
Несомненным недостатком изобретения (RU 2209078 C1) является тот факт, что при разработке композиции не была учтена потенциальная способность ГМДП-А вступать в агрегативное или ковалентное взаимодействие с ФНО-альфа в растворах, снижающее его действие. Известно, что ковалентные или агрегативные производные ФНО-альфа могут быть получены путем связывания с ним соединений по группам его боковых аминокислотных цепей (RU 2076151). Предпочтительными участками в молекуле ФНО-альфа для образования производных являются остатки цистеина или гистидина. Такие ковалентно или агрегативно образованные дериваты уже не будут выполнять его функции цитокина. Поэтому отсутствие в примерах данного изобретения сведений о результатах применения ГМДП-А в предложенном составе оставляет бездоказательной возможность ее использования для сочетанной терапии против опухолевых ФНО-альфа-чувствительных клеток.
Задача, решаемая предлагаемым изобретением, - разработка эффективной сочетанной цитостатической и биотерапии для лечения злокачественных гематологических заболеваний или меланомы. Технический результат от использования предлагаемого изобретения, повышающего результативность лечения злокачественных гематологических заболеваний или меланомы, заключается в достижении синергетического эффекта при сочетанном воздействии цитостатика и его иммунного модификатора, позволяющего снижать терапевтическую дозу высокотоксичных цитостатиков без снижения их противоопухолевой эффективности.
Указанный результат достигается терапией злокачественных гематологических заболеваний или меланомы у субъекта путем применения одного или нескольких цитостатиков, воздействующих на ДНК, в комбинации с N-ацетил-D-глюкозаминил-β-(1-4)-N-ацетилмурамил-L-аланил-D-глутаминовой кислотой (ГМДП-А) по следующей схеме лечения субъектов:
- введение внутривенно от 1/4 до 1/2 стандартной терапевтической дозы цитостатика, принятой для данного вида субъектов;
- затем последующее после введения цитостатика, первое введение N-ацетил-D-глюкозаминил-β-(1-4)-N-ацетилмурамил-L-аланил-D-глутаминовой кислоты (ГМДП-А) в эффективном количестве, установленном для данных субъектов;
- повторные введения ГМДП-А в эффективном количестве, установленном для выбранных субъектов.
При этом в частном случае осуществления изобретения субъектом терапии является животное или человек, первые и повторные введения осуществляют подкожно, первое введение ГМДП-А осуществляют через час после введения цитостатика, а повторные подкожные введения ГМДП-А осуществляют один раз в сутки в течение 4-20 дней.
В предлагаемом изобретении для сочетанной цитостатической и биотерапии злокачественных гематологических заболеваний или меланомы впервые предложено использовать в качестве индивидуального иммунного модификатора цитостатиков, преимущественно воздействующих на ДНК, N-ацетил-D-глюкозаминил-β-(1-4)-N-ацетилмурамил-L-аланил-D-глутаминовую кислоту (ГМДП-А).
Используя ГМДП-А в терапии опухолей с целью купирования иммунотоксичности цитостатика и вызываемой им миелосупрессии, авторами изобретения была установлена ранее неизвестная способность N-ацетил-D-глюкозаминил-β-(1-4)-N-ацетилмурамил-L-аланил-D-глутаминовой кислоты (ГМДП-А) при определенных дозировках и схемах лечения потенциировать действие цитостатиков, преимущественно воздействующих на ДНК, в отношении иммунозависимых злокачественных гематологических заболеваний, а также меланомы. Следовательно, несмотря на ранее известные сведения о возможности применения ГМДП-А для ингибирования роста опухолевых клеток (US 4395399 А; RU 96109376 А; WO 9809989; EP 0722332 B1; US 20071673555), способность ГМДП-А потенциировать действие цитостатиков, преимущественно воздействующих на ДНК, при лечении злокачественных гематологических заболеваний и меланомы, установлена впервые.
ГМДП-А может быть получена в достаточном количестве технологически эффективными и относительно мало затратными методами пептидного синтеза, описанными в US 4395399. ГМДП-А является апирогенной в широком диапазоне концентраций, включая потенциально терапевтические. Проведенные доклинические исследования острой, хронической и специфической токсичности ГМДП-А показали отсутствие токсического действия данного вещества, как при предполагаемой терапевтической дозе, так и при пятикратном превышении ее (Отчет ин-та иммунологии РАМН, М., 1998 г.; Отчет ВНЦ БАВ МО, г. Старая Купавна, 2014 г.). Таким образом, ГМДП-А может быть использована в клинической практике при наличии обоснованного способа ее применения.
ГМДП-А, применяемая в настоящем изобретении, вводится парентерально, что может быть осуществлено подкожно, внутрикожно или внутримышечно. Предпочтительным является подкожное введение, которое обеспечивает эффективное взаимодействие препарата с клетками-мишенями: дендритными клетками, клетками Лангерганса и макрофагами. Возможно также интратуморальное введение ГМДП-А (в опухолевую ткань).
Эффективное количество, выраженное в виде разовой терапевтической дозы составляет в условиях in vivo (мыши) от 0,002 мг/кг до 8,825 мг/кг.
Дозы на курс лечения в условиях in vivo (мыши) от 0,012 мг/кг до 185,300 мг/кг.
Для парентерального введения, согласно предлагаемому изобретению, лекарственное средство ГМДП-А может быть изготовлено в виде дозированных стерильных лиофилизатов для приготовления инъекционных растворов и в виде стерильных растворов, содержащих подходящий фармацевтический носитель.
В случае применения лиофилизатов, растворителем субстанции ГМДП-А может быть физиологический раствор, вода для инъекций, а также другие традиционно применяемые для этого растворители.
В случае растворов для инъекций предпочтительным является водный носитель, в качестве которого может быть использована вода, физиологический солевой раствор (0,9% NaCl), раствор глицина (0,3%) и аналогичные известные носители. Помимо водных носителей могут быть использованы такие растворители как пропиленгликоль, диметилсульфоксид, диметилформамид, а также всевозможные смеси названных растворителей. Раствор может также содержать подходящие вспомогательные вещества, например, буферные вещества, неорганические соли для достижения нормального осмотического давления, другие вещества для увеличения стабильности растворов ГМДП-А. Примерами такого рода добавок могут быть соли натрия и калия (хлориды или фосфаты), сахароза, глюкоза, маннитол, сорбитол, белковые гидролизаты, декстран, поливинилпирролидон, полиэтиленгликоль, динатрия эдетат.
В сочетании с модификатором - N-ацетил-D-глюкозаминил-β-(1-4)-N-ацетилмурамил-L-аланил-D-глутаминовой кислотой (ГМДП-А) в предложенной специфической сочетанной терапии злокачественных гематологических заболеваний или меланомы могут быть использованы цитостатики различных классов, выбранные из группы цитостатиков, преимущественно воздействующих на ДНК. Так, ГМДП-А оказывает при лечении злокачественных гематологических заболеваний, а также меланомы, потенциирующее действие на циклофосфан (алкилирующий цитостатик), цисплатин (соединения платины), гемцитабин (антиметаболит). Общим для этих цитостатических агентов является их преимущественное воздействие на ДНК клетки.
Режим введения предложенных препаратов для заявленной специфической сочетанной терапии является приемлемым для клинической практики.
Отличительными признаками данного технического решения являются:
- использование в специфической сочетанной терапии злокачественных гематологических заболеваний или меланомы в качестве модификатора цитостатиков N-ацетил-D-глюкозаминил-β-(1-4)-N-ацетилмурамил-L-аланил-D-глутаминовой кислоты (ГМДП-А);
- нахождение для специфической сочетанной терапии злокачественных гематологических заболеваний и меланомы эксклюзивной пары {цитостатик, преимущественно воздействующий на ДНК + ГМДП-А}, для которой может быть достигнут синергетический эффект, позволяющий снизить терапевтическую дозу высокотоксического цитостатика без снижения эффективности его противоопухолевого воздействия;
- способ лечения сочетанной цитостатической и биотерапией злокачественных гематологических заболеваний и меланомы, позволяющий реализовать синергетический эффект от применения эксклюзивной пары (цитостатик, преимущественно воздействующий на ДНК + ГМДП-А), приводящий к снижению терапевтической дозы высокотоксического цитостатика, без снижения эффективности его противоопухолевого воздействия.
Данные признаки мы полагаем существенными, поскольку именно их совокупность позволяет получить новый неожиданный результат - непредсказуемое заранее потенциирующее действие ГМДП-А в отношении цитостатиков, преимущественно воздействующих на ДНК, повышающее эффективность противоопухолевого лечения.
Данный результат обусловлен:
а) способностью ГМДП-А, тропной к NOD2 рецепторам, активизировать неспецифические и специфические механизмы защиты организма, стимулируя большое разнообразие иммунных ответов. В их числе - индукция каскадов цитокинов, снижающих иммунносупрессивное действие опухолей и цитостатиков, с одной стороны, и каскадов цитокинов, усиливающих противоопухолевую защиту, с другой стороны;
б) правильно подобранной специфической сочетанной цитостатической и биотерапией терапией {цитостатик, преимущественно воздействующий на ДНК + ГМДП-А}, учитывающей фенотип злокачественных новообразований и механизм действия цитостатика;
в) правильно подобранным способом лечения, который учитывает способность ГМДП-А, как и многих иммунных препаратов, оказывать разнонаправленное действие на пролиферацию опухолевых клеток и на чувствительность их к действию цитостатика в зависимости от его дозы и схемы лечения.
Преимуществом предлагаемого изобретения является увеличение эффективности бинарной терапии за счет использования ГМДП-А в качестве относительно недорогого, не пирогенного и не токсичного модификатора цитостатического препарата.
Другим преимуществом предлагаемого способа специфической сочетанной терапии является тот факт, что установлена связь между фенотипическими параметрами новообразований (только злокачественные гематологические заболевания или меланома), механизмом воздействия цитостатика (преимущественно воздействующего на ДНК), химическим строением модификатора - мурамилпептида (только ГМДП-А) и противоопухолевым ответом. Таким образом, предлагаемый способ содержит в себе критерии «включения» / «исключения» в протокол лечения, позволяющие применять его с максимальной эффективностью.
К дополнительным преимуществам предлагаемого способа можно отнести известную способность ГМДП-А корректировать миелосупрессию у больного, если она может быть вызвана используемым цитостатиком (WO 9809989).
Сведения, подтверждающие возможность осуществления изобретения
Реальное воплощение предлагаемой специфической сочетанной терапии злокачественных гематологических заболеваний и меланомы путем воздействия цитостатика, преимущественно воздействующего на ДНК, и его модификатора, проиллюстрировано примерами исследований, проведенных с использованием животных с перевиваемыми опухолями.
При исследовании эффективности предлагаемой специфической сочетанной терапии использовали следующие модели опухолей, перевиваемых на правую боковую поверхность тела животных: лимфолейкоз Р388 (Р388) и меланому В16 (В16).
В качестве цитостатиков, преимущественно воздействующих на ДНК, использовали циклофосфан, цисплатин и гемцитабин.
В качестве модификатора цитостатика использовали ГМДП-А в виде растворов для инъекций или лиофилизатов, отвечающих требованиям фармакопеи.
Лечение животных с опухолями в опытных группах проводили на ранние (24 часа после инокуляции опухоли) и поздние (5 суток после инокуляции опухоли) сроки развития опухоли с использованием однократного введения цитостатика внутривенно в дозе, составляющей 1/2 или 1/4 от терапевтической дозы, и различных режимов введения ГМДП-А:
- первичное введение подкожно модификатора ГМДП-А в разовой дозе 3,75 мг/кг;
- повторное курсовое введение подкожно модификатора ГМДП-А в разных режимах: 4-кратно, 9-кратно и 20-кратно один раз в день в разовой дозе 3,75 мг/кг (курсовые дозы - 18,75 мг/кг, 37,5 мг/кг и 78,75 мг/кг, соответственно), кратность зависит от модели (гистологической формы перевиваемой опухоли).
Для выявления эффективности предложенной сочетанной терапии в качестве контроля после инокуляции опухоли проводили самостоятельное лекарственное лечение одним из компонентов бинарной терапии - цитостатическим препаратом или модификатором: цитостатик вводили внутривенно в 1/2 или 1/4 терапевтической дозы, однократно, через сутки или через 5 суток после инокуляции опухоли; модификатор - ГМДП-А вводили подкожно в разовой дозе 3,75 мг/кг 5-кратно с 1 по 5 сутки или с 5 по 9 сутки, либо 10-кратно с 1 по 10 сутки или с 5 по 14 сутки, либо 21-кратно с 1 по 21 сутки после инокуляции опухоли.
Общим контролем для всех групп служили животные без воздействия.
Оценку противоопухолевой эффективности предлагаемой специфической сочетанной терапии и сравнительной монотерапии только цитостатиком или только модификатором ГМДП-А проводили по общепринятым в экспериментальной онкологии критериям: объему опухоли (OO), торможению роста опухоли (ТРО), увеличению продолжительности жизни животных (УПЖ), частоте метастазирования опухоли (ЧM), уровню торможения метастазирования (ТМ).
Критериями эффективности противоопухолевых и антиметастазирующих свойств являлись значения вышеназванных критериев: ТРО≥70%; УПЖ≥50%; ТМ≥75%.
Пример 1
Оценка эффективности сочетанной терапии «ДДП + ГМДП-А» на модели лимфолейкоза Р388
Эффективность сочетанной терапии - химиотерапии цитостатиком цисплатином (ДДП) и биотерапии ГМДП-А оценили на модели лимфолейкоза Р388, инокулированного мышам линии BDF1, самкам, подкожно на правую боковую поверхность тела.
Раствор ГМДП-А для подкожного введения с концентрацией 1 мг/мл готовили растворением лиофилизата ГМДП-А в воде для инъекций.
ГМДП-А вводили мышам ежедневно подкожно в однократной дозе 3,75 мг/кг в различных режимах:
- пятикратно (суммарная доза 18,75 мг/кг) на 1-5 или 5-9 сутки после инокуляции опухоли;
- десятикратно (суммарная доза 37,5 мг/кг) на 1-10 или 5-14 сутки после инокуляции опухоли;
- двадцатиоднократно (суммарная доза 78,75 мг/кг) на 1-21 сутки после инокуляции опухоли.
ДДП (Цисплатин, торговая марка «Цисплатин-Тева», производитель «Тева Фармацевтические Предприятия Лтд, Израиль, произведено на заводе Фармахеми Б.В., Нидерланды) вводили внутривенно, однократно, в дозе 4 мг/кг (1/2 ТД).
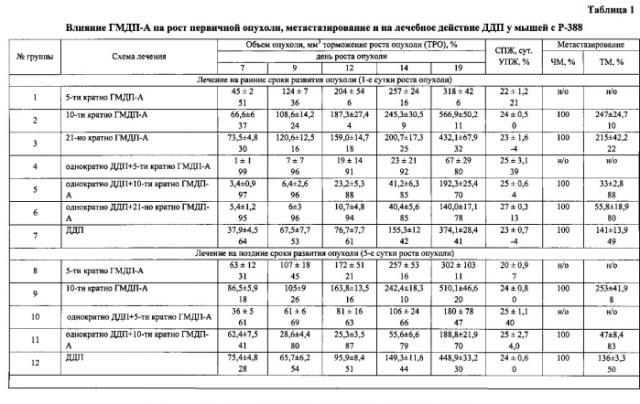
Результаты представлены в таблице 1.
Пример 1 показывает, что на модели лимфолейкоза Р388 добавление биотерапии ГМДП-А к химиотерапии ДДП (введение в 1/2 ТД) достоверно увеличивает эффективность лечения по показателям ТРО и ТМ, причем модифицирующий эффект ГМДП-А относительно ДДП в терапевтически неэффективной дозе (1/2 ТД) проявляется в одинаковой степени при всех использованных режимах введения при раннем начале лечения (через 24 часа после инокуляции опухоли).
При позднем начале лечения (на 5 сутки после инокуляции опухоли) эффективность сочетанной терапии несколько снижается, однако при 10-кратном введении ГМДП-А остается достоверно более высокой, чем эффективность химиотерапии в монорежиме (табл. 1).
Пример 2
Оценка эффективности бинарной терапии «ДДП + ГМДП-А» на модели меланомы В16
Эффективность сочетанной терапии - химиотерапии цитостатиком ДДП и биотерапии ГМДП-А оценили на модели меланомы В16, инокулированной мышам линии BDF1, самкам, подкожно на правую боковую поверхность тела.
Раствор ГМДП-А для подкожного введения с концентрацией 1 мг/мл готовили растворением лиофилизата ГМДП-А в воде для инъекций.
ГМДП-А вводили мышам ежедневно подкожно в однократной дозе 3,75 мг/кг в различных режимах:
- пятикратно (суммарная доза 18,75 мг/кг) на 1-5 или 5-9 сутки после инокуляции опухоли;
- десятикратно (суммарная доза 37,5 мг/кг) на 1-10 или 5-14 сутки после инокуляции опухоли.
ДДП (Цисплатин, торговая марка «Цисплатин-Тева», производитель «Тева Фармацевтические Предприятия Лтд, Израиль (произведено на заводе Фармахеми Б.В., Нидерланды) вводили внутривенно, однократно, в дозе 4 мг/кг (1/2 ТД).
Результаты представлены в таблице 2.
Эффективность сочетанного действия химио- и биотерапии на этой модели сходна с таковой на модели Р388. Наиболее эффективным является режим 10-кратного введения ГМДП-А после химиотерапии ДДП (1/2 ТД), при раннем (через 24 часа после инокуляции опухоли), и режим 5-кратного введения - при позднем (на 5 сутки после инокуляции опухоли) начале лечения.
Как видно из данных, приведенных в примерах 1 и 2, эффективность ГМДП-А при индивидуальном применении (без химиотерапии) не достигает биологически значимого уровня.
Пример 3
Оценка эффективности сочетанной терапии «химиотерапия (различные цитостатики) + ГМДП-А» на модели лимфолейкоза Р388
На модели лимфолейкоза Р388 провели сравнительное исследование модифицирующего действия ГМДП-А в отношении различных цитостатических препаратов: цисплатина (ДДП), гемзара и циклофосфана (ЦФ). Эффективность сочетанной терапии цитостатиками и ГМДП-А оценивали при использовании ДДП в 1/2 ТД, гемзара - в 1/2 ТД и ЦФ - в 1/4 ТД, лечение начинали на раннем сроке роста опухоли (через 24 часа после инокуляции), ГМДП-А вводили в течение 21 дня в суточной дозе 3,75 мг/кг, введение проводили подкожно в 2 зоны: в зону роста опухоли (над опухолью) или в симметричную зону (на противоположной стороне от опухолевого узла).
Использовались коммерческие препараты: Циклофосфан, торговая марка «Эндоксан®», производитель «Бакстер Онкология ГмбХ», Германия; Цисплатин, торговая марка «Цисплатин-Тева», производитель «Тева Фармацевтические Предприятия Лтд, Израиль (произведено на заводе Фармахеми Б.В., Нидерланды»; Гемцитабин, торговая марка «Гемцитар», производитель «ЗАО «Биокад», Россия.
Раствор ГМДП-А для подкожного введения с концентрацией 1 мг/мл готовили растворением лиофилизата ГМДП-А в воде для инъекций.
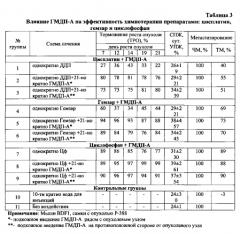
Результаты приведены в таблице 3.
Как видно из результатов Примера 3, ГМДП-А эффективно модифицирует терапевтическое действие всех использованных химиопрепаратов по показателям ТРО, УПЖ и ТМ, причем выраженность модификации при введении в различные зоны различается недостоверно. Это косвенно подтверждает иммуномодулирующее действие ГМДП-А, которое реализуется не только при введении в непосредственной близости от опухолевого очага, но и дистантно, при введении на противоположную сторону.
Выраженность модифицирующего действия ГМДП-А зависит от используемого цитостатика и реализуется только в случае использования цитостатика, преимущественно воздействующего на ДНК клеток и минимально - на РНК (следовательно, приводящего к получению минимального количества дефектной РНК, препятствующей синтезу специфических белковых соединений, через выработку которых реализуется потенциирующее действие ГМДП-А).
Пример 4
Сравнительная оценка эффективности сочетанной терапии «химиотерапия ДДП + ГМДП-А» на модели лимфолейкоза Р388 при использовании лиофилизата субстанции ГМДП-А и готовой лекарственной формы «ГМДП-А, раствор для подкожного введения 1 мг/мл»
Сравнительное изучение терапевтической эффективности лиофилизата субстанции и ГЛФ ГМДП-А провели на модели солидного варианта лимфолейкоза Р388 при раннем начале лечения (24 часа после подкожной перевивки опухолевого материала) в виде монотерапии ГМДП-А (лиофилизата или ГЛФ), а также сочетанного введения с ДДП.
Условия проведения эксперимента в отношении лиофилизата субстанции описаны в примере 1.
В качестве готовой лекарственной формы использовали стерильные растворы «ГМДП-А, раствор для подкожного введения 1 мг/мл», содержащие ГМДП-А и следующие вспомогательные вещества и носители в фармацевтически приемлемых количествах: сорбитол, динатрия эдетат, пропиленгликоль, воду.
Как видно из данных, представленных в таблице 4, лиофилизат субстанции и ГЛФ ГМДП-А проявляют себя одинаково: в сочетании с цитостатиком они приводят к достоверному увеличению противоопухолевой эффективности по всем показателям. ТРО в группах сочетанного лечения примерно на 30% превышает таковое в группе ДДП на все сроки наблюдения. УПЖ составляет 44%, 37% и 22% в группах «лиофилизат ГМДП-А + ДДП», «ГМДП-А, раствор для подкожного введения 1 мг/мл + ДДП» и ДДП, а ингибирование метастазирования в этих группах - 82%, 79% и 32%, соответственно.
Таким образом, лиофилизат субстанции ГМДП-А и готовая лекарственная форма ГМДП-А оказывают сходный модифицирующий эффект в отношении ДДП на модели лимфолейкоза Р338.
1. Способ терапии злокачественных гематологических заболеваний или меланомы у субъекта путем применения одного или нескольких цитостатиков, воздействующих на ДНК, в комбинации с N-ацетил-D-глюкозаминил-β-(1-4)-N-ацетилмурамил-L-аланил-D-глутаминовой кислотой (ГМДП-А) по следующей схеме лечения субъектов:- введение внутривенно от 1/4 до 1/2 стандартной терапевтической дозы цитостатика, принятой для данного вида субъектов;- затем последующее после введения цитостатика первое введение N-ацетил-D-глюкозаминил-β-(1-4)-N-ацетилмурамил-L-аланил-D-глутаминовой кислоты (ГМДП-А) в эффективном количестве, установленном для данных субъектов;- повторные введения ГМДП-А в эффективном количестве, установленном для выбранных субъектов.
2. Способ по п. 1, отличающийся тем, что субъектом терапии является животное или человек.
3. Способ по п. 1, отличающийся тем, что первые и повторные введения осуществляют подкожно.
4. Способ по п. 1, или 2, или 3, отличающийся тем, что первое введение ГМДП-А осуществляют через час после введения цитостатика, а повторные подкожные введения ГМДП-А осуществляют один раз в сутки в течение 4-20 дней.