Моноклональное тело против амилоида бета
Иллюстрации
Показать всеНастоящее изобретение относится к иммунологии и биотехнологии. Предложены варианты антитела или его эпитоп-связывающего фрагмента, специфичных в отношении бета-амилоидного пептида 1-40. Каждый из вариантов характеризуется тем, что включает области VH и VL, либо 6 CDR из лёгкой и тяжёлой цепи. Описаны: кодирующая НК; варианты депонированных линий клеток (гибридом) с коллекционными номерами DSM ACC2844, DSM ACC2845, DSM ACC2846 и линия клеток, включающая указанный полинуклеотид, для получения антитела. Предложены: терапевтическая композиция для лечения заболеваний или расстройств, вызванных или связанных с амилоидом или амилоидоподобными белками, и набор для обнаружения амилоидного белка в биологическом образце, - использующие антитело. Раскрыты варианты способа получения антитела: с использованием гибридом или кодирующей НК. Описаны: способ диагностирования предрасположенности к заболеванию или состоянию, связанному с амилоидозом; способ определения степени нагрузки амилоидогенными бляшками в ткани; способ мониторинга минимального остаточного заболевания, связанного с амилоидом; способ прогнозирования восприимчивости субъекта; способ лечения или облегчения заболеваний, связанных с амилоидозом; способ снижения количества бляшек или их нагрузки в мозге; способ снижения общего количества растворимого белка амилоида и способ сохранения или повышения когнитивного объема памяти субъекта - использующие антитело или его эпитоп-связывающий фрагмент. Описаны варианты применения антитела или его эпитоп-связывающего фрагмента для приготовления лекарственного средства. Предложенные изобретения обеспечивают новые антитела, что может найти применение в терапии и диагностике болезни Альцгеймера и других перечисленных амилоидозов. 28 н. и 26 з.п. ф-лы, 20 ил., 13 табл., 3 пр.
Реферат
Перекрестные сведения на родственные заявки
По настоящей заявке испрашивается приоритет на основе предварительной заявки на патент США US 60/943543, поданной 12 июня 2007 г., предварительной заявки на патент США US 60/943541, поданной 12 июня 2007 г., и предварительной заявки на патент США US 60/943790, поданной 13 июня 2007 г., которые включены в настоящее изобретение в виде ссылок.
Предпосылки создания изобретения
Настоящее изобретение относится к способам и композициям для диагностики и лечения заболеваний и расстройств, которые связаны или вызваны амилоидом или амилоидоподобными белками, в том числе амилоидозов - группы заболеваний и нарушений, связанных с амилоидным белком, например болезни Альцгеймера.
Амилоидоз означает не единственное заболевание, а разнородную группу прогрессирующих заболеваний, отличающихся внеклеточными тканевыми отложениями восковидного крахмалоподобного белка, называемого амилоидом, который накапливается в одном или нескольких органах или системах организма. По мере накопления отложений амилоида они начинают мешать нормальному функционированию органа или системы организма. Имеется по меньшей мере 15 разных типов амилоидоза. Основными формами являются первичный амилоидоз без известных предшествующих проявлений заболевания, вторичный амилоидоз, проявляющийся после некоторого другого болезненного состояния, и наследственный амилоидоз.
Вторичный амилоидоз отмечают у людей с хронической инфекцией или воспалительным заболеванием, например, туберкулезом, бактериальной инфекцией, называемой семейной средиземноморской лихорадкой, костными инфекциями (остеомиелитами), ревматоидным артритом, воспалением тонкой кишки (грануломатозным илеитом), болезнью Ходжкина и лепрой.
Амилоидные белковые фибриллы, которые составляют примерно до 90% амилоидного материала, представляют один из нескольких различных типов белков. Эти белки способны складываться в так называемые «бета-складчатые» плоские фибриллы - уникальную белковую конфигурацию, которая имеет сайты связывания для красителя Конго красного, и в результате возникает уникальное для амилоидного белка свойство - окрашивание. Кроме того, амилоидные отложения тесно связаны с пентагональным компонентом амилоида Р (amyloid pentagonal - АР), гликопротеином, близким к нормальному сывороточному амилоиду Р (serum amyloid Р - SAP), и сульфатированными глюкозаминогликанами (glycosaminoglycans - GAG), сложными углеводами соединительной ткани.
Многие возрастные заболевания основаны или связаны с белками амилоидного типа и в частности характеризуются накоплением внеклеточных отложений амилоида или амилоидо-подобного материала, который участвует в патогенезе, а также в прогрессировании заболевания. К таким заболеваниям относятся, но ими не ограничиваются, неврологические заболевания, например, болезнь Альцгеймера (БА), включая заболевания и состояния, отличающиеся утратой когнитивного объема памяти, например, умеренное когнитивное поражение (mild cognitive impairment - MCI), болезнь диффузных поражений телец Леви, синдром Дауна, наследственное цереброспинальное кровоизлияние с амилоидозом (типа Dutch), комплекс паркинсонизм-деменция о. Гуам. К другим заболеваниям, которые связаны с белками амилоидного типа, относятся прогрессирующий супрануклеарный паралич, рассеянный склероз, болезнь Крейсфельда-Якоба, болезнь Паркинсона, слабоумие, связанное со СПИД, амиотропный латеральный склероз (amyotropic lateral sclerosis - ALS), диабет взрослых, старческий кардиальный амилоидоз, эндокринные опухоли и другие, включая дегенерацию желтого пятна.
Хотя патогенез этих заболеваний может быть различным, свойственные для них отложения часто содержат много общих молекулярных составляющих. В значительной степени они могут быть следствием местного активирования провоспалительных метаболических путей, связанных с одновременным отложением активированных компонентов комплемента, веществами острой фазы, иммунными модуляторами и другими медиаторами воспаления (McGeer и др., 1994).
Болезнь Альцгеймера (БА) является нейрологическим расстройством, предположительно вызываемым амилоидными бляшками, накоплением нарушенного отложения белков в мозге. Наиболее часто тип амилоида, обнаруженного в мозге больных, преимущественно состоит из фибрилл Аβ. Научное подтверждение заключается в том, что повышение выработки и накопления бета-амилоидного белка в бляшках приводит к отмиранию нервных клеток, которое влияет на развитие и прогрессирование БА. Утрата нервных клеток в стратегически важных участках мозга в свою очередь вызывает снижение содержания нейротрансмитеров и ухудшает память. К белкам, играющим основную роль в формировании бляшек, относятся амилоидный белок-предшественник (amyloid precursor protein - АРР) и два презенилина (презенилин I и презенилин II). Последующее расщепление амилоидного белка-предшественника (АРР), который экспрессируется конститутивно и подвергается катаболизму в большинстве клеток, ферментами β и γ секретазами приводит к высвобождению пептида Аβ, включающего от 39 до 43 аминокислот. Разрушение белков АРР вероятно повышает их предрасположенность агрегировать в бляшки. Особенно это относится к фрагменту Аβ(1-42), который имеет высокую предрасположенность к связыванию агрегатов из-за двух в высокой степени гидрофобных аминокислотных остатков по С-концу. Поэтому предполагают, что фрагмент Aβ(1-42) преимущественно вовлечен и ответственен за инициацию формирования старческих бляшек у больных БА, и соответственно обладает высоким патологическим потенциалом. Таким образом, существует потребность в агентах для предупреждения формирования амилоидных бляшек и растворения имеющихся бляшек у больных БА.
Симптомы болезни Альцгеймера проявляются медленно, и первым симптомом может быть небольшая забывчатость. На этой стадии индивидуумы могут забывать недавние события, поступки, имена знакомых людей или названия предметов и могут быть не в состоянии решить простые математические задачи. По мере прогрессирования заболевания симптомы становятся более заметными и достаточно серьезными, чтобы больные БА или их родственники стали обращаться за медицинской помощью. На средней стадии БА к симптомам относятся утрата способности выполнять простые задачи, например, поддержание личной гигиены, и проблемы, связанные с речью, пониманием, чтением или письмом. Пациенты на последующей стадии БА могут пребывать в состоянии обеспокоенности или агрессии, могут уйти из дома, а также могут полностью нуждаться в уходе.
В настоящее время единственным точным способом диагностики БА является идентификация бляшек и сплетений в ткани мозга при аутопсии после смерти индивидуума. Следовательно, врачи могут диагностировать БА только «приблизительно» или «примерно» при жизни пациента. С помощью современных методов врачи могут с точностью диагностировать БА до 90% случаев, используя некоторые средства для диагностики «возможной» БА. Врачи проводят опрос об общем состоянии здоровья пациента, перенесенных заболеваниях, а также о появлении каких-либо осложнений в быту. Поведенческое тестирование памяти, решения задач, внимания, счета и речи дают информацию о когнитивном вырождении, а медицинские анализы, например, крови, мочи, спинномозговой жидкости и сканирование мозга, могут предоставить некоторую дополнительную информацию.
Поддержание состояния пациентов с БА заключается в медицинском и немедицинском уходе. Способы лечения, направленные на изменение течения болезни (откладывая или ревертируя ее прогрессирование) до настоящего времени почти совсем неэффективны. Было показано, что лекарственные средства, которые восстанавливают недостаточность (дефицит) или нарушенное действие химических посредников нервных клеток (нейротрансмиттеров), в частности ингибиторов холинэстеразы (cholinesterase inhibitor - ChEI), например, такрин и ривастигмин, проявляют улучшение симптомов. Ингибиторы ChEI препятствуют ферментативному разрушению нейротрансмитеров, тем самым, повышая содержание химических посредников, способных передавать нервный сигнал в мозг.
У некоторых людей на ранних и средних стадиях заболевания лекарственные средства такрин (продукт COGNEX®, Morris Plains, NJ), донепезил (продукт ARICEPT®, Токия, Япония), ривастигмин (продукт EXELON®, Восточный Гоновер, Нью-Джерси) или галантамин (продукт REMINYL®, Нью-Брунсвик, Нью-Джерси) могут помочь предупредить наихудшее проявление некоторых симптомов в течение ограниченного периода времени. Другое лекарственное средство, мемантин (продукт NAMENDA®, Нью-Йорк, Нью-Йорк), было одобрено для лечения БА, проявляющейся в формах от умеренных до тяжелых. Медикаментозные средства также применимы для лечения психиатрических проявлений БА. Кроме того, некоторые медикаментозные средства могут способствовать контролю поведенческих симптомов при БА, например, бессонницы, беспокойства, блуждания, состояния тревоги и депрессии. Лечение этих симптомов часто облегчает существование больных, делая его более комфортабельным, и облегчает уход за ними для персонала. К сожалению, несмотря на существенные преимущества лечения, показавшего, что агенты этого класса стабильно лучше плацебо, болезнь продолжает прогрессировать и обычное воздействие на ментальное функционирование проявляется умеренно. Многие лекарственные средства, используемые для лечения БА, например, ChEI, также обладают побочными эффектами, к которым относятся желудочно-кишечные расстройства, печеночная токсичность и потеря массы тела.
Другими заболеваниями, связанным или основанными на накоплении и отложении белка амилоидного типа, являются умеренное когнитивное нарушение (УКН), болезнь диффузных поражений телец Леви, амиотропный латеральный склероз (amyotropic lateral sclerosis - ALS), миозит с включенными тельцами (МВТ) и дегенерацию желтого пятна, в частности возрастную дегенерацию желтого пятна.
Предполагают, что отложение β-амилоида в энторинальной области коры головного мозга играет ключевую роль в развитии умеренного расстройства с когнитивным нарушением (mild cognitive impairment - MCI) у престарелых. Это согласуется с наблюдением, заключающемся в том, что уровни СМЖ-А Aβ(1-42) существенно снижаются, когда клиническое проявление симптомов БА становится очевидным. В отличие от СМЖ- Aβ(1-42), уровни СМЖ-тау существенно повышены на стадии MCI, и позднее эти величины продолжают повышаться, свидетельствую о том, что повышенные уровни СМЖ-тау могут помочь выявить субъектов с MCI, у которых прогнозируют развитие БА.
Болезнь диффузных поражений телец Леви является нейродегенеративным расстройством, которое может быть у людей старше 65 лет, при котором обычно проявляются симптомы когнитивного (умственного) ухудшения и нарушенного поведения. К симптомам могут относиться когнитивное ухудшение, нейрологические признаки, расстройство сна и недостаточность вегетативной нервной системы. Когнитивное ухудшение представляет симптом LBD в большинстве случаев. У пациентов повторяются приступы помрачения сознания, которые постепенно ухудшаются. Флуктуация когнитивной способности часто связана с изменением степеней проявления внимания и живости поведения. Когнитивное ухудшение и флюктуации мыслительной способности могут меняться на протяжении минут, часов или суток.
Тельца Леви формируются из фосфорилированных и нефосфорилированных нейрофиламентных белков; они содержат синаптический белок альфа-синуклеин, а также убиквитин, которые участвуют в элиминации поврежденных или аномальных белков. Помимо телец Леви также могут присутствовать нейриты Леви, которые являются тельцами-включениями в клеточные процессы нервных клеток. Амилоидные бляшки могут формироваться в мозге пациентов с болезнью диффузных поражений телец Леви, однако проявляется тенденция к уменьшению их числа по сравнению с пациентами с болезнью Альцгеймера. Нейрофибриллярные сплетения и другие микропатологические признаки БА не являются основными симптомами болезни диффузных поражений телец Леви, но они часто присутствуют наряду с амилоидными бляшками.
Амиотропный латеральный склероз (amyotropic lateral sclerosis - ALS) характеризуется дегенерацией нижних и верхних моторных нейронов. У некоторых пациентов с ALS может быть слабоумие или потеря речи (афазия) (ALS-D). Слабоумие в большинстве случаев является лобно-височным слабоумием (frontotemporal dementia - FTD), при этом у многих пациентов имеются убиквитин-положительные, тау-отрицательные включения в нейронах зубчатой извилины медиальной и нижней поверхности полушария большого мозга и поверхностные слои лобных и височных долей.
Миозит с включенными тельцами (МВТ) (Inclusion-body myositis - IBM) является травматическим заболеванием, обычно выявляемым у людей старше 50 лет, у которых в мышечных волокнах формируется воспаление и начинается атрофия, но у которых сохранен мозг и полностью сохранен интеллект. Установлено, что в большинстве случаев содержание двух ферментов, участвующих в выработке белка амилоида-В, повышено в мышечных клетках пациентов этого наиболее распространенного прогрессирующего мышечного заболевания пожилых людей, у которых содержание амилоида-В также повышено.
Другим заболеванием, основанным или связанным с накоплением и отложением белка типа амилоида, является дегенерация желтого пятна.
Дегенерация желтого пятна представляет распространенное заболевание, при котором происходит повреждение желтого пятна, являющегося центральной областью сетчатки (ткани, толщиной с лист бумаги в задней части глаза, из которой светочувствительные клетки посылают зрительные сигналы в мозг). Острое, четкое, «прямое» зрение перерабатывается желтым пятном. Повреждение желтого пятна приводит к развитию слепых пятен и расплывчатому или искаженному восприятию. Возрастная дегенерация желтого пятна (ВДЖП) представляет основную причину ухудшения зрения в США, а для людей старше 65 лет она представляет основную причину развития практической (гражданской) слепоты среди представителей европеоидной расы. Примерно 1,8 миллионов американцев в возрасте 40 лет и старше, имеющие продвинутую форму ВДЖП, и другие 7,3 миллионов американцев, имеющие промежуточную форму ВДЖП, подвержены значительному риску потери зрения. По оценке правительства к 2020 году у 2,9 миллионов людей будет продвинутая форма ВДЖП. Жертвы ВДЖП часто удивляются и расстраиваются, узнав, что о причинах слепоты и ее лечении известно слишком мало.
Имеется две формы дегенерации желтого пятна: сухая дегенерация желтого пятна и влажная дегенерация желтого пятна. Сухая форма, при которой клетки желтого пятна начинают медленно разрушаться, диагностируют в 85% случаев дегенерации желтого пятна. Оба глаза обычно поражены сухой формой ВДЖП, хотя один глаз может потерять зрение при сохранности второго глаза. Старческие бляшки, которые представляют желтые отложения под сетчаткой, обычно представляют ранние симптомы сухой формы ВДЖП. Риск развития продвинутой сухой формы ВДЖП или влажной формы ВДЖП повышается по мере увеличения числа или размера старческих бляшек. Сухая форма ВДЖП может прогрессировать и вызвать потерю зрения без перехода к влажной форме заболевания, однако также возможен для ранней стадии сухой формы ВДЖП внезапный переход во влажную форму.
Влажная форма, хотя она встречается только в 15% случаев, в 90% приводит к слепоте, и рассматривается в виде продвинутой формы ВДЖП (нет ранней или промежуточной стадии у влажной формы ВДЖП). Влажной форме ВДЖП всегда предшествует сухая форма заболевания. По мере ухудшения сухой формы у некоторых людей начинается патологический рост кровеносных сосудов за желтым пятном. Эти сосуды очень хрупкие, и могут быть кровотечения (отсюда «влажная» дегенерация желтого пятна), вызывающие быстрое разрушение желтого пятна.
Сухая форма ВДЖП может в начальной стадии часто вызывать слегка расплывчатое зрение. Центр изображения в частности затем может стать расплывчатым, и эта область разрастается по мере прогрессирования заболевания. Симптомы могут остаться незамеченными, если поражен только один глаз. При влажной форме ВДЖП прямые линии могут казаться волнистыми, а утрата центрального зрения может происходить быстро.
Диагностика дегенерации желтого пятна обычно включает расширенный анализ глаз, используя метод, называемый фундоскопией, который способствует диагностике ВДЖП, и, если предполагается влажная форма ВДЖП, также могут проводить флуоресцентную ангиографию. Если сухая форма ВДЖП достигает продвинутых стадий, в настоящее время нет лечения для предупреждения потери зрения. Однако специфические высокие дозы формулы антиоксидантов и цинка могут отсрочить или предупредить промежуточную стадию ВДЖП от прогрессирования до продвинутой стадии. Продукт Macugen® (инъекция пегаптаниба натрия), коагуляция лазером и фотодинамическая терапия могут контролировать патологический рост кровеносных сосудов и кровотечение в желтом пятне, что полезно для некоторых людей с влажной формой ВДЖП, однако, такими способами утраченное зрение восстановить нельзя. Если зрение уже утрачено, существует мало средств, которые могут помочь улучшить качество жизни.
Одним из ранних признаков возрастной дегенерации желтого пятна (ВДЖП) является накопление внеклеточных отложений, известных под названием «старческих бляшек», между базальным слоем пигментированного эпителия сетчатки (retinal pigmented epithelium - RPE) и базальной пластинки, также называемой оболочкой Бруха (Bruch's membrane - ВМ). Предшествующие исследования, выполненные Anderson и др., подтвердили, что старческие бляшки содержат амилоид бета (Experimental Eye Research 78, 2004, cc.243-256).
Современные исследования продолжают исследовать факторы внешней среды, генетические факторы и факторы питания, которые могут содействовать ВДЖП. Также исследуются новые стратегии лечения, включая трансплантаты клеток сетчатки, лекарственные средства, которые могут предупредить или понизить прогрессирование заболевания, радиационную терапию, генную терапию, имплантацию компьютерного чипа в сетчатку, которые могут помочь стимулировать зрение, и агенты, которые могут предупредить рост новых кровеносных сосудов под желтым пятном.
Важным фактором, который рассматривают при разработке новых лекарственных средств, является легкость применения пациентами, для которых они предназначены. Средства доставки пероральных лекарственных средств, особенно таблетки, капсулы и мази, составляют до 70% от всех потребляемых лекарственных форм, поскольку они удобнее для пациентов. Разработчики лекарственных средств полагают, что пациенты предпочитают пероральное введение в большей степени, чем инъекции или другие более инвазивные формы медикаментозного введения. Также предпочтительны составы, с увеличенными интервалами дозирования (т.е. раз в сутки или составы устойчивого высвобождения). Простота введения антибиотиков в пероральной лекарственной форме приводит к повышению соблюдения пациентом режима и схемы лечения.
Необходимы эффективные способы и композиции для выработки высокоспецифических и высокоэффективных антител, если антитела предусмотрены в пероральной дозированной форме. Предпочтительно такие антитела могут распознавать специфические эпитопы на различных антигенах, например, на амилоидном белке.
Следовательно, необходимы эффективные способы и композиции для предупреждения или выявления осложнений, связанных с заболеваниями или расстройствами у субъектов, нуждающихся в этом, которые вызваны или связаны с амилоидом или белками типа амилоида, включая амилоидоз - группу заболеваний и расстройств, связанных с формированием амилоидных бляшек, включая вторичный амилоидоз и возрастной амилоидоз, включая, но ими не ограничиваясь, неврологические расстройства, например, болезнь Альцгеймера (БА), болезнь диффузных поражений телец Леви, синдром Дауна, наследственное цереброспинальное кровоизлияние с амилоидозом (типа Dutch), комплекс паркинсонизм-деменция о. Гуам, а также другие заболевания, которые основаны или связаны с белками амилоидного типа, например, прогрессирующий супрануклеарный паралич, рассеянный склероз, болезнь Крейсфельда-Якоба, болезнь Паркинсона, слабоумие, связанное со СПИД, амиотропный латеральный склероз (amyotropic lateral sclerosis - ALS), диабет взрослых, старческий кардиальный амилоидоз, эндокринные опухоли и другие, включая дегенерацию желтого пятна. В частности необходимы агенты, способные противодействовать физиологическим проявлениям заболевания, например, формированию бляшек, ассоциированных с агрегированием волокон амилоида или амилоидоподобного пептида.
Сообщалось, что антиамилоидные антитела, возникшие в результате инокуляции амилоидом Aβ1-42, смешанным с полным или неполным адъювантом Фройнда, снижают амилоидную нагрузку у трансгенных мышей, связанную с болезнью Альцгеймера человека (Schenk и др., 1999).
Внутрибрюшинное введение тетрапальмитоилированного Aβ1-16, помещенного в липосомы, трансгенным мышам NORBA, высвобождает существенные титры антиамилоидных антител, о которых сообщалось, что они растворяют амилоидные волокна и бляшки in vitro и in vivo (Nicolau и др., 2002).
Возможный механизм, с помощью которого происходит растворение амилоидных бляшек и волокон, впервые был предложен Bard и др. (2000), которые заключили, что опсонизированные антителами бляшки были последовательно разрушены макрофагами микроглии. De Mattos и др. (2001) установили, что моноклональное антитело (MAb), направленное против центрального домена β-амилоида, способно связывать и полностью изолировать амилоид плазмы. Они пришли к заключению, что наличие моноклональных антител в кровеносном русле смещает баланс Aβ между мозгом и плазмой, способствую периферическому очищению и катаболизму вместо отложения в мозге.
Настоящее изобретение предусматривает новые способы и композиции, включающие высоко специфичные и высоко эффективные антитела, способные специфически распознавать и связывать специфические β-амилоидные белки.
Антитела по настоящему изобретению особенно применимы для лечения заболеваний и расстройств у субъектов, нуждающихся в этом, которые вызваны или связаны с амилоидом или белками типа амилоида, в том числе амилоидоза - группы заболеваний и расстройств, связанных с формированием амилоидных бляшек, включая вторичный амилоидоз и возрастной амилоидоз, включая, но ими не ограничиваясь, неврологические расстройства, например, болезнь Альцгеймера (БА), включая заболевания или состояния, отличающиеся утратой когнитивного объема памяти, например, миозит с включенными тельцами (МВТ), болезнь диффузных поражений телец Леви, синдром Дауна, наследственное цереброспинальное кровоизлияние с амилоидозом (типа Dutch), комплекс паркинсонизм-деменция о. Гуам, а также другие заболевания, которые основаны или связаны с белками амилоидного типа, например, прогрессирующий супрануклеарный паралич, рассеянный склероз, болезнь Крейсфельда-Якоба, наследственное цереброспинальное кровоизлияние с амилоидозом (типа Dutch), болезнь Паркинсона, слабоумие, связанное со СПИД, амиотропный латеральный склероз (amyotropic lateral sclerosis - ALS), миозит с включенными тельцами (МВТ), диабет взрослых, старческий кардиальный амилоидоз, эндокринные опухоли и другие, включая дегенерацию желтого пятна, а также многие другие.
Кроме того, настоящее изобретение предусматривает новые способы и композиции для удержания или повышения когнитивного объема памяти у млекопитающих со связанным с амилоидом заболеванием или состоянием, включающие введение субъекту, особенно млекопитающему, особенно человеку, нуждающемуся в таком лечении, терапевтически эффективное количество моноклонального антитела по настоящему изобретению.
Краткое описание изобретения
Настоящее изобретение относится к применению презентации антигена, которая приводит к повышенной экспозиции и стабилизации предпочтительной конформации антигена, которая в конечной счете приводит к антителам с уникальными свойствами.
В одном из вариантов осуществления настоящее изобретение предусматривает антитело, в том числе какое-либо функционально эквивалентное антитело или его функциональные фрагменты, или, более предпочтительно, моноклональное антитело, в том числе какое-либо функционально эквивалентное антитело или его функциональные части, которые возникают против надмолекулярной антигенной конструкции, включая антигенный пептид, соответствующий аминокислотной последовательности β-амилоидного пептида, особенно его выбранного фрагмента, модифицированного гидрофильной частью молекулы, например, полиэтиленгликолем (ПЭГ), или, в другом случае, гидрофобной частью молекулы, например, пальмитиновой кислотой, причем указанная гидрофильная или гидрофобная часть молекулы ковалентно связана с каждым из концов антигенного пептида через, по меньшей мере, одну, по меньшей мере одну или две аминокислоты, например, лизин, глутаминовую кислоту и цистеин, или какую-либо другую соответствующую аминокислоту или аналог аминокислоты, которые способны быть связующим механизмом для соединения гидрофильного и гидрофобного фрагментов пептидного фрагмента.
При использовании гидрофильной части молекулы, например, ПЭГ, выбранный фрагмент β-амилоидного пептида может быть фрагментом, соответствующим аминокислотной последовательности Aβ22-35 и Аβ29-40, соответственно, и свободные от ПЭГ концы могут быть ковалентно связаны с фосфатидилэтаноломамином или каким-либо другим соединением, пригодным для действия в качестве элемента заякоривания, например, к погруженной антигенной конструкции в двухслойной липосомы.
При использовании гидрофобной части молекулы, например, пальмитиновой кислоты, выбранный фрагмент β-амилоидного пептида может быть фрагментом, соответствующим аминокислотной последовательности Aβ1-15, и такая гидрофобная часть может непосредственно действовать в качестве элемента заякоривания, например, к погруженной антигенной конструкции в двухслойной липосомы.
В одном из вариантов осуществления настоящего изобретения предусмотрено антитело, предпочтительно моноклональное антитело, включая какое-либо функционально эквивалентное антитело или его функциональные части, причем указанное антитело распознает и связывается с конформационным эпитопом и связывается с полимерным растворимым амилоидом, и с амилоидными фибриллами или волокнами, соответственно, особенно с полимерными растворимыми Aβ пептидами и амилоидными Aβ фибриллами или волокнами, соответственно.
В одном из вариантов осуществления настоящего изобретения предусмотрено антитело, предпочтительно моноклональное антитело, включая какое-либо функционально эквивалентное антитело или его функциональные части, причем указанное антитело распознает и связывается с конформационным эпитопом, предпочтительно представленным на полимерном растворимом амилоиде и олигомерных амилоидных пептидах, соответственно, на полимерных растворимых амилоидных Aβ пептидах и олигомерных амилоидных Aβ пептидах, включая множество мономерных Aβ 1-42 пептидов, соответственно.
В одном из вариантов осуществления настоящего изобретения предусмотрено антитело, предпочтительно моноклональное антитело, включая какое-либо функционально эквивалентное антитело или его функциональные части, причем указанное антитело распознает и связывается с конформационным эпитопом, предпочтительно представленным на полимерном растворимом амилоиде и олигомерных амилоидных пептидах, соответственно, а также на амилоидных волокнах или фибриллах, особенно на полимерных растворимых амилоидных Aβ пептидах и олигомерных амилоидных Аβ пептидах, включая множество мономерных Aβ 1-42 пептидов и амилоидные фибриллы и волокна, включая множество указанных олигомерных пептидов, соответственно.
В одном из вариантов осуществления настоящего изобретения предусмотрено антитело, особенно моноклональное антитело, включая какое-либо функционально эквивалентное антитело или его функциональные части, которое распознает и связывается с конформационным эпитопом, предпочтительно представленным на полимерных растворимых амилоидных и олигомерных амилоидных пептидах, соответственно, но также на амилоидных фибриллах или волокнах, особенно на полимерных растворимых амилоидных Aβ пептидах и олигомерных амидоидных Aβ пептидах, включая множество мономерных Aβ 1-42 пептидов, и на амилоидных фибриллах и волокнах, включающих множество указанных олигомерных пептидов, соответственно.
Наследование аллеля ε4 белка аполипопротеина Е (ароЕ4) является важным генетическим фактором риска при БА. Этот белок способен связывать амилоид и известно, что он участвует и в клиренсе Aβ через гематоэнцефалитный барьер, и в индукции отложения Aβ. Напротив, связывание амилоидных участков в гидрофобной липопротеин-связывающей области ApoE и эта связь резко снижает среднюю связывающую липид способность ApoE.
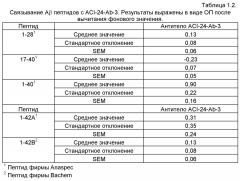
Таким образом, еще одним вариантом осуществления настоящего изобретения по получению антитела, особенно моноклонального антитела, включая какое-либо функционально эквивалентное антитело или его функциональные части, согласно описанному в настоящем изобретении, является антитело, способное ингибировать или в другом варианте уменьшать взаимодействие амилоида с ApoE4 в мозге субъекта, особенно млекопитающего, особенно человека, особенно в мозге субъекта, особенно млекопитающего, но особенно человека с заболеванием или состоянием, связанным с повышенной концентрацией Aβ в мозге. Антитело по настоящему изобретению, особенно моноклональное антитело, включая какое-либо функционально эквивалентное антитело или его функциональные части, таким образом, предпочтительно связывается с полимерными растворимыми амилоидными и олигомерными амилоидными пептидами, соответственно, особенно с растворимыми полимерными Aβ пептидами и олигомерными Aβ пептидами, включая множество Aβ 1-42 мономерных пептидов, соответственно. В одном из вариантов осуществления настоящее изобретение относится к антителу, описанному в настоящем изобретении, особенно моноклональному антителу, включая какое-либо функционально эквивалентное антитело или его функциональные части, которое связывается с Aβ мономерными пептидами, имеющими по меньшей мере 30, предпочтительно по меньшей мере 35, более предпочтительно по меньшей мере 38, еще более предпочтительно по меньшей мере 40 аминокислотных остатков, но практически не связываются с Aβ мономерными пептидами, имеющими менее 30 остатков, предпочтительно пептидами, имеющими менее 20 остатков, более предпочтительно пептидами, имеющими менее 10 остатков, но особенно пептидов, имеющих 8 и менее остатков.
В одном из вариантов осуществления настоящее изобретение относится к антителу, описанному в настоящем изобретении, особенно моноклональному антителу, включая какое-либо функционально эквивалентное антитело или его функциональные части, причем антитело связывается с Aβ мономерными пептидами, имеющими по меньшей мере 30, предпочтительно по меньшей мере 35, более предпочтительно по меньшей мере 38, еще более предпочтительно по меньшей мере 40 аминокислотных остатков, предпочтительно с мономерным Aβ пептидом 1-40 и растворимым полимерным и/или олигомерным пептидом, включающим множество Aβ 1-42 мономерных пептидов, но практически не проявляет связывания с Aβ мономерными пептидами 17-40.
В другом варианте осуществления настоящего изобретения предусмотрено антитело, описанное в настоящем изобретении, особенно моноклональное антитело, включая какое-либо функционально эквивалентное антитело или его функциональные части, причем антитело связывается с Aβ мономерным пептидом 1-40, особенно с Aβ мономерным пептидом 1-40 и с растворимым полимерным и/или олигомерным амилоидным пептидом, включая множество Aβ 1-42 мономерных пептидов, но существенно слабее связывается с Aβ мономерным пептидом 1-28.
В другом варианте осуществления настоящего изобретения предусмотрено антитело, описанное в настоящем изобретении, особенно моноклональное антитело, включая какое-либо функционально эквивалентное антитело или его функциональные части, причем антитело связывается с Aβ мономерным пептидом 1-40, особенно с Aβ мономерным пептидом 1-40 и с растворимым полимерным и/или олигомерным амилоидным пептидом, включая множество Aβ 1-42 мономерных пептидов, но проявляет промежуточное связывание с Aβ мономерным пептидом 1-42.
В другом варианте осуществления настоящего изобретения предусмотрено антитело, описанное в настоящем изобретении, особенно моноклональное антитело, включая какое-либо функционально эквивалентное антитело или его функциональные части, причем антитело связывается с Aβ мономерным пептидом 1-40, особенно с Aβ мономерным пептидом 1-40 и с растворимым полимерным и/или олигомерным амилоидным пептидом, включая множество Aβ 1-42 мономерных пептидов, но существенно слабее связывается с Aβ мономерным пептидом 1-28 и проявляет промежуточное связывание с мономерным пептидом 1-42.
В другом варианте осуществления настоящего изобретения предусмотрено антитело, описанное в настоящем изобретении, особенно моноклональное антитело, включая какое-либо функционально эквивалентное антитело или его функциональные части, причем антитело связывается с Aβ мономерным пептидом 1-40, особенно с Aβ мономерным пептидом 1-40 и с растворимым полимерным и/или олигомерным амилоидным пептидом, включая множество Aβ 1-42 мономерных пептидов, но существенно слабее связывается с Aβ мономерным пептидом 1-28, и практически не связывается с Aβ мономерным пептидом 17-40.
В другом варианте осуществления настоящего изобретения предусмотрено антитело, описанное в настоящем изобретении, особенно моноклональное антитело, включая какое-либо функционально эквивалентное антитело или его функциональные части, причем антитело связывается с Aβ мономерным пептидом 1-40, особенно с Aβ мономерным пептидом 1-40 и с растворимым полимерным и/или олигомерным амилоидным пептидом, включая множество Aβ 1-42 мономерных пептидов, но проявляет промежуточное связывание с Aβ мономерным пептидом 1-42, и практически не связывается с Aβ мономерным пептидом 17-40.
В другом варианте осуществления настоящего изобретения предусмотрено антитело, описанное в настоящем изобретении, особенно моноклональное антитело, включая какое-либо функционально эквивалентное антитело или его функциональные части, причем антитело связывается с Aβ мономерным пептидом 1-40, особенно с Aβ мономерным пептидом 1-40 и с растворимым полимерным и/или олигомерным амилоидным пептидом, включая множество Aβ 1-42 мономерных пептидов, но существенно слабее связывается с Aβ мономерным пептидом 1-28, проявляет промежуточное связывание с мономерным пептидом 1-42 и практически не связывается с Aβ мономерным пептидом 17-40.
В одном из вариантов осуществления настоящего изобретения антитело по настоящему изобретению, описанное в нем, при совместном инкубировании с Aβ мономерным пептидом в мономерной и/или олигомерной форме, имеющим по меньшей мере 30, предпочтительно по меньшей мере 35, более предпочтительно по меньшей мере 38, еще более предпочтительно по меньшей мере 40 аминокислотных остатков в мономерной и/или олигомерной форме, но особенно с Aβ1-42 мономерным пептидом и/или олигомерным пептидом, включающим множество указанных Aβ1-42 мономерных пептидов, особенно в соотношении мольных концентраций антитела к Aβ1-42 до 1:1000, но особенно в соотношении мольных концентраций от 1:10 до 1:100, ингибирует агрегирование Aβ мономеров и/или олигомеров в высокомолекулярные полимерные фибриллы.
Предпочтительно совместное инкубирование антитела по настоящему изобретению с амилоидными мономерными и/или олигомерными пептидами проводят в течение 24-60 ч, особенно в течение 30-50 ч, более предпочтительно в течение 48 ч при температуре от 28°С до 40°С, особенно от 32°С до 38°С, более предпочтительно при 37°С.
В одном из вариантов осуществления настоящего изобретения совместное инкубирование с амилоидными мономерными и/или олигомерными пептидами проводят в течение 48 ч при температуре 37°С.
В частности антитело, особенно моноклональное антитело по настоящему изобретению, включая какое-либо функционально эквивалентное антите