Улучшенная очистка белка посредством модифицированного элюирования белка а
Иллюстрации
Показать всеИзобретение относится к биотехнологии, а именно к способу очистки полипептида, содержащего Сн2/Сн3-область. Способ включает связывание полипептида с белком А и элюирование полипептида с градиентом pH, начинающимся с 5,0 или менее, с использованием элюирующего буфера, причем элюирующий буфер включает буфер с высоким pH и буфер с низким pH, а градиент pH образуется в результате регулирования процентного содержания каждого pH-буфера в элюирующем буфере. Буфер с высоким pH имеет pH примерно 5,0. Буфер с низким pH имеет pH примерно 2,7. Изобретение позволяет отделить агрегат, примесь из клеток-хозяев, загрязнение вирусного фильтра, вирусную частицу или вирусоподобную частицу от требуемого полипептида. 20 з.п. ф-лы, 21 ил., 8 табл., 11 пр.
Реферат
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Данная заявка имеет приоритет по предварительной патентной заявке США № 61/238867, поданной 1-го сентября 2009 г., и по предварительной патентной заявке США № 61/253438, поданной 20-го октября 2009 г., полное описание которых включено в настоящий документ путем ссылки.
ОБЛАСТЬ ТЕХНИКИ
Область данного изобретения в общем относится к способам очистки полипептида, содержащего СН2/СН3-область, включающим связывание полипептида с белком А и элюирование градиентом рН.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Крупномасштабная экономичная очистка белков представляет собой растущую проблему в биотехнологической промышленности. Обычно, белки продуцируют в культурах клеток с использованием либо линий клеток млекопитающих, либо бактериальных клеточных линий, модифицированных методами генной инженерии для продукции целевого белка в результате введения рекомбинатной плазмиды, содержащей ген этого белка. Поскольку используемые клеточные линии представляют собой живые организмы, они должны получать питание из комплексной ростовой среды, содержащей сахара, аминокислоты и ростовые факторы, обычно с добавленными препаратами животной сыворотки. Выделение целевого белка из смеси соединений, используемых для питания клеток, и из побочных продуктов самих клеток до чистоты, достаточной для его использования в качестве терапевтического средства для применения у человека, представляет огромную проблему.
Методики очистки белков из клеточного дебриса исходно зависят от места экспрессии белка. Для некоторых белков можно вызывать их секрецию напрямую из клетки в окружающую ростовую среду; другие синтезируются внутри клетки. В последнем случае, первая стадия способа очистки включает лизис клетки, который можно осуществить рядом способов, включая механическое воздействие, осмотический шок или обработку ферментами. Такое разрушение высвобождает все содержимое клетки в гомогенат и, кроме того, генерирует субклеточные фрагменты, которые сложно удалить вследствие их малого размера. Их обычно удаляют дифференциальным центрифугированием или с помощью фильтрации. Такая же проблема возникает, хотя и в меньшей степени, с секретируемыми напрямую белками вследствие естественной гибели клеток и высвобождения внутриклеточных белков клеток-хозяев в течение процесса продукции белка.
После получения осветленного раствора, содержащего целевой белок, его выделение из других белков, продуцируемых клеткой, обычно пытаются осуществить, используя комбинацию разных хроматографических методик. Для некоторых белков (например, белков для использования в качестве терапевтических средств для применения у людей) обычно используют аффинную хроматографию, в которой задействовано специфичное взаимодействие между очищаемым белком и иммобилизованным захватывающим агентом. Белок А представляет собой адсорбент, пригодный для аффинной хроматографии белков, таких как антитела, которые содержат Fc-область. Белок А представляет собой белок (41 кДа) клеточной стенки Staphylococcus aureas, который связывается с высокой аффинностью (примерно, 10-8 M для IgG человека) с Fc-областью антител. Однако вследствие того, что белки имеют тенденцию к агрегации или некорректному фолдингу, целевой белок (то есть мономер) часто элюируется с таких аффинных колонок вместе с другими примесями, такими как белковые агрегаты, побочные продукты жизнедеятельности самих клеток (то есть, примеси из клеток-хозяев) или загрязнение вирусного фильтра.
Для дополнительного разделения этих примесей и смесей белков на основе их заряда, степени гидрофобности или размера, были разработаны другие методики, такие как ионообменная хроматография, гидрофобная хроматография или эксклюзионная хроматография. Для каждой из этих методик доступны несколько разных хроматографических смол или сорбентов, что позволяет точно подобрать схему очистки для конкретного белка. Основой каждого из этих способов выделения является то, что белки можно заставить либо двигаться с различной скоростью по длинной твердой фазе (например, колонке), достигая физического разделения, которое увеличивается по мере дальнейшего продвижения белков по твердой фазе, либо селективно связываться с разделяющей средой с последующим дифференциальным элюированием разными растворителями. Однако каждый из этих способов требует дополнительных буферов, смол или сорбентов, а также других ресурсов для дополнительной очистки, что, в свою очередь, приводит к более длительному времени обработки и более высокой стоимости. Поэтому, необходимы более эффективные и экономичные способы очистки белковых мономеров.
Способы очистки полипептидов из агрегатов, мультимеров и модифицированных белков с использованием колонки с белком А и элюирования градиентом рН были описаны в патентной заявке США № 12/008,160.
Все публикации, патенты и патентные заявки, цитируемые в настоящем документе, таким образом полностью включены в него путем ссылки для всех целей в такой же степени, как если бы каждая индивидуальная публикация, каждый индивидуальный патент и каждая индивидуальная патентная заявка были бы специально и индивидуально указаны включенными путем ссылки.
КРАТКОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к способам очистки полипептида, содержащего СН2/СН3-область, в результате связывания полипептида с белком А и элюирования с градиентом рН, начинающимся с низкого рН. Эти способы очистки обеспечивают преимущество достижения лучшего последовательного отделения полипептидов или не-агрегатов от различных примесей, включая примеси из клеток-хозяев, загрязнение вирусного фильтра, вирусные или вирусоподобные частицы, основные варианты полипептида и агрегаты полипептидного мономера, а также обеспечивают более высокую чистоту целевых полипептидных мономеров в очищенной фракции/пуле. Данные способы можно осуществлять с использованием различных хроматографических смол и хроматографических сорбентов с белком А. Эти способы также можно использовать в промышленном или коммерческом процессе, они могут способствовать использованию альтернативных последующих методик очистки помимо колоночной хроматографии.
В одном аспекте изобретение относится к способу очистки полипептида, содержащего СН2/СН3-область, включающему связывание с белком А и элюирование градиентом рН, начинающимся с 5,0 или менее.
В другом аспекте изобретение относится к способу очистки полипептида, содержащего СН2/СН3-область, включающему стадии: (а) связывания полипептида с белком А; и (b) элюирования полипептида градиентом рН, начинающимся с 5,0 или менее, с использованием элюирующего буфера, причем элюирующий буфер включает буфер с высоким рН и буфер с низким рН, а градиент рН образуется в результате регулирования процентного содержания каждого рН-буфера в элюирующем буфере.
В некоторых вариантах осуществления изобретения градиент рН начинается примерно с рН 4,2. В других вариантах осуществления изобретения градиент рН начинается примерно с рН 4,3. В некоторых вариантах осуществления изобретения градиент рН начинается примерно с рН 4,6. В некоторых вариантах осуществления изобретения градиент рН заканчивается на рН 3,0 или более высоком значении. В некоторых вариантах осуществления изобретения градиент рН заканчивается примерно на рН 3,7.
В некоторых вариантах осуществления изобретения буфер с высоким рН имеет значение примерно рН 5,0, причем буфер с низким рН имеет рН примерно 2,7.
В некоторых вариантах осуществления изобретения процентное содержание буфера с низким рН начинается примерно с 35%. В некоторых вариантах осуществления изобретения элюирующий буфер, содержащий примерно 35% буфера с низким рН, включает примерно 16,25 мМ ацетат и примерно 8,25 мМ формиат. В других вариантах осуществления изобретения процентное содержание буфера с низким рН начинается примерно с 25%. В некоторых вариантах осуществления изобретения элюирующий буфер, содержащий примерно 25% буфера с низким рН, включает примерно 18,75 мМ ацетат и примерно 6,25 мМ формиат. В некоторых вариантах осуществления изобретения процентное содержание буфера с низким рН начинается примерно с 40%. В некоторых вариантах осуществления изобретения элюирующий буфер, содержащий примерно 40% буфера с низким рН, включает примерно 15 мМ ацетат и примерно 10 мМ формиат.
В некоторых вариантах осуществления изобретения полипептид наносят с плотностью нагрузки, начинающейся примерно с 14 г/л. В некоторых вариантах осуществления изобретения полипептид наносят с плотностью нагрузки в диапазоне от примерно 14 г/л до примерно 45 г/л.
В некоторых вариантах осуществления изобретения белок А представляет собой смолу с белком А для колоночной хроматографии или хроматографический сорбент с белком А. В некоторых вариантах осуществления хроматографический сорбент с белком А представляет собой мембрану или монолит.
В некоторых вариантах осуществления изобретения белок А представляет собой смолу с белком А для колоночной хроматографии, причем скорость потока для элюирования полипептида варьирует от примерно 5 объемов колонки в час до примерно 25 объемов колонки в час.
В некоторых вариантах осуществления изобретения белок А представляет собой смолу с белком А для колоночной хроматографии, причем очищенная фракция полипептида содержит около или меньше примерно 12 объемов колонки с белком А.
В некоторых вариантах осуществления изобретения примеси из клеток-хозяев отделены от полипептида. В некоторых вариантах осуществления изобретения примеси из клеток-хозяев представляют собой белки клеток яичника китайского хомячка (СНОР).
В некоторых вариантах осуществления изобретения агрегат отделен от полипептида. В других вариантах осуществления изобретения загрязнение вирусного фильтра отделено от полипептида.
В некоторых вариантах осуществления изобретения вирусные частицы или вирусоподобные частицы отделены от полипептида. В некоторых вариантах осуществления изобретения основный вариант полипептида отделен от полипептида.
В некоторых вариантах осуществления изобретения СН2/СН3-область содержит Fc-область иммуноглобулина.
В некоторых вариантах осуществления изобретения полипептид представляет собой антитело. В некоторых вариантах осуществления изобретения антитело является моноклональным антителом, поликлональным антителом, полиспецифичным антителом или фрагментом антитела.
В других вариантах осуществления изобретения полипептид является иммуноадгезином.
В некоторых вариантах осуществления изобретения полипептид имеет чистоту по меньшей мере примерно 98% мономера. В других вариантах осуществления изобретения полипептид имеет чистоту по меньшей мере примерно 99% мономера.
В некоторых вариантах осуществления настоящего изобретения соотношение примесей из клеток-хозяев и очищенного полипептида по меньшей мере примерно на 75% ниже, примерно на 80% ниже, примерно на 85% ниже, примерно на 90% ниже, примерно на 95% ниже, примерно на 96% ниже, примерно на 97% ниже, примерно на 98% ниже или примерно на 99% ниже соотношения в неочищенном полипептиде.
В некоторых вариантах осуществления изобретения соотношение примесей из клеток-хозяев и очищенного полипептида по меньшей мере примерно на 20% ниже соотношения в полипептиде, очищенном способом с использованием ступенчатого элюирования, причем способ с использованием ступенчатого элюирования включает связывание полипептида с белком А и элюирование рН, начиная с рН 3,6 или менее. В некоторых вариантах осуществления изобретения соотношение примесей из клеток-хозяев и очищенного полипептида по меньшей мере примерно на 60% ниже соотношения в полипептиде, очищенном способом с использованием ступенчатого элюирования, причем способ с использованием ступенчатого элюирования включает связывание полипептида с белком А и элюирование рН, начиная с рН 3,6 или менее.
В некоторых вариантах осуществления изобретения очищенный полипептид имеет содержание вирусных или вирусоподобных частиц меньше примерно 15000 частиц/мл. В некоторых вариантах осуществления изобретения очищенный полипептид имеет содержание вирусных или вирусоподобных частиц меньше примерно 12500 частиц/мл, меньше примерно 10000 частиц/мл, меньше примерно 7500 частиц/мл, меньше примерно 5000 частиц/мл, меньше примерно 2500 частиц/мл, меньше примерно 1500 частиц/мл, меньше примерно 1000 частиц/мл, меньше примерно 750 частиц/мл, меньше примерно 500 частиц/мл, меньше примерно 250 частиц/мл, меньше примерно 100 частиц/мл или меньше примерно 50 частиц/мл. В некоторых вариантах осуществления изобретения вирусоподобная частица является ретровирусоподобной частицей.
В некоторых вариантах осуществления изобретения очищенный полипептид имеет степень очистки от вирусных или вирусоподобных частиц по меньшей мере примерно 4 LRV (число порядков снижения количества вируса). В некоторых вариантах осуществления изобретения очищенный полипептид имеет степень очистки от вирусных или вирусоподобных частиц в диапазоне от примерно 4 LRV до примерно 8 LRV. В некоторых вариантах осуществления изобретения очищенный полипептид имеет степень очистки от вирусных или вирусоподобных частиц в диапазоне от примерно 4 LRV до примерно 7 LRV. В некоторых вариантах осуществления изобретения очищенный полипептид имеет степень очистки от вирусных или вирусоподобных частиц примерно 5 LRV, примерно 6 LRV, примерно 7 LRV или примерно 8 LRV. В некоторых вариантах осуществления изобретения вирусоподобная частица является ретровирусоподобной частицей.
В некоторых вариантах осуществления изобретения очищенный полипептид является мономером полипептида.
В некоторых вариантах осуществления изобретения белок А представляет собой модифицированный или немодифицированный белок А-лиганд.
В некоторых вариантах осуществления изобретения очистка является промышленным способом.
В некоторых вариантах осуществления любого из аспектов изобретения способ очистки дополнительно включает при очистке полипептида проведение стадии фильтрации вирусов или стадии ионообменной хроматографии. В некоторых вариантах осуществления изобретения стадию ионообменной хроматографии проводят после стадии очистки.
В некоторых вариантах осуществления любого из аспектов изобретения способ очистки не включает дополнительную стадию удаления агрегатов.
В некоторых вариантах осуществления любого из аспектов изобретения способ очистки не включает дополнительную стадию удаления загрязнения вирусного фильтра.
В некоторых вариантах осуществления любого из аспектов изобретения способ очистки не включает дополнительную стадию удаления основного варианта полипептида. В некоторых вариантах осуществления любого из аспектов изобретения способ очистки не включает дополнительную стадию удаления кислотного варианта полипептида.
В другом аспекте изобретение относится к полипептидному продукту, очищенному описанными в настоящем документе способами.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг.1 показана хроматограмма ступенчатого градиента рН: по оси х отложен объем в мл от начала элюирования с белка А, а по оси y отложено поглощение (mAU). Также показана отличительная форма кривой УФ-поглощения при 280 нм при элюировании ступенчатым градиентом - большой пик в начале элюирования, затем снижающийся до постоянной высоты и убывающий по мере снижения рН.
На фиг.2 показаны результаты SEC (эксклюзионной хроматографии) фракций анти-VEGF антитела №1. По оси Х отложено время удерживания на SEC-колонке (мин), а на оси Y отложено нормализованное поглощение в УФ (mAU). По мере увеличения номера фракции (то есть, снижения рН по мере прохождения градиентного элюирования) также увеличиваются пики HMWS (высокомолекулярных соединений) и димеров (время удерживания около 12,5 минут и 13,5 минут, соответственно), в то время как пик мономера уменьшается (время удерживания 16 минут). Количественную оценку результатов, полученных из этих кривых, проводили с помощью интегрирования всех пиков (например, HMWS, димера и мономера), сравнивая отдельные относительные площади пиков в виде процентов (например, общую площадь устанавливали как 100%, а профиль интегрирования пиков SEC-кривой (далее профиль SEC-интегрирования) выражали в процентах, как, например, «31% HMWS, 36% димера и 33% мономера»).
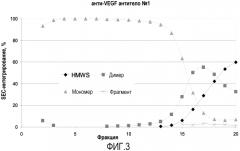
На фиг.3 показан график результатов SEC-интегрирования для анти-VEGF антитела №1. На этом графике показано, что для первых девяти элюированных фракций уровень мономера высокий, причем в четырех фракциях он составляет 100%, а уровень димера и HMWS достигает пика позднее в процессе элюирования. Данные результаты демонстрируют, что ступенчатый градиент рН отделяет агрегаты от мономера анти-VEGF антитела №1.
На фиг.4А показан профиль SEC-интегрирования для ряда белковых молекул (анти-CD20 антитела, анти-VEGF антитела №2, анти-MUC16 антитела и анти-CD4 антитела). С помощью ступенчатого градиента рН мономеры были успешно отделены от агрегатов для анти-CD20 антитела, анти-VEGF антитела №2, анти-MUC16 антитела и анти-CD4 антитела.
На фиг.4В показан профиль SEC-интегрирования для негликозилированного анти-Met антитела с одним антиген-связывающим участком, продуцируемого ферментацией бактериальных клеток-хозяев (E. coli). С помощью ступенчатого градиента рН мономеры были успешно отделены от агрегатов для негликозилированного анти-Met антитела с одним антиген-связывающим участком.
На фиг.5 показано параллельное сравнение между стандартным ступенчатым элюированием (контроль; элюирование белков при рН 3,6 или менее без градиента рН) и элюированием ступенчатым градиентом рН анти-CD20 антитела. График элюирования анти-CD20 антитела и СНОР на левой панели показывает уровень СНОР на фракцию в ppm (частей на миллион; показатель, используемый для стандартизации измерения примесей на количество продукта). График элюирования анти-CD20 антитела и агрегатов на правой панели показывает значения интегрирования пиков SEC-кривых на фракцию в течение градиентного элюирования. Вертикальные линии на левой и правой панелях представляют собой символическое объединение содержащихся фракций, в результате которого был бы получен пул элюирования градиентом рН с характеристиками, показанными в таблице внизу слайда.
На фиг.6 показано отделение СНОР от анти-VEGF антитела №1. Уровень СНОР на фракцию выражен в ppm или нг/мл.
На фиг.7 показано отделение СНОР от анти-MUC16 антитела. Уровень СНОР на фракцию выражен в ppm или нг/мл.
Фиг.8 представляет собой наложение хроматограмм на смолах с белком А: MABSELECT™, MABSELECT SURE™, PROSEP® Va, PROSEP® Ultra Plus и POROS® MABCAPTURE™ A.
Фиг.9 представляет собой график Парето, показывающий, что стартовый % В (стартовое значение рН и наклон градиента элюирования) является наиболее важным параметром в определении эффективности отделения агрегатов, за которым следуют плотность нагрузки и время удерживания.
Фиг.10 представляет собой профиль взаимодействия для параметров стартового % В, плотности нагрузки и стартового % В, общей продолжительности элюирования и времени удерживания.
Фиг.11 представляет собой пример элюирования ступенчатым градиентом рН в производственном масштабе.
На фиг.12 показаны результаты исследования по применению ионообменных мембран после элюирования с белка А, в котором использовали два размера катионообменной мембраны и три размера анионообменной мембраны. Мембраны Coin и Nano, обе представляют собой производственный тип в отношении числа слоев мембраны, в то время как мембраны ACRODISC® имеют меньшее число слоев, но являются типичными используемыми лабораторными моделями.
На фиг.13 показан результат сравнения SEC-интегрирования между очисткой на колонке объемом 4,1 л (пилотный производственный масштаб) и колонке 28 мл (лабораторный масштаб).
Фиг.14 представляет собой график падения пропускной способности фильтра VIRESOLVE® Pro для анти-VEGF антитела №1, на котором проведено сравнение элюирования с белка А ступенчатым градиентом рН и стандартного ступенчатого элюирования с белка А в отношении увеличения пропускания большей массы через парвовирусный фильтр VIRESOLVE® Pro. При использовании ступенчатого градиента рН для элюирования с белка наблюдалось 6-кратное увеличение пропускаемой массы.
Фиг.15 представляет собой хроматограмму элюирования полным градиентом рН, показывающую фактические данные, полученные хроматографическим программным обеспечением AKTA UNICORN™ для полного градиента рН при плотности нагрузки 21 г/л. Отсутствие исходного высокого пика при 250 нм в начале градиента указывает на то, что рН в начале элюирования выше необходимого для элюирования продуктов с колонки с белком А.
Фиг.16 представляет собой хроматограмму (полученную с использованием оборудования АКТА) с вариантом градиента рН 5,0-2,7 (0-100%B), указывающую на то, что анти-VEGF антитело №1 элюируется в виде дискретного пика в диапазоне рН 4,6-3,6.
Фиг.17 представляет собой интегрирование пиков, полученных ионообменным анализом вариантов для фракций после элюирования ступенчатым градиентом рН с белка А, которое указывает на отделение основного варианта полипептида в хвостовой части элюирования ступенчатым градиентом.
Фиг.18 представляет собой количество частиц RVLP (ретровирусоподобных частиц) на фракцию, определенное с помощью QPCR-анализа (анализа с помощью количественной полимеразной цепной реакции), выраженное относительно элюирования анти-VEGF антитела №1. Основная масса RVLP элюируется в конце градиента, когда элюируется мало продукта.
Фиг.19 представляет собой LRV (число порядков снижения количества вируса) для каждой фракции при элюировании анти-VEGF антитела №1 с белка А с помощью ступенчатого градиента рН.
На фиг.20 приведены совокупные величины LRV для символических пулов фракций, показывающие, что можно получить более высокое значение LRV в пуле после элюирования с белка А, если исключить более поздние фракции.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к способам очистки полипептида, содержащего СН2/СН3-область, путем связывания полипептида с белком А и элюирования градиентом рН, начинающимся с низкого рН. Авторы изобретения сделали важное открытие, что элюирование полипептидов, содержащих СН2/СН3-область, с белка А градиентом рН при низком рН может обеспечить лучшее последовательное отделение полипептидов от различных примесей, включая примеси из клеток-хозяев, загрязнение вирусного фильтра, вирусные или вирусоподобные частицы, основные варианты полипептида и/или агрегаты полипептида, в очищенной фракции/пуле, а также может обеспечить более высокую чистоту или процентное содержание целевых полипептидных мономеров в очищенной фракции/пуле. Поэтому, изобретение имеет значительные преимущества. Авторы изобретения также открыли, что эти способы можно осуществить, используя различные хроматографические смолы и хроматографические сорбенты с белком А, и что эти способы можно использовать в промышленных или коммерческих процессах, и они могут способствовать применению альтернативных последующих методик очистки помимо колоночной хроматографии (например, мембранных адсорбентов).
Соответственно, один аспект изобретения относится к способу очистки полипептида, содержащего СН2/СН3-область, включающему связывание полипептида с белком А и элюирование градиентом рН, начинающимся с 5,0 или более низкого значения.
В другом аспекте изобретение относится к способу очистки полипептида, содержащего СН2/СН3-область, включающему стадии: (а) связывания полипептида с белком А; и (b) элюирования полипептида градиентом рН, начинающимся с 5,0 или меньшего значения, с использованием элюирующего буфера, причем элюирующий буфер включает буфер с высоким рН и буфер с низким рН, а градиент рН образуется в результате регулирования процентного содержания каждого рН-буфера в элюирующем буфере.
В еще одном аспекте изобретения относится к полипептиду, очищенному способами, описанными в настоящем документе.
В осуществлении настоящего изобретения на практике будут использоваться, если не указано иное, общепринятые методики молекулярной биологии (включая рекомбинатные методики), микробиологии, клеточной биологии, биохимии и иммунологии, которые входят в компетенцию специалиста в данной области. Такие методики полностью описаны в литературе, такой как, Molecular Cloning: A Laboratory Manual, second edition (Sambrook et al., 1989) Cold Spring Harbor Press; Oligonucleotide Synthesis (M.J. Gait, ed., 1984); Methods in Molecular Biology, Humana Press; Cell Biology: A Laboratory Notebook (I.E. Cellis, ed., 1998) Academic Press; Animal Cell Culture (R.I. Freshney, ed., 1987); Introduction to Cell and Tissue Culture (J.P. Mather and P.E. Roberts, 1998) Plenum Press; Cell and Tissue Culture: Laboratory Procedures (A. Doyle, J.B. Griffiths, and D.G. Newell, eds., 1993-1998) J. Wiley and Sons; Methods in Enzymology (Academic Press, Inc.); Handbook of Experimental Immunology (D.M. Weir and C.C. Blackwell, eds.); Gene Transfer Vectors for Mammalian Cells (J.M. Miller and M.P. Calos, eds., 1987); Current Protocols in Molecular Biology (F.M. Ausubel et al., eds., 1987); PCR: The Polymerase Chain Reaction, (Mullis et al., eds., 1994); Current Protocols in Immunology (I.E. Coligan et al., eds., 1991); Short Protocols in Molecular Biology (Wiley and Sons, 1999); Immunobiology (C.A. Janeway and P. Travers, 1997); Antibodies (P. Finch, 1997); Antibodies: a practical approach (D. Catty., ed., IRL Press, 1988-1989); Monoclonal antibodies: a practical approach (P. Shepherd and C. Dean, eds., Oxford University Press, 2000); Using antibodies: a laboratory manual (E. Harlow and D. Lane (Cold Spring Harbor Laboratory Press, 1999); The Antibodies (M. Zanetti and J.D. Capra, eds., Harwood Academic Publishers, 1995).
Определения
Следует понимать, что целевой полипептид в настоящем документе представляет собой полипептид, содержащий СН2/СН3-область, и, поэтому, подходит для очистки с помощью белка А. Термин «СН2/СН3-область» при использовании в настоящем документе относится к таким аминокислотным остаткам в Fc-области молекулы иммуноглобулина, которые взаимодействуют с белком А. В некоторых вариантах осуществления изобретения СН2/СН3-область содержит интактную СН2-область, за которой следует интактная СН3-область, и наиболее предпочтительно содержит Fc-область иммуноглобулина. Примеры белков, содержащих СН2/СН3-область, включают антитела, иммуноадгезины и слитые белки, содержащие целевой белок, слитый или конъюгированный с СН2/СН3-областью.
Термины «полипептид» и «белок» используются в настоящем документе взаимозаменяемо для обозначения полимеров аминокислот любой длины. Полимер может быть линейным или разветвленным, он может содержать модифицированные аминокислоты, и может быть прерван неаминокислотами. Термины также охватывают аминокислотный полимер, модифицированный естественным образом или в результате вмешательства человека; например, модифицированный в результате образования дисульфидных связей, гликозилирования, модификации липидами, ацетилирования, фосфорилирования или любой другой манипуляции или модификации, такой как конъюгация с меткой. Также в определение включены, например, полипептиды, содержащие один или несколько аналогов аминокислот (включая, например, неприродные аминокислоты и т.п.), а также другие модификации, известные в данной области.
Используемый в настоящем документе термин «очищенный полипептид» или «очищенный белок» представляют собой продукт, элюированный после аффинной хроматографии на белке А с использованием способов элюирования рН-градиентом, описанных в настоящем документе. Очищенные полипептиды/белки, предпочтительно содержат мономеры полипептида.
Используемый в настоящем документе термин «неочищенный полипептид», «неочищенный белок» или «белковая нагрузка» представляет собой полипептид или белок в нагружаемом материале или исходном материале до стадии очистки аффинной хроматографией на белке А.
Используемый в настоящем документе термин «примесь» или «примеси» представляет собой материал, отличающийся от целевого полипептидного мономерного продукта. Примеси включают, но не ограничены этим, вариант полипептида (например, кислотный или основный варианты полипептида), фрагмент полипептида, агрегат или производное целевого полипептидного мономера, другой полипептид, липид, нуклеиновую кислоту, эндотоксин, примесь из клеток-хозяев или загрязнение вирусного фильтра.
Используемый в настоящем документе термин «мономер» («мономеры») относится к одной единице полипептида, содержащей СН2/СН3-область. Например, в случае антитела мономер состоит из двух тяжелых цепей и двух легких цепей; в случае антитела с одним антиген-связывающим участком мономер состоит из одной тяжелой цепи и одной легкой цепи.
Используемый в настоящем документе термин «основный вариант полипептида» или «основный вариант» относится к варианту целевого полипептида, который имеет большую основность (например, определенную с помощью катионообменной хроматографии), чем целевой полипептид.
Используемый в настоящем документе термин «кислотный вариант полипептида» или «кислотный вариант» относится к варианту целевого полипептида, который имеет большую кислотность (например, определенную с помощью катионообменной хроматографии), чем целевой полипептид.
Используемый в настоящем документе термин «агрегат» («агрегаты») относится к любым мультимерам полипептида или фрагмента полипептида, содержащим СН2/СН3-область. Например, агрегат может быть димером, тримером, тетрамером или мультимером выше тетрамера, и т.п.
Используемый в настоящем документе термин «примесь из клеток-хозяев» относится к любому белковому загрязнению или побочному продукту, вносимому линией клеток-хозяев, клеточной культуральной жидкостью или клеточной культурой. Примеры включают, но не ограничены этим, белки клеток яичника китайского хомячка (СНОР), белки E. coli, дрожжевые белки, белки клеток COS обезьяны или белки клеток миеломы (например, белки клеток NS0 (клетки плазмацитомы мышей, полученные из мыши линии BALB/c)).
Используемый в настоящем документе термин «загрязнение вирусного фильтра» относится к любой макромолекулярной частице или высокомолекулярным соединениям (HMWS) с гидродинамическим диаметром, аналогичным или выше размера пор парвовирусного фильтра. Загрязнение вирусного фильтра включает, но не ограничено этим, растворимые высокомолекулярные полипептидные агрегаты, и растворимые и/или нерастворимые агрегаты примесей из клеток-хозяев (например, СНОР).
«Клетка-хозяин» включает индивидуальную клетку или клеточную культуру, которая может быть или является реципиентом вектора (вектором) для включения полинуклеотидных вставок для продукции полипептидов. Клетка-хозяин включает потомство одной клетки-хозяина, и потомство может не быть полностью идентично (по морфологии или совпадению геномной ДНК) исходной родительской клетке вследствие природной, случайной или преднамеренной мутации.
«Твердая фаза», используемая в настоящем изобретении, относится к неводному матриксу, к которому может прикрепляться белок А.
«Буфер» представляет собой буферный раствор, который препятствует изменению рН путем действия своих кислотно-основных сопряженных компонентов. Различные буферы, которые можно использовать в зависимости, например, от желаемого рН буфера, описаны в Buffers. A Guide for the Preparation and Use of Buffers in Biological Systems, Gueffroy, D., Ed. Calbiochem Corporation (1975).
«Уравновешивающий буфер» в настоящем документе представляет собой буфер, используемый для подготовки твердой фазы (с иммобилизованным белком А) для нанесения целевого белка.
«Промывочный буфер» в настоящем документе используется для обозначения буфера, который пропускают через твердую фазу (с иммобилизованным белком А) после нанесения и до элюирования целевого белка.
Термин «антитело» используется в максимально широком смысле и определенно охватывает моноклональные антитела (включая полноразмерные моноклональные антитела), поликлональные антитела, полиспецифичные антитела (например, биспецифичные антитела) и фрагменты антител, при условии что они сохраняют СН2/СН3-область или модифицированы, чтобы содержать СН2/СН3-область, описанную в настоящем документе.
«Фрагменты антител» содержат часть полноразмерного антитела, обычно его антиген-связывающую или вариабельную область. Примеры фрагментов антител включают Fab-, Fab'-, F(ab')2- и Fv-фрагменты; молекулы одноцепочечных антител; диантитела; линейные антитела и полиспецифичные антитела, образуемые фрагментами антител. Используемый в настоящем изобретении фрагмент антитела содержит СН2/СН3-область.
Используемый в настоящем документе термин «моноклональное антитело» относится к антителу, полученному из популяции по существу гомогенных антител, то есть индивидуальные антитела, содержащиеся в популяции, являются идентичными за исключением того, что возможные природные мутации могут присутствовать в минорных количествах. Моноклональные антитела являются высоко специфичными, будучи направленными против единственного антигенного сайта. Кроме того, в отличие от стандартных препаратов (поликлональных) антител, которые обычно включают различные антитела, направленные против разных детерминант (эпитопов), каждое моноклональное антитело направлено против единственной детерминанты на антигене. Определитель «моноклональное» указывает на характер антитела, как полученного из по существу гомогенной популяции антител, и его не следует истолковывать так требование получения антитела каким-либо конкретным способом. Например, моноклональные антитела для использования по настоящему изобретению можно изготовить гибридомным способом, впервые описанным Kohleret al, Nature 256:495 (1975), или его можно изготовить методами рекомбинантных ДНК (см., например, патент США № 4816567). «Моноклональные антитела» также можно выделить из фаговых библиотек антител, используя методики, описанные, например, в Clackson et al., Nature 352:624-628 (1991) и Marks et al., J. Mol. Biol. 222:581-597 (1991).
Моноклональные антитела в настоящем документе специально включают «химерные» антитела (иммуноглобулины), в которых часть тяжелой и/или легкой цепи идентична или гомологична соответствующим последовательностям в антителах, полученных из определенных биологических видов или принадлежащих к определенному классу или подклассу антител, в то время как остаток цепи (цепей) идентичен или гомологичен соответствующим последовательностям в антителах, полученных из других биологических видов или принадлежащих другому классу или подклассу антител, а также включают фрагменты таких антител, при условии что они проявляют желаемую биологическую активность (патент США № 4816567 и Morrison et al., Proc. Natl. Acad. Sci. USA 81:6851-6855 (1984)).
Термин «гипервариабельная область» при использовании в настоящем документе относится к аминокислотным остаткам антитела, которые отвечают за связывание антигена. Гипервариабельная область включает аминокислотные остатки из «определяющей комплементарность области» или «CDR» (то есть остатки 24-34 (L1), 50-56 (L2) и 89-97 (L3) в вариабельном домене легкой цепи и остатки 31-35 (H1), 50-65 (H2) и 95-102 (H3) в вариабельном домене тяжелой цепи; Kabat et al., Sequences of Proteins of Immunological Interest, 5 th Ed. Public Health Service, National Institutes of Health, Bethesda, Md. (1991)) и/или остатки из «гипервариабельной петли» (то есть остатки 26-32 (L1), 50-52 (L2) и 91-96 (L3) в вариабельном домене легкой цепи и остатки 26-32 (H1), 53-55 (H2) и 96-101 (H3) в вариабельном домене тяжелой цепи; Chothia and Lesk J. Mol. Biol. 196:901-917 (1987)). «Каркасные» или «FR»-остатки являются аминокислотными остатками вариабельного домена помимо остатков гипервариабельной области, указанных в настоящем документе.
«Гуманизированными» формами антител других биологических видов кроме человека (например, мышиных) являются химерные антитела, которые содержат минимальную последовательность, полученную из иммуноглобулина другого биологического вида кроме человека. Преимущественно гуманизированные антитела являются иммуноглобулинами человека (реципиентным антителом), в которых остатки гипервариабельной области реципиента замещены остатками гипервариабельной области антител других биологических видов кроме человека (донорного антитела), таких как мышь, крыса, кролик или нечеловекообразный примат, имеющими желаемую специфичность, аффинность и связывающую способность. В некоторых случаях, остатки каркасной области (FR) Fv-фрагмента иммуноглобулина человека замещены соответствующими остатками иммуноглобу